Gebruik
van
epoxyvetzuren
als
indicator voor oxidatieve stabiliteit
van gerookte vis
Aantal woorden: 18890
Nick De Henau
Studentennummer: 01812124Promotor: Prof. dr. ir. Bruno De Meulenaer Tutor: MSc Kennedy Bomfeh
Thesis voorgelegd voor het behalen van de graad Master in de Bio-ingenieurswetenschappen Academiejaar: 2019 – 2020
ii
Auteursrecht
De auteur en de promotor geven de toelating deze masterproef voor consultatie beschikbaar te stellen en delen van de masterproef te kopiëren voor persoonlijk gebruik. Elk ander gebruik valt onder de beperkingen van het auteursrecht, in het bijzonder met betrekking tot de verplichting de bron uitdrukkelijk te vermelden bij het aanhalen van resultaten uit de masterproef.
5 juni 2020
Auteur: Nick De Henau
Promotor: Prof. dr. ir. Bruno De Meulenaer Tutor: MSc Kennedy Bomfeh
Voorwoord
Ik wil graag mijn promotor prof. dr. ir. Bruno De Meulenaer bedanken voor het aanbrengen van dit interessante thesisonderwerp. Ook bedankt om mij telkens te helpen wanneer ik met vragen zat en voor de feedback doorheen het traject. Daarnaast wil ik ook graag mijn tutor MSc Kennedy Bomfeh bedanken. Door Kennedy zijn tips en goede raad kon ik deze thesis tot een goed einde brengen. Ook wil ik hem graag bedanken voor het ter beschikking stellen van zijn stalen uit Ghana, het assisteren tijdens het praktische werk en het uitvoeren van analyses tijdens de
lockdown periode. In deze bijzondere periode was het niet evident om labo werk uit
te voeren en aan data te raken in de laatste weken, zonder hem zou dit dan ook maar een halve thesis geworden zijn. So Kennedy, Thank you for al your help and
advice!
Verder wil ik graag iedereen van de onderzoeksgroep nutriFOODchem bedanken voor het ter beschikking stellen van het materiaal, de apparatuur en de hulp bij vragen. Hierbinnen wil ik graag Nathalie De Muer en Chunxia Su bedanken voor de uitleg bij verschillende protocollen. An Maes wil ik bedanken omdat ik bij haar telkens terecht kon met vragen over de apparatuur of wanneer ik iets nodig had dat niet direct vindbaar was.
Ten slotte maar zeker niet in het minste wil ik ook graag mijn ouders en familie bedanken die mij steeds gesteund hebben doorheen het maken van deze thesis.
Aan allen een welgemeende merci!
Nick De Henau
iv
Preambule omtrent de impact door de coronamaatregelen
Op 18 maart ging België in een lockdown light en voerde de federale regering enkele maatregelen in om de verspreiding van COVID-19 te beperken. Hierdoor werd van thuis uit werken de norm en werden alle niet essentiële verplaatsingen verboden. Ook binnen Universiteit Gent werden deze maatregelen nauwgezet opgevolgd. Vanaf 18 maart werden dan ook geen thesisstudenten meer toegelaten in de laboratoria. Op dat moment moesten echter nog enkele testen afgewerkt worden en enkele data verzameld worden:
Ø Op 6 geëpoxideerde en 6 gethermoxideerde visoliecapsule stalen diende nog SPE toegepast te worden.
Ø Alle gerookte visstalen (9), onbehandelde capsulestalen (6), bewaarde capsulestalen (6), geëpoxideerde capsulestalen (6) en gethermoxideerde capsulestalen (6) diende nog geïnjecteerd te worden op het GC-MS toestel voor de exploratieve studie naar epoxyvetzuren.
Ø De bekomen massaspectra na GC-MS diende nog verwerkt te worden voor alle stalen en geëpoxideerde standaarden (35 in totaal).
De resterende staalvoorbereidingen en de injecties op het GC-MS toestel werden uitgevoerd door mijn tutor Kennedy Bomfeh. De interpretatie van de massaspectra werd vanop afstand uitgevoerd via Anydesk remote desktop software (AnyDesk Software GmbH, Stuttgart, Duitsland).
Deze preambule werd in overleg tussen de student en de promotor opgesteld en door beiden goedgekeurd.
Inhoudsopgave
Auteursrecht ii
Voorwoord iii
Preambule omtrent de impact door de coronamaatregelen iv
Lijst van afkortingen vii
Samenvatting viii
1. Inleiding 1
2. Literatuurstudie 3
2.1. Lipiden aanwezig in vis 3
2.1.1 Acylglycerolen en vetzuren aanwezig in vis 3
2.1.2 Fosfolipiden aanwezig in vis 5
2.2 Oxidatie van vetzuren aanwezig in vis 7
2.2.1 Oxidatieproces 7
2.2.2 Oxidatiecomponenten 9
2.2.2.1 Klassieke oxidatiecomponenten 9
2.2.2.2 Epoxyvetzuren 9
2.2.2.3 Hydroxyvetzuren 10
2.2.3 Effecten van lipide oxidatiecomponenten 11
2.3 Roken van vis 12
2.3.1 Functie van het rookproces 12
2.3.2 Gevormde rookcomponenten 12
2.3.3 Effect van rookproces op de vetzuursamenstelling 13 2.3.4 Effect van roken op vetzuurstabiliteit tijdens bewaring 14 2.3.4.1 Effect van warmte vrijgekomen bij het rookproces 14 2.3.4.2 Antioxidatieve werking van rookcomponenten 14
3 Materiaal en methoden 17
3.1 Materiaal 17
3.2 Methoden 17
3.2.1 Monstervoorbereiding 17
3.2.1.1 Verzamelen van de gerookte vis stalen 17
3.2.1.2 Vet-extractie van gerookte vis stalen 18
3.2.1.3 Visoliecapsules 19
3.2.1.4 Epoxidatie van visolie en standaarden 19
3.2.1.5 Thermoxidatie van visolie 20
3.2.2 Bepaling van het vetzuurprofiel met GC-FID 20
3.2.2.1 Aanmaak vetzuur methylesters (FAME) 20
3.2.2.2 Condities gaschromatograaf (GC-FID) 21
3.2.2.3 Dataverwerking en statistische analyse 21
3.2.3 Exploratieve studie van epoxy- en hydroxyvetzuren met GC-MS 22
3.2.3.1 Transmethylatie 22
3.2.3.2 Solid phase extraction (SPE) 23
3.2.3.3 Condities gaschromatograaf (GC-FID) 24
3.2.3.4 Condities massaspectrometer (GC-MS) 25 3.2.3.5 Dataverwerking 25
vi
4 Resultaten 26
4.1 Vetzuursamenstelling van de visstalen 26
4.1.1 Kwalitatieve analyse: identificatie van vetzuurpieken 26 4.1.2 Kwantitatieve analyse van het vetzuurprofiel 30
4.1.2.1 Gerookte vis stalen 30
4.1.2.2 Visoliecapsules 36
4.2 Exploratieve studie van epoxyvetzuren 40
4.2.1 Kwalitatieve analyse: identificatie van epoxyvetzuur pieken 40 4.2.1.1 Methylesters van mono-epoxyvetzuren gevormd uit methy-EPA 41 4.2.1.2 Methylesters van mono-epoxyvetzuren gevormd uit methy-DHA 46 4.2.1.3 Methyl-EPA en methyl-DHA afgeleide epoxyvetzuren in gerookte visstalen 50 4.2.1.4 Methyl-EPA en methyl-DHA afgeleide epoxyvetzuren in visolie uit capsules 53 4.2.2 Semi-kwantitatieve analyse van epoxyfractie 55
5 Discussie 59
5.1 Vetzuursamenstelling van de stalen 59
5.1.1 Totaal vetzuurgehalte 59
5.1.2 SFA, MUFA en PUFA gehalte 60
5.1.3 Effect van de rooktechniek 60
5.2 Veranderingen in vetzuursamenstelling in functie van de bewaarperiode 61
5.2.1 Oxidatie van vetzuren 61
5.2.2 Afzetting van antioxidatieve componenten uit rook op de visstalen 63
5.3 Epoxyvetzuren als indicator voor oxidatie 65
5.3.1 Geïdentificeerde epoxyvetzuren in de standaarden 65
5.3.2 Epoxyvetzuurgehalte in visstalen 66
5.3.3 Conclusie omtrent het gebruik van epoxyvetzuren als oxidatie indicator 68
6 Algemene conclusie 69
7 Ideeën voor verder onderzoek 71
8 Referenties 73
9. Addenda 76
Lijst van afkortingen
ANOVA Analysis of Variance, variantieanalyse
DAG Diacylglycerolen
DCM Dichloormethaan
DHA Docosahexaeenzuur
DS Droge stof
EPA Eicosapentaeenzuur
FAME Fatty acid methyl ester, Vetzuur methylester
FAO Food and Agriculture Organisation, Voeding- en landbouworganisatie van de Verenigde Naties
FID Flame ionisation detector, vlamionisatiedetector
FTT FAO Thairoye Techniek
GC Gaschromatograaf, gaschromatografie
M Moleculair ion
MAG Monoacylglycerolen
MS Massaspectrometer, massaspectrometrie
MUFA Mono Unsaturated Fatty Acids, mono-onverzadigde vetzuren
MW Molecular Weight, moleculair gewicht
n.a. Niet aanwezig
n.d. Niet gedetecteerd
NIST National Institute of Standards and Technology p.a. Pro analyse
PAK Polycyclische aromatische koolwaterstoffen
PUFA Poly Unsaturated Fatty Acids, poly-onverzadigde vetzuren
RSD Relatieve standaarddeviatie
RT Retentietijd
SD Standaarddeviatie
SFA Saturated Fatty Acids, verzadigde vetzuren
SPE Solid phase extraction, vaste fase extractie
TAG Triacylglycerolen
tBME Tertiair-butyl methyl ether
UFA Unsaturated Fatty Acids, onverzadigde vetzuren
viii
Samenvatting
In Ghana levert de consumptie van vis een belangrijke bijdrage tot de dagelijkse aanbevolen eiwitinname per persoon. Deze vis wordt na de vangst vaak gerookt om zo de microbiële stabiliteit te garanderen tijdens de bewaring in afwachting van consumptie. Deze bewaring gebeurt veelal in open lucht. Het rookproces kan via drie verschillende technieken gebeuren: twee traditionele manieren namelijk via een rookvat of via een rookoven (Chorkor smoker) en via een recent ontwikkelde FAO Thairoye techniek (FTT). In deze thesis werd onderzocht wat de impact is van de bewaarperiode op de oxidatieve stabiliteit van het vetzuurprofiel van de vissen. Om deze impact in kaart te brengen werd beroep gedaan op epoxyvetzuren als indicator voor de oxidatieve stabiliteit. Concreet werd onderzocht of veranderingen in epoxyvetzuurgehalte een geschikte indicator kunnen zijn voor oxidatie. Op drie tijdstippen (0, 3 en 6 maanden na roken) werden staalnames gedaan bij de drie technieken. Deze stalen werden toegeleverd uit Ghana waarna in eerste instantie een extractie toegepast werd om het vet uit de vismatrix te halen. Op een deel van dit bekomen extract werd Fatty acid methyl ester analyse (FAME) toegepast. Via een gaschromatograaf uitgerust met een flame ionisation detector (GC-FID) werd het vetzuurprofiel van de verschillende stalen geanalyseerd. Vervolgens werd op het andere deel van het extract een transmethylatie en solid phase extraction (SPE) toegepast. De bekomen epoxyfractie werd geanalyseerd door middel van een gaschromatograaf gekoppeld aan een massaspectrometer (GC-MS).
Uit de resultaten van het vetzuurprofiel van de verschillende stalen bleek dat vooral het gehalte poly-onverzadigde vetzuren (PUFA), waaronder ook EPA en DHA, veranderde in functie van de bewaarperiode. De verandering in vetzuursamenstelling na een bewaarperiode van drie en zes maanden was het grootste bij vissen gerookt via FTT en via een rookvat. In de epoxyfractie van de visstalen werden verschillende epoxyvetzuren afgeleid van EPA en DHA geïdentificeerd. Na een semi-kwantitatieve analyse op deze epoxyvetzuren kon echter geen duidelijke trend gevonden worden in epoxyvetzuurgehalte in functie van de bewaarperiode. Hieruit kan geconcludeerd worden dat het vetzuurprofiel wel degelijk veranderd tijdens de bewaring van de vissen door toedoen van oxidatie maar dat deze verandering niet op te merken is in het gehalte aan epoxyvetzuren. Het besluit is dan ook dat het gebruik van epoxyvetzuren geen goede indicator is voor de oxidatieve stabiliteit van gerookte vis.
1. Inleiding
In Afrikaanse landen heeft de consumptie van vis een belangrijke bijdrage tot de aanbevolen hoeveelheid eiwitopname per persoon en per dag. Een vereiste hierbij is uiteraard dat het land toegang heeft tot water om aan visserij te kunnen doen (Mindjimba, Rosenthal, Diei-Ouadi, Bomfeh, & Randrianantoandro, 2019).
Deze thesis kadert specifiek in de visconsumptie van Ghana. In Ghana is een belangrijk aandeel van de totale dierlijke eiwitopname afkomstig van visconsumptie (Bomfeh, et al., 2019). Deze vis wordt ter plaatse op zee gevangen en vervolgens bewaard. Om de houdbaarheid van de vis te verhogen worden technieken toegepast om een stabiel product te bekomen. Hierbij wordt vooral getracht om de microbiële voedselveiligheid te garanderen.
Een frequent gebruikte techniek is het roken van de vis. Dit gebeurt in Ghana op de traditionele manier door middel van een rookvat of een rookoven (Chorkor). Bij een rookvat, zoals voorgesteld in figuur 1.1a, worden de vissen op een rooster geplaatst die zich boven een vat met brandend hout bevindt. Bij de Chorkor techniek (figuur 1.1b) worden de vissen op roosters boven een gemetste oven gestapeld. In beide gevallen maken de verbrandingsgassen rechtstreeks contact met de vis.
Figuur 1.1: a. Rookvat b. Chorkor rookoven (Bomfeh, et al., 2019).
Het roken van vis brengt enkele gevolgen met zich mee. Zo worden polycyclische aromatische koolwaterstoffen (PAK’s) gevormd. Deze PAK’s worden gevormd door onvolledige verbranding van organische verbindingen zoals hout of houtskool gebruikt voor het rookproces. PAK’s zijn schadelijk voor de gezondheid door hun carcinogene werking en tevens is inname via voeding de hoofdbron van blootstelling
Traditional Fish Smoking in Ghana
• The process relies on the use of kilns with firewood as fuel
• Results in heavy contamination with polycyclic aromatic hydrocarbons (PAHs)
3
2 landbouworganisatie van de Verenigde Naties (FAO) een nieuw type van rookoven ontwikkeld. De FAO Thairoye techniek (FTT) zorgt voor een duidelijke vermindering in PAK’s (figuur 1.2). Deze vermindering is te wijten aan verschillende factoren zoals het indirect contact met de rook (opsplitsen kook- en rookgedeelte), het gebruik van houtskool als brandstof en het gebruik van een filter (Bomfeh, et al., 2019).
Figuur 1.2: FTT rooktechniek (Bomfeh, et al., 2019).
Na het roken worden de gerookte vissen gestapeld en afgedekt tot het moment van consumptie. Deze opslag gebeurt buiten in open lucht. Door de gerookte vis te stockeren in open lucht bij omgevingstemperatuur kunnen veranderingen optreden naar kwaliteit van de vetzuren toe. In deze thesis wordt onderzocht wat de impact is van de bewaartijd op de vetzuursamenstelling van gerookte vis. Hier wordt concreet gekeken naar de vorming van vetoxidatiecomponenten zoals epoxyvetzuren en hydroxyvetzuren. In een eerste deel wordt door gebruik te maken van fatty acid
methyl ester analyse (FAME analyse) de vetzuursamenstelling onderzocht. Dit
gebeurt op verschillende monsters verzameld op verschillende tijdstippen tijdens de bewaring van de gerookte vis. Gedurende zes maanden werden hiervoor stalen genomen van de bewaarde vis. In het tweede deel wordt gekeken naar de aanwezigheid van epoxyvetzuren in de stalen. Zo wordt onderzocht of epoxyvetzuren een goede indicator kunnen zijn om de oxidatieve stabiliteit van de gerookte vis te onderzoeken. In deze exploratieve studie wordt vooral gefocust op de mogelijke vorming van epoxyvetzuren uit poly-onverzadigde vetzuren (PUFA) aanwezig in de visstalen. De keuze voor epoxyvetzuren als indicator komt doordat deze beschouwd worden als stabiele eindproducten van het oxidatieproces. Ook wordt aangenomen dat deze componenten in hoge mate voorkomen in thermisch geoxideerde levensmiddelen zoals gerookte vis (Mubiru, Shrestha, Papastergiadis, & De Meulenaer, 2013).
Traditional kilns vs. FTT
8
Cooking unit Smoke flavouring unit
Smoke generation chamber
Filter Filter before use
2. Literatuurstudie
2.1. Lipiden aanwezig in vis
In dit deel worden de lipiden en de vetzuursamenstelling besproken van vis. Lipiden bevatten hoofdzakelijk acylglycerolen en vrije vetzuren. In mindere mate komen ook fosfolipiden voor.
2.1.1 Acylglycerolen en vetzuren aanwezig in vis
Vis is in eerste instantie een eiwitbron. Daarnaast zijn lipiden een van de meest voorkomende componenten in vis naast water en as (mineralen) (Mohanty, Mahanty, Ganguly, Mitra, Karunakaran, & Anandan, 2019). Het vetgehalte van vis is afhankelijk van verschillende factoren. Zo is de soort vis bepalend voor het vetgehalte. Ook de voeding die de vis opneemt, de geografische ligging (het habitat waar de vis leeft) en de periode van het jaar waarop de vis gevangen wordt beïnvloedt de samenstelling. Daarnaast kan het vetgehalte van de vis ook sterk variëren met leeftijd en levensfase van de vis. Dieren in de voortplantingsfase zullen bijvoorbeeld een andere vetsamenstelling hebben (Murillo, Rao, & Durant, 2014). Afhankelijk van de hoeveelheid lipiden aanwezig in de vis kan deze opgedeeld worden in vier categorieën. Vette vis heeft een gemiddeld lipide gehalte van meer dan 8% vet, bepaald op droge stof gehalte. Middelvette vis heeft een gehalte 4% tot 8% D.S., laag vette vis 4% tot 2% D.S. en magere vis heeft een lipide gehalte van minder dan 2% D.S. (Mohanty, Mahanty, Ganguly, Mitra, Karunakaran, & Anandan, 2019).
Lipiden bestaan voor het grootste deel uit vetzuren veresterd met glycerol. Deze acylglycerolen zijn hoofdzakelijk triacylglycerolen (TAG) maar ook diacylglycerolen (DAG) en monoacylglycerolen (MAG) komen voor. Glycerol kan met heel wat verschillende vetzuren veresterd zijn (De Meulenaer, 2016). Twee grote categorieën worden van elkaar onderscheiden namelijk de verzadigde vetzuren (SFA) en de onverzadigde vetzuren (UFA). Deze laatste categorie kan op zijn beurt opgedeeld worden in mono-onverzadigde vetzuren (MUFA) en poly-onverzadigde vetzuren (PUFA).
In vis is het aandeel onverzadigde vetzuren hoger dan het deel verzadigde vetzuren (Mohanty, Mahanty, Ganguly, Mitra, Karunakaran, & Anandan, 2019). Zo bedraagt het aandeel SFA ongeveer 40% van het totale vetzuurgehalte, terwijl het gehalte aan
4 MUFA’s en PUFA’s beiden 30% bedragen. De meest voorkomende verzadigde vetzuren in vis zijn palmitinezuur (C16:0), met 22% tot 26% van het totale vetzuurgehalte. Op de tweede plaats staat stearinezuur (C18:0) met hoeveelheden tussen 8% en 10% van de totale hoeveelheid vetzuren (Murillo, Rao, & Durant, 2014). In mindere mate komen ook caprinezuur (C10:0) en myristinezuur (C:14:0) voor (Hussain, Sultana, Sultana, Al-Ghanim, Al-Misned, & Mahboob, 2019).
Om en bij 60% van de totale hoeveelheid vetzuur onverzadigd. Van deze onverzadigde vetzuren is de helft mono-onverzadigd. Oliezuur (C18:1 n-9) is het meest aanwezig bij de MUFA’s en dit met 15% tot 20%. Ook palmitoleïnezuur (C16:1 n-7) is met 8% tot 15% goed vertegenwoordigd. In mindere mate komt ook erucazuur (C22:1) en nervonzuur (C24:1) voor als mono-onverzadigde vetzuren in verse vis (Murillo, Rao, & Durant, 2014).
Als laatste categorie van in verse vis voorkomende vetzuren worden de poly-onverzadigde vetzuren besproken. Deze maken ongeveer 30% uit van het totale vetzuurprofiel. Hier kan verder onderscheid gemaakt worden tussen omega-6 vetzuren en omega-3 vetzuren afhankelijk van de locatie van de dubbele bindingen. Het meest voorkomende omega-6 vetzuur in verse vis is linolzuur (C18:2 n-6). In mindere mate komt ook eicosadieenzuur (C20:2 n-6) voor. De groep van omega-3 vetzuren in vis wordt vertegenwoordigd door linoleenzuur (C18:3 n-3), eicosapentaeenzuur (EPA, C20:5 n-3) en docosahexaeenzuur (DHA, C22:6 n-3). EPA varieert in voorkomen tussen 0% en 10% terwijl DHA tussen 0% en 28% ligt (Mohanty, Mahanty, Ganguly, Mitra, Karunakaran, & Anandan, 2019).
Linolzuur en linoleenzuur zijn essentiële vetzuren: deze worden niet door de mens aangemaakt. Daarom is het belangrijk om deze via de voeding op te nemen, omdat ze immers belangrijk zijn in tal van (weefsel)structuren in het lichaam. De omega-3/ omega-6 ratio is hierbij van belang. Deze index is belangrijk om de nutritionele kwaliteit van de vetten te bepalen. Een te hoog omega-6 gehalte resulteert in allerhande (chronische) aandoeningen terwijl een hoog omega-3 gehalte deze juist onderdrukken en daarbij ook de kans op kanker en hart- en vaatziekten vermindert. Een hoge ratio betekent dus een kwalitatief betere vetzuursamenstelling (Murillo, Rao, & Durant, 2014). Tabel 2.1 geeft een aantal vaak voorkomende vetzuren weer per categorie.
Tabel 2.1: Vetzuren per categorie.
2.1.2 Fosfolipiden aanwezig in vis
Een belangrijke groep van minorcomponenten in lipiden zijn fosfolipiden. Fosfolipiden bestaan uit glycerol veresterd met twee vetzuren op de sn-1 en sn-2 positie. Daarbij bevindt zich op de sn-3 positie van glycerol een fosfaatgroep (Tocher, Bendiksen, Campbell, & Bell, 2008). Door de twee vetzuren en de fosfaatgroep krijgt het fosfolipide unieke eigenschappen. De twee vetzuurketens hebben een hydrofoob karakter en de fosfaatgroep heeft een hydrofiel karakter (amfifiel). Dit speelt in organismen zoals vissen een belangrijke rol in membraanstructuren door de vorming van een lipide dubbellaag (Tocher, Bendiksen, Campbell, & Bell, 2008). Vaak zijn de vetzuren van fosfolipiden poly-onverzadigd (PUFA), zo kunnen hogere concentraties aan EPA en DHA gevonden worden in deze fosfolipiden.
De fosfaatgroep kan nog veresterd zijn met een andere chemische groep. Bij fosfatidylcholine is bijvoorbeeld choline veresterd met de fosfaatgroep. Daarnaast komen ook fosfatidylethanolamine, fosfatidylserine en fosfatidylinositol voor die respectievelijk veresterd zijn met ethanolamine, serine of inositol.
Naast bijdragen aan tal van membraanstructuren, hebben fosfolipiden ook nog andere functies in organismen zoals vissen. Het zijn precursoren voor een aantal belangrijke fysiologische verbindingen zoals prostaglandines, prostacyclines en
Catergorie Code Naam
C8:0 Caprylzuur C10:0 Caprinezuur C12:0 Laurinezuur C14:0 Myristinezuur C16:0 Palmitinezuur C18:0 Stearinezuur C20:0 Arachidinezuur C22:0 Beheenzuur C24:0 Lignocerinezuur C14:1 Myristoninezuur C16:1 Palmitoleïnezuur C18:1 Oliezuur C20:1 Gondonzuur C22:1 Erucazuur C24:1 Nervonzuur C18:2 ω6 Linolzuur C18:3 ω3 Linoleenzuur C20:2 ω6 Eicosadieenzuur C20:3 ω6 Dihomogammalinoleenzuur C20:4 ω6 Arachidonzuur C20:5 ω3 Eicosapentaeenzuur EPA C22:4 ω6 Docosatetraeenzuur C22:6 ω3 Docosahexaeenzuur DHA SFA MUFA PUFA
6 vaatsterkte, immunologische functies, nier werking en zenuwfuncties (Tocher, Bendiksen, Campbell, & Bell, 2008). Fosfolipiden kunnen na verestering met inositol omgevormd worden tot fosfoinositiden. Deze hebben een belangrijke functie in metabolische processen en celstructuren. Daarnaast kunnen fosfolipiden ook energie voor de cel aanbrengen.
2.2 Oxidatie van vetzuren aanwezig in vis
In het vorige hoofdstuk werd gezien dat ongeveer 60% van het totaal vetzuurgehalte in vis onverzadigd is. Hiervan is ongeveer de helft poly-onverzadigd (PUFA). In dit hoofdstuk wordt dieper in gegaan op de oxidatie van vetzuren.
2.2.1 Oxidatieproces
Het oxidatieproces wordt aanzien als een belangrijk probleem bij levensmiddelen. Door oxidatie kunnen smaakafwijking en mogelijke gevaren opsteken in het levensmiddel
Bij oxidatie worden vetzuren geoxideerd tot vorming van vetoxidatiecomponenten. De oxidatie kan gebeuren bij vetzuren die veresterd zijn met glycerol tot lipiden (TAG, DAG, MAG). Maar vooral vrije vetzuren zijn vatbaar voor oxidatie. Deze oxidatie kan op verschillende manieren gekatalyseerd worden. Zo kan licht (foto-oxidatie), warmte (bijvoorbeeld roken), enzymen (enzymatische (foto-oxidatie), metalen, metalloproteïnen en micro-organismen oxidatie van vetzuren veroorzaken (Vercellotti, St. Angelo, & M. Spanier, 1992). Onverzadigde vetzuren zijn meer vatbaar voor oxidatie dan verzadigde vetzuren. Om deze reden is vis oxidatiegevoelig door het grote aantal PUFA’s. Naarmate het contactoppervlak met zuurstof groter wordt of de vetzuren beter bereikbaar zijn, zal de kans op oxidatie aanzienlijk toenemen. Zo zal gefileerde vis sneller oxideren dan verse volledige vissen. Ook een hogere temperatuur, zoals bij het rookproces ontwikkeld wordt, zal leiden tot meer kans op oxidatie (Roman, Heyd, Broyart, Castillo, & Maillard, 2013). Componenten die het oxidatieproces kunnen afremmen worden antioxidanten genoemd. De invloed van antioxidanten worden verder besproken in paragraaf 2.3.4. Een van de oxidatiemechanismen is een radicalaire kettingreactie (auto-oxidatieproces). Deze reactie bestaat uit een initiatiestap gevolgd door de propagatiereactie en finaal een terminatiestap (Roman, Heyd, Broyart, Castillo, & Maillard, 2013). Daarnaast kunnen ook tal van nevenreacties optreden tussen de gevormde oxidatiecomponenten en componenten aanwezig in het levensmiddel (Zamora & Hidalgo, 2016). De verschillende stappen van het oxidatieproces worden weergegeven in Figuur 2.1.
8 Figuur 2.1: Auto-oxidatieschema van vetzuren.
Bij de initiatiestap wordt een vrij radicaal gegenereerd. Deze reactie is thermodynamisch niet gunstig. Hierdoor is een initiator nodig om deze eerste stap te laten doorgaan. Deze initiators kunnen licht (foto-initiatie), warmte, metalen en metaalhoudende componenten zijn. De beginstap bij auto-oxidatie is gelijk voor de verschillende initiators. Een waterstofatoom wordt onttrokken aan het vetzuur ter hoogte van het allylische koolstofatoom. Bij deze initiatiestap wordt een reactief alkyl-radicaal gevormd (R) (Zamora & Hidalgo, 2016).
De tweede fase is de propagatiereactie. Hierbij reageert het alkyl-radicaal met zuurstof tot de vorming van een peroxideradicaal (ROO). Dit is een zeer reactieve component die kan reageren met anderen componenten tot de vorming van een groot aantal oxidatiecomponenten. Voor de verdere propagatiereactie gaat dit radicaal reageren met een nieuw vetzuur. Hierdoor wordt uit het nieuwe vetzuur een nieuw alkyl-radicaal gevormd en wordt het initiële peroxideradicaal omgevormd tot een hydroperoxide (ROOH). Deze ketenreactie kan zo verder doorgaan (Roman, Heyd, Broyart, Castillo, & Maillard, 2013). Hydroperoxide kan op zijn beurt omgezet worden naar nieuwe radicalen (alkoxyradicalen, RO) die deelnemen aan de ketenreactie of reageren tot een stabiele component tijdens de terminatiestap.
De finale stap is de terminatiereactie. Hierbij gaan de tijdens propagatie gevormde radicalaire componenten, verder reageren met zichzelf en met andere componenten tot stabiele verbindingen. In de volgende paragrafen worden de mogelijke secundaire oxidatiecomponenten besproken (Zamora & Hidalgo, 2016).
2.2.2 Oxidatiecomponenten
Naast primaire oxidatiecomponenten zoals peroxideradicalen, hydroperoxiden en alkoxyradicalen worden door nevenreacties tal van andere verbindingen gevormd. Dit gebeurt via complexe reactiemechanismen waardoor de variatie aan secundaire oxidatiecomponenten zeer groot is. Een opsplitsing wordt gemaakt tussen de klassieke oxidatiecomponenten en de minder bestudeerde componenten zoals epoxyvetzuren en hydroxyvetzuren.
2.2.2.1 Klassieke oxidatiecomponenten
Uit de primaire oxidatieproducten worden secundaire componenten zoals alcoholen, ketonen, aldehyden en carbonzuren gevormd. Vooral het gevormde alkoxyradicaal (RO) is zeer reactief en kan reageren tot een groot aantal stabiele verbindingen. Door opnieuw een waterstofatoom te onttrekken aan een nieuw vetzuur kan een alcohol gevormd worden. Daarnaast kan polymerisatie ontstaan door het radicaal te adderen op een dubbele binding van een nieuw onverzadigd vetzuur. Dit zorgt voor een stijging van de viscositeit van olie (Roman, Heyd, Broyart, Castillo, & Maillard, 2013). Ook kunnen splitsingsreacties optreden bij het alkoxyradicaal. Bij dit type reacties worden carbonylverbindingen gevormd zoals aldehyden, ketonen of ketozuren. Daarnaast bestaat ook de kans op vorming van nieuwe vetzuren, alkanen en alkenen (Zamora & Hidalgo, 2016).
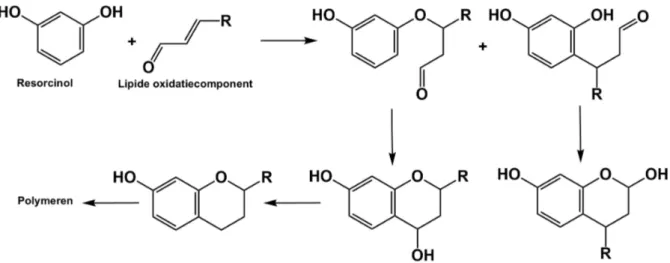
2.2.2.2 Epoxyvetzuren
Epoxyvetzuren zijn secundaire oxidatiecomponenten die via verschillende mechanismen uit vetzuren gevormd kunnen worden. Concreet kunnen deze via twee verschillende mechanismen gecreëerd worden tijdens de oxidatiereactie. Een eerste mogelijke mechanisme is via peroxideradicalen (ROO) die gevormd worden uit vetzuren tijdens de primaire oxidatiereacties. Deze reactie gaat door ter hoogte van de dubbele binding van een tweede vetzuur. Hierbij gaat een zuurstofatoom over van het reactieve peroxideradicaal op het nieuwe vetzuur. Op deze manier ontstaat een epoxide ter hoogte van de dubbele binding en een resterend alkoxyradicaal (RO) (Neff & Byrdwell, 1998). Figuur 2.2 geeft dit reactiemechanisme weer.
10 Figuur 2.2: Mechanisme van epoxidevorming.
Een tweede mogelijke reactie die tot de vorming van epoxyvetzuren kan leiden is via cyclisatie van een alkoxyradicaal (RO). Hierbij gaat het zeer reactieve radicaal reageren met zichzelf waardoor een ringsluiting ontstaat.
Verwacht wordt dat mono- en poly-onverzadigde vetzuren aanleiding geven tot vorming van epoxyvetzuren. Zo zal bijvoorbeeld DHA (C22:6) kunnen geoxideerd worden tot epoxy docosapentaeenzuur (epoxy C22:5). Wanneer linolzuur (C18:2) een oxidatie ondergaat tot vorming van een epoxide wordt epoxyoleïnezuur gevormd (epoxy, C18:1). Zo wordt een dubbele binding opgeofferd tot vorming van een epoxide (Marmesat, Velasco, & Dobarganes, 2008). Epoxyvetzuren worden beschouwd als stabiele eindproducten. Vooral in thermisch geoxideerde levensmiddelen komen deze componenten in grote hoeveelheden voor (Mubiru, Shrestha, Papastergiadis, & De Meulenaer, 2013). Om deze reden wordt gekozen voor een onderzoek naar epoxyvetzuren als indicator voor oxidatie. Onderzocht wordt of het gehalte aan epoxyvetzuren veranderd gedurende een bewaarperiode en hiermee dus een maat kan zijn voor de oxidatie.
2.2.2.3 Hydroxyvetzuren
Ook hydroxyvetzuren worden gevormd uit primaire oxidatiecomponenten. Meer bepaald worden hydroxyvetzuren gevormd uit alkoxyradicalen (RO) (Marmesat, Velasco, & Dobarganes, 2008). Dit kan via twee verschillende reactiemechanismen gebeuren. De eerste manier is via het onttrekken van een waterstofatoom afkomstig van een nieuw vetzuur. Hierbij wordt het overeenkomstig hydroxyvetzuur en een nieuw alkyl-radicaal gevormd. De tweede mogelijke weg is via een reactie met een ander alkoxyradicaal. Hierbij wordt overeenkomstig aan het eerste radicaal een hydroxyvetzuur gecreëerd en overeenkomstig met het tweede radicaal een keton (Instituto de la Grasa (CSIC), 2019). Figuur 2.3 geeft deze reactiemechanismen weer.
Figuur 2.3: Twee vormingsmechanismen van hydroxyvetzuren. 2.2.3 Effecten van lipide oxidatiecomponenten
Oxidatie van vetzuren heeft tal van gevolgen voor het levensmiddel. Zo hebben secundaire oxidatiecomponenten een impact op sensorische parameters van het levensmiddel. De gevormde componenten hebben impact op de geur, smaak en aroma van het levensmiddel. Veelal zijn deze bijdragen van negatieve aard en worden de gevormde oxidatiecomponenten als off-flavour beschreven (Vercellotti, St. Angelo, & M. Spanier, 1992). Daarnaast zorgen lange polymeerketens, gevormd door polymerisatie van primaire oxidatiecomponenten, voor een stijging in viscositeit van visolie. De visolie wordt bijgevolg dikker en minder vloeibaar (Roman, Heyd, Broyart, Castillo, & Maillard, 2013). Sommige oxidatiecomponenten kunnen als schadelijk voor het menselijk lichaam aanzien worden. Dit kan komen door de directe gevaren die inname van een bepaalde component veroorzaakt. Veel van de primaire en secundaire oxidatiecomponenten zijn immers zeer reactief (radicalen, peroxiden) en kunnen interageren met biologische macromoleculen in het lichaam (De Meulenaer, 2016). Ook kan de inname van oxidatiecomponenten voor indirecte problemen zorgen in het lichaam. Belangrijke vetzuren zoals omega-3 vetzuren waaronder EPA en DHA zullen door oxidatie hun nutritionele kwaliteiten verliezen (Zamora & Hidalgo, 2016). Daarnaast kunnen oxidatiecomponenten reageren met nutriënten aanwezig in het levensmiddel. Hierdoor gaat de nutritionele waarde verloren en kan de verteerbaarheid verminderen. Een belangrijk voorbeeld hiervan zijn interacties met eiwitten. Door deze interacties kunnen proteïnen moeilijker verteerd worden waardoor bijgevolg ook de opname van essentiële aminozuren daalt (Obando, Papastergiadis, Li, & De Meulenaer, 2015).
12
2.3 Roken van vis
In dit deel wordt het roken van vis besproken. De functies van het rookproces en de gevormde rookcomponenten worden toegelicht. Verder wordt in dit deel ook gekeken naar de directe impact van het rookproces op de vetzuursamenstelling. Ten slotte wordt ook het effect op de vetzuurstabiliteit tijdens bewaring onderzocht.
Het rookproces kan in twee categorieën onderverdeeld worden, namelijk koud roken en warm roken (Huang, et al., 2019). In deze thesis wordt gefocust op het warm roken van vis. Hierbij wordt gebruik gemaakt van de verbrandingsgassen afkomstig van de verbranding van brandstoffen zoals verschillende houtsoorten en houtskool.
2.3.1 Functie van het rookproces
Levensmiddelen worden gerookt om diverse redenen. Zo levert het roken van producten een typische rooksmaak aan het levensmiddel. Deze smaak wordt sensorisch als positief beschreven. Naast het sensorische aspect zorgt roken ook voor een langere microbiële houdbaarheid (Huang, et al., 2019). Door de hoge temperatuur van de rookgassen ondergaat het behandelde levensmiddel een temperatuurstijging. Hierdoor worden mogelijke bederf veroorzakende en pathogene micro-organismen afgedood.
2.3.2 Gevormde rookcomponenten
Wanneer hout en houtskool verbrand worden, komen naast warmte ook heel wat verbrandingscomponenten vrij. Zo komen bij een (onvolledige) verbranding van hout en houtskool polycyclische aromatische koolwaterstoffen (PAK) vrij. Deze componenten worden algemeen als schadelijk voor de gezondheid aanzien. De meest voorkomende PAK’s zijn benzo(a)pyreen, benzo(a)antraceen, benzo(b)fluoranteen en chryseen. Deze componenten zijn allemaal carcinogeen. Naast de schadelijke componenten zitten in rookgassen ook componenten die positief zijn voor de chemische houdbaarheid van levensmiddelen. Zo bestaat hout uit een mengsel van meer dan 250 verschillende (poly)fenolen die aan elkaar verbonden zijn tot polyfenolketens (lignine). Bij verbranding komen deze fenolen los uit de gecrosslinkte polyfenolen. Afhankelijk van de samenstelling van het gebruikte hout en de temperatuur van de verbranding kunnen de fenolen vrij komen als mono-, di- en trihydroxyfenolen. Ook kunnen deze fenolen andere functionele groepen hebben zoals hydroxyl-, carbonyl-, carboxyl- en estergroepen (Stołyhwo, Kołodziejska, & Sikorski, 2006). Figuur 2.4 geeft de algemene structuur van lignine
weer en de mogelijke verbrandingscomponenten (polyfenolen) die hieruit gevormd kunnen worden.
Figuur 2.4: Lignine uit hout en door verbranding gevormd polyfenol. 2.3.3 Effect van rookproces op de vetzuursamenstelling
De directe effecten van het rookproces op de vetzuursamenstelling zullen verwaarloosbaar zijn. Janiszewski et al. deed onderzoek naar de impact van thermische processen, zoals roken, op de vetzuursamenstelling. Concreet werd in dit onderzoek gekeken naar de vetzuursamenstelling van lam- en varkensvlees voor en direct na een rookproces. Voor de gehalten (g/ 100 g vetzuur) aan SFA en MUFA werden geen statistische significante verschillen opgemerkt. Bij het gehalte aan poly-onverzadigde vetzuren werd een kleine stijging opgemerkt na het roken. Dit is toe te schrijven aan kleine verschillen in vetzuursamenstelling van het gebruikte vlees en zijn bijgevolg eveneens niet significant (Janiszewski, et al., 2016).
Een kanttekening hierbij is dat in het onderzoek gewerkt werd met varkensvlees en niet met vis, wat een hoger gehalte aan PUFA’s heeft.
14
2.3.4 Effect van roken op vetzuurstabiliteit tijdens bewaring 2.3.4.1 Effect van warmte vrijgekomen bij het rookproces
De vrijgekomen warmte zorgt voor verlies van water uit de vis. In een droger product is de mobiliteit van bepaalde pro-oxidatieve componenten, zoals metaalionen, lager. Door een lagere mobiliteit kunnen deze metaalionen moeilijker bij de vetzuren geraken waardoor de kans op oxidatie tijdens de bewaring verminderd wordt (Stołyhwo, Kołodziejska, & Sikorski, 2006).
2.3.4.2 Antioxidatieve werking van rookcomponenten
Polyfenolen hebben een antioxidatieve werking. Deze werking is sterk afhankelijk van het type polyfenol en de hoeveelheid van voorkomen in de rook.
De meest antioxidatieve fenolen die voorkomen zijn: pyrogallol, catechol, resorcinol, 4-methylguaiacol, 4- vinylguaiacol en 4-trans-propenylsyringol (Stołyhwo, Kołodziejska, & Sikorski, 2006). Figuur 2.5 geeft enkele frequente polyfenolen uit rook weer.
Figuur 2.5: Mogelijke antioxidatieve polyfenolen in rook.
De antioxidatieve werking remt de vetzuuroxidatie tijdens de bewaring van de vis af. Deze rookcomponenten hebben bijgevolg een beschermende werking (Janiszewski, et al., 2016).
Polyfenolen kunnen de vetzuuroxidatie op drie verschillende manieren afremmen. Het eerste mechanisme grijpt in op de initiatiestap. Polyfenolen zijn in staat om metalen, aanwezig in de voedingsmatrix, te cheleren (Andjelkovic, et al., 2006). Deze metalen kunnen bijgevolg niet meer als initiator voor de oxidatiereactie dienen waardoor deze reactie geremd wordt (Zamora & Hidalgo, 2016).
In tweede instantie kunnen sommige polyfenolen fungeren als radicaalvangers. Hun vermogen tot vangen en stabiliseren van radicalen is afhankelijk van de locatie van de hydroxylgroepen op de ring (Bendary, Francis, Ali, Sarwat, & El Hady, 2013). Concreet wordt een waterstofatoom van het polyfenol afgestaan aan het
vetzuurradicaal waardoor dit polyfenol een radicaal wordt. Door delokalisatie en omlegging wordt dit polyfenolradicaal gestabiliseerd. Door een vermindering in vetzuurradicalen wordt de propagatiereactie afgeremd (Zamora & Hidalgo, 2016). Het mechanisme is voor catechol weergegeven in figuur 2.6.
Figuur 2.6: Werking van polyfenolen als radicaalvangers.`
Een derde en laatste manier van antioxidatieve werking van polyfenolen kan toegeschreven worden aan het vermogen om reactieve carbonylcomponenten te vangen. Carbonylverbindingen die ontstaan bij vetzuuroxidatie kunnen reageren met eiwitten amine reacties) maar eveneens ook met polyfenolen (carbonyl-polyfenol reacties). Door deze competitie wordt de beschikbare hoeveelheid reactieve componenten verminderd. Figuur 2.7 toont een mogelijk reactiemechanisme tussen een carbonylverbinding en resorcinol. De gevormde componenten kunnen verdere reacties ondergaan tot vorming van polymeren. Deze polymeren zijn mede de oorzaak van de bruine kleur bij gerookte levensmiddelen (Zamora & Hidalgo, 2016).
16 Samengevat heeft het roken van vis een impact op de stabiliteit van vetzuren tijdens de bewaring. Vooral de antioxidatieve werking van polyfenolen, aanwezig in rook, zullen hier op een impact hebben. Polyfenolen hebben drie antioxidatieve werkingsmechanismen: metaal cheleren (initiatiereactie remmen), radicaalvangers (propagatie- en terminatiereactie afremmen) en carbonylvangers (verdere reactie tussen oxidatiecomponenten en andere verbindingen in levensmiddel remmen). Figuur 2.8 geeft een overzicht weer van alle mogelijke antioxidatieve werkingen van polyfenolen uit rook (Zamora & Hidalgo, 2016).
Figuur 2.8: Overzicht van de antioxidatieve werking van polyfenolen uit rook (Zamora & Hidalgo, 2016).
first place the corresponding addition product that is later either stabilized to produce the corresponding carbonyl-phenol adduct or it can suffer a polymerization to produce brown lipid-phenol polymers. In addition, the formation of some carbonyl-phenol ad-ducts might have positive consequences for the healthy properties of these compounds.
As observed inFig. 6, several kinds of polymers can be produced during the lipid oxidation pathway when it takes place in the pres-ence of amino compounds and phenols. In addition to the lipid-derived polymers, lipid-amine polymers, and lipid-phenol poly-mers indicated in the figure, the formation of mixed lipid-amine-phenol polymers is also likely to be produced because of the pres-ence of carbonyl compounds in the firstly produced polymers might induce further reactions with both amino compounds and phenols. 7. Different parts in the flavonoid structure are responsible for the different protective functions
As discussed above, each protective effect has specific structural requirements, and these requirements are different for the different protective functions. This can be observed inFig. 7, in which four flavones with different hydroxylation pattern are shown. When the
carbonyl group is available, the metal ion complexes are prefer-entially formed between the keto group in the C-4 and the hydroxyl group in C-5. An ellipse between these two groups in the figure indicates the part of the molecule mainly responsible for its chelating activity. This activity should be present in the four selected flavones because the keto group in the C-4 and the hy-droxyl group in C-5 are present in all of them.
The free-radical scavenging activity of flavonoids depends on the presence of catechol or o-trihydroxyl (pyrogallol) systems, because if these systems are not present, the flavonoids form relatively unstable radicals and are weak scavengers (Pannala et al., 2001). For that reason, whenCai, Sun, Xing, Luo, and Corke (2006) studied the free-radical scavenging activity of the four flavones collected in Fig. 7, only luteolin and baicalein exhibited activity. These two compounds are the only compounds among those included in the figure that have catechol or o-trihydroxyl (pyro-gallol) systems. The active free radical-scavenging system has also been marked inFig. 7.
Finally, the carbonyl-scavenging activity needs the presence of phenolic carbons with a high electronic density. It occurs in luteolin, apigenin, chrysin and, to a lower extent, also in baicalein. The active carbonyl-scavenging region has been marked inFig. 7.
Fig. 6. The triple defensive barrier of phenolic compounds against the lipid oxidation damage in food products. LH, lipid; L!, lipid radical; LO!, lipid alkoxyl radical; LOO!, lipid
peroxyl radical; LOOH, lipid hydroperoxide;!OH, hydroxyl radical.
3 Materiaal en methoden
3.1 MateriaalDichloormethaan p.a. (>99,8%), waterstofchloride p.a. (>37,0%), iso-octaan p.a. (>99,5%), n-hexaan p.a. (>99,0%), diethylether p.a. (>99,5%), natriumsulfaat watervrij z. (>99,0%), natriumchloride p.a. (>99,8%), natriumhydroxide parels p.a. (>99,0%) en zuurgewassen en gegloeid zeezand p.a. werden aangekocht bij Chem-Lab (Zedelgem, België). 3-Chloorperbenzoëzuur (>77,0%), nonadecaanzuur (>98,0%) en natriummethoxide (25% oplossing in methanol) werden aangekocht bij Sigma-Aldrich (Overijse, België). De GLC reference standard (68D), methyl-eicosapentanoaat en methyl-docosahexanoaat werden aangekocht bij Nu-Chek-Prep, inc. (Elysian, Verenigde Staten). Boortrifluoride methanol complex (20% oplossing in methanol) en Silicagel 60 (0,063-0,100 mm) werden aangekocht bij Merck Millipore (Darmstadt, Duitsland). Methanol (>99,9%) en zwavelzuur (>95,0%) werden aangekocht bij Fisher Scientific (Loughborough, Verenigd Koninkrijk). Tert-butylmethylether (>99,9%) werd aangekocht bij Acros organics (Geel, België).
3.2 Methoden
3.2.1 Monstervoorbereiding
3.2.1.1 Verzamelen van de gerookte vis stalen
In deze thesis werd gebruik gemaakt van gerookte vis stalen die toegeleverd werden. Bomfeh et al. (2019) voerde in Ghana rookexperimenten uit op Sardinella sp. om het effect van verschillende rooktechnieken na te gaan op de vorming van PAK’s (Bomfeh, et al., 2019). De vissen werden gerookt op drie verschillende manieren: metalen rookvat, rookoven (Chorkor smoker) en FTT. Deze rookexperimenten werden per techniek 5 keer herhaald. Gedurende een periode van zes maanden na roken van de vis werden stalen genomen. Dit gebeurde aan het begin van de bewaarperiode, halverwege de bewaarperiode (3 maanden) en op het einde van de bewaarperiode (6 maanden). Op elk tijdstip werden telkens tien vissen verzameld en gehomogeniseerd door middel van een Waring CB15V Heavy Duty Commercial Blender (Waring commercial, Stamford, Verenigde Staten). Zo werden per techniek en per bewaarperiode 5 mengstalen bekomen. Op die manier werden in totaal 45 gerookte vis stalen bekomen (3 methoden x 3 tijdstippen en telkens 5 herhalingen).
18 De stalen werden vacuüm verpakt en bewaard bij -22 °C onmiddellijk na de staalname. Vervolgens werden de stalen overgebracht naar België waar deze bewaard werden bij -20 °C in afwachting van verder onderzoek.
3.2.1.2 Vet-extractie van gerookte vis stalen
Het vet werd geëxtraheerd via de Bligh en Dyer methode (Bligh & Dyer, 1959). Als eerste stap werden de stalen vermalen en werd het vochtgehalte per staal bepaald door Bomfeh et al. Dit gebeurde door de stalen af te wegen en vervolgens 2 uur bij 105 °C te drogen. Door nadien opnieuw te wegen kon het vochtgehalte berekend worden.
Volgend protocol werd vier keer per staal toegepast, in totaal werd een extractie uitgevoerd op 10,0 g visstaal (4 x 2,5 g visstaal). Dit gebeurden op de 45 stalen. Per extractie werd 2,5 g afgewogen in een glazen centrifuge buis. Aan deze centrifugebuis werd achtereenvolgens toegevoegd: gedestilleerd water (afhankelijk van het vochtgehalte van het staal, finaal moet 14,5 ml water in het staal aanwezig zijn), 11,0 ml dichloormethaan (DCM) en 26,0 ml methanol. Vervolgens werd het staal gehomogeniseerd met een Ultra turrax (IKA, Staufen, Duitsland) gedurende 2 minuten. Daarna werd opnieuw 15,0 ml DCM toegevoegd en terug gehomogeniseerd gedurende 30 seconden. Vervolgens werd 15,0 ml zuur water (5 M HCl in gedestilleerd water tot pH<1,0) toegevoegd en opnieuw 30 seconden gehomogeniseerd. Hierna werd de pH gecontroleerd met pH-strips (Merck KGAa, Darmstadt, Duitsland). Indien hoger dan pH 2,0 werden enkele druppels 5 M HCl toegevoegd en gehomogeniseerd. Daarna werden de verschillende fasen van elkaar gescheiden door middel van een centrifuge (10 minuten op 3600 x g bij 4 °C). Na centrifugatie werd de bovenliggende waterige fase verwijderd.
De onderste (apolaire) laag bevat het geëxtraheerde vet. Deze laag werd van de vier aparte centrifugebuizen per staal, samen over een plooifilter met een bodem watervrij natriumsulfaat gebracht. Dit werd opgevangen in een vooraf gedroogde en gewogen kolf. Het DCM werd vervolgens met een rotavapor (Heidolph, Schwabach, Duitsland) verwijderd. Door opnieuw het gewicht van de kolf te bepalen kon het vetpercentage in het staal berekend worden.
De 45 stalen werden ten slotte met iso-octaan overgebracht in donkere vials, drooggedampt onder stikstof en bewaard bij -20 °C.
3.2.1.3 Visoliecapsules
Om de vorming van epoxyvetzuren tijdens bewaring in visolie na te gaan werden verschillende visoliecapsules onderzocht. Van verschillende merken werden capsules aangekocht die dienen als voedingssupplement. Concreet werden zes verschillende merken aangekocht: Biover omega 3 (Biover, Nazareth, België), Oméga-3 Boni (Boni selection, Halle, België), Lucovitaal Super visolie omega 3 (Lucovitaal, Eindhoven, Nederland), Laboratoires Vitarmonyl Oméga 3 cardiovasculair evenwicht (Laboratoires Vitarmonyl, Doornik, België), Kruidvat omega 3 capsules (Kruidvat, Antwerpen, België). Het zesde aangekochte merk bevatte in tegenstelling tot de voorgaande krillolie in plaats van visolie, Krill omega 3 (Orca natural solutions, Zedelgem, België).
De visolie werd door middel van een naald en spuit uit de capsules verzameld en bewaard in donkere vials bij -20 °C. Een deel van de verzamelde visolie werd eveneens donker bewaard bij kamertemperatuur gedurende drie weken. Dit om de oxidatieve stabiliteit tijdens bewaring te onderzoeken.
3.2.1.4 Epoxidatie van visolie en standaarden
Om een beeld te krijgen van de mogelijke epoxiden in visolie werd een epoxidatiereactie uitgevoerd op de olie uit de zes capsules. De methode was gebaseerd op deze beschreven door Gunstone en Jacobsberg (Gunstone & Jacobsberg, 1972). Hiervoor werd 200,0 mg staal (visolie uit capsules bewaard bij -20,0 °C) afgewogen in een peervormige kolf. De epoxidatie gebeurde met 208,0 mg 3-chloorperbenzoëzuur opgelost in 20,0 ml DCM. Dit werd toegevoegd aan de olie in de kolf, vervolgens werd de kolf afgesloten en afgedekt met aluminiumfolie (4 uur, kamertemperatuur). Achteraf werd de reactie stopgezet door DCM te verwijderen met de rotavapor. Door n-hexaan toe te voegen aan de kolf, losten de gevormde componenten op. Dit werd vervolgens over een vouwfilter gebracht met een bodem watervrij natriumsulfaat en opgevangen in donkere vials. Het overige 3-chloorperbenzoëzuur en 3-chloorbenzoëzuur was slecht oplosbaar in n-hexaan en bleef achter op de filter. De vials werden ten slotte drooggedampt onder stikstof en bewaard bij -20 °C. Ook op de gemethyleerde EPA en DHA standaarden werd een epoxidatie uitgevoerd.
20
3.2.1.5 Thermoxidatie van visolie
Op een deel van visolie uit de zes capsules, bewaard bij -20 °C, werd een thermoxidatie uitgevoerd. Hierbij werden de oliën in een glazen recipiënt in een moffeloven geplaatst. De thermoxidatie gebeurde bij 180 °C gedurende 10 uur. Nadien werden de stalen gekoeld en vervolgens bewaard bij -20 °C.
3.2.2 Bepaling van het vetzuurprofiel met GC-FID
Het vetzuurprofiel van de verschillende stalen werd bepaald door middel van gaschromatografie uitgerust met en flame ionisation detector (FID). Hiervoor dienen de vetten verzeept te worden tot vrije vetzuren en vervolgens veresterd tot methylesters (fatty acids methyl esters, FAME). Het gebruikte protocol is gebaseerd op de methode voor marine olie te bepalen (Ce 1b-89), beschreven door The American Oil Chemists Society (American Oil Chemists Society, 1990).
3.2.2.1 Aanmaak vetzuur methylesters (FAME)
Standaarden
Als interne standaard werd 0,5 g nonadecaanzuur (C19:0) opgelost in 100,0 ml iso-octaan. Hiervan werd telkens 0,5 ml overgebracht in een proefbuis met schroefdop die vervolgens drooggedampt werd onder stikstof.
Als referentiestandaard werd GLC reference standard 68D gebruikt. Deze standaard is een mengsel van vetzuur methylesters. Van de standaard werd 25,0 µl aangelengd met iso-octaan tot 1000 µl (1/40 verdunning). Van deze oplossing werd 20,0 µl in een GC-vial gebracht, aangelengd met 980,0 µl iso-octaan en afgesloten voor analyse.
Stalen
Van de verschillende visoliestalen werd 25,0 mg afgewogen in de proefbuis met schroefdop die reeds de drooggedampte interne standaard bevat. Aan deze proefbuis werd 2,0 ml 0,5 M methanolische NaOH-oplossing toegevoegd. Vervolgens werd de proefbuis goed afgesloten en in een kokend waterbad geplaatst. De verzepingsreactie gebeurde gedurende 7 minuten waarna de stalen gekoeld werden onder stromend water. Daaropvolgend werd 2,0 ml boortrifluoride methanol complex toegevoegd aan de stalen en werden deze gehomogeniseerd gedurende 30 seconden met een vortexmenger (VWR International, Leuven, België). Daarna werden de stalen veresterd in een kokend waterbad en dit gedurende 5 minuten. Na koelen onder stromend water werd 3,0 ml iso-octaan toegevoegd aan de
proefbuizen. Gedurende 30 seconden werd gevortext en nadien werd 5,0 ml verzadigde NaCl oplossing in water toegevoegd. Opnieuw werd 30 seconden gehomogeniseerd. Na een korte periode werden twee fasen gevormd. De bovenliggende iso-octaan laag bevat de vetzuuresters. Deze werd overgebracht in een andere proefbuis waaraan een bodem watervrij natriumsulfaat was toegevoegd. Bij een tweede extractie werd opnieuw 3,0 ml iso-octaan toegevoegd aan de initiële proefbuis. Opnieuw werd 30 seconden gehomogeniseerd en wederom werd na fasescheiding de bovenste laag overgebracht in de nieuwe proefbuis. Finaal werd de nieuwe proefbuis met de opgeloste vetzuuresters gevortext gedurende 15 seconden. Per staal werd telkens 160,0 µl uit deze proefbuis in een GC-vial gebracht en aangelengd met 840,0 µl iso-octaan, alvorens de vial af te stuiten voor analyse.
3.2.2.2 Condities gaschromatograaf (GC-FID)
Voor de analyse van de stalen werd gebruik gemaakt van een gaschromatograaf uitgerust met FID (6890N (G1530N) GC FID, Agilent Technologies, Santa Clara, Verenigde Staten). De injectie van de stalen gebeurde cold-on-colum, per staal werd 0,1 µl geïnjecteerd. De kolom was een capillaire siloxaan kolom van het type CP-Sil 88 for FAME (Agilent Technologies, Santa Clara, Verenigde Staten) met als afmetingen: 60 m bij 0,20 mm en een filmdikte van 0,20 µm. De oven van de gaschromatograaf doorliep een specifiek temperatuurprogramma: 50 °C aanhouden gedurende 4 minuten vervolgens stijgen met 20 °C/min naar 225 °C, deze temperatuur gedurende 25 minuten aanhouden. Als dragergas werd helium gebruikt aan een debiet van 1 ml/min, het make-up gas was helium aan een debiet van 20 ml/min. De temperatuur van de FID was 300 °C, als gas werd lucht en waterstofgas gebruikt aan een debiet van respectievelijk 400 ml/min en 40 ml/min.
3.2.2.3 Dataverwerking en statistische analyse
In totaal werden 64 stalen geïnjecteerd op het GC-FID toestel: 45 stalen van gerookte visolie, 6 stalen van verse visoliecapsules, 6 stalen van visoliecapsules na een bewaarperiode, 6 gethermoxideerde visoliecapsules en 1 geëpoxideerde visoliecapsule. De GLC reference standard werd eveneens bij elke batch geïnjecteerd. Aan de hand van de retentietijden, bekomen uit de GLC reference
standard, konden de verschillende vetzuurpieken uit de stalen geïdentificeerd
22 (C19:0), de piekoppervlakten en de afgewogen hoeveelheid staal kon het gehalte per vetzuur berekend worden volgens onderstaande formule:
! !"#$%%& 100 ! !"ë!"#$ℎ!!"# !"# = !""!"#$%%& !""!" × !"##"!" !"##"!"##$ ×100
De resultaten werden uitgedrukt in g vetzuur/100 g geëxtraheerd vet. Aan de hand van het vochtgehalte van de visstalen werd ook het gehalte in g vetzuur/100 g droge stof bepaald.
Op de gerookte visstalen werden statistische analyses uitgevoerd. Om een indicatie van uitbijters te krijgen werd naast het gemiddelde en standaarddeviatie over de vijf mengstalen ook de relatieve standaarddeviatie berekend per vetzuur. Bij een RSD hoger dan 10% werd een Grubbs test uitgevoerd op de resultaten. Vetzuren die een significante uitbijter vertoonden (p<0,05) werden weggelaten. Na filteren van de data werd gecontroleerd op normaliteit, de data bleken normaal verdeeld te zijn waardoor een variantieanalyse kon uitgevoerd worden. Hiervoor werd een one-way ANOVA-test uitgevoerd om significante verschillen te bepalen (p<0,05). De statistische analyse werd uitgevoerd met het SPSS Statistics 25 datapakket (IBM, New York, Verenigde Staten).
3.2.3 Exploratieve studie van epoxy- en hydroxyvetzuren met GC-MS
Voor de exploratieve studie werd gebruik gemaakt van een protocol gebaseerd op de door Mubiru et al. beschreven methode voor analyse van epoxyvetzuren (Mubiru, Shrestha, Papastergiadis, & De Meulenaer, 2013).
3.2.3.1 Transmethylatie
Van de verschillende visoliestalen werd 200,0 mg afgewogen in een centrifugebuis. Hier werd 5,0 ml tertiair-butyl methyl ether (tBME) en 2,5 ml 0,2 M natriummethoxide oplossing in methanol aan toegevoegd. Dit werd gevortext gedurende 1 minuut. Na 2 minuten te laten staan bij kamertemperatuur werd 0,17 ml 0,5 M H2SO4 toegevoegd. Daarna werd 5,0 ml gedestilleerd water toegevoegd aan de stalen en werden deze gevortext. Na scheiding van de fasen werd de bovenliggende fase via een plooifilter met een bodem watervrij natriumsulfaat overgebracht in een peervormige kolf. Deze kolf was vooraf gewogen. De extractie vond twee keer plaats. Dit door nadien terug 5,0 ml tBME toe te voegen aan de centrifugebuis en gedurende 30 seconden te
homogeniseren. Dit werd opnieuw via de plooifilter overgebracht in de peervormige kolf. Finaal werd de filter gespoeld met 15,0 ml tBME. Het solvent (tBME) werd vervolgens verwijderd uit de peervormige kolf door middel van een rotavapor. Ten slotte werden de peervormige kolven met de vetzuuresters gewogen.
3.2.3.2 Solid phase extraction (SPE)
Activatie silicagel
Voor de uitvoering van een solid phase extraction werd gebruik gemaakt van silicagel. Deze silica diende eerst geactiveerd te worden. Hiervoor werd een hoeveelheid silicagel gedroogd in een moffeloven bij 450 °C en dit gedurende 12 uur. Na afkoelen in een desiccator werd het vochtgehalte op 10% gebracht met gedestilleerd water en gedurende 1 uur geschud. De geactiveerde silica werd maximaal twee weken afgesloten bewaard in een desiccator.
Voorbereiding kolom
De kolom werd voorbereid door 1,0 g geactiveerde silicagel in een SPE cartridge te brengen. De cartridge had als afmetingen: 6,5 cm hoog bij 1,3 cm diameter. Op deze kolom werd 3,0 ml van een 98:2 v/v n-hexaan-diethylether oplossing (98:2 solvent) gebracht en vervolgens werd de pakking geroerd. Na settelen van de silicagel werd op de kolom een laag van 0,5 cm zeezand aangebracht ter bescherming van de pakking. Finaal werd de elutievloeistof afgevoerd door de kraan van de kolom onderaan te openen. De pakking werd tijdens SPE continu vochtig gehouden. Figuur 3.1 geeft de opstelling weer.
24 Extractie van verschillende fasen
De vetzuuresters in de kolf werden terug in oplossing gebracht door 17,0 ml 98:2 solvent toe te voegen. Onderstaande werkwijze werd uitgevoerd op de stalen na transmethylatie:
Ø Extractie van de apolaire fractie: De esters in 98:2 oplossing werden zorgvuldig overgebracht op de silicagel kolom totdat de 17,0 ml volledig overgebracht was. Na openen van de kraan werd de apolaire fractie afgevoerd.
Ø Extractie van polaire fractie 1: Na afvoeren van de apolaire fractie werd de kraan van de cartridge opnieuw gesloten. Vervolgens werd 15,0 ml van een 90:10 v/v n-hexaan-diethylether oplossing (90:10 solvent) toegevoegd aan de kolom. Na openen van de kraan werd de eerste polaire fractie (epoxyfractie) opgevangen in een proefbuis. Vervolgens werd de proefbuis drooggedampt onder stikstof. Deze fractie werd door middel van iso-octaan overgebracht in donkere vials en drooggedampt. Finaal werd 1000 µl iso-octaan toegevoegd aan de vial. Hiervan werd 200,0 µl gebruikt voor GC injectie. De rest werd bewaard bij -20 °C.
Ø Extractie van polaire fractie 2: Na verzamelen van de eerste polaire fractie werd de kraan terug dicht gedaan. Vervolgens werd 25,0 ml van een 70:30 v/v n-hexaan-diethylether oplossing toegevoegd aan de kolom. De kraan werd geopend en de tweede polaire fractie (hydroxyfractie) werd verzameld in een proefbuis. Deze proefbuis werd drooggedampt onder stikstof. Vervolgens werden de componenten met iso-octaan overgebracht in vials en opnieuw drooggedampt.
3.2.3.3 Condities gaschromatograaf (GC-FID)
Voor de analyse van de stalen werd gebruik gemaakt van een gaschromatograaf uitgerust met FID. De injectie van de stalen gebeurde cold-on-colum, per staal werd 0,1 µl geïnjecteerd. De gebruikte kolom was dezelfde als onder sectie 3.2.2.2 beschreven. De oven van de gaschromatograaf doorliep een specifiek temperatuursverloop: 1 minuut aanhouden op 50 °C, vervolgens stijgen naar 225 °C aan 40 °C/min en dit 45 minuten aanhouden.
Als dragergas werd helium gebruikt aan een debiet van 1 ml/min, het make-up gas was helium aan een debiet van 20 ml/min. De temperatuur van de FID was 300 °C,
als gas werd lucht en waterstofgas gebruikt aan een debiet van respectievelijk 400 ml/min en 40 ml/min.
3.2.3.4 Condities massaspectrometer (GC-MS)
Voor de identificatie van de pieken werd gebruik gemaakt van een massaspectrometer (5975C VL MSD with triple axis detector, Agilent Technologies, Santa Clara, Verenigde Staten). Hier werd 1,0 µl staal geïnjecteerd door middel van een Split-Splitless injector uitgevoerd in de Splitless mode. De oven van de gaschromatograaf (7890A GC System, Agilent Technologies, Santa Clara, Verenigde Staten) doorliep een specifiek temperatuursprogramma: 1 minuut aanhouden op 50 °C, vervolgens stijgen naar 225 °C aan 40 °C/min en dit 70 minuten aanhouden. De MS interface was een capillaire directe interface met een temperatuur van 250 °C. De MS scande over een range van 30 m/z tot 600 m/z aan een scansnelheid van 3,64 cycli per seconde. De ionisatie zelf gebeurde door middel van elektron impact (70 eV).
3.2.3.5 Dataverwerking
Aan de hand van de bekomen massaspectra kunnen de verschillende oxidatiecomponenten geïdentificeerd worden. In de verschillende visoliestalen werd onderzocht welke componenten al dan niet aanwezig waren, hierbij werd vooral gefocust op epoxyvetzuren van EPA en DHA. Verder werd ook een semi-kwantitatieve analyse uitgevoerd door middel van ratio’s.
26
4 Resultaten
4.1 Vetzuursamenstelling van de visstalen
4.1.1 Kwalitatieve analyse: identificatie van vetzuurpieken
De verschillende vetzuren, aanwezig in de stalen, werden geïdentificeerd aan de hand van hun retentietijd op de kolom. Hiervoor werd een standaard gebruikt die bepaalde vetzuuresters bevat. Aangezien de stalen meer vetzuren bevatten dan aanwezig zijn in de referentiestandaard, kunnen niet alle vetzuren geïdentificeerd worden op deze manier. De overige vetzuren in de visstalen werden geïdentificeerd aan de hand van de massaspectra van de betrokken pieken.
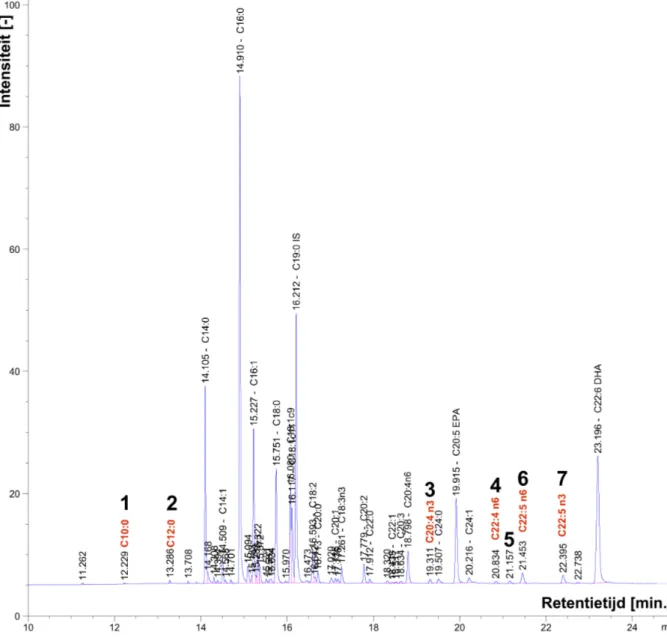
Als referentie werd gebruik gemaakt van de GLC reference standard 68D. Uit het chromatogram volgen de specifieke retentietijden voor de vetzuren in deze standaard. Figuur 4.1 geeft het chromatogram van de referentiestandaard weer.
Figuur 4.1: Chromatogram van de GLC 68D referentiestandaard met retentietijden.
De gebruikte interne standaard (C19:0) zat niet in de GLC 68D referentiestandaard. De retentietijd van de IS werd na aparte testen vastgesteld op 16,2 minuten. Figuur 4.2 geeft een chromatogram van de vetzuurmethylesters, aanwezig in vet geëxtraheerd uit een gerookt visstaal, weer. In bijlage 1 is ook een chromatogram
van de vetzuurmethylesters aanwezig in een visoliestaal (Biover) opgenomen. Het chromatogram van de methylesters bekomen na epoxidatie van datzelfde visoliestaal is eveneens opgenomen in bijlage 1.
Figuur 4.2: Chromatogram van vetzuurmethylesters bekomen van vet geëxtraheerd uit een gerookt visstaal (FTT, maand 0).
20 methylesters van vetzuren werden geïdentificeerd in de visstalen door middel van de standaard. Naarmate de ketenlengte toeneemt zal de retentietijd ook toenemen. Aan de hand van het verschil in retentietijden voor C14:0, C16:0, C18:0 en C20:0 werd geschat waar de mogelijke posities van C10:0 en C12:0 lagen. De posities van C10:0 (piek 1) en C12:0 (piek 2) werden bevestigd aan de hand van
28 massaspectrometrie en de NIST databank die massaspectra bevat voor verschillende componenten.
Figuur 4.3 geeft voor piek 3 het massaspectrum weer. Ook het massaspectrum voor C20:4 n3 volgens de databank is weergegeven.
Figuur 4.3: Massaspectrum van onbekende piek 3 uit het chromatogram van methylesters, bekomen van vet geëxtraheerd uit een gerookt visstaal (FTT, maand 0).
Uit deze figuur is af te leiden dat het massaspectrum van de onbekende piek grotendeels overeenkwam met dat van C20:4 n3. Verder volgde ook uit onderzoek van Alves & Bessa (2009) dat op de gebruikte CP-sil 88 kolom de retentietijd toeneemt met stijgende graad van onverzadiging. In datzelfde onderzoek werd ook vastgesteld dat binnen eenzelfde ketenlengte en graad van onverzadiging: omega-9 vetzuren eerst elueren, vervolgens omega-6 vetzuren en finaal omega-3 vetzuren (Alves & Bessa, 2009). Hierdoor zal C20:4 n3 na C20:4 n6 elueren maar voor C20:5 (beiden aanwezig in GLC referentiestandaard). Hieruit kan besloten worden dat piek 3 overeenstemt met C20:4 n3.
Op analoge manier werd piek 4 geïdentificeerd als C22:4 n6 (Figuur 4.4). Piek 5 kon niet met zekerheid geïdentificeerd worden.
Figuur 4.4: Massaspectrum van onbekende piek 4 uit het chromatogram van methylesters, bekomen van vet geëxtraheerd uit een gerookt visstaal (FTT, maand 0).
Piek 6 en 7 werden geïdentificeerd als respectievelijk C22:5 n6 en C22:5 n3 op basis van elutievolgorde en aan de hand van de databank. Figuur 4.5 geeft de massaspectra voor beide pieken weer in combinatie met de spectra uit de databank.
Figuur 4.5: Massaspectrum onbekende piek 6 (boven) en piek 7 (onder) uit het chromatogram van methylesters, bekomen van vet geëxtraheerd uit een gerookt visstaal (FTT, maand 0).
30
4.1.2 Kwantitatieve analyse van het vetzuurprofiel 4.1.2.1 Gerookte vis stalen
Tabel 4.1 geeft de percentages aan geëxtraheerd vet uit de visstalen weer bij verschillende rooktechnieken en bewaarperioden.
Tabel 4.1: Hoeveelheid geëxtraheerd vet uit de gerookte visstalen in functie van de rooktechniek en bewaarperiode.
Uit deze tabel volgt dat bij FTT stalen de bewaarperiode geen significante invloed had op het gehalte geëxtraheerd vet uit de stalen. Ook in het geëxtraheerd vetpercentage bij Chorkorstalen waren geen significante verschillen op te merken in functie van de tijd. Het gehalte geëxtraheerd vet verschilde wel significant bij de rookvatstalen na drie en zes maanden bewaring ten opzichte van maand 0. Concreet was een relatieve daling in gehalte aan geëxtraheerd vet op te merken van 29 % na 6 maanden ten opzichte van 0 maand. Wanneer de tijd als constante factor genomen werd, viel op dat de gehaltes aan geëxtraheerd vet significant verschillen tussen enerzijds FTT en Chorkorstalen en anderzijds rookvatstalen. Dit voor zowel 0 maand, 3 maanden als 6 maanden bewaring. De vet extraheerbaarheid bij FTT en Chorkorstalen was het laagste. Bij rookvatstalen kon het meeste vet geëxtraheerd worden uit de stalen.
De resultaten uitgedrukt in g vetzuur per 100 g geëxtraheerd vet zijn voor de geïdentificeerde vetzuren weergegeven in bijlage 2. In wat volgt worden de resultaten per categorie (totaal vetzuur, SFA, MUFA en PUFA) besproken in functie van de bewaartijd en rooktechniek. Tabel 4.2 geeft de totale vetzuurgehalten per 100 g geëxtraheerd vet weer voor de visstalen.
0 maanden 3 maanden 6 maanden
FTT 6,61±0,67 a 5,75±0,42 a 5,95±0,80 a
Chorkor 7,58±1,24 a,b 6,51±0,39 a 7,36±1,69 a,b
Rookvat 12,33±0,55 c 9,40±0,41 d 8,76±0,43 b,d
Gemiddelde waarden uit 5 herhalingen ± standaarddeviatie.
Verschillende letters duiden statistische significante verschillen aan (p<0,05).