De invloed van de bewaartemperatuur op de bloeikwaliteit
van de azalea
Aantal woorden: 20044
Freke Van Damme
Studentennummer: 01502763Promotoren: Prof. dr. Ir. MC. Van Labeke, dr. Ir. Annelies Christiaens Tutor: dr. Ir. Annelies Christiaens
Masterproef voorgelegd voor het behalen van de graad master in de Biowetenschappen - Tuinbouw
De invloed van de bewaartemperatuur op de bloeikwaliteit
van de azalea
Aantal woorden: 20044
Freke Van Damme
Studentennummer: 01502763Promotoren: Prof. dr. Ir. MC. Van Labeke, dr. Ir. Annelies Christiaens Tutor: dr. Ir. Annelies Christiaens
Masterproef voorgelegd voor het behalen van de graad master in de Biowetenschappen – Tuinbouw
I
Auteursrechtelijke bescherming
De auteur en de promotor geven de toelating deze scriptie voor consultatie beschikbaar te stellen en delen van de scriptie te kopiëren voor persoonlijk gebruik. Elk ander gebruik valt onder de beperkingen van het auteursrecht, in het bijzonder met betrekking tot de verplichting de bron uitdrukkelijk te vermelden bij het aanhalen van resultaten uit deze scriptie.
The author and the promoter give the permission to use this thesis for consultation and to copy parts of it for personal use. Every other use is subject to the copyright laws, more specifically the source must be extensively specified when using the results from this thesis.
II
Woord vooraf
Deze masterproef maakt deel uit van het Vlaio onderzoeksproject Atmo-Flor. Het onderwerp van deze masterproef sprak mij aan doordat, naast de interessante gedachte dat deze met zicht op de praktijk werd gedaan, deze proeven mij ook een blik wierpen op verschillende aspecten waar rekening mee gehouden moet worden tijdens onderzoek. Zo leerde ik niet alleen meer over de manieren van het bewaren van sierplanten, meer bepaald azalea’s, maar ook hoe dit een impact kan hebben op de fysiologie van de plant en welke gevolgen dit kan hebben voor een plant. Ook de combinatie van het opvolgen van de planten en het leren van verschillende meet- en analysetechnieken was zeer interessant.
Een masterproef schrijven kan je niet alleen. Daarom zijn er enkele mensen, die ik graag wil bedanken. Zonder hen zou deze masterproef niet tot stand gekomen zijn.
Om te beginnen zou ik graag het PCS en alle medewerkers willen bedanken om mij de kans te geven deze proeven uit te voeren op het proefcentrum. Vervolgens zou ik Mariane Bruggeman, de laborante van het proefcentrum, graag bedanken voor haar hulp in het labo en het uitvoeren van enkele analyses. Ook mijn tutor en promotor Annelies Christiaens wil ik bedanken voor haar ondersteuning en geduld bij de proeven en de antwoorden op mijn vele vragen tijdens het schrijven van deze masterproef. Mijn promotor, professor Marie-Christine Van Labeke, bedank ik voor haar opvolging en feedback tijdens het schrijven van deze masterproef. Dit was in deze bijzondere omstandigheden door de maatregelen getroffen omtrent Covid19 niet altijd evident.
Tot slot wil ik ook mijn ouders en mijn vrienden bedanken voor hulp tijdens het schrijven van deze scriptie.
III
Invloeden door Covid-19-maatregelen
Door de maatregelen die getroffen werden in verband met het Covid19-virus, verliep het schrijven van een thesis niet geheel zoals gepland. Voor deze thesis waren er echter geen grote hindernissen in het praktisch luik van het onderzoek. Door de maatregelen waren de analyses van de oplosbare suikers in de bladeren en de bloemen niet mogelijk omdat de labo-activiteiten onder de niet-essentiële activiteiten vielen. Hierdoor zijn er enkele hypothesen niet volledig kunnen behandeld worden.
IV
Abstract
De bewaring van een azalea is een belangrijke stap bij het traject dat de plant aflegt van de producent naar de consument. Deze stap kan echter een negatieve impact hebben op de kwaliteit van de plant en de bloei. Om de bewaring verder te optimaliseren, zodat de bewaarduur verlengd kan worden zonder kwaliteitsverlies, werd onderzocht wat de impact is van de bewaartemperatuur en de bewaarduur op de bloei van de azaleaplanten. Hiervoor werden twee cultivars onderzocht: de vroege cultivar Helmutt Vogel ‘Pia’ en de late cultivar ‘Sachsenstern’. Deze werden na forceren bij 2°C, 7°C en 15°C in het kleurtonend stadium bewaard gedurende 1 en 2 weken. Hierna werd bepaald of er visuele schade aan de planten en verdere ontwikkeling van de bloemen te bemerken was. Ook volgende eigenschappen werden bepaald, namelijk de zetmeelinhoud van de bladeren en bloemen, het stikstofgehalte, de relatieve waterinhoud en het vers- en drooggewicht. Het effect op de fotosynthese en plantgezondheid werd onderzocht via chlorofylfluorescentie, spectrale reflectantie van het blad en het chlorofylgehalte. De bloeikwaliteit werd opgevolgd en de bloemdiameter werd bepaald. Hieruit bleek dat bij 2°C de bloemontwikkeling van de planten tijdens de bewaring het beste werd tegengehouden. Deze planten kunnen echter na bewaring symptomen van kiltestress vertonen. Bij 15°C daalde de houdbaarheid van de planten in de huiskamer door een vroegtijdige bloemontwikkeling tijdens de bewaring. Hieruit blijkt dat 7°C een betere temperatuur is voor bewaring. Vanaf een bewaring van 2 weken kon voor geen enkele bewaartemperatuur een uniforme bloei meer aangetoond worden. De kwaliteit van de bloei neemt af.
Kernwoorden: Azalea, Hellmut Vogel ‘Pia’, ‘Sachsenstern’, bewaarduur, bewaartemperatuur, bloeikwaliteit
V
Abstract (English)
Storage of azalea is an important step in the process to bring the plants from the producer to the consumer. This step, however, can have a negative impact on the quality of the plant and the flowering quality. To optimize the storage conditions in order to prolong storage without compromising the quality of the plants, it is researched how temperature and storage duration have an impact on de flowering quality of azalea. To do this two cultivars are used: the early cultivar Helmutt Vogel ‘Pia’ and the late cultivar ‘Sachsenstern’. After forcing till the colour showing buds they were stored at 2°C, 7°C and 15°C during 1 week or 2 weeks. Hereafter visual damage to the plants was noted. Besides, following properties were determined: the starch content of the leaves and the flowers, the nitrogen content, the relative water content and fresh- and dry weight. Effects on photosynthesis were evaluated by chlorophyll fluorescence, the spectral reflectance of the leaves and the chlorophyll content. Also, the flowering quality of the plants was observed and the maximal diameter of the flowers was measured. It turned out that the storage at 2°C was best at holding back the development of the flower buds. However, these were also more prone to chilling stress. At 15°C the shelf life of the plants in the living room decreased due to the development during storage. This shows that 7°C is a better temperature to store azaleas. After 2 weeks there was no uniform bloom anymore, which shows that with a longer storage duration, the quality of the inflorescences decreased.
Keywords: Azalea, Helmutt Vogel ‘Pia’, ‘Sachsenstern’, storage temperature, storage period, inflorescence, flower quality
1
Inhoudstafel
Auteursrechtelijke bescherming ... I Woord vooraf ... II Invloeden door Covid-19-maatregelen ...III Abstract ... IV Abstract (English) ... V
Inhoudstafel ... 1
Lijst met afkortingen ... 3
Lijst met figuren ... 4
Lijst met tabellen ... 7
Inleiding ... 9
Hoofdstuk I: Literatuurstudie ...10
1 Het economisch belang van azalea ...10
1.1 Sierteelt in België, meer bepaald Vlaanderen ...10
1.2 Azalea teelt in Vlaanderen ...10
1.3 Handelsbalans van azalea ...11
2 Rhododendron simsii ...12
2.1 Taxonomie van Rhododendron ...12
2.2 Veredeling en assortiment van potazalea’s ...13
3 Teelt van azalea ...14
4 Bewaring ...16 5 Koolhydraatmetabolisme ...17 5.1 Fotosynthese ...17 5.1.1 Lichtabsorptie ... 17 5.1.2 Lichtreacties ... 17 5.1.3 Donkerreacties of Calvincyclus ... 20 5.2 Ademhaling ...22 6 Chlorofylfluorescentie ...24
Hoofdstuk II: Materiaal en methode ...26
1 Plantenmateriaal ...26
2 Proefopzet ...26
3 Suiker- en zetmeelbepaling van blad en bloemknop ...27
2
3.2 Zetmeelbepaling ...28
4 Stikstofbepaling ...29
5 Bepaling van de bloeikwaliteit...29
6 Bloemdiameter ...29
7 Relatieve waterinhoud, vers- en drooggewicht ...29
8 Niet-destructieve metingen ...30
8.1 Chlorofyl fluorescentie ...30
8.2 Pigmentatie ...31
8.3 Spectrale reflectiepatronen ...31
9 Statistische verwerking ...33
Hoofdstuk III: Resultaten ...34
1 Klimaatsgegevens ...34
2 Visuele schade ...35
3 Verloop van het zetmeelgehalte ...36
4 Stikstof ...37
5 Uitbloei in de huiskamer ...37
6 Invloed van de bewaring op de bloemdiameter ...43
7 Relatieve waterinhoud ...43
8 Drogestofgehalte en vochtgehalte ...44
9 Chlorofylfluorescentie ...46
10 Pigmentatie ...47
11 Reflectantiepatronen ...48
Hoofdstuk IV: Bespreking ...52
1. De invloed van bewaring op de plantkwaliteit ...52
2. Uitbloei wordt beïnvloed door bewaring ...55
Algemeen besluit ...57
Literatuurlijst ...58
3
Lijst met afkortingen
ARI Anthocyanin Reflectance Index
ATP Adenosinetrifosfaat
BGA Beschermde Geografische Aanduiding
C3 3-Fosfoglyceraat Molecules
C4 Koolstoffixatie
CAM-planten Crassulacean Acid Metabolism
CRI1 Carotenoid Reflectance Index 1
Ctr2 Carter Stress Index
CU Koudesom DW Drooggewicht DW% Droge Stofgehalte FW Versgewicht G6P-DH Fosfaatdehydrogenase HK Hexokinase
HPLC High-Performance Liquid Chromatography
LAI Bladoppervlakte Index
LHC Light Harvesting Complex
MCARI Modified Chlorophyll Absorption In Reflectance Index
NADPH Nicotineamide Adenine Dinucleotide Fosfaat
NDVI Normalized Differencence Vegetation Index
PAK Project Azalea Kwaliteit-voorwaarden
PAM Pulse Amplitude Modulation
PAR Photosynthetic Active Radiation
PC Plastocyanine
Pep-Carboxylase Fosfoenylpyruvaat-Carboxylase
Pheo Pheophytine
Pi Orthofosfaten
PPi Pyrofosfaat
PRI Photochemical Reflectance Index
QA Plastochinon A
QB Plastochinon B
Rubisco Ribulose-Bisfosfaat Carboxylase/Oxygenase
RV Luchtvochtigheid
RWC Relative Water Content
SD Standaard deviatie
SE Standaard fout
TW Turgorgewicht
4
Lijst met figuren
Figuur 1 Belgische sierteeltoppervlakten voor de periode 2009-2018. Boven: Sierteelt per teelt; Onder: Azalea’s in serres en open lucht
Figuur 2 Verdeling van het bloementeeltareaal in Vlaanderen 2018
Figuur 3: Aandeelbestemmingen in Belgische export van azalea's en rhododendrons (in % van de exportwaarde)
Figuur 4 Differentiatie van het bloemprimordium bij azalea: Boven: stadium 1, 2 en 4 ; Onder: stadium 5, 7 en 8
Figuur 5 Fasen van bloemontluiking: Van links naar rechts: groene, kleurtonende bloemknop, kaarsvlam en open bloem
Figuur 6 Het Z-schema, dat de energieoverdracht weergeeft van fotosysteem II (P680) naar fotosysteem I (P700)
Figuur 7 Schematische voorstelling van de verschillende fasen van de fotosynthese in de chloroplast
Figuur 8 Fotosynthese-lichtresponsiecurve op plantniveau voor 'Nordlicht (A) en 'Thesla (B) en het effect op het ontwikkelingsstadium van de knoppen. Pmax: maximale fotosynthese, Ic:
lichtcompensatiepunt,RD de donkerrespiratie, c kwantumefficiëntie
Figuur 9 Schematische voorstelling van de donkerreacties bij A: C3-planten; B: C4-planten (Taiz and Zeiger 2002)
Figuur 10 Schematische voorstelling van de respiratie met de glycolyse, de pentosefosfaat pathway, de citroenzuurcyclus en de oxidatieve fosforylatie
Figuur 11: Het typisch verloop van de fluorescentie kinetieken van een blad zoals bepaald met een PAM fluorometer. F: kinetieken in het donker, F’: kinetieken in het licht, SP: saturatie pulsen, AL: actinisch licht
Figuur 12 'H. Vogel' Pia (links) en 'Sachsenstern' (rechts)
Figuur 13 Niet-destructieve meters: A. Mini-PAM, B. Dualex, C Polypen
Figuur 14 Absorptie patronen van chlorofyl, anthocyanen en flavonoïden in een blad. Chlorofyl bevindt zich in het mesofyl weefsel terwijl flavonoiden en anthocyanen accumuleren in de epidermis. Het absorptiespectrum in het zichtbare en nabije infrarood licht van de Dualex meter is eveneens weergegeven.
Figuur 15 Schade bij 'Pia' A. door vraat bij de bloem na 5 dagen in huiskameromstandigheden van planten die 1 week bij 15°C werden bewaard, B. vraat aan het blad na 7 dagen in huiskameromstandigheden van planten die 2 weken bij 7°C werden bewaard. C. Verwelking op 12 november bij een plant van 1 week bewaring bij 15°C. D. Schade door vermoedelijk Botrytis aan het blad bij een plant van de controle na 21 dagen in huiskameromstandigheden.
5
Figuur 16 Schade bij 'Sachsenstern' A. geel verkleuring van de bladeren net na bewaring bij de controle, B. vraat aan het blad na 7 dagen in huiskameromstandigheden van planten die 2 weken bewaard werden bij 2°C, C. een tak bruine verdroogde bladeren van een plant bij 1 week bewaring bij 7°C.
Figuur 17 Zetmeelgehalte bij 'Pia' (A. in het blad ; B. In de bloem) en bij 'Sachsenstern' (C. in het blad ; D. in de bloem). Verschillende letters tonen de significante verschillen aan ( p < 0.05).
Figuur 18 Stikstofgehalte [g/100g DW] bij azalea A. 'Pia' ; en B. 'Sachsenstern'. Verschillende letters tonen de significante verschillen aan (p < 0.05).
Figuur 19 Ontwikkelingsstadia na bewaring (0 dagen in huiskameromstandigheden) bij de verschillende bewaaromstandigheden bij 'Pia'. Verschillende letters geven de significante verschillen per ontwikkelingsstadium weer (p < 0.05).
Figuur 20 'Pia' onmiddellijk na bewaring A. controle; B. 1 week bij 2°C; C. 1 week bij 7°C; D. 1 week bij 15°C; E. 2 weken bij 2°C; F. 2 weken bij 7°C; G. 2 weken bij 15°C
Figuur 21 Verloop van de uitbloei volgens het verloop van het percentage groene en kleurtonende knoppen, het kaarsvlamstadium en de open bloemen bij azalea 'Pia' bij A. de controle; B. 1 week bij 2°C; C. 2 weken bij 2°C; D. 1 week bij 7°C; E. 2 weken bij 7°C; F. 1 week bij 15°C en G. 2 weken bij 15°C.
Figuur 22 Ontwikkelingsstadia na bewaring (0 dagen in huiskameromstandigheden) bij de verschillende bewaaromstandigheden bij 'Sachsenstern’'. Verschillende letters geven de significante verschillen per ontwikkelingsstadium weer (p < 0.05).
Figuur 23 'Sachsenstern' onmiddellijk na bewaring A. controle; B. 1 week bij 2°C; C. 1 week bij 7°C; D. 1 week bij 15°C; E. 2 weken bij 2°C; F. 2 weken bij 7°C; G. 2 weken bij 15°C Figuur 24 Bruine verkleuring van de bloemranden door verwelking bij de planten, die 2 weken bij 2°C werden bewaard na 11 dagen in huiskameromstandigheden
Figuur 25 Verloop van de uitbloei volgens het verloop van het percentage groene en kleurtonende knoppen, het kaarsvlamstadium en de open bloemen bij azalea 'Sachsenstern’' bij A. de controle; B. 1 week bij 2°C; C. 2 weken bij 2°C; D. 1 week bij 7°C; E. 2 weken bij 7°C; F. 1 week bij 15°C en G. 2 weken bij 15°C.
Figuur 26 Invloed van de bewaarduur en –temperatuur op de bloemdiameter [cm] bij A. azalea ‘Pia’ en B. azalea ‘Sachsenstern’. Verschillende letters tonen de significante verschillen aan (p < 0.05).
Figuur 27 Invloed van de bewaarduur en –temperatuur op de RWC [%] bij A. azalea 'Pia' en B. azalea 'Sachsenstern'. De letters tonen de significante verschillen aan (p < 0.05).
Figuur 28 Invloed van de bewaarduur en –temperatuur op de het drogestofgehalte [DW%] bij azalea 'Pia' (A. in het blad en B. in de bloem) en bij azalea 'Sachsenstern' (C. in het blad en D. in de bloem). De letters tonen de significante verschillen aan ( p < 0.05).
6
Figuur 29 De maximale kwantumefficiëntie van PSII (Fv/Fm) na 0 uur, 2 uur en 24 uur in de
huiskamer bij azalea 'Pia' (resp. A, B en C) en 'Sachsenstern' (resp. D, E, F). De ster toont de significante verschillen na 2 uur en 24 uur tegenover 0 uur (p < 0.05). Verschillende letters tonen de significante verschillen tussen de objecten (p < 0.05)
Figuur 30 Chlorofylgehalten na bewaring en na 1 week in de huiskamer bij azalea 'Pia' (resp. A en B) en 'Sachsenstern' (resp. C en D). De ster toont de significante verschillen na 1 week in de huiskamer tegenover net na bewaring (p < 0.05). De letters tonen de significante verschillen aan tussen de objecten (p < 0.05.)
Figuur 31 Het verloop van MCARI naargelang de chlorofylinhoud (µg/cm²) van het blad Figuur 32 Klimaatgegevens tijdens forcerie.A. Slralingsintensiteit bij 'Pia' ; B. Temperatuur bij 'Pia ; C. RV bij 'Pia' ; D. Stralingsintensiteit bij 'Sachsenstern' ; E. Temperatuur bij 'Sachsenstern' ; F. RV bij 'Sachsenstern’
Figuur 33 Klimaatgegevens bij bewaring. A. RV bij 'Pia' ; B. Temperatuur bij 'Pia' ; C. RV bij 'Sachsenstern' ; D. Temperatuur bij 'Sachsenstern'
Figuur 34 Klimaatgegevens in de huiskamer tijdens uitbloei. A. RV bij 'Pia' ; B. Temperatuur bij 'Pia' ; C. RV bij Sachsenstern ; D. Temperatuur bij 'Sachstenstern'
7
Lijst met tabellen
Tabel 1 Overzicht van het genus Rhododendron
Tabel 2 Overzicht van de toegepaste bewaarduur en bewaartemperatuur
Tabel 3 Gemiddelde waarden voor de temperatuur, de relatieve vochtigheid (RV) en de lichtintensiteit bij azalea's 'Pia' en 'Sachsenstern' tijdens de forcerie met de standaard deviatie (SD)
Tabel 4 Gemiddelde waarden voor de reële temperatuur en RV bij azalea's 'Pia' en 'Sachsenstern' tijdens de bewaring bij de verschillende temperaturen met de standaard deviatie (SD)
Tabel 5 Gemiddelde waarden voor de temperatuur en RV bij azalea's 'Pia' en 'Sachsenstern' in de huiskamer met de standaard deviatie (SD)
Tabel 6 Invloed van de bewaarduur en –temperatuur op het gemiddelde versgewicht (FW) en drooggewicht (DW) van het blad en de bloem bij azalea 'Pia'. De letters tonen de significante verschillen aan met p < 0.05 voor elke kolom.
Tabel 7 Invloed van de bewaarduur en –temperatuur op de het gemiddeld versgewicht (FW, mg) en drooggewicht (DW, mg) van het blad en de bloem van azalea 'Sachsenstern'. De letters tonen de significante verschillen per parameter aan met p < 0.05.
Tabel 8 Gemiddelde waarden van de indices net na bewaring voor ieder object voor 'Pia' Verschillende cursieve letters tonen de significante verschillen aan tussen de objecten per index (p < 0.05). De kleine letters tonen de verschillen van de bewaarduur aan. De drukletters tonen de verschillen tussen de bewaartemperatuur. De laatste 3 rijen tonen de significante p-waarden van de verschillende factoren (ns = niet significant).
Tabel 9 Gemiddelde waarden van de indices na 1 week in de huiskamer voor ieder object voor 'Pia'. Verschillende kleine letters tonen de significante verschillen aan tussen de bewaarduur per index (p < 0.05). De drukletters tonen de verschillen tussen de bewaartemperatuur (p < 0.05). De laatste 3 rijen tonen de significante p-waarden van de verschillende factoren (ns = niet significant). De ster toont de significante verschillen van de index net na bewaring (p < 0.05).
Tabel 10 Gemiddelde waarden van de indices net na bewaring voor ieder object voor 'Sachsenstern'. Verschillende cursieve letters tonen de significante verschillen aan tussen de objecten per index (p < 0.05). De kleine letters tonen de verschillen van de bewaarduur aan (p < 0.05). De laatste 3 rijen tonen de significante p-waarden van de verschillende factoren (ns = niet significant).
Tabel 11 Gemiddelde waarden van de indices na 1 week in de huiskamer voor ieder object voor 'Sachsenstern'. Verschillende letters tonen de significante verschillen aan tussen de bewaarduur per index (p < 0.05). De laatste 3 rijen tonen de significante p-waarden van de
8
verschillende factoren (ns = niet significant). De ster toont de significante verschillen van de index net na bewaring (p < 0.05).
9
Inleiding
De azaleateelt beslaat 24% van het areaal van de bloementeelt en is daarmee één van de meest geteelde bloeiende potplanten in België. Het belangrijkste productiegebied ligt in Oost-Vlaanderen. De teelt is verantwoordelijk voor een handelssaldo van 32.6 miljoen euro in België (Statbel, 2018). De azaleateelt is dus een zeer belangrijke teelt in België. Daarom wordt steeds bekeken hoe de productieketen verder geoptimaliseerd kan worden en de teler steeds kwaliteitsvolle producten kan aanbieden aan de consument. De bewaring van azalea’s is hierin een belangrijke stap. Wanneer de planten onder ongunstige omstandigheden worden bewaard kunnen deze schade oplopen met een onregelmatige bloei tot gevolg Om dit te vermijden, moeten de bewaaromstandigheden van de planten steeds geoptimaliseerd worden.
In deze masterproef wordt onderzocht of het mogelijk is azalea’s te bewaren in kleurtonende fase zonder te moeten inboeten in de kwaliteit van de plant en meer bepaald de bloei, wanneer ze in de huiskamer van de consument terecht komen. Hierbij werd onderzocht hoe de azalea’s reageerden op een bewaring bij drie verschillende temperaturen, namelijk 2°C, 7°C en 15°C. Na bewaring werd bekeken bij welke temperaturen de planten nog steeds voldeden aan de eisen voor een kwalitatieve azalea. De planten werden één week en twee weken bewaard om na te gaan wat het effect is van de bewaarduur. Er werd nagegaan of het overbrengen van de azalea’s van de forcerie met een hoge lichtintensiteit en hoge temperaturen naar een donkerbewaring bij lage temperaturen, tekenen van kiltestress zou geven aan de planten. Dit werd bestudeerd bij twee genotypes: de vroege cultivar H. Vogel ‘Pia’ en de late cultivar ‘Sachsenstern’. De visuele schade aan de planten onmiddellijk na bewaring werd eerst beschouwd. Daarna werd de bloei in de huiskamer opgevolgd om de kwaliteit van de uitbloei te onderzoeken. Om de interne kwaliteit te onderzoeken, werden enkele destructieve metingen en niet-destructieve metingen uitgevoerd. Bij de destructieve metingen werden de reservestoffen, en meer bepaald het zetmeelgehalte bepaald. Ook het stikstofgehalte en de relatieve waterinhoud (RWC) gecombineerd met het drogestofgehalte, vers- en drooggewicht, werden geanalyseerd. Tot slot werd de invloed van bewaring op het fotosysteem bestudeerd door de niet-destructieve metingen van de chlorofypfluorescentie, het chlorofylgehalte en de spectrale reflectantiepatronen van de bladeren. Deze metingen werden opnieuw uitgevoerd op de planten in de huiskamer om eventueel herstel op te sporen.
10
Hoofdstuk I: Literatuurstudie
1 Het economisch belang van azalea
1.1 Sierteelt in België, meer bepaald Vlaanderen
Het sierteeltareaal in België is 6.547 ha (Statbel, 2018). Het totale sierteeltareaal bleef sinds 2009 tot 2018 vrij stabiel (Figuur 1). 17% van de oppervlakte wordt besteed aan de teelt van bloemen. De overige oppervlakte wordt gebruikt voor boomkwekerij (Statbel, 2018). Het aandeel voor boomkwekerij gaat in licht stijgende lijn, terwijl het areaal bloementeelt daalt (VLAM, 2018b). Uit de cijfers blijkt dat hierbij meer dan 90% van het areaal gebruikt wordt voor teelt in open lucht (Statbel, 2018).
Figuur 1 Belgische sierteeltoppervlakten voor de periode 2009-2018. Boven: Sierteelt per teelt; Onder: Azalea’s in serres en open lucht (VLAM, 2018b)
In Vlaanderen is het areaal voor sierteelt 5.917 ha. Dit is zo’n 90% van het areaal sierteelt in België. 37% van de sierteelt in Vlaanderen kan gesitueerd worden in Oost-Vlaanderen en vertegenwoordigt hiermee het grootste aandeel aan sierteelt in Vlaanderen. Ook hier is bijna een vijfde van het sierteeltareaal in gebruik voor de teelt van bloemen (Statbel, 2018).
1.2 Azalea teelt in Vlaanderen
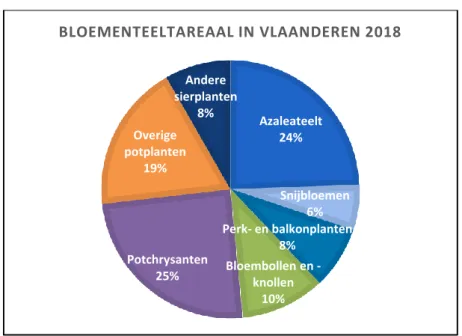
De teelt van azalea’s in België is volledig gesitueerd in Vlaanderen en beslaat een oppervlakte van 262 ha. Dit is een kwart van het areaal voor bloementeelt. Met deze oppervlakte beslaat de azaleateelt, na de potchrysant, het grootste areaal van de bloementeelt (Figuur 2). De volledige azaleateelt, met uitzondering van 1 bedrijf van 1 ha, is in Oost-Vlaanderen gelegen. Het gaat om zo’n 73 bedrijven (Statbel, 2018). In Figuur 1 is duidelijk dat de oppervlakte voor azaleateelt in België sinds 2009 afneemt. Azalea’s kunnen zowel in serres als in open lucht geteeld worden. De teelt onder glas is belangrijker in België
11
dan de openluchtteelt. De planten staan echter ook een deel van de teelt binnen om te overwinteren. (VLAM, 2018b).
Figuur 2 Verdeling van het bloementeeltareaal in Vlaanderen 2018 (Statbel, 2018)
In de 18e eeuw werd de azalea vanuit hun land van herkomst, nl. Japan en China, in België
geïntroduceerd. Door de juiste infrastructuur, de interesse in sierteelt, het gunstige klimaat en goede bodem, hadden Gent en omstreken alle elementen om de azaleateelt te laten bloeien. Het gevolg was de ontwikkeling van de Gentse azalea.
Om het label van ‘Gentse Azalea’ te mogen dragen moeten de azalea’s aan strenge regels voldoen. Ze moeten geteeld worden in Oost-Vlaanderen en voldoen aan de ‘Project Azalea Kwaliteit’-voorwaarden (PAK). Doordat Oost-Vlaanderen een zeer belangrijke producent is van de azalea, is de Gentse azalea in 2010 erkent als ‘Beschermde Geografische Aanduiding’ (BGA) en als streekproduct. De azalea was de eerste sierteelt die dit label kreeg (Gentse Azalea, 2019).
1.3 Handelsbalans van azalea
De exportwaarde van azalea en rhododendron bedraagt 33,2 miljoen euro. De importwaarde is 0,6 miljoen euro (VLAM, 2019c). Dit geeft een handelssaldo van 32,6 miljoen euro (VLAM, 2018a). Sinds 2009 stijgt de totale exportwaarde. Azalea en rhododendron vertegenwoordigen 5% van de exportwaarde van de niet-eetbare tuinbouwproducten. Dit aandeel is sinds 2009 vrij stabiel gebleven (VLAM, 2019b).
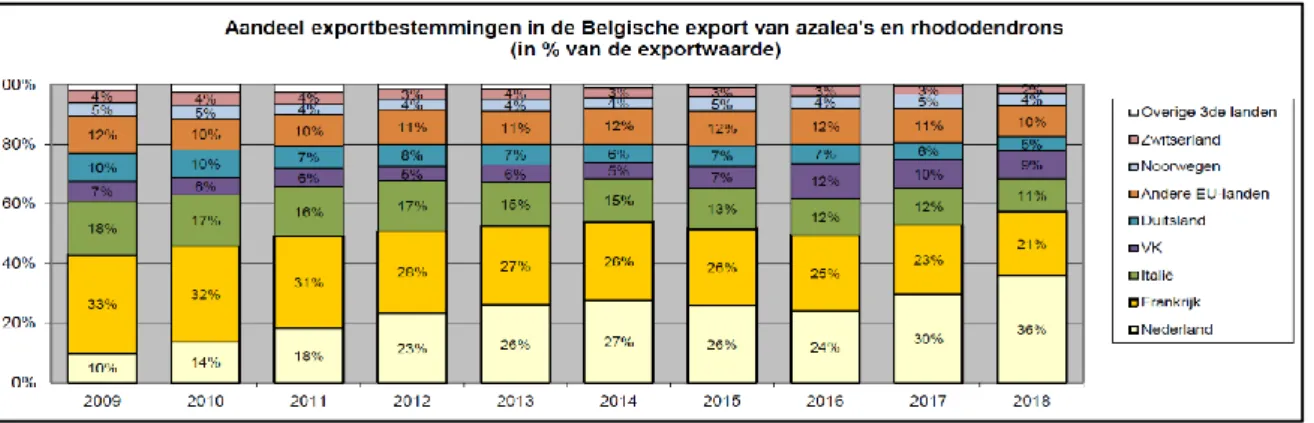
Figuur 3 geeft de exportbestemmingen van azalea’s en rhododendrons weer. De voornaamste bestemmingen voor export zijn Nederland en Frankrijk, die respectievelijk 36% en 21% van de geëxporteerde producten ontvangen. Sinds 2009 zijn er enkele opmerkelijke verschuivingen in het exportaandeel. Het aandeel van Frankrijk daalde (-12%) het sterkst sinds 2009. Ook voor Italië (-7%) en Duitsland (-5%) nam de export af. Voor Nederland (+26%) nam dit aandeel echter sterk toe en ook het Verenigd Koninkrijk (+2%) importeerde meer azalea’s en rhododendrons vanuit België (VLAM, 2019a).
Azaleateelt 24% Snijbloemen 6% Perk- en balkonplanten 8% Bloembollen en -knollen 10% Potchrysanten 25% Overige potplanten 19% Andere sierplanten 8% BLOEMENTEELTAREAAL IN VLAANDEREN 2018
12
Figuur 3: Aandeelbestemmingen in Belgische export van azalea's en rhododendrons (in % van de exportwaarde)
(VLAM, 2019a)
2 Rhododendron simsii
2.1 Taxonomie van Rhododendron
De azalea behoort tot de familie van de Ericaceae. Binnen deze familie wordt azalea, samen met rhododendron, geclassificeerd in het genus Rhododendron. De classificatie van dit genus werd in 1920-1930 ingedeeld door Balfour, Hutchinson, Tagg en Rehder. Deze onderverdeling werd in 1978 herbekeken door Cullen en Chamberlain (Heursel, 1999). Volgens deze systematiek bevat het genus 8 subgenera. Door het gebruik van genetische sequentie kon Goetsch et al. (2005) het aantal subgenera herleiden tot 5 op basis van 6 regio’s op het gen RPB2-I. Deze subgenera zijn Azaleastrum, Hymenanthes, Rhododendron,
Therorhodion en Choniastrum (Tabel 1).
Het geslacht Rhododendron kan onderverdeeld worden in bladverliezende en bladhoudende soorten. R. simsii is een houtachtige, altijd groene azalea. Deze species is, naast 65 andere, onderverdeeld in het subgenus Azaleastrum, sectie Tsutsusi. De niet-bladhoudende rhododendrons worden geclassificeerd in het subgenus Hymenanthes, sectie Pentanthera terwijl de bladhoudende tuinrhododendrons in de sectie Pontica zijn ondergebracht. Binnen de soort R. simsii kunnen 3 groepen gevormd worden: de R. simsii-hybriden met grote bloemen, de kleinbloemige Japanse azalea’s, die winterharde planten bevat, en de R.
noriakianum-hybriden met een piramidale planthabitus (Heursel, 1999).
Tabel 1 Overzicht van het genus Rhododendron (Goetsch, Eckert and Hall, 2005)
Subgenus Sectie 1. Rhododendron Rhododendron Vireya Pogonanthum 2. Hymenanthes Pontica Pentanthera 3. Azaleastrum Tsutsusi Sciadorhodion 4. Therorhodion - 5. Choniastrum -
13
2.1.1 Rhododendron simsii-hybriden
De groep van de R. simsii-hybriden, ook gekend als potazalea’s, zijn het resultaat van het kruisen van hoofdzakelijk 4 species. R. simsii Planch. bracht vroege bloei en de vorming van sporten aan bij de potazalea’s. R. indicum (L.) Sweet, zorgde voor de halve bolvorm en de karmijnrode kleur van de bloemen. R. scabrum G. Don en R. mucronatum G. Don. gaven de grote bloemen, de purperen bloemen en de onderstam ‘Concinna’, die lang belangrijk was voor de mogelijkheid tot griffelen (Heursel, 1999). Echter bij het introduceren van R. simsii in Europa startte de verwarring over de oorsprong van de R. simsii–hybriden toen deze hier werden geïntroduceerd als R. indicum. Deze onduidelijkheid werd nooit uitgeklaard en door eventuele vroegere veredeling in de landen van herkomst, o.a. Japan en China, is het niet duidelijk wat de ware origine van de potazalea is (De Riek et al., 2018).
2.1.2
Japanse azalea’s
De Japanse azalea’s, ook soms het Kurume-type genoemd, zijn voornamelijk herkenbaar door hun kleine bloemen. Er zijn vermoedelijk drie soorten, die aan de basis liggen van deze cultivars. De eerste soort is Rhododendron kiusianum Makino. Deze soort draagt de kleinste bloemen van alle azalea’s. Deze kunnen purper en lila gekleurd zijn. Karmijnrood en wit zijn weinig voorkomend. De tweede soort, die heeft bijgedragen tot de huidige Japanse azalea’s is R. kaempferi Planch. Deze zijn schaduwminnend en hebben rode bloemen. Tot slot maakte ook R. sataense Nakai deel uit van de ontwikkeling van de Japanse azalea’s. Deze vormen purperen, karmijnrode en rode bloemen en hebben grotere, zachtere en glanzende bladeren t.o.v. de eerder vernoemde soorten (Heursel, 1999).
2.1.3 Rhododendron noriakianum-hybriden
De Rhododendron noriakianum-hybriden zijn afkomstig van R. noriakianum Suzuki. Deze plant wordt niet gecommercialiseerd door zijn spichtige vorm en zijn te kleine bloemen. Wel wordt deze species gebruikt in veredelingsprogramma’s. Zo werd ze gekruist met R. simsii om een piramidale vorm te verkrijgen in een uitgebreid kleurenaanbod van wit, rood, karmijn en purper. Deze werden de Noria-hybriden genoemd (Heursel, 1999).
2.2 Veredeling en assortiment van potazalea’s
De veredeling van de Belgische potazalea startte meer dan 200 jaar geleden en in 1867 was de eerste Belgische azalea, ‘Madame Van der Cruyssen’, commercieel verkrijgbaar (De Riek
et al., 2018). Om steeds aan de verlangens van de kopers te kunnen voldoen, is veredeling
van groot belang en voortdurend in ontwikkeling (Heursel, 1999).
Er zijn drie belangrijke ontwikkelingen in de veredeling van de potazalea. Lange tijd werden azalea’s gegriffeld voor de commerciële teelt. De selectie van een cultivar, die op eigen wortel kon groeien was een doorbraak. Dit verminderde de nodige arbeid voor de teelt. Een tweede doorbraak in de veredeling van de azalea was een vervroegde bloei in de herfst. De voornaamste cultivar met deze eigenschap is ‘Hellmut Vogel’. Tot slot had ook verlenging van de houdbaarheid van de bloem een significante rol in de evolutie van de potazalea. Recent is ook de resistentie tegen biologische stress, voornamelijk schimmelziekten, een
14
topic bij veredeling. De belangrijkste eigenschappen waarop nog steeds veredeld wordt, zijn de bloemkarakteristieken, zoals de bloemkleur, bloemgrootte, etc., maar ook de bladkarakteristieken, plantvorm en bloeiperiode zijn belangrijk. Door het voortdurend verder maken van kruisingen en het spontaan vormen van sporten ging dit snel. Hierdoor is er het hele jaar door een groot assortiment aan bloeiende planten beschikbaar. De bloemkleur kan variëren van karmijnrood naar rood, paars, roos en wit. Ook bonte bloemen en picotees zijn beschikbaar. De enkelvoudige bloemen kunnen door muteren van de meeldraden ook dubbele bloemen vormen (De Riek et al., 2018). Ook de mutatie van kelkbladeren kunnen zorgen voor dubbele bloemen (Heursel, 1999). De azalea’s kunnen ook op basis van de bloeiperiode onderverdeeld worden in zeer vroege (augustus), vroege (november) en late (februari) cultivars. Deze verdeling gebeurd op basis van de vroegste bloeiperiode van de cultivar in een gemiddeld teeltsysteem (Christiaens, 2014).
3 Teelt van azalea
Azalea wordt vegetatief vermeerderd, meer bepaald door het nemen van stekken. Afhankelijk van de gewenste plantgrootte, worden er 1 tot 5 stekken in een pot geplaatst om te bewortelen. Deze worden in een mengsel van veen en kokosnootvezels als substraat gestoken. De optimale pH voor de azaleastekken is 4,5. Wanneer de stekken zijn gestoken, worden ze overdekt met plastic. De luchtvochtigheid moet zo hoog mogelijk blijven en de bodemtemperatuur moet 23 – 25°C zijn, zodat de stekken in een ideaal klimaat verkeren om wortels te vormen.
Wanneer de stekken hun wortels hebben gevormd, mag de plastic verwijderd worden. Dit gebeurt na 8 tot 10 weken. De eerste topbeurt vindt dan plaats. De apicale dominantie wordt opgeheven, waardoor de okselscheuten uitlopen. Na de tweede topbeurt worden de planten buiten geplaatst op een containerveld voor verdere vegetatieve groei. De irrigatie van de planten gebeurt manueel of automatisch op basis van de instraling. Voor bemesting wordt gebruik gemaakt van een traagwerkende meststof, hoofdzakelijk Osmocote. Deze wordt met het substraat gemengd. Ook extra fertigatie kan worden toegepast. Wanneer de planten de gewenste grootte hebben behaald, worden de planten gestuurd naar de generatieve fase (Christiaens, 2014).
Bodson (1983) identificeert hierbij 9 stadia (Figuur 4). Stadium 0 is de vegetatieve knop. Stadium 1 is de aanleg van de knopschubben. In stadium 2 worden de bloemprimordia aangelegd, gevolgd door de aanleg van sepalen (stadium 3), petalen (stadium 4), de meeldraden (stadium 5), het vruchtblad (stadium 6), de verlenging van de stijl (stadium 7) en tot slot worden in stadium 8 de eicellen in de vruchtbeginsels aangelegd.
15
Figuur 4 Differentiatie van het bloemprimordium bij azalea: Boven: stadium 1, 2 en 4 ; Onder: stadium 5, 7 en 8
(Christiaens, 2014)
Onder natuurlijke omstandigheden wordt de bloei beïnvloed door de daglengte, temperatuur en lichtintensiteit. Rhododendron is een facultatieve korte dagplant, hoewel er ook facultatieve lange dagvariëteiten beschreven zijn. Om meer controle te hebben op het moment van bloei-inductie kunnen ook groeiregulatoren gebruikt worden. De meeste gebruikte groeiregulatoren zijn chloormequat en paclobutrazol (A. Christiaens et al., 2014). Deze spelen in op de gibberelline biosynthese (Rademacher, 2000). De producten worden 2 tot 8 keer wekelijks toegepast (Christiaens, 2014). Bij een eerste rembeurt wordt vaak chloormequat gebruikt. Elf dagen later is de bloei-inductie waarneembaar. Wanneer de bloemknoppen gevormd zijn, volgt nog een behandeling met paclobutrazol om de axillaire knoppen niet te laten uitlopen. Deze beïnvloeden de verdere differentiatie van de bloemen niet (Annelies Christiaens et al., 2014).
Na de ontwikkeling van de bloemknoppen moet de bloemknopdormantie doorbroken worden voordat de bloemknoppen over kunnen gaan naar anthese. Dit gebeurt door het geven van een koudebehandeling (Christiaens, 2014). De meest gebruikte temperatuur hiervoor is 7°C (Christiaens et al., 2013). Afhankelijk van de koudesom (CU), die de cultivar nodig heeft om de dormantie te doorbreken, wordt ze beschouwd als een vroege of late cultivar. Dit is het aantal uren dat de planten in deze temperatuur moeten staan voor het breken van de dormantie. De vroege cultivar ‘H. Vogel’ heeft 672 CU of 4 weken koude nodig, terwijl de semi-vroege cultivar ‘M. Marie’ 1008 CU of 6 weken en de late cultivar ‘G. Kint’ 1344 CU of 8 weken koude nodig heeft (Christiaens et al., 2013, 2015).
De optimale gemiddelde temperatuur om de bloemknopdormantie bij azalea te doorbreken is 6-8°C. De koudebehandeling kan eventueel ook vervangen worden door een behandeling met het groeihormoon gibberelline. Dit geeft echter een slechtere bloei dan een koudebehandeling.
16
Na het breken van de bloemknopdormantie kan het forceren van start gaan. Bij het forceren van de planten worden de planten voor twee tot drie weken in een serre geplaatst bij 20-21°C. Ze krijgen licht toegediend wanneer er niet voldoende natuurlijk licht beschikbaar is. Bij de anthese kunnen er 2 fasen onderscheiden worden, de verlenging van de kroonbladen en het openen van de bloemen. Voor het openen van de bloemen is energie nodig onder de vorm van koolhydraten die zorgen voor de opbouw van het osmotisch potentiaal. Ook het openen van de bloem kan in verschillende fases opgedeeld worden, nl. groene bloemknop, kleurtonende knop, kaarsvlam en open bloem (Figuur 5). Zodra de planten in de kleurtonende fase of in kaarsvlam zijn, kunnen ze uit de forcerie gehaald worden en worden ze verkocht (Christiaens, 2014).
Figuur 5 Fasen van bloemontluiking: Van links naar rechts: groene, kleurtonende bloemknop, kaarsvlam en open bloem (Christiaens, 2014)
4 Bewaring
De bewaring is een noodzakelijke stap in de productie van de azalea om de verkoopperiode te spreiden. Na de vele inspanningen, die geleverd zijn voor het produceren van een kwaliteitsvolle azalea, moet de bewaring en het daaropvolgend transport in optimale condities gebeuren. Hier mogen de planten niet onder lijden (Tijskens et al., 1996).
Tijdens de bewaring worden planten blootgesteld aan verschillende stressfactoren. Zo kunnen de planten droogtestress ondervinden, of juist overbewatering. Ook de aanwezigheid van ethyleen of de lange donkerperiode kunnen een negatieve invloed hebben op de kwaliteit van de planten. De opslag in het donker kan resulteren in de val van bladeren, bloemen en bracteeën alsook bruin- of geelkleuring van de bladeren. Dit toont aan dat de planten, onafhankelijk van de watergift, stress ondervinden. De azalea is in staat langere periodes van bewaring te doorstaan en kan ook goed lagere temperaturen verdragen (Tijskens et al., 1996).
17
5 Koolhydraatmetabolisme
5.1 Fotosynthese
5.1.1 Lichtabsorptie
Voor hun groei en ontwikkeling hebben planten energie nodig. Deze leggen ze vast in organische verbindingen met gebruik van zonne-energie. Dit doen ze volgens volgende vergelijking
6 CO2 + 6 H2O C6H12O6 + 6 O2
Koolstofdioxide Water Koolhydraten Zuurstof
De fotosynthese kan onderverdeeld worden in de licht- en donkerreacties. De fotosynthetisch actieve pigmenten absorberen specifieke golflengten van het zonlicht. Dit wordt de fotosynthetisch actieve straling (Photosynthetic Active Radiation, PAR) (400-700nm) genoemd. Het enige pigment, dat rechtstreeks kan deelnemen aan de lichtreacties, is chlorofyl. Deze bevinden zich in de cellen van groene weefsels. Er zijn twee soorten chlorofyl op basis van de golflengtes die ze absorberen: chlorofyl a (430-662nm) en chlorofyl b (454-643nm). Chlorofyl a is het pigment in het reactiecentrum. Chlorofyl b in het antennecomplex zorgt ervoor dat zelfs bij lage lichtintensiteiten voldoende energie opgevangen kan worden. Carotenoïden (400-500nm) zijn pigmenten die de geabsorbeerde energie kunnen doorgeven aan het chlorofyl. Samen vormen de chlorofyl en de carotenoïden het antenne-complex of het ‘light harvesting complex’ (LHC).
Om de energie van het licht vast te leggen in moleculen, zullen de pigmenten fotonen opnemen. Fotonen zijn pakketjes energie, die door de zon worden uitgestuurd. Naargelang de golflengte dat het licht heeft, zullen deze pakketjes meer of minder energie bevatten. Door een foton zal het pigment van een grondtoestand naar een geëxciteerde toestand overgaan. Wanneer ze deze terug afgeeft, valt ze terug naar de grondtoestand. De energie, die hierbij vrij komt, kan op 3 manieren afgegeven worden: als warmte, als foton (fluorescentie) of het wordt doorgegeven aan een ander pigment (resonantie). Bij de lichtreacties zal de energie doorgegeven worden door resonantie (Taiz and Zeiger 2002).
5.1.2 Lichtreacties
In de lichtreacties van de fotosynthese worden adenosinetrifosfaat (ATP) en nicotineamide adenine dinucleotide fosfaat (NADPH) gevormd als eindproducten. Deze reacties gaan door
in de chloroplasten (Taiz and Zeiger, 2002).
Fotosysteem I en Fotosysteem II gebruiken lichtenergie met verschillende golflengtes voor de reacties. Hiervoor hebben ze elk hun eigen antennecomplex ter beschikking, namelijk LHCI en LHCII. Voor Fotosysteem I (P700) is de energie afkomstig van verrood licht (>680nm) voldoende. Fotosysteem II (P680) gebruikt rood licht (680nm) voor de reacties (Taiz and Zeiger, 2002).
18
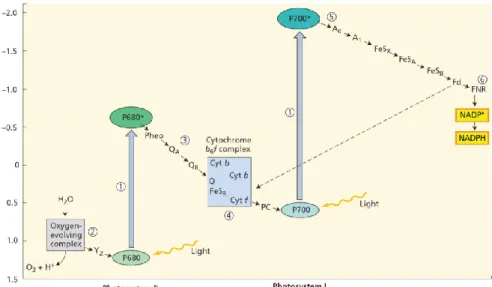
Figuur 6 Het Z-schema, dat de energieoverdracht weergeeft van fotosysteem II (P680) naar fotosysteem I (P700) (Taiz and Zeiger 2002)
In Figuur 6 wordt de vastlegging van lichtenergie weergegeven volgens het Z-schema. Wanneer LHCII en LHCI fotonen opnemen, exciteren Fotosysteem II (P680) en Fotosysteem I (P700), waarna ze deze doorgeven. P680 geeft deze door aan pheophytine (Pheo). P680 wordt na deze oxidatie, opnieuw gereduceerd door een tyrozine residue (Yz) met een
elektron afkomstig van een watermolecule. De twee fotosystemen zijn van elkaar afgescheiden door locatie, waardoor de elektronen van PSII naar PSI verplaatst moeten worden via de oplosbare elektronen carrier plastochinon. Het elektron wordt van Pheo vervolgens overgedragen naar opeenvolgend plastochinon A (QA) en plastochinon B (QB).
Met behulp van cytochroom b6f wordt het elektron van QB overgebracht op plastocyanine
(PC), een oplosbaar proteïne dat met het elektron P700+ opnieuw zal reduceren. Het
elektron dat bij excitatie van P700 wordt doorgegeven, wordt doorgegeven aan enkele elektronencarriers en zal uiteindelijk NADP+ naar NADPH reduceren. Deze wordt gebruikt in
de Calvincyclus om CO2 te reduceren.
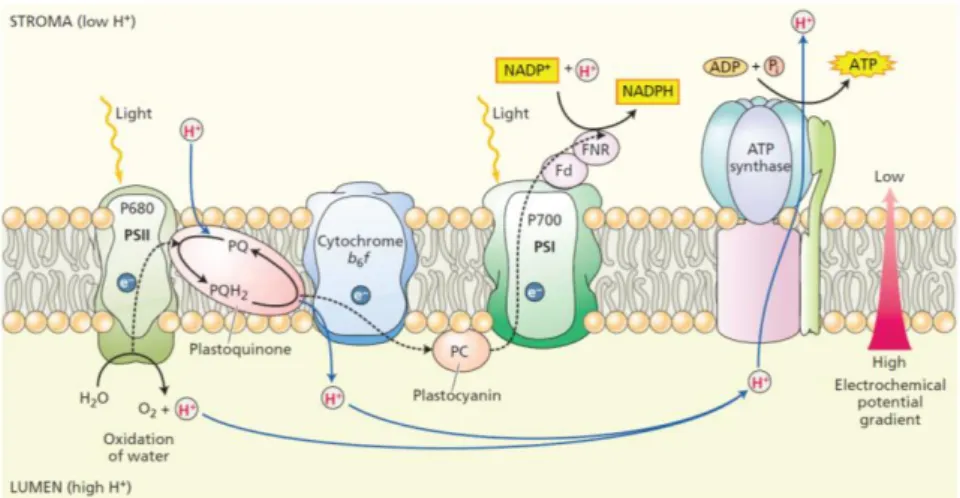
Het transport van de elektronen en de protonen wordt door vier verschillende proteïne-complexen uitgevoerd (Figuur 7). De elektronencyclus zorgt voor een afzet van protonen naar het lumen van de chloroplast. Deze protongradiënt wordt door ATP synthase gebruikt om ATP aan te maken. (Taiz and Zeiger, 2002).
19
Figuur 7 Schematische voorstelling van de verschillende fasen van de fotosynthese in de chloroplast (Taiz and
Zeiger, 2002)
Lichtintensiteit
Om de invloed van de lichtintensiteit op de netto fotosynthese te visualiseren wordt de lichtresponsie curve gebruikt (Figuur 8). Wanneer de lichtintensiteit onvoldoende hoog is, kan de lichtreactie niet door gaan, waardoor er geen energie wordt vastgelegd. Voor de Calvincyclus (ook wel donker reacties genoemd) is er echter geen licht nodig, waardoor deze wel nog steeds kan doorgaan totdat er onvoldoende energie aanwezig is. De netto-fotosynthese snelheid is hier negatief en er wordt netto CO2 afgegeven door de plant, omdat
de respiratie wel doorgaat. Naarmate de lichtintensiteit stijgt, zal ook de netto fotosynthetische snelheid stijgen. Deze zal nul zijn, wanneer de CO2-opname en de
elektronenstroom van de lichtreacties aan gelijke snelheid gebeuren als de respiratie. Dit is het lichtcompensatie punt (Ögren and Evans, 1993). De netto fotosynthetische snelheid zal blijven stijgen tot deze een plateau bereikt op Pmax. In Figuur 8 is deze 7,88 μmol CO2 m-2 s-1
voor ‘Nordlicht’. Bij ‘Thesla’ is Pmax 8,91 μmol CO2 m-2 s-1 voor planten met gesloten knoppen
en 9,16 μmol CO2 m-2 s-1 voor planten met kleurtonende knoppen. Dit is het punt waar de
saturatie van de reactiecentra optreedt (Ceulemans, Impens and Gabriëls, 1980). In de eerste fase is licht de limiterende factor voor een stijging in de fotosynthese. Vanaf Pmax
limiteert de CO2-beschikbaarheid een stijging (Ögren and Evans, 1993).
Figuur 8 Fotosynthese-lichtresponsiecurve op plantniveau voor 'Nordlicht (A) en 'Thesla (B) en het effect op het ontwikkelingsstadium van de knoppen. Pmax: maximale fotosynthese, Ic: lichtcompensatiepunt,RD de
20
Temperatuur
Ook de temperatuur kan een invloed hebben op de fotosynthese. Deze is echter kleiner dan deze van de lichtintensiteit. Lage temperaturen kunnen het PSI inactiveren, waardoor de fotosynthetische capaciteit daalt (Miyake, 2020). In extreme gevallen kan de temperatuur stress induceren. Chlorofyl, een belangrijke component in de fotosynthese, is echter zeer gevoelig aan stress, waardoor dus ook de fotosynthese beïnvloed wordt (Ashraf and Harris, 2013).
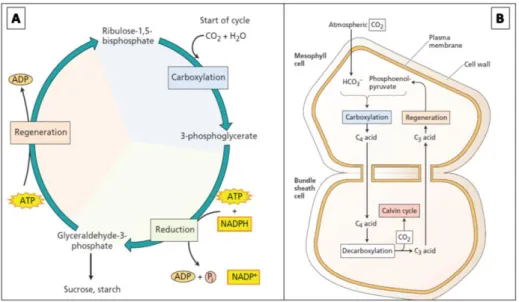
5.1.3 Donkerreacties of Calvincyclus
Bij de donkerreacties wordt CO2 gereduceerd om koolhydraten te vormen. Hierbij worden
NADPH- en ATP-moleculen verbruikt. Er zijn verschillende manieren waarop een plant CO2
kan assimileren. Ze kunnen in drie groepen verdeeld worden: C3, C4 en CAM (Taiz and
Zeiger, 2002).
C3 - planten
Figuur 9A toont de cyclus die doorlopen wordt voor de productie van suikers en zetmeel. Deze gaan door in het mesofyl. Om koolhydraten te vormen worden CO2 en H2O
gecombineerd met een 5-koolstof molecule, ribulose-1,5- bisfosfaat, om twee intermediaire 3-fosfoglyceraat molecules (C3) te vormen. Dit is een carboxylatie en wordt gekatalyseerd
door het enzym ribulose-bisfosfaat carboxylase/oxygenase (Rubisco). Deze intermediair wordt gereduceerd met verbruik van NADPH en ATP. In deze stap wordt glyceraldehyde-3-fosfaat gevormd. Eerst wordt 3-fosfoglyceraat omgezet tot 1,3-bisfosfoglyceraat gekatalyseerd door enzym 3-fosfoglyceraat kinase. Vervolgens wordt deze molecule gereduceerd naar glyceraldehyde-3-fosfaat en gekatalyseerd door NADP:glyceraldehyde-3-fosfaat dehydrogenase. Om de cyclus te sluiten, zodat de CO2-acceptor steeds aanwezig is,
wordt deze molecule gebruikt voor het regenereren van ribulose-1,5-bifosfaat. Hierbij is energie afkomstig van ATP nodig. Bij elke stap van de Calvincyclus wordt de koolstof (aangebracht door CO2) gereduceerd om incorporatie in organische moleculen mogelijk te
maken. De cyclus heeft drie ATP en één NADPH nodig om één koolstof in te bouwen.
Het voornaamste deel van de 3C-fosfaten wordt gebruikt om de cyclus te kunnen waarborgen. In stabiele omstandigheden wordt slechts een zesde van deze moleculen gebruikt voor de vorming van glucose en andere metabolieten, die zorgen voor de vorming van zetmeel. C3-planten krijgen hun naam door de verwijzing naar de intermediairen die 3
koolstoffen bevatten (Taiz and Zeiger, 2002). Azalea’s behoren tot deze groep.
C4-planten
Sommige planten zijn aangepast aan warmere klimaten en vermijden de fotorespiratie waarbij CO2 fixatie ruimtelijk gescheiden wordt van de cellen waar de Calvincyclus doorgaat.
Hierbij vindt een tussenstap plaats waarbij een verbinding met 4 koolstofatomen de eerste stap is van de koolstoffixatie (C4)
21
Figuur 9B geeft de C4-cyclus schematisch weer. CO2 wordt vastgelegd in de intermediaire
moleculen malaat of aspartaat. Het koolstofatoom afkomstig van CO2 zal vervolgens
doorgegeven worden voor de vorming van 3-fosfoglyceraat. De eerste carboxylatie wordt gekatalyseerd door PEP-carboxylase (fosfoenylpyruvaat-carboxylase) met vorming van fosfoenolpyruvaat. Deze vastlegging gaat door in de mesofylcellen. Vervolgens wordt het C4
-zuur getransporteerd naar de schedecellen, waar decarboxylatie doorgaat, gevolgd door de Calvin cyclus. Een C3-zuur blijft achter en wordt opnieuw naar de mesofylcel gestuurd voor
regeneratie van fosfoenolpyruvaat. Zo kan deze opnieuw optreden als CO2-acceptor.
Naast ATP en NADPH voor de Calvin cyclus, heeft het inbouwen van CO2 ook twee extra
ATP nodig. Dit metabolisme is dus meer energie eisend dan deze van C3-planten. C4-planten
zijn echter wel goed aangepast aan een droge, warme omgeving. PEP-carboxylase heeft HCO3- als substraat, waardoor er geen competitie optreed met O2. Dit is wel het geval voor
Rubisco in C3-planten. Door deze sterke activiteit van het enzym, is het mogelijke de stomata
sneller te sluiten om verdamping, en dus ook het waterverlies, te verminderen met een even hoge capaciteit aan CO2-fixatie (Taiz and Zeiger, 2002).
Figuur 9 Schematische voorstelling van de donkerreacties bij A: C3-planten; B: C4-planten (Taiz and Zeiger 2002)
CAM-planten (‘Crassulacean Acid Metabolism’)
Het CAM metabolisme heeft veel overeenkomstigheden met het C4-metabolisme. De CO2
-fixatie gebeurt gedurende de nacht en wordt als malaat in de vacuole opgeslagen. Overdag wordt vervolgens de opgeslagen malaat opnieuw getransporteerd en doet dienst als C-donor in de Calvincyclus. Door dit mechanisme kunnen de stomata overdag gesloten blijven. Op deze manier wordt ook het verdampen van water verminderd, met beter behoud van de waterbalans tot gevolg. Dit geeft de planten met dit metabolisme een voordeel in aride gebieden of met een epifytische levenswijze.
Facultatieve planten zijn een kleine groep planten, die onder optimale omstandigheden de C3-cyclus gebruiken voor het fixeren van koolstof en overschakelen naar het
22
Koolhydraatmetabolisme
Het koolhydraatmetabolisme omvat de biochemische omzettingen van koolhydraten in de plantencel, alsook de opslag en transport in en naar sinkweefsels (bv. wortels, jonge bladeren, bloemen,…). Gewoonlijk is het transportkoolhydraat sucrose en wordt voor opslag zetmeel aangemaakt. Beiden worden gevormd uit de glyceraldehyde-3-fosfaat, maar op een andere locatie in de cel. Zetmeel wordt aangemaakt in de chloroplast. Sucrose in het cytosol. Voor de aanmaak van zetmeel wordt fructose-1,6-bifosfaat gevormd van de triose-fosfaten uit de Calvin-cyclus. Deze wordt omgezet tot glucose-1-fosfaat en na reactie met ATP naar ADP-glucose. Deze vormt een polymeer, zetmeel. Wat er over blijft van de ATP-molecule is pyrofosfaat (PPi). Deze wordt meestal omgezet tot twee orthofosfaten (Pi).
Voor de omzet naar sucrose wordt de triose-koolhydraat naar het cytosol getransporteerd. Net als het zetmeel wordt deze omgezet naar ADP-glucose. Deze wordt echter vervolgens omgezet naar sucrose-fosfaat, gevolgd door een reactie tot sucrose.
De concentraties van orthofosfaat en triose-fosfaten zijn indicatoren of de koolstof in sucrose of zetmeel gefixeerd wordt. Dit wordt gecommuniceerd via de fosfaat (Pi)-translocator. Bij
een lage concentratie orthofosfaat in het cytosol, zal er minder transport van triose-fosfaat plaats vinden naar het cytosol, met als gevolg een productie van zetmeel. Bij een hoge concentratie aan orthofosfaat zal dit transport wel doorgaan waardoor sucrose gevormd wordt (Taiz and Zeiger, 2002).
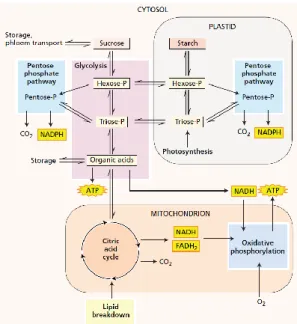
5.2 Ademhaling
Bij de ademhaling, of respiratie, worden de koolhydraten afgebroken om energie vrij te maken voor het metabolisme. Deze energie wordt vastgelegd in ATP-moleculen. Hieruit komen ook precursoren vrij voor biosynthese. Bij planten is aerobe respiratie het meest voorkomend. In een chemische formule kan de respiratie als volgt beschreven worden:
C12H22O11 + 12 O2 → 12 CO2 + 11 H2O
De respiratie kan in vier stappen onderverdeeld worden: glycolyse, pentosefosfaat pathway, de citroenzuurcyclus en de oxidatieve fosforylatie (Figuur 10).
Bij de glycolyse ondergaan suikers een omzetting naar C6-suiker fosfaten, gevolgd door een omzetting naar een C3-suiker-fosfaat. Hieruit worden vervolgens organische zuren, zoals pyruvaat, gevormd. Deze resulteren in de productie van een ATP en NADH. Dit gebeurt in het cytosol en de plastiden door oplosbare enzymen.
Voor de pentose-fosfaat pathway worden de suiker-fosfaten van de glycolyse gebruikt voor de vorming van een C5-ribulose-5-fosfaat. CO2 wordt vrijgesteld en twee NADPH-moleculen
worden gevormd. De ribulose-5-fosfaten worden omgezet tot suikers met drie tot zeven koolstoffen.
23
De pyruvaatmolecules uit de glycolyse ondergaan vervolgens oxidatieve decarboxylatie tot acetyl-CoA, waarbij een CO2-molecule wordt verwijderd en twee NADH-moleculen worden
gevormd. Acetyl-CoA wordt verwerkt in de citroenzuurcyclus. Ze wordt enkele keren gedecarboxyleerd, 16 NADH- en 4 FADH2-moleculen vormend gedurende de cyclus. Deze
stap gaat door in de mitochondriën.
Tot slot is er de oxidatieve fosforylatie. Hier worden de elektronen volgens de elektrontransportketen van NADPH overgebracht naar zuurstof (O2) door een serie aan
oxidatie-reductiereacties. In dit proces wordt energie opgeslagen in ATP voor ATPase. (Taiz and Zeiger, 2002)
Figuur 10 Schematische voorstelling van de respiratie met de glycolyse, de pentosefosfaat pathway, de citroenzuurcyclus en de oxidatieve fosforylatie (Taiz and Zeiger, 2002)
Temperatuur
De omgevingstemperatuur is een belangrijke sturende factor voor de respiratie. Deze gaat namelijk mee bepalen hoeveel koolhydraten de plant nodig heeft voor de groei en andere metabolische processen. Bij lage temperaturen zal de vraag naar koolhydraten laag zijn, door het stilvallen of verminderen van vele processen. In deze omstandigheden kunnen er reserves opgebouwd worden. Bij hoge temperaturen echter, indien de assimilatie van de koolhydraten onvoldoende snel gebeurd, zullen deze opgeslagen moleculen verbruikt moeten worden (A. Christiaens et al., 2014).
24
6 Chlorofylfluorescentie
Zoals eerder vermeld kan bij het terugvallen van chlorofyl naar de grondtoestand een deel van de energie verloren gaan als fotonen. Dit wordt zichtbaar als fluorescentie. Door deze fluorescentie te meten kan de stress van de plant gemeten worden. (Taiz and Zeiger, 2002). In de lichtreactie is de eerste acceptor van het elektron na excitatie van het reactiecentrum van PSII plastochinon QA. Acceptatievan dit elektron reduceert de energie die beschikbaar is
voor fluorescentie en dit wordt de fotochemische quenching genoemd. De daling in excitatie-energie door warmte is de niet-fotochemische quenching (Baker, 2008).
Bepaling van de maximale kwantumefficiëntie van PSII (Fv/Fm)
Wanneer een plant in een donkere omgeving staat, zullen de reactiecentra van PSII ‘open’ beschouwd kunnen worden. Dit wil zeggen dat alle QA-moleculen geoxideerd zijn en de
reactiecentra in staat zijn een elektron op te vangen en door te geven. In deze toestand wordt de minimale fluorescentie F0 gemeten. Deze meting wordt opgevolgd door een korte
puls van sterk fotosynthetisch actief licht. QA wordt maximaal gereduceerd, waardoor deze
geen elektronen meer kunnen opvangen van het PSII totdat ze hun elektron hebben doorgeven. Het reactiecentrum is ‘gesloten’ en er wordt een maximale fotochemische quenching Fm gemeten. Het verschil tussen Fm en F0 geeft de variabele fluorescentie Fv weer
(Figuur 11). De verhouding tussen Fv en Fm geeft een maat voor de reductie van QA en kan
gebruikt worden om de opbrengst van PSII te onderzoeken. Hier zijn echter ook enkele factoren die een invloed hebben op de nauwkeurigheid van deze index. Zo moet er aangenomen worden dat de fluorescentie van geëxciteerde toestand voor elke chlorofyl gelijk is. Deze verhouding is geen absolute weergave van de opbrengst, maar moet relatief geïnterpreteerd worden. De Fv/Fm voor gezonde bladeren is ongeveer 0,83.
Stressomstandigheden bij planten zorgen voor een toename van niet-fotochemische quenching, wat Fm kleiner maakt en bijgevolg ook Fv/Fm. Reactiecentra van PSII kunnen ook
geïnactiveerd en beschadigd worden door de niet-fotochemische quenching, waardoor F0
stijgt, wat Fv/Fm opnieuw doet dalen.
Bepaling van de kwantumefficiëntie in het licht
Wanneer de plant wordt belicht zal de fluorescentie stabiliseren naar F’. Bij dosering met een gesatureerde lichtpuls, stijgt de fluorescentie tot Fm’. Het verschil tussen Fm’ en F’ is Fq’.
Nadien valt de fluorescentie terug naar F0’ (Figuur 11). De vergelijking Fq’/Fv’ wordt de
PSII-efficiëntie genoemd. Het geeft een maat voor de fractie van de maximaal mogelijke fotosynthese door PSII, die doorgaat bij de aanwezige omgevingsfactoren. Hierbij is Fv’ het
verschil tussen Fm’ en F0’. Fq’/Fm’ is de verhouding, die de fotosynthetische activiteit van PSII
van de plant voor die lichtpuls weergeeft (= fotochemische quenching). De verhouding Fv’/Fm’
kan gebruikt worden voor het bepalen van de invloed van de niet-fotochemische quenching op de efficiëntie van PSII. Via deze coëfficiënten kan bepaald worden hoe efficiënt de aandrijving van het elektronentransport gebeurt.
De niet-fotochemische quenching wordt gebuikt voor de bepaling van stress. Dit wordt meestal weergegeven door de parameter NPQ.
25
NPQ = (Fm/Fm’) – 1
Het gebruik van deze parameter is echter gelimiteerd. Deze kan enkel vergeleken worden wanneer de bladeren een gelijke Fv/Fm hebben (Baker, 2008).
Figuur 11: Het typisch verloop van de fluorescentie kinetieken van een blad zoals bepaald met een PAM fluorometer. F: kinetieken in het donker, F’: kinetieken in het licht, SP: saturatie pulsen, AL: actinisch licht
26
Hoofdstuk II: Materiaal en methode
1 Plantenmateriaal
Voor de proeven werden twee R. simsii cultivars gebruikt, namelijk H. Vogel ‘Pia’ en ‘Sachsenstern’. Pia is een sport van de vroege cultivar H. Vogel met licht roze, gevulde bloemen. ‘Sachsenstern’ is een late cultivar met wit-rode, picotee bloemen (Figuur 12).
Figuur 12 'H. Vogel' Pia (links) en 'Sachsenstern' (rechts)
2 Proefopzet
Het proefwerk werd uitgevoerd op het Proefcentrum voor Sierteelt te Destelbergen. Op 02/10/2019 en 23/01/2020 werden 150 planten van respectievelijk ‘H. Vogel’ Pia en ‘Sachsenstern’ in forcerie geplaatst. Wanneer de planten kleurtonend waren, op 10 oktober 2019 voor ‘H. Vogel’ Pia en 6 februari 2020 voor ‘Sachsenstern’, werden de planten uit de forcerie gehaald en bewaard voor 1 en 2 weken bij drie verschillende temperaturen: 2°C, 7°C en 15°C (Tabel 2). Voor elke combinatie van temperatuur en bewaarduur werden er 20 planten in koeling gebracht, 10 planten voor de niet-destructieve metingen en 10 planten voor de destructieve metingen. Na bewaring werden de planten in huiskameromstandigheden geplaatst om de uitbloei te beoordelen. Als controle werden planten zonder bewaring rechtstreeks in huiskameromstandigheden geplaatst. De luchtvochtigheid (RV), de temperatuur en lichtintensiteit werden tijdens de forcerie, de bewaring en in de huiskamer tijdens de uitbloei opgevolgd met dataloggers.
De destructieve metingen bestonden uit het nemen van stalen van de bladeren en bloemen voor de bepaling van de suiker- en zetmeelinhoud. Er werden bladstalen genomen voor de bepaling van de stikstofinhoud en voor de bepaling van de waterinhoud. De niet-destructieve metingen werden gedaan op de planten die vervolgens in een huiskamer omgeving werden geplaatst voor de opvolging van de bloei. De niet-destructieve metingen waren het meten van de chlorofylfluorescentie, chlorofylconcentratie en bladreflectantiepatronen. Hierna werd de ontwikkeling van de bloei voor iedere bewaringsconditie opgevolgd door middel van bloeitellingen tot de bloemen verwelkten.
27
Tabel 2 Overzicht van de toegepaste bewaarduur en bewaartemperatuur
Behandeling Einde bewaring
‘Helmut Vogel’ Pia Sachsenstern
Object 1 0 weken bewaring - controle 10 oktober 6 februari
Object 2 1 week bewaring – 2°C 17 oktober 13 februari
Object 3 1 week bewaring – 7°C
Object 4 1 week bewaring – 15°C
Object 5 2 weken bewaring – 2°C 24 oktober 20 februari
Object 6 2 weken bewaring – 7°C
Object 7 2 weken bewaring – 15°C
3 Suiker- en zetmeelbepaling van blad en bloemknop
Wanneer planten in het donker bewaard worden, kunnen ze niet meer aan fotosynthese doen. Daarom moet de plant beroep doen op zijn suikerreserves om zijn metabolisme te laten doorgaan. Om te weten hoe ver de suikerreserves afgebroken werden tijdens de bewaarfase, werd de concentratie aan oplosbare koolhydraten en zetmeel bepaald. De suiker- en zetmeelconcentratie van het blad en de bloemknop werden destructief bepaald. Hiervoor werden zes planten gebruikt. De stalen van deze metingen werden onmiddellijk na bewaring genomen. Er werden telkens bladeren of bloemknoppen van twee planten samengevoegd om een mengstaal te maken. Dit werd driemaal uitgevoerd om drie stalen te bekomen. Voor de staalname van de bloemen werden de schubbetjes en de bloemstelen verwijderd. De bladeren of bloemen werden vervolgens elk in een vijzel met vloeibare stikstof verbrijzeld en in een cryobuisje bij -80°C bewaard tot de analyse.
3.1 Suikerbepaling
Voor het bepalen van de concentratie van de oplosbare suikers werd eerst 250 – 300mg van de stalen afgewogen in centrifugeerbuisjes. Na het toevoegen van 6ml ethanol 80% werden de stalen gemengd met een vortex en voor 3 uur in een waterbad van 45°C geplaatst voor extractie. Hierna werden de stalen opnieuw gemengd met de vortex en voor 5 minuten gecentrifugeerd bij kamertemperatuur op 5000rpm. Het supernatant werd in een beker gepipetteerd. De overblijvende pellet bevatte het onoplosbare zetmeel en werd opzij gezet voor het volgende deel van de extractie.
4 ml van het supernatant werd in een centrifugeerbuisje gebracht met 200 mg PVPP (50mg/ml). Na het mengen met een vortex werden de buisje opnieuw gecentrifugeerd voor 5 minuten op 5000rpm. 2 ml van het supernatant werd in een schaaltje gebracht en in een trekkast geplaatst voor overnachting, om de ethanol te laten verdampen. De volgende dag werd 2 ml gedestilleerd water in de schaaltjes gebracht om alle suikers opnieuw in oplossing te brengen. 1 ml van de vloeistof werd vervolgens in een kolfje van 5 ml gebracht en aangelengd met gedestilleerd water. De oplossing werd gefilterd door een 0,22 μm filter in een cupje van de HPCL autosampler. De verdere analyse via high-performance liquid
chromatography (HPLC) kon door het ingaan van de Coronamaatregelen niet uitgevoerd worden.
28
3.2 Zetmeelbepaling
De eerste stap is de zure hydrolyse van zetmeel naar glucose. De pellet na extractie van de oplosbare suikers bevat het onoplosbare zetmeel en wordt gebruikt bij de verdere analyse. De pellet werd 3 maal met 1,5 ml ethanol 80% gewassen om alle resterende oplosbare koolhydraten te verwijderen. Na elke wasbeurt werden de centrifugeerbuisjes gecentrifugeerd. Wanneer alle opgeloste koolhydraten verwijderd waren, werden ze aan de lucht gedroogd gedurende de nacht. De volgende dag werd 5 ml HCl toegevoegd en werden de buisjes gedurende 2 uur in een warmwaterbad van 95°C geplaatst voor extractie. Na het mengen met een vortex werden ze opnieuw gecentrifugeerd voor 5 minuten op 5000rpm. Het supernatant werd in een beker gepipetteerd en de pellet werd nog eens gewassen met HCl. Beide supernatant werden samengebracht. De vloeistof in de beker werd door titratie met NaOH op pH 7,6 gebracht en overgegoten in een 10 ml kolfje. De beker werd met gedestilleerd water nagespoeld en het kolfje werd aangelengd, geschud en bewaard in de koelkast.
Voor de verdere analyse zijn enkele reagentia nodig. Deze werden als volgt klaargemaakt. Voor de Tra buffer werd 14g triethanolamine met 250mg MgSO4.7H2O gemengd en
aangelengd met 75ml water. De pH werd aangepast tot 7,6 met NaOH en aangelengd met gedestilleerd water tot 100ml. Voor de NADP-oplossing werd 100mg NADP-Na2 opgelost in
10ml gedestilleerd water. Tot slot werd voor de ATP-oplossing 50mg ATP-Na2A2 met 500mg
NaHCO3 opgelost in 10ml water. Deze werden samengevoegd tot één buffer.
Hierop volgt de zetmeelbepaling, uitgedrukt in glucose-equivalenten. In elke cuvet werd 1200μl buffer gepipetteerd. De stalen werden op kamertemperatuur gebracht en toegevoegd in de cuvet. Vervolgens werd gedestilleerd water bijgevoegd, zodat de hoeveelheid staal en water samen 1920μl bedroeg. Ook een blanco (1200μl buffer + 1920μl gedestilleerd water) en standaard glucoseoplossing (1g/l ; 1200μl buffer + 100 μl glucose oplossing + 1820 μl gedestilleerd water) werden bereid.
Voor elke cuvet werd de absorbantie A1 van de oplossing bij 340nm gemeten. Hierna werd aan elke cuvet 20 μl van het enzymmengsel hexokinase(HK)glucose-6-fosfaatdehydrogenase (G6P-DH) toegevoegd en werd na 15 minuten de absorbantie A2 bij 340nm bepaald.
Voor het berekenen van de zetmeelconcentratie (c) werd volgende formule gebruikt: c(g/l) = 𝛥𝐴∗(𝑉∗𝑀𝑊)
(𝜀∗𝑑∗𝑣∗1000)
V = eindvolume (3.14ml) v = volume staal (ml)
MW = moleculaire gewicht van de te analyseren molecule (staal: 162.1 g/mol ; standaard glucose: 180.16 g/mol) d = lichtpad (1cm)
ε = extinctiecoëfficiënt ( 6.3 l/mmol*cm) ΔA = (A2-A1)staal – (A2-A1)Blanco