EVALUATIE VAN DE MEDICATIEBEGELEIDING EN -BEWAKING DOOR
APOTHEKERS BIJ VOLWASSEN PATIËNTEN IN BEHANDELING MET
ORALE ANTITUMORALE GENEESMIDDELEN IN HET UZ GENT
Apr. Sofie Verstraete
Interuniversitaire opleiding Master in de Ziekenhuisfarmacie
Academiejaar: 2017-2020
Promotor: prof. dr. apr. A. Somers
EVALUATIE VAN DE MEDICATIEBEGELEIDING EN -BEWAKING DOOR
APOTHEKERS BIJ VOLWASSEN PATIËNTEN IN BEHANDELING MET
ORALE ANTITUMORALE GENEESMIDDELEN IN HET UZ GENT
Apr. Sofie Verstraete
Interuniversitaire opleiding Master in de Ziekenhuisfarmacie
Academiejaar: 2017-2020
Promotor: prof. dr. apr. A. Somers
Deze pagina is niet beschikbaar omdat ze persoonsgegevens bevat.
Universiteitsbibliotheek Gent, 2021.
This page is not available because it contains personal information.
Ghent University, Library, 2021.
DANKWOORD
Ik wil graag enkele mensen bedanken die mij geholpen hebben met het realiseren van deze masterproef. In eerste instantie wil ik mijn promotor, Prof. dr. Annemie Somers bedanken voor de algemene begeleiding, hetnalezen en de feedback op deze thesis. Ik wil ook graag mijn begeleiders, apr. Sabine Deryckere en apr. dr. Karen Vermis, bedanken voor de aangename en
vlotte samenwerking en de tijd die ze geïnvesteerd hebben in dit onderzoek. Ik kon steeds bij hen terecht voor vragen en feedback. Graag wil ik ook alle apothekers en apotheekassistenten van het UZ Gent bedanken die mij geholpen hebben met het verzamelen van data. Vervolgens wil ik mijn ouders bedanken voor het taalkundig nakijken van mijn masterproef, de vele tips en om mij
altijd gesteund te hebben tijdens mijn volledige academische opleiding. Ik wil ook graag de mede-ZAIO’s bedanken voor de onvergetelijke momenten samen. Tot slot wil ik mijn zus en vrienden bedanken voor de steun tijdens deze periode.
SAMENVATTING
Inleiding: De opkomst van orale antitumorale therapie (OAT) is vrij recent en de verschuiving van intraveneuze therapie naar orale therapie gaat gepaard met een veranderende houding t.o.v. kankertherapie, van zowel de zorgverstrekker als de patiënt. De patiënt is zelf verantwoordelijk voor correct en veilig gebruik van de medicatie. Een optimale medicatiebegeleiding en -bewaking voor deze patiënten is bijgevolg onontbeerlijk. Hierdoor is een geneesmiddelexpert naast de oncoloog, de verpleegkundig consulent en de psycholoog een belangrijke partner van het multidisciplinair team. Counseling van deze patiënten is sinds augustus 2018 geïmplementeerd in de apotheek van het UZ Gent.
Objectieven en methoden: Dit onderzoek heeft tot doel om de counselingsfunctie van de ziekenhuisapotheker in het UZ Gent te evalueren op verschillende manieren. Ten eerste werd een analyse gedaan van het aantal gecounselde patiënten en de tijdsbesteding. Ook werden de medicatie gerelateerde problemen m.b.t. correcte inname, afgeleverde hoeveelheid, discrepanties in de medicatielijst, interacties en de vragen van patiënten, op basis van het observatieblad, geïnventariseerd, evenals de acties en adviezen die door de apotheker werden geïnitieerd. Voor niet gecounselde patiënten werd opgelijst waarom een counseling niet kon doorgaan. Ten tweede werd prospectief onderzocht of counseling door een apotheker positief kon bijdragen tot de kennis van de patiënt over zijn behandeling. Hiervoor werd bij patiënten die starten met hun OAT-behandeling een vragenlijst afgenomen voor (T0) en na counseling (T1). Daarnaast werd bij alle gecounselde patiënten gepeild naar de tevredenheid van informatieverstrekking door de ziekenhuisapotheker. Ten derde werd de bevraging van de therapietrouw via de MARS-5-vragenlijst geïntegreerd in het counselingsgesprek en opgevolgd. De overeenkomst tussen deze score en de Medication Possession Ratio werd nagegaan.
Resultaten: Van de 225 te counselen OAT-patiëntcontacten werden effectief 100 contacten gecounseld. De voornaamste redenen om niet te counselen waren 1) afhaling van de medicatie door familie of vrienden (N = 27 patiëntcontacten) en 2) geen tijd voor een gesprek (N=21 patiëntcontacten). Een counselingsgesprek duurde gemiddeld 15,7 min ± 8,01 min, waarbij een eerste gesprek ongeveer 3 minuten langer duurde. Van de 96 patiëntcontacten, waarbij de thuismedicatie bevraagd is, was bij 59,4% de thuismedicatielijst vóór de counseling niet accuraat. Er werden in totaal 137 discrepanties geregistreerd, meestal ging dit over ontbrekende medicatie (43,8%) en reeds gestopte medicatie (39,4%). In totaal werden 43 apotheekadviezen voor 25 patiëntcontacten (26,04%) geregistreerd. Bij 29 adviezen (67,44%) was een OAT betrokken, deze handelden allemaal over een interactie met een OAT. Vervolgens werden 18 bijkomende vragen van 11 patiënten geregistreerd en beantwoord. De kennistest werd door 6 patiënten ingevuld. Het percentage correcte antwoorden was op alle vragen groter op T1 dan op T0. De tevredenheid van het counselingsgesprek werd bij 20 patiënten bevraagd, de gemiddelde totale tevredenheid was 37,7 ± 3,53 op een score van 40 en de Cronbach’s alfa was gelijk aan 0,926. De score volgens de MARS-5 was bij 87,0% van de patiënten ≥ 23/25. In de vergelijking tussen de Medication Possession Ratio en de MARS-5 waren een aantal ongelijkheden te zien.
Conclusies: Door middel van het gestructureerd observatieblad verloopt een counseling in het UZ Gent op een gestandaardiseerde manier waarbij een aantal vaste items dienen nagekeken te worden. Het missen van data zorgde ervoor dat het nemen van een duidelijke conclusie moeilijk was. Het correct en volledig ingevuld observatieblad geeft aanleiding tot het verzamelen van patiënt-specifieke informatie, waardoor opvolging beter mogelijk is.
Het percentage correcte antwoorden op de kennistest was hoger na een counseling. Om meer zekerheid te krijgen over de kennis van de patiënt over de OAT na een counseling met de ziekenhuisapotheker is een grotere studiepopulatie nodig. De tevredenheidsenquête had een Cronbach’s alfa score van 0,926 en bleek hierdoor een betrouwbare methode te zijn om de tevredenheid te meten. De gemiddelde globale tevredenheid van gecounselde patiënten over het verloop van de begeleiding met de ziekenhuisapotheker was hoog. Tevens kan een grotere studiepopulatie hierover uitsluitsel geven.
LIJST MET GEBRUIKTE AFKORTINGEN
ACE-ME: Assessment, Collaboration, Education, Monitoring and Evaluation AIDES: Assessment, Individualization, Documentation, Education and Supervision ASK-12: Adherence Starts with Knowlegde
B-SMART: Barriers, Solutions, Motivation, Adherence Tools, Relationship and Triage BARS: Brief Adherence Rating Scale (BARS)
BCFI: Belgisch Centrum voor Farmacotherapeutische Informatie CAM: complementary and alternative medicine
CM: CredibleMeds
CML: chronisch myeloïde leukemie CP: Clinical Pharmacology
EGFR: epidermale groeifactor receptor EPD: elektronisch patiëntendossier GMA: gestructureerde medicatieanamnese KLAP: Klinisch Logistiek ApotheekPakket MARS-5: Medication Adherence Rating Scale
MASCC: Multinational Association of Supportive Care in Cancer MMAS-8: Morisky Medication Adherence Scale
MOATT: MASCC Teaching Tool for Patients Receiving Oral Agents for Cancer MPR: Medication Possession Ratio
MSKCC: Memorial Sloan Kettering Cancer Centre NICE: National Institute for health and care Excellence OAT: orale antitumorale therapie
Ps-CaTE: Patient satisfaction with Cancer Treatment Education SDI: Stockley’s Drug Interactions
SEAMS: Self-Efficacy for Appropriate Medication use Scale TdP: Torsades de Pointes
Inhoudsopgave
DANKWOORD ... SAMENVATTING ... LIJST MET GEBRUIKTE AFKORTINGEN ...
1 INLEIDING ... 1
1.1 ALGEMENE CIJFERS OVER KANKER ... 1
1.2 ONCOLOGISCHE BEHANDELINGEN ... 1
1.2.1 Evolutie naar behandeling met orale antitumorale therapie ... 1
1.2.2 Voordelen van orale antitumorale therapie ... 2
1.2.3 Nadelen van orale antitumorale therapie ... 3
1.3 PATIËNTEDUCATIE EN -OPVOLGING BIJ ORALE ANTITUMORALE THERAPIE ... 5
1.3.1 Algemeen ... 5
1.3.2 Educatietools ... 5
1.3.3 Therapietrouw ... 7
1.3.4 Rol van de ziekenhuisapotheker bij patiënten op orale antitumorale therapie ... 10
1.4 MEDICATIEBEGELEIDING EN -BEWAKING VAN PATIËNTEN OP OAT IN HET UZ GENT ... 11
1.4.1 Flow van een counselingsgesprek ... 11
2 OBJECTIEVEN ... 18
3 METHODEN ... 19
3.1 COMMISSIE VOOR MEDISCHE ETHIEK ... 19
3.2 RETROSPECTIEVE ANALYSE VAN DE COUNSELINGSFUNCTIE ... 19
3.2.1 Patiëntinclusie ... 19
3.2.2 Algemene gegevens van gecounselde en niet-gecounselde patiënten ... 20
3.2.3 Gestructureerde medicatieanamnese ... 20
3.2.4 Posologie op het voorschrift en afgeleverde medicatie ... 21
3.2.5 Interactiescreening en apotheekadviezen ... 21
3.4.2 Retrospectieve analyse van de therapietrouw a.d.h.v. de MARS-5 en de MPR ... 23
4 RESULTATEN ... 25
4.1 RETROSPECTIEVE ANALYSE VAN DE COUNSELINGSFUNCTIE ... 25
4.1.1 Patiëntinclusie ... 25
4.1.2 Gestructureerde medicatieanamnese ... 29
4.1.3 Posologie op het voorschrift en afgeleverde medicatie ... 31
4.1.4 Interactiescreening en apotheekadviezen ... 31
4.1.5 Bijkomende vragen van patiënten en klinisch relevante informatie ... 33
4.2 PROSPECTIEVE ANALYSE VAN DE COUNSELINGSFUNCTIE ... 34
4.2.1 Kennistest en tevredenheidsenquête ... 34
4.3 THERAPIETROUW ... 36
4.3.1 Retrospectieve analyse van de therapietrouw a.d.h.v. de MARS-5 en de MPR ... 36
5 DISCUSSIE ... 38
5.1 STUDIEPOPULATIE ... 38
5.2 TIJDSINVESTERING ... 40
5.3 EVALUATIE VAN DE COUNSELINGSFUNCTIE DOOR DE ZIEKENHUISAPOTHEKER ... 40
5.3.1 Belang van een gestructureerd verloop op basis van het observatieblad ... 40
5.3.2 Therapietrouw ... 43
5.3.3 Kwalitatieve meting van de counseling door de ziekenhuisapotheker aan de hand van een vragenlijst 45 5.4 STERKTES EN ZWAKTES VAN DEZE STUDIE ... 47
5.5 TOEKOMSTPERSPECTIEVEN ... 47
6 CONCLUSIE ... 49 7 BRONNEN ... 8 BIJLAGEN ...
8.1 BIJLAGE1: VOORBEELD VAN EEN GENEESMIDDEL-SPECIFIEKE FICHE ...
8.2 BIJLAGE2: VEILIGHEIDSFICHE ...
8.3 BIJLAGE3: INFORMATIEBRIEF EN TOESTEMMINGSFORMULIER VOOR DE DEELNEMERS ...
8.4 BIJLAGE4: KENNISTEST ...
8.5 BIJLAGE5: TEVREDENHEIDSENQUETE ...
1 INLEIDING
1.1
ALGEMENE CIJFERS OVER KANKER
Volgens de World Health Organization (WHO) lag de wereldwijde incidentie van kanker in 2018 op ongeveer 18,1 miljoen patiënten en overleden er 9,6 miljoen patiënten aan de ziekte. Het meest voorkomende type was borstkanker, gevolgd door prostaatkanker, longkanker en darmkanker. [1] Aan de hand van berekeningen wordt geschat dat het aantal nieuwe diagnoses in 2040 nog verder zal oplopen tot 29,5 miljoen. Dit zou het gevolg zijn van een aantal factoren zoals de toename en de vergrijzing van de wereldbevolking en de wereldwijde vermindering van de levenskwaliteit. [1], [2] Volgens de Stichting Kankerregister, die in België gegevens registreert over de aandoening, werden in 2017, 68.702 nieuwe diagnoses van kanker vastgesteld (exclusief niet-melanome huidkankers). De ziekte treft meer mannen dan vrouwen en wordt meer gezien bij ouderen. [3], [4]
1.2 ONCOLOGISCHE BEHANDELINGEN
1.2.1 Evolutie naar behandeling met orale antitumorale therapie
Traditioneel wordt kanker behandeld met een combinatie van chirurgie, radiotherapie en intraveneuze therapie met klassieke cytostatica. Intraveneuze therapie heeft een nadelige invloed op de levenskwaliteit van de patiënt, aangezien toediening regelmatig ziekenhuisopname vereist en behandeling gepaard gaat met veel algemene bijwerkingen. Dit laatste is het gevolg van de niet-specifieke manier waarop klassieke cytostatica werken, nl. door interferentie met de celdeling, wat leidt tot celdood. Hierdoor tasten ze zowel kankercellen als gezonde cellen aan. [5]
Intraveneuze cytostatica behoren nog steeds tot de klassieke behandeling van zowel vaste als hematologische kankers, maar sinds het midden van de 20e eeuw worden klassieke cytostatica zoals cyclofosfamide en chloorambucil
ook oraal ingenomen. Een betere kennis van de cellulaire processen van het ontstaan van de ziekte heeft in het begin van de 21e eeuw geleid tot het ontwikkelen van oraal of intraveneus toe te dienen moleculen die specifieke targets
van kankercellen tot doelwit hebben (targeted therapy). [6], [7] De enorme stijging van het aantal nieuwe perorale behandelingen is vrij recent en dankzij deze nieuwe therapeutische inzichten is kanker de laatste jaren meer
Er zijn verschillende klassen orale antitumorale geneesmiddelen: de niet-specifieke cytostatica, waaronder bv. cyclofosfamide en chloorambucil, de doelgerichte geneesmiddelen en de hormonale therapie. [8] Enkel de laatste twee klassen worden toegediend bij chronische kankertherapie. [6]
Orale doelgerichte therapie maakt gebruik van kleine moleculen die gericht zijn tegen een specifiek doelwit binnen de kankercel. Ze inhiberen specifieke enzymen, zoals proteïnekinasen, die noodzakelijk zijn voor signaaloverdracht naar de celkern. Op deze manier wordt de signaaloverdracht geblokkeerd met remming van de groei en overleving van de kankercel tot gevolg. [9]
De proteïnekinase inhibitoren, herkenbaar aan de uitgang “nib”, kunnen één of meerdere kinasen remmen. Ze kunnen een kankercel op verschillende manieren nadelig beïnvloeden door inhibitie van de oncogenese of tumor-angiogenese of ze kunnen de tumormicro-omgeving negatief beïnvloeden. [10] Door hun doelgerichte werking treden er, in vergelijking met klassieke, niet-specifieke cytostatica, minder algemene neveneffecten op. [11]
Hormonale therapie wordt toegepast bij hormoonafhankelijke tumoren, zoals borst- en prostaatkanker. Beide types zijn voor hun groei afhankelijk van hormonen, respectievelijk oestrogeen en testosteron. Door de productie en/of werking van deze hormonen te blokkeren, wordt de groei van deze kankercellen geremd. [11], [12]
Uit verschillende studies is gebleken dat patiënten orale toediening verkiezen boven intraveneuze toediening, op voorwaarde dat de efficaciteit en toxiciteit minstens vergelijkbaar is. [7], [13]–[15]
1.2.2 Voordelen van orale antitumorale therapie
Het gebruiksgemak van orale antitumorale therapie speelt een belangrijke rol, de patiënt heeft namelijk meer autonomie en controle over zijn behandeling. De patiënt neemt zelf thuis de medicatie in waardoor er minder tijd in het ziekenhuis moet doorgebracht worden. Hierdoor wordt er minder hinder ervaren in het dagelijkse leven van de patiënt en de familie, wat een belangrijke factor is voor de levenskwaliteit. [6], [7], [14], [16]
De meeste orale antitumorale middelen werken doelgericht in op specifieke pathways van de kankercel. Dit betekent dat de toxiciteit van doelgerichte therapie tumor specifiek is, waardoor gezonde cellen minder beïnvloed worden en er minder algemene neveneffecten worden gezien dan bij klassieke chemotherapie. [9], [17] Bovendien vereist
intraveneuze therapie een intraveneuze lijn. Dit houdt een potentieel risico in op katheter gerelateerde infecties, extravasatie en trombose, wat vermeden wordt bij orale therapie. [16], [18]
Dankzij de lagere toxiciteit kan een OAT chronisch ingenomen worden. De kankercellen worden hierdoor langdurig blootgesteld aan het geneesmiddel, dit in vergelijking met intraveneuze therapie die een periodieke toediening vereist. Chronische blootstelling kan een gunstig effect hebben op de plasmaconcentraties en de werkzaamheid van het geneesmiddel. [16], [19]
Door orale inname kunnen er kosten uitgespaard worden in vergelijking met IV-toediening. Door het verminderd aantal ziekenhuisbezoeken voor patiënten op OAT wordt de werkdruk voor medisch personeel en de bijbehorende personeels- en administratiekosten gereduceerd, alsook het gebruik van medisch materiaal. [6], [7], [16], [20] 1.2.3 Nadelen van orale antitumorale therapie
Aangezien de patiënt zelf instaat voor inname van de medicatie, stijgt het aandeel van de eigen verantwoordelijkheid voor het slagen van de therapie. OAT vereist een chronische en vaak complexe inname. [5], [7] De controle en monitoring door getrainde zorgverstrekkers in het ziekenhuis, die aanwezig is bij toediening van intraveneuze medicatie, valt weg en komt in handen van onervaren patiënten. [7], [8], [15] Hierdoor kunnen patiënten minder ondersteuning ervaren wat nadelig kan zijn voor correcte inname van het geneesmiddel. [6], [11]
Incorrecte inname van OAT heeft een nadelige invloed op de overleving en de levenskwaliteit van de patiënt, de relatie tussen zorgverstrekker en patiënt, veiligheid en toxiciteit van de medicatie en totale kost voor de patiënt en de maatschappij door een verhoogd en verlengd aantal ziekenhuisopnames. [21]
Ondanks minder algemeen toxische bijwerkingen zoals pancytopenie, misselijkheid, braken en haaruitval zoals bij de klassieke cytostatica, zijn deze bij OAT specifieker en is het herkennen van neveneffecten zeer belangrijk. Een typische bijwerkingen van vele orale antitumorale middelen is bijvoorbeeld huiduitslag. [12], [22]
De patiënt staat zelf in voor de beoordeling van de graad van ernst van de bijwerking en moet dus zelf kunnen inschatten of een opvolging door een arts noodzakelijk is. Dit betekent dat de patiënt moet ingelicht worden over
De meeste OAT’s vertonen een nauwe toxisch-therapeutische marge. Dit wordt geassocieerd met een extra risico op bijwerkingen, ondanks de specifiekere werking. [23], [24] Vaak is er een misperceptie bij patiënten dat orale medicatie minder toxisch is dan intraveneuze medicatie, waardoor patiënten hun therapie als minder belangrijk kunnen inschatten en er een kans bestaat op verkeerde inname zoals een dubbele dosis innemen ter compensatie van een gemiste dosis. [25]
Niet enkel patiënten zijn gevoelig voor effecten van een OAT, maar ook de naasten moeten beschermd worden. Zij kunnen blootgesteld worden aan het antitumoraal middel door accidentele blootstelling, bijvoorbeeld door in aanraking te komen met urine of stoelgang van de patiënt waarin zich resten van het geneesmiddel bevinden of door de handen niet te wassen na het klaarleggen van de medicatie voor de patiënt. [23] Dit benadrukt de noodzaak aan educatie en het correct opvolgen van de veiligheidsmaatregelen, niet enkel door de patiënt, maar ook door zijn naasten. [22]–[24]
Aangezien veel OAT’s gemetaboliseerd worden via het cytochroom P450 enzymsysteem vormen interacties tussen orale antitumorale geneesmiddelen en andere medicatie, kruiden, voeding of voedingssupplementen een extra bezorgdheid. [11], [26] Vaak is er bij kankerpatiënten sprake van polyfarmacie. Aangezien de incidentie van kanker stijgt met de leeftijd, worden veel ouderen, met reeds verschillende comorbiditeiten, getroffen. Bovendien nemen kankerpatiënten naast een OAT ook vaak medicatie in ter behandeling van de bijwerkingen. [27] Interacties kunnen leiden tot toxiciteit of gedaalde werkzaamheid van de therapie. Mogelijks kan er ook sprake zijn van een verminderde biologische beschikbaarheid, in vergelijking met een 100% biologische beschikbaarheid bij een intraveneuze toediening. [24] Intra- en interindividuele variabiliteit in absorptie van het geneesmiddel, wat kan leiden tot een minder voorspelbare plasmaconcentratie, kan voor een bijkomend probleem bij orale antitumorale medicatie zorgen. [7], [24], [27]
Therapie met orale antitumorale geneesmiddelen is duur. Zo is de kostprijs voor een behandeling van een maand met osimertinib (Tagrisso®) bij een patiënt met longkanker 6.466 euro. In België worden deze geneesmiddelen via attestregeling terugbetaald. [28] Hierdoor worden de individuele kosten voor de patiënt beperkt, maar zorgt dit wel voor een hoge kost voor de maatschappij.
1.3 PATIËNTEDUCATIE EN -OPVOLGING BIJ ORALE ANTITUMORALE THERAPIE
1.3.1 AlgemeenOm een goede behandelingskeuze te maken, moeten patiënten volledig geïnformeerd zijn over de werkzaamheid en toxiciteit van de medicatie. [7], [14], [15]
De verschuiving van intraveneuze therapie naar orale therapie gaat gepaard met een veranderende houding t.o.v. kankertherapie, van zowel de zorgverstrekker als de patiënt. Toediening en monitoring gebeurt niet meer in een gecontroleerde klinische setting zoals bij intraveneuze therapie, maar speelt zich nu gewoon thuis bij de patiënt af. De patiënt is zelf verantwoordelijk voor correct en veilig gebruik van de medicatie. Dit veroorzaakt een wijziging in de rol en de verantwoordelijkheid van zorgverstrekkers en patiënten. Bovendien verandert de relatie tussen beide. [30], [29], [31] Bij behandeling met intraveneuze therapie moeten patiënten op geregelde tijdstippen naar het ziekenhuis waardoor ze tijdens infusie problemen en bezorgdheden kunnen bespreken met zorgverstrekkers, alsook advies krijgen. Dit draagt bij tot een goede relatie tussen patiënt en zorgverstrekker. [30] Om patiënten op OAT goed op te volgen en bij te staan tijdens hun behandeling is er dus noodzaak aan nieuwe communicatiemethoden. Zoals reeds besproken in 1.2.2 en 1.2.3 zijn er voor- en nadelen verbonden aan orale antitumorale therapie. Aangezien correct gebruik van het geneesmiddel van groot belang is voor het slagen van de therapie, wordt educatie van de patiënt een groot onderdeel van deze nieuwe aanpak. Patiënten moeten voldoende geïnformeerd worden over o.a. het correct en veilig gebruik, het optreden en aanpakken van bijwerkingen, bewaaromstandigheden, interacties en mogelijke dosisaanpassingen. [30], [32], [31] Gebrek aan informatie kan namelijk leiden tot geneesmiddel gerelateerde problemen door o.a. verkeerde inname, inadequate aanpak van bijwerkingen, slechte therapietrouw, wat nadelig kan zijn voor het effect van de therapie. [31]
1.3.2 Educatietools
Er zijn reeds een aantal gestandaardiseerde tools die zorgverleners kunnen gebruiken voor educatie van patiënten over het correct en veilig gebruik van OAT. Ze halen verschillende aspecten aan die noodzakelijk zijn om patiënten te begeleiden.
mogelijkheid van de patiënt om tabletten te slikken, medicatierecipiënten te openen, bijsluiters te lezen. Het tweede deel omvat items over het correct gebruik van een OAT in het algemeen die de zorgverlener moet bespreken met de patiënt. Er wordt informatie gegeven over veilig omgaan met het geneesmiddel voor zowel de patiënt als de naasten, zoals het wassen van de handen na contact met het geneesmiddel, het niet pletten van tabletten, het buiten bereik van kinderen bewaren, het correct handelen bij een gemiste dosis of een overdosis. In het derde deel wordt OAT-specifieke informatie meegegeven. De naam van het geneesmiddel, het innameschema, de bewaaromstandigheden, de bijwerkingen en behandeling ervan, de potentiële interacties met andere geneesmiddelen of voeding en andere belangrijke voorzorgsmaatregelen worden met de patiënt besproken. Het vierde deel omvat samenvattende vragen die kunnen nagaan of de patiënt de uitleg heeft begrepen zoals: “Wat is de naam van het geneesmiddel?”, “Wanneer wordt de medicatie ingenomen?”, “Hoe wordt het geneesmiddel bewaard?”, “Speelt voeding een rol bij inname van de medicatie?”. Bijkomend wordt een folder met geneesmiddel-specifieke informatie opgesteld en meegegeven aan de patiënt en wordt er ruimte gelaten voor de patiënt om vragen te stellen.
Deze tool werd ontwikkeld door experten en geëvalueerd in 15 landen. De tool is wereldwijd online beschikbaar in verschillende talen en is de enige die specifiek voor OAT werd ontwikkeld. Om de betrouwbaarheid van de vertaalde versies na te gaan, alsook de impact op de outcome van de patiënt, is verdere evaluatie van de tool noodzakelijk. [29], [32], [33]
• Barriers, Solutions, Motivation, Adherence Tools, Relationship and Triage (B-SMART) Appropriate Medication Use Process is een gids die gebruikt kan worden door zorgverstrekkers zowel voor, tijdens als na interactie met een patiënt. Het bestaat uit 6 stappen die noodzakelijk zijn om patiënten optimaal te begeleiden in correct en veilig gebruik van hun medicatie. De eerste stap is identificatie van de drempels voor correct medicatiegebruik door de patiënt (“barriers”). Er worden vragen gesteld aan de patiënt om patiënt-gerelateerde drempels, medicatie-patiënt-gerelateerde drempels en zorgverstrekker-patiënt-gerelateerde drempels te herkennen. Vervolgens wordt de motivatie van de patiënt voor een langdurige therapie gemeten aan de hand van “The Readiness Assessment Ruler”. In een tweede stap worden oplossingen gezocht voor de aangetoonde drempels (“solutions”). De derde stap bestaat uit het motiveren van patiënten om de medicatie correct in te nemen (“motivation”). Hieronder valt educatie omtrent de behandeling. In een vierde stap worden methoden voor therapietrouw besproken met de patiënt (“adherence”). De relatie tussen patiënt en zorgverstrekker op
zorgen voor een continue begeleiding van patiënten met de mogelijkheid om patiënten kennis te laten maken met andere ondersteunende diensten (“triage”). [32], [34], [35]
• Assessment, Collaboration, Education, Monitoring and Evaluation (ACE-ME) Model is een tool specifiek ontwikkeld voor educatie van oudere patiënten door verpleegkundigen. De tool is gebaseerd op het Assessment, Individualization, Documentation, Education and Supervision (AIDES) model. [36] ACE-ME omvat vijf activiteiten. De eerste drie activiteiten zijn noodzakelijk om een behandelingsplan, aangepast aan de noden van de patiënt, op te stellen, nl.: het beoordelen van het al dan niet correct kunnen beheren van de medicatie door de patiënt en de evaluatie van de geschiktheid van de medicatie voor de patiënt (assessment), samen met de patiënt en andere zorgverstrekkers drempels voor therapietrouw bespreken (collaboration) en educatie van de patiënt over de therapie en de noodzaak ervan (education). De volgende twee activiteiten zijn belangrijk om het behandelingsplan steeds actueel te houden, nl.: het monitoren en documenteren (monitoring) en het evalueren (evaluation) van het huidige behandelingsplan. Indien nodig wordt het behandelingsplan opnieuw aangepast na deze stappen. [32], [37]
1.3.3 Therapietrouw
Extra aandacht bieden aan therapietrouw bij OAT is zeer belangrijk aangezien de patiënt zelf instaat voor correct gebruik. [7], [14] Therapietrouw wordt door de WHO gedefinieerd als de mate waarin de patiënt zijn behandeling uitvoert in overeenstemming met de aanbevelingen door de behandelaar.
De ‘Adherence Assessment with Glivec: Indicators and Outcomes (ADAGIO) studie’ onderzocht de invloed van therapietrouw op het effect van imatinib (Glivec®) bij behandeling van patiënten met chronische myeloïde leukemie (CML). Op een totaal van 169 patiënten werd 33,3% als niet-therapietrouw beschouwd en slechts 14,2% bleek volledig therapietrouw. Verder zag men een suboptimale respons bij patiënten die minder therapietrouw waren. [38] Een gelijkaardige studie van Marin et al. (2010) stelde vast dat de therapietrouw van CML-patiënten, behandeld met imatinib, varieerde tussen 22,6% en 103,8% met een mediaan van 97.6%. Ook uit deze studie kon men concluderen dat de mate van therapietrouw bepalend was voor de moleculaire respons. [39]
begrijpen. Dit in tegenstelling tot intentionele therapieontrouw waarbij het een bewuste keuze is van de patiënt om de behandeling niet conform het voorschrift uit te voeren. Redenen voor intentionele therapieontrouw zijn o.a. zich zorgen maken omtrent mogelijke bijwerkingen, chronisch gebruik en afhankelijkheid van de medicatie, de angst voor een verminderde levenskwaliteit en denken geen winst te halen uit de behandeling. [40]
De therapietrouw kan door verschillende factoren beïnvloed worden, deze werden door de WHO in vijf dimensies onderverdeeld (zie fig. 1.1):
• Sociaal-economische factoren zoals leeftijd, opleidingsniveau, geslacht, inkomen, burgerlijke status • Therapie-gerelateerde factoren zoals neveneffecten, aantal tabletten, complexiteit van het innameschema • Patiënt-gerelateerde factoren zoals motivatie en zelfvertrouwen, kennis over de ziekte, overtuiging van de
behandeling
• Ziekte-gerelateerde factoren zoals ernst van de aandoening, aantal symptomen en de ernst ervan
• Gezondheidszorg-gerelateerde factoren zoals de relatie tussen zorgverlener en patiënt, terugbetaling, opvolging van patiënten [21], [41]
Zo is de therapietrouw bv. hoger bij hoger opgeleide patiënten. Een complex innameschema, inname van veel tabletten en chronische inname, wat bij veel OAT van toepassing is, beïnvloeden de therapietrouw dan weer nadelig. [7], [32], [41]
Om de therapietrouw te meten werden reeds verschillende methoden ontwikkeld. Objectieve meetmethoden zijn o.a. het tellen van de resterende pillen om het aantal ingenomen pillen te berekenen (pill count) en medicatie monitoringsystemen (medication event monitoring system). [32], [42], [43] Deze methodes bevatten beperkingen, zo kunnen patiënten medicatie weggooien waardoor het lijkt alsof de medicatie ingenomen werd. [31], [32] Morisky Medication Assessment Scale (MMAS-8), Medication Adherence Report Scale (MARS-5), Adherence Starts with Knowlegde (ASK-12), Brief Adherence Rating Scale (BARS), Self-Efficacy for Appropriate Medication use Scale (SEAMS) zijn subjectief en scoren de therapietrouw op basis van een vragenlijst. De patiënt kan de antwoorden aanpassen om de score te beïnvloeden waardoor dit niet altijd een goed beeld van de werkelijke situatie weerspiegelt. [32], [42], [43]
Het National Institute for Health and Care Excellence (NICE) heeft een aantal richtlijnen opgesteld om de therapietrouw te verbeteren. [44]
• Patiënten betrekken in beslissingen over hun therapie: o Verbeteren van de communicatie met patiënten o Patiënten meer betrekken bij beslissingen
o Rekening houden met de bezorgdheden en overtuigingen die patiënten hebben over hun therapie o Patiënten informeren
• Patiënten ondersteunen in therapietrouw
o Nagaan of er problemen zijn met therapietrouw door onder andere vragen te stellen of gebruik te maken van de pill count methode
o Bespreken van oplossingen om therapietrouw te verbeteren
§ Bespreken van de reden(en) voor therapieontrouw met patiënten (intentioneel of niet-intentioneel)
§ Bedenken van oplossingen om de therapietrouw te verbeteren, gebaseerd op de onderliggende reden(en) (met andere woorden de oplossingen zijn patiëntafhankelijk en moeten afgestemd worden op de situatie van de patiënt)
§ Oplossingen bieden voor praktische problemen waardoor patiënten niet therapietrouw zijn door onder andere het innameschema minder complex te maken, gebruik te maken van een medicatiedoos met verschillende compartimenten en een innames te registreren. § Bespreken van bijwerkingen en aanpak ervan met patiënten indien deze een probleem
vormen
§ Bespreken van de therapiekosten met de patiënt
• Verbeteren van de communicatie tussen zorgverstrekkers onderling aangezien patiënten vaak met meerdere zorgverstrekkers in contact komen
Om de therapietrouw te doen stijgen is dus een multifactoriële aanpak nodig, die inspeelt op de verschillende beïnvloedende factoren. [7], [32], [41]
1.3.4 Rol van de ziekenhuisapotheker bij patiënten op orale antitumorale therapie
Educatie is een onontbeerlijk onderdeel van behandeling met een OAT en kan uitgevoerd worden door de behandelende arts en oncologisch verpleegkundigen, maar ook ziekenhuisapothekers kunnen hierin een rol spelen. Met uitzondering van imatinib en de klassieke orale cytostatica, worden orale antitumorale geneesmiddelen namelijk verplicht via de ziekenhuisapotheek afgeleverd. [30]
Volgens het KB van 4 maart 1991 omtrent de normen waaraan een ziekenhuisapotheek moet voldoen, wordt gesteld dat ziekenhuisapothekers verantwoordelijk zijn voor de gezondheidsbegeleiding van de gehospitaliseerde patiënten en de ontslagen patiënten in samenwerking met het medisch en verpleegkundig korps. [45]
Verschillende studies vermelden dat 50% van de informatie die patiënten krijgen van hun behandelende arts wordt vergeten. Tijdens een eerste consultatie moeten patiënten een grote hoeveelheid informatie verwerken, bovendien kunnen patiënten nog emotioneel zijn door hun diagnose. [29] Bij aflevering van de medicatie is er een extra opportuniteit voor de ziekenhuisapotheker om de patiënt te informeren. De verschillende tools besproken in 1.3.2 kunnen hiervoor aangewend worden. Door hun uitgebreide kennis in farmacotherapie, toxiciteit, monitoring en farmaco-economie is de ziekenhuisapotheker de geschikte persoon om uitleg te geven over de werking en het belang van het geneesmiddel, het innameschema, het veilig omgaan en bewaren van OAT, het identificeren van en omgaan met bijwerkingen, het optreden en voorkomen van interacties, opvolgen en bevorderen van de therapietrouw en andere geneesmiddel-specifieke informatie. Toezicht houden op voorgeschreven en afgeleverde medicatie is eveneens belangrijk. [23], [24], [30], [45] Ook het bijhouden van een accurate thuismedicatielijst is een onderdeel van
van een gestructureerde medicatieanamnese (GMA). Dit is een proces waarbij getracht wordt om de meest complete en accurate medicatielijst van een patiënt te verkrijgen en is van belang om medicatiefouten tijdens overgangen in de zorg te vermijden. [46], [47]
De ziekenhuisapotheker maakt hierdoor deel uit van een multidisciplinair team dat gekenmerkt wordt door een transparante communicatie tussen de verschillende zorgverstrekkers. Zeker bij de start van een behandeling is educatie belangrijk en wordt deze aangepast aan de noden van de patiënt. Hierbij is zowel verbale als geschreven informatie noodzakelijk en kan er advies gegeven worden over het gebruik van elektronische tools zoals een smartphone-app die de patiënt helpt bij medicatiegebruik. Om de kwaliteit van een counseling hoog te houden, is continue bijscholing van de apotheker onontbeerlijk [23], [29], [30], [48]
Opvolging van de patiënt door de ziekenhuisapotheker kan via direct contact, maar kan ook telefonisch gebeuren. Patiënteducatie en -opvolging is een continu proces waarbij steeds belang gehecht moet worden aan het verstrekken van geneesmiddel-specifieke informatie, therapietrouw en het beantwoorden van vragen van patiënten. [29] De weinige studies die het effect van begeleiding van patiënten op OAT door apothekers onderzoeken, hebben kunnen aantonen dat begeleiding door apothekers een positieve impact heeft op het begrijpen van de noodzaak van de therapie door de patiënt en het identificeren, oplossen en voorkomen van medicatiegerelateerde problemen. [49]
1.4 MEDICATIEBEGELEIDING EN -BEWAKING VAN PATIËNTEN OP OAT IN HET UZ GENT
1.4.1 Flow van een counselingsgesprek
1.4.1.1 Algemeen
Counseling van patiënten in behandeling met orale antitumorale medicatie is sinds augustus 2018 geïmplementeerd in de apotheek. Momenteel beperkt dit zich echter tot 11 geneesmiddelen (zie Tabel 1.1) en uitbreiding per indicatie gebeurt geleidelijk. Volgens het WHO Collaborating Centre for Drugs Statistics Methodology behoren deze geneesmiddelen tot ATC-klasse L: antineoplatische en immunomodulerende agentia. [50] Het Belgisch Centrum voor Farmacotherapeutische Informatie (BCFI) verdeelt deze geneesmiddelen onder in de klasse van de antitumorale geneesmiddelen. [28]
Patiënten worden bij afhaling van een OAT, behorend tot Tabel 1.1, aan de balie in de ziekenhuisapotheek uitgenodigd voor een counselingsgesprek met de ziekenhuisapotheker in een daartoe voorziene begeleidingsruimte. Tijdens het gesprek wordt het voorschrift gecontroleerd en geeft de apotheker aan de hand van een multidisciplinair opgestelde geneesmiddel-specifieke fiche, advies over de werking, correcte inname en bijwerkingen. Daarnaast gebeurt een volledige medicatieanamnese, wordt er gescreend op interacties en gebeurt een bevraging met betrekking tot therapietrouw. Er wordt eveneens tijd genomen voor het beantwoorden van vragen die de patiënten kunnen stellen. Patiënten die geen volledige counseling kunnen ontvangen, worden kort begeleid aan de balie in een ‘minicounseling’. De bedoeling hiervan is om, bij gebrek aan een gewone counseling, de patiënt toch kort te begeleiden aan de hand van de geneesmiddel-specifieke fiche en veiligheidsfiche, wijzigingen in de thuismedicatie kunnen overlopen worden zodat de ziekenhuisapotheker op een later moment een interactiecheck kan uitvoeren en er kan nagevraagd worden of er eventuele problemen zijn met de medicatie.
Stofnaam Merknaam Klasse Indicatie ATC-code
Alectinib AlecensaÒ Proteïnekinase inhibitor Longcarcinoom L01XE36
Afatinib GiotrifÒ Proteïnekinase inhibitor Longcarcinoom L01XE13
Gefitinib IressaÒ Proteïnekinase inhibitor Longcarcinoom L01XE02
Trifluridine/tipiracil LonsurfÒ Anitmetaboliet Coloncarcinoom L01BC59
Cladribine MavencladÒ Purine-analoog Multiple Sclerose L01BB04
L04AA40 Osimertinib TagrissoÒ Proteïnekinase inhibitor Longcarcinoom L01XE35
Erlotinib TarcevaÒ Proteïnekinase inhibitor Longcarcinoom L01XE03
Crizotinib XalkoriÒ Proteïnekinase inhibitor Longcarcinoom L01XE16
Enzalutamide XtandiÒ Anti-androgeen Prostaatcarcinoom L02BB04
Ceritinib ZykadiaÒ Proteïnekinase inhibitor Longcarcinoom L01XE28
Abirateron ZytigaÒ Anti-androgeen Prostaatcarcinoom L02BX03
1.4.1.2 Registratie van een counseling: het observatieblad
De informatie-uitwisseling tijdens een counseling kent een gestructureerd verloop en wordt geregistreerd in een daartoe bestemd observatieblad in het elektronisch patiëntendossier (EPD) (zie fig. 1.2). Op deze manier wordt elke counseling, ongeacht van de ziekenhuisapotheker die de patiënt begeleidt, op dezelfde manier uitgevoerd.
Het observatieblad bestaat uit 8 onderdelen die met de patiënt overlopen worden:
• Algemene gegevens: de naam en startdatum van de therapie, de indicatie, welke voorgaande behandelingen, de posologie en de datum van de counseling
• Logistieke gegevens: de hoeveelheid resterende medicatie thuis, de datum van de volgende consulatie bepaald op basis van de hoeveelheid afgeleverde medicatie, de effectieve datum waarop de patiënt terug naar het ziekenhuis komt, de afgeleverde hoeveelheid en eventuele afwijkingen hierop
• Gegevens over therapietrouw
• Gegevens over nevenwerkingen: het type nevenwerkingen die optreden en het bijbehorend advies dat gegeven werd
• Gegevens over medicatie anamnese en interacties: de status van het uitvoeren van een medicatieanamnese, de status van het meegeven van een afgeprint medicatieschema, de achtergrond en eventuele afhandeling van interacties
• Datum van meegeven van een geneesmiddel-specifieke fiche, met daarop noodzakelijke informatie over correcte inname en de werking van het geneesmiddel, bijwerkingen, interacties, bewaring en beschikbaarheid van het geneesmiddel. Patiënten kunnen dit bewaren en thuis opnieuw raadplegen indien nodig. (zie bijlage 8.1)
• Datum van meegeven van een veiligheidsfiche, met daarop noodzakelijke informatie over het veilig omgaan met een OAT voor zowel de patiënt als omstaanders van de patiënt. (zie bijlage 8.2)
• Andere: vragen die patiënten stellen tijdens counseling, andere klinische info die van toepassing is op de patiënt
1.4.1.3 Gestructureerde medicatieanamnese
Naast registratie van de medicatie tijdens een consultatie door de behandelende arts of verpleegkundige wordt een bijkomende GMA uitgevoerd door ziekenhuisapothekers en apotheekassistenten. De thuismedicatie wordt standaard geregistreerd in de folder ‘thuismedicatie’ in het EPD. Dit is een centrale folder waar artsen, verpleegkundigen, apothekers en apotheekassistenten toegang tot hebben, ongeacht de discipline. In de folder worden de verplichte velden ‘geneesmiddelnaam’, ‘dosering’ en ‘eenheid’ ingevuld. [51]
Tijdens een counseling wordt door de ziekenhuisapotheker een medicatieverificatie uitgevoerd, dit wil zeggen dat de lijst van de thuismedicatie, bekomen via bevraging, vergeleken wordt met de reeds door de arts of verpleegkundige geregistreerde medicatie in de folder ‘thuismedicatie’. Aangezien voedingssupplementen, homeopathie en fytotherapie (complementary and alternative medicine, CAM) veelvuldig ingenomen worden door kankerpatiënten en mogelijks een extra risico vormen voor interacties, wordt hieraan extra aandacht besteed tijdens bevraging. [52], [53]
Discrepanties worden geregistreerd. Op basis van de accurate medicatielijst wordt een interactiescreening uitgevoerd (zie 1.3.1.5 Interactiescreening).
Klinisch relevante discrepanties kunnen leiden tot een advies gericht aan de behandelende arts. [51] De medicatielijst wordt in tweevoud meegegeven aan de patiënt: één exemplaar is voor de patiënt zelf en één exemplaar is voor de thuisapotheker.
1.4.1.4 Posologie op het voorschrift en afgeleverde medicatie
Een correcte dosering en aflevering zijn twee van de belangrijke onderdelen van een geslaagde therapie. [54], [55] Elke OAT heeft een specifieke dosering. Een dosisreductie, onderbreking of stop van de therapie kan noodzakelijk zijn in het geval van toxiciteit of nevenwerkingen. Hierdoor is de dosering van een OAT patiëntafhankelijk. Incorrect doseren en afleveren van een OAT verhoogt de kans op onvoldoende werkzaamheid of toxiciteit voor de patiënt. Bijgevolg is het correct voorschrijven van een OAT belangrijk. [56]
Voor elke gecounselde patiënt wordt in EPD geregistreerd of de posologie op het voorschrift correct vermeld staat, dit gebeurt op basis van de info in de geneesmiddel-specifieke fiche. De afleverhoeveelheid wordt, op basis van de datum van de volgende consultatie, berekend. Bij een tekort of een overschot aan voorschriften, kan de ziekenhuisapotheker contact opnemen met de behandelende arts om respectievelijk een extra voorschrift aan te maken of om het teveel in medicatie niet af te leveren. De afgeleverde hoeveelheid wordt geregistreerd in het EPD.
1.4.1.5 Therapietrouw
Om te peilen naar de therapietrouw van patiënten wordt geen gebruik gemaakt van een gevalideerde vragenlijst, maar worden een aantal willekeurige vragen gesteld zoals: “Lukt het voor u om de medicatie dagelijks in te nemen?” en “Hoeveel keer bent u reeds een dosis vergeten?”. Vervolgens worden niet-gevalideerde adviezen om therapietrouw te verbeteren voorgesteld aan de patiënt.
1.4.1.6 Interactiescreening
Interactiescreening is een belangrijk onderdeel van een counselingsgesprek aangezien interacties met een OAT het succes van de behandeling kunnen beïnvloeden en/of het risico op ongewenste effecten kunnen vergroten. [54], [55] Intern gebeurt interactiescreening bij patiënten op OAT aan de hand van volgende databanken: UpToDate (UTD),
ernst van de interactie wordt onderverdeeld in verschillende niveaus en waarbij per niveau een specifiek advies betreffende de te nemen acties wordt geformuleerd. Via Credible Meds (CM) worden de geneesmiddelen verdeeld in risicocategorieën op basis van hun potentieel tot verlenging van het QT-interval en het veroorzaken van Torsades de Pointes (zie Tabel 1.2). [57]–[60]
Interactiescreening wordt uitgevoerd volgens de flowchart in figuur 1.3. Alle geneesmiddelen en CAM worden ingegeven in UTD en CP op merknaam of, indien niet gekend, op stofnaam. Interacties van niveau X of D volgens UTD en/of level 1 of 2 volgens CP worden weerhouden. De ernst van interacties van het type QT-verlenging wordt verder bepaald met de CM-database.
Voor de interacties die niet van het type QT-verlenging zijn, wordt vervolgens een onderscheid gemaakt tussen: • X/D EN 1/2: interacties van niveau X of D volgens UTD en waar CP ook level 1 of 2 aan toekent. Dit wil zeggen
dat er een overeenkomst wordt gezien in graad van ernst van de interactie tussen beide databases. Een advies voor deze interactie wordt geformuleerd aan de hand van de informatie in UTD en CP.
• X/D OF 1/2: interacties van niveau X of D volgens UTD, maar waar door CP geen level 1 of 2 aan wordt toegekend of omgekeerd. De interactie wordt vervolgens opgezocht in SDI. Indien de interactie door SDI in één van de twee hoogste niveaus van ernst wordt onderverdeeld, wil dit zeggen dat er met ofwel UTD ofwel met CP een overeenkomst wordt gezien in graad van ernst van de interactie. Een voorstel voor een advies wordt ten slotte geformuleerd aan de hand van de informatie in de overeenkomstige databases. Indien geen Tabel 1.2 Overzicht van de verschillende niveaus van interactie afhankelijk van de database [57]–[60]
UpToDate Clinical Pharmacology Stockley’s Drug interactions Credible Meds
X = Avoid combination Level 1 = Severe interaction = Levensbedreigende interactie/ contra-indicatie = Verlengt QT-interval EN bewezen risico op TdP D =Consider therapy modification Level 2 = Major interaction = Dosisaanpassing/monitoring therapie
= Kan QT-interval verlengen en mogelijks risico op Tdp C = Monitor Therapy Level 3 = Moderate
interaction
= Monitoring therapie = conditioneel risico op Tdp
B = No action needed Level 4 = Minor interaction
= Geen klinisch significante interactie
= te vermijden bij congenitaal verlengd QT-interval A = No known
Aangezien niet alle CAM worden herkend door UTD CP en SDI, worden interacties tussen OAT en CAM nogmaals nagegaan via de ‘wegwijzer voedingssupplementen’ van de Stichting tegen Kanker en via de website van het Memorial Sloan Kettering Cancer Centre (MSKCC). [61], [62] Het resultaat van de interactiescreening, alsook klinische adviezen worden vervolgens geregistreerd in EPD en afhankelijk van het advies kan de behandelende arts gecontacteerd worden.
2 OBJECTIEVEN
Dit onderzoek heeft als doel de counselingsfunctie van de ziekenhuisapotheker in de apotheek van het UZ Gent te evalueren op verschillende niveaus. Ten eerste gebeurt een analyse van het aantal gecounselde patiënten en de tijdsbesteding. Ook worden de medicatie gerelateerde problemen met betrekking tot de correcte inname, de afgeleverde hoeveelheid, de discrepanties in de medicatielijst en de interacties bijgehouden en worden vragen van patiënten geïnventariseerd, evenals de acties en adviezen die door de apotheker werden geïnitieerd. Voor niet gecounselde patiënten wordt opgelijst waarom een counseling niet kan doorgaan.
Ten tweede wordt prospectief onderzocht of counseling door een apotheker positief kan bijdragen tot de kennis van de patiënt over zijn behandeling. Hiervoor wordt enerzijds o.b.v. de geneesmiddel-specifieke patiëntfiche een kennistest opgesteld. Aan de hand van een test voor en na counseling bij patiënten in opstart met een OAT wordt de medicatiebegeleiding door de ziekenhuisapotheker in kaart gebracht. Op basis van de correcte antwoorden kan de invloed van de counseling op de kennis van de patiënt geëvalueerd worden. Hierdoor kan op een kwalitatieve manier een inschatting gemaakt worden over de inhoud van de informatie die een ziekenhuisapotheker meegeeft tijdens begeleiding van patiënten op OAT. Daarnaast wordt bij alle gecounselde patiënten gepeild naar de tevredenheid van informatieverstrekking door de ziekenhuisapotheker.
Ten derde wordt de bevraging van de therapietrouw via de MARS-5 vragenlijst geïntegreerd in het counselingsgesprek en opgevolgd. De resultaten worden vergeleken met de MPR (medication possession ratio).
3 METHODEN
3.1 COMMISSIE VOOR MEDISCHE ETHIEK
Dit monocentrisch onderzoek gaat door in de ziekenhuisapotheek van het UZ Gent en werd goedgekeurd door de Commissie voor medische ethiek van het UZ Gent op 21/11/2019 met nummer 2019/1588. Alle patiënten zijn ouder dan 18 jaar en hun gegevens worden gepseudonimiseerd verwerkt.
3.2 RETROSPECTIEVE ANALYSE VAN DE COUNSELINGSFUNCTIE
3.2.1 PatiëntinclusiePatiëntselectie gebeurt retrograad via de digitale apotheekdatabank KLAP (Klinisch Logistiek ApotheekPakket) op basis van de in de ziekenhuisapotheek ambulant afgeleverde medicatie, behorend tot ATC-klasse L01, L02 en L04, in de periode van 21 augustus 2019 tot en met 29 februari 2020. Elke afhaling wordt per geneesmiddel geregistreerd als een OAT-patiëntcontact. De resulterende OAT-patiëntcontacten worden vervolgens gefilterd voor producten uit tabel 1.1. (= te counselen OAT-patiëntcontacten). Aangezien patiënten enkel gecounseld worden op weekdagen tussen 8u. ’s morgens en 16.30 u. ’s avonds (= OAT-patiëntcontacten binnen kantooruren), worden afhaalmomenten die buiten deze uren vallen, namelijk op weekdagen na 16.30 u. en tijdens het weekend, niet geïncludeerd (= OAT-patiëntcontacten buiten kantooruren). Een overzicht van deze werkflow wordt weergegeven in fig. 3.1.
3.2.2 Algemene gegevens van gecounselde en niet-gecounselde patiënten
Voor OAT-patiëntcontacten binnen kantooruren waarbij een counselingsgesprek mogelijk is, wordt een observatieblad ingevuld in het EPD en wordt de tijdsbesteding genoteerd. Dit laatste laat toe de gemiddelde duur van een counseling te bepalen. Wanneer niet gecounseld kan worden (= gemiste OAT-patiëntcontacten), registreert de counselende ziekenhuisapotheker één van volgende redenen: ‘patiënt had geen tijd’, ‘familie/vrienden halen medicatie op’, ‘apotheek had geen tijd’, ‘andere’ of ‘onbekend’. Onder de categorie ‘andere’ worden de redenen die afwijken van de reeds genoemde, geregistreerd. Het al of niet uitvoeren van een minicounseling bij deze patiënten wordt bijgehouden. OAT-patiëntcontacten binnen kantooruren waarvoor geen registratie werd gedaan, worden ingedeeld in de groep ‘onbekend’. Uit deze registratie wordt een overzicht van de gecounselde en gemiste OAT-patiëntcontacten per OAT opgesteld.
Op basis van het EPD wordt, voor elk OAT-patiëntcontact binnen kantooruren, algemene gegevens zoals het geslacht, de leeftijd, de woonplaats, het type tumor en de naam van de OAT, geregistreerd. Verder wordt er een onderscheid gemaakt tussen het aantal te counselen OAT-patiëntcontacten en het aantal unieke te counselen OAT-patiënten. De verzamelde gegevens worden bijgehouden en verwerkt met MicrosoftÒ Office Excel versie 16.38 en er wordt een beschrijvende statistiek toegepast.
3.2.3 Gestructureerde medicatieanamnese
De door de ziekenhuisapotheker geregistreerde wijzigingen in het medicatieschema van gecounselde OAT-patiëntcontacten worden per patiëntcontact geëvalueerd. Hiervoor wordt de thuismedicatiefolder in EPD geraadpleegd op datum van de counseling en op de laatste datum vlak vóór de counseling, waarbij de registratie van de thuismedicatie op de laatste datum vlak vóór de counseling geregistreerd moet zijn door een zorgverlener van het UZ Gent. Vervolgens worden beide schema’s met elkaar vergeleken en gecontroleerd op 9 soorten discrepanties: verkeerd geneesmiddel/CAM, verkeerde dosis, verkeerde frequentie, ontbrekende frequentie, verkeerd tijdstip, ontbrekend tijdstip, verkeerde farmaceutische vorm, ontbrekende medicatie (= medicatie die de patiënt inneemt, maar die niet geregistreerd staat) en reeds gestopte medicatie (= medicatie die de patiënt niet meer inneemt, maar wel nog geregistreerd staat).
Alle in België geregistreerde geneesmiddelen (inclusief magistrale bereidingen), buitenlandse medicatie en CAM (voedingssupplementen, homeopathie, fytotherapie) worden geïncludeerd.
Het aantal discrepanties per soort en per ATC-klasse wordt bepaald alsook het percentage van de patiëntcontacten waarbij de thuismedicatielijst niet correct was vóór de counseling en de patiëntcontacten waarbij de medicatielijst wel correct was vóór de counseling.
3.2.4 Posologie op het voorschrift en afgeleverde medicatie
Bij gecounselde OAT-patiëntcontacten worden, op basis van het observatieblad in EPD, de discrepanties in de correctheid van de posologie op het voorschrift en de aflevering van afwijkende hoeveelheden medicatie t.o.v. de voorgeschreven medicatie bepaald. Er wordt hierbij onderscheid gemaakt tussen ‘niet afwijkend’, ‘meer afgeleverd’ en ‘minder afgeleverd’.
3.2.5 Interactiescreening en apotheekadviezen
Op basis van het in EPD geregistreerde resultaat van de interactiescreening, worden de verschillende OAT-geneesmiddel- en OAT-CAM-interacties geïnventariseerd en onderverdeeld per type en ernst, als ook de interactie gerelateerde apotheekadviezen.
Hieruit wordt vervolgens het percentage gecounselde OAT-patiëntcontacten waarbij een interactiescreening aanleiding geeft tot een advies berekend. Op basis van de vergelijking tussen de thuismedicatielijst vóór en na het gegeven apotheekadvies wordt berekend bij hoeveel OAT-patiëntcontacten de thuismedicatielijst werd aangepast. Tot slot worden niet-OAT-interacties en adviezen geïnventariseerd.
3.2.6 Bijkomende vragen van patiënten en klinisch relevante informatie
In EPD geregistreerde vragen bij gecounselde OAT-patiëntcontacten en klinisch relevante informatie, met betrekking tot het patiëntcontact, worden bijgehouden en onderverdeeld op basis van het type van de vraag en informatie.
3.3 PROSPECTIEVE ANALYSE VAN DE COUNSELINGSFUNCTIE
3.3.1 Kennistest en tevredenheidsenquête
Om bij patiënten die starten met hun OAT-behandeling in de periode van 6 januari 2020 t.e.m. 31 maart 2020 te peilen naar de kennis van het correct gebruik van de OAT, wordt een vragenlijst over de OAT opgesteld. Patiënten worden zowel mondeling als schriftelijk (informatiebrief) geïnformeerd over de studie en bij akkoord voor deelname wordt een toestemmingsformulier (informed consent) ondertekend door de patiënt. (zie bijlage 8.3).
en/of zonder voeding), wat te doen bij een vergeten inname, de bijwerkingen, de bewaaromstandigheden en de beschikbaarheid van de medicatie. Vervolgens wordt elke vraag op correctheid beoordeeld met: ‘ja’, ‘nee’, ‘patiënt weet het niet’ en ‘niet van toepassing’.
De vragenlijst wordt op twee verschillende momenten aan patiënten voorgelegd: vlak vóór het eerste counselingsgesprek met de ziekenhuisapotheker (T0) en een week na de counseling (T1). Op T1 wordt de vragenlijst
telefonisch overlopen.
Algemene informatie zoals geslacht, leeftijd, graad van diploma en welke informatie reeds uitgewisseld werd over de OAT en door wie wordt in kaart gebracht.
Om de tevredenheid van alle patiënten, ongeacht het aantal counselgesprekken, over de begeleiding te evalueren in de periode van 6 januari 2020 t.e.m. 31 maart 2020, wordt een beoordelingsformulier (zie bijlage 8.5) ontwikkeld dat gebaseerd is op de PS-CaTE-vragenlijst (Patient Satisfaction with Cancer Treatment Education).
Antwoorden worden gegeven aan de hand van een Likert schaal (1 = helemaal niet akkoord, 2 = niet akkoord, 3 = neutraal, 4 = akkoord, 5 = helemaal akkoord). Een zesde antwoordmogelijkheid, nl. ‘niet van toepassing’, wordt toegevoegd zonder score, alsook een mogelijkheid voor de patiënt om extra opmerkingen of suggesties ter verbetering van het informatiegesprek aan te brengen.
Deze tevredenheidsenquête wordt onmiddellijk na het counselingsgesprek anoniem ingevuld door de patiënt.
Een overzicht van de flow van bevraging wordt weergegeven in bijlage 8.6.
Aangezien beide vragenlijsten niet gevalideerd zijn, werden na goedkeuring door de Commissie voor medische ethiek van het UZ Gent, vóór de start van het onderzoek 3 willekeurige patiënten door de counselende apotheker bevraagd, gedurende een periode van 2 weken.
3.3.2 Dataverwerking
De beoordeling van de vragen en de algemene gegevens worden verwerkt met behulp van MicrosoftÒ Office Excel, versie 26.38 en SPSS.
Er wordt een vergelijking gemaakt tussen de kennis van patiënten op T0 en de kennis van patiënten op T1.
Om de statistische verwerking van de gegevens te vereenvoudigen, wordt de beoordeling van de vragen opgedeeld in twee categorieën: ‘correct’ en ‘niet correct’. De beoordeling ‘nee’ en ‘patiënt weet het niet’ worden onder categorie
Per item van de tevredenheidsenquête wordt het percentage van de antwoorden berekend. Om de verwerking van de gegevens te vereenvoudigen, worden de antwoordmogelijkheden ingedeeld in drie groepen van tevredenheid: de tevreden groep omvat de antwoordmogelijkheden ‘helemaal akkoord’ en ‘akkoord’; de neutrale groep omvat de antwoordmogelijkheid ‘neutraal’ en de ontevreden groep omvat de antwoordmogelijkheden ‘niet akkoord’ en ‘helemaal niet akkoord’. Vervolgens worden de groepen per vraag in een grafiek uitgezet. Om na te gaan of de verschillende items van de enquête hetzelfde meten, wordt de Cronbach’s alfa, de interne consistentie coëfficiënt, berekend. Een waarde van >0,70 wijst op betrouwbaarheid, waarna de totale tevredenheid per patiënt berekend kan worden. [63], [64] Extra opmerkingen en suggesties van patiënten worden geïnventariseerd.
3.4 THERAPIETROUW
3.4.1 Integratie MARS-5-vragenlijst in een counseling
Om tijdens een counseling de therapietrouw te beoordelen aan de hand van een gevalideerde vragenlijst zoals MARS-5, wordt in EPD een observatieblad voor therapietrouw aangemaakt (zie bijlage 8.7), waarin volgende items opgenomen worden: de naam van het geneesmiddel, de MARS-5-vragenlijst en een conclusie omtrent de therapietrouw van de patiënt. De MARS-5-vragenlijst bestaat uit 5 stellingen die door de patiënt beoordeeld worden met ‘altijd’, ‘vaak’, ‘soms’, ‘zelden’ of ‘nooit’. Aan elke beoordeling is een score gekoppeld (Altijd = 1, Vaak = 2, Soms = 3, Zelden = 4, Nooit = 5). De som van elke individuele score geeft een totale score die kan variëren van 5 tot en met 25. Hoe hoger de score, hoe hoger de therapietrouw van de patiënt. Indien de score gelijk, of groter is dan 23 kan men besluiten dat de patiënt therapietrouw is. Deze grens werd na overleg tussen ziekenhuisapothekers van het UZ Gent bepaald. [65] Indien de therapietrouw onvoldoende is, worden door de ziekenhuisapotheker verbeteracties voorgesteld die vervolgens geregistreerd worden in het veld ‘Acties’. Tenslotte wordt tijdens een volgende counseling bijgehouden of de therapietrouw verbeterd of verslechterd is t.o.v. een vorige counseling.
3.4.2 Retrospectieve analyse van de therapietrouw a.d.h.v. de MARS-5 en de MPR
In een periode van 2 januari t.e.m. 14 juni 2020 wordt per gecounselde OAT-patiëntcontact de MPR (Medication Possession Ratio) tussen twee opeenvolgende voorschriften berekend in Microsoft® Office Excel versie 26.38,
De MPR wordt bepaald aan de hand van volgende formule [43]:
Op basis van de, in EPD en KLAP bijgehouden, hoeveelheid afgeleverde en voorgeschreven posologie, wordt de som van het aantal dagen waarvoor medicatie is verstrekt, berekend. Het tijdsinterval tussen de afhaaldatum en de datum waarop de patiënt terug naar het ziekenhuis komt wordt berekend aan de hand van het verschil tussen de vorige afhaaldatum en de datum waarop de patiënt naar het ziekenhuis komt voor herbevoorrading van de medicatie. Vervolgens worden de berekende MPR’s in een spreidingsdiagram uitgezet t.o.v. van de totaalscore van de MARS-5 om de overeenstemming tussen beide resultaten visueel na te gaan. Er wordt rekening gehouden met de kritische grens van 23 voor de MARS-5-score en van 90% voor de MPR. [39]
Vergelijking 3.1 Formule voor het berekenen van de MPR
MPR = Som van het aantal dagen waarvoor medicatie is verstrekt
4 RESULTATEN
4.1 RETROSPECTIEVE ANALYSE VAN DE COUNSELINGSFUNCTIE
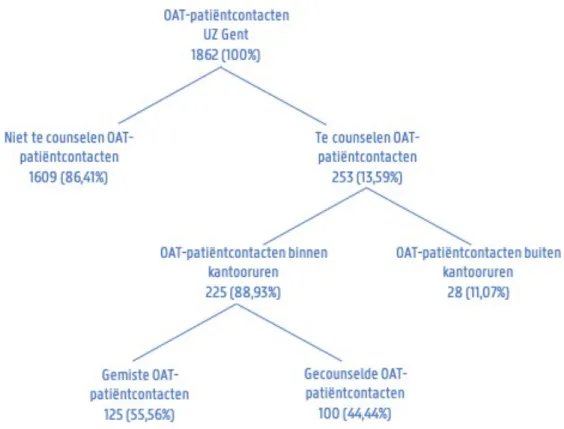
4.1.1 PatiëntinclusieIn de periode van 21/08/2019 t.e.m. 29/02/2020 werden 1862 OAT-patiëntcontacten in de apotheek geregistreerd (zie fig. 4.1). Bij 253 OAT-patiëntcontacten (13,6%, 112 unieke patiënten) werd een OAT afgeleverd uit Tabel 1.1. Hiervan vielen 225 (88,9%) OAT-patiëntcontacten binnen de kantooruren. Dit komt overeen met 106 unieke patiënten binnen de groep ‘Te counselen OAT-patiëntcontacten’, waarvan 37 patiënten (34,9%) voor het eerst gecounseld werden en 27 patiënten (25,5%) nog nooit gecounseld werden.
Van de 225 te counselen OAT-patiëntcontacten vond bij 100 patiëntcontacten (44,4%, 29 unieke patiënten) effectief een counselingsgesprek plaats met een range van minimum één en maximum vier counselingsgesprekken voor éénzelfde patiënt gedurende de studieperiode.
Bij 125 patiëntcontacten (55,6%, 77 unieke patiënten) werd niet gecounseld. Redenen waren een afhaling van de medicatie door familie of vrienden bij 27 patiëntcontacten (21,6%), geen tijd voor een gesprek bij 21 patiëntcontacten (16,8%) en geen tijd voor de apotheker om een gesprek aan te gaan bij 6 patiëntcontacten (4,8%). Andere oorzaken (25,6%) voor het missen van een counseling waren: ‘reeds een counseling gekregen in het verleden’ (N=15 OAT-patiëntcontacten), ‘het niet nuttig vinden om een counseling te krijgen (N=12 OAT-patiëntcontacten) en ‘geen gesprek wensen’ zonder verdere uitleg (N=5 OAT-patiëntcontacten). Tot slot was bij 39 patiëntcontacten (31,2%) de oorzaak van een gemiste counseling onbekend. Elf OAT-patiëntcontacten (8,8%) die niet gecounseld werden, kregen een minicounseling aan de balie van de apotheek. Hiervan hadden 6 patiëntcontacten geen tijd voor een volledige counseling, voor 2 patiëntcontacten kregen de familieleden een korte uitleg aan de balie en 3 patiëntcontacten kregen een minicounseling omdat ze reeds op een ander moment een volledige counseling hadden gekregen.
De gemiddelde tijd die nodig was voor een counselingsgesprek was 15,7 min ± 8,01min (N=100 patiëntcontacten). Een eerste gesprek duurde gemiddeld 17,6 min ± 8,08 min (N=37 patiëntcontacten) en een herhalingsgesprek duurde gemiddeld 14,5 min ± 7,81 min (N=63 patiëntcontacten).
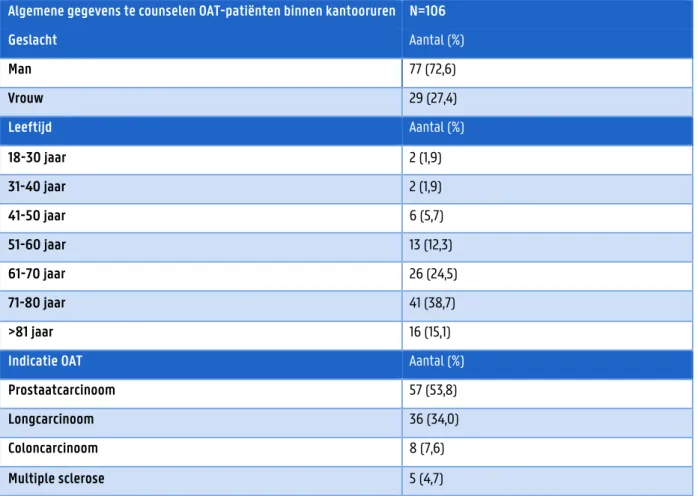
Tabel 4.1 geeft een overzicht van de algemene gegevens van de unieke te counselen OAT-patiënten binnen de kantooruren. Van de 106 patiënten zijn er 77 mannen (72,6%) en 29 vrouwen (27,4%). De leeftijdsrange ligt tussen 21 jaar en 89 jaar, met een gemiddelde leeftijd van 68 jaar. Een OAT voor prostaatcarcinoom werd aan 57 patiënten afgeleverd (53,8%), een OAT voor longcarcinoom aan 36 patiënten (34,0%), een OAT voor coloncarcinoom aan 8 patiënten (7,6%) en een OAT voor multiple sclerose aan 5 patiënten (4,7%).
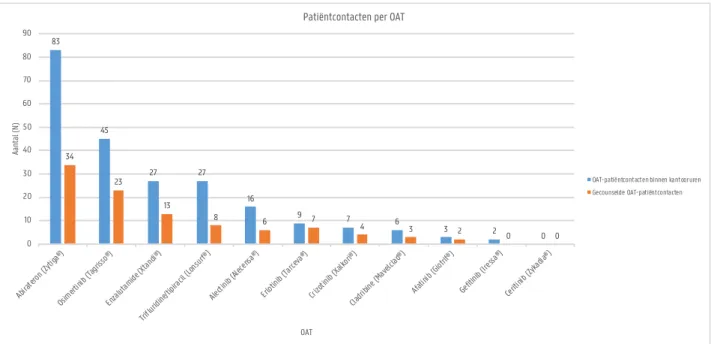
Figuur 4.2 geeft per OAT een overzicht van de patiëntcontacten binnen de kantooruren en de gecounselde patiëntcontacten. Er is te zien dat zowel het aantal patiëntcontacten binnen de kantooruren (83) als het aantal gecounselde patiëntcontacten (34) voor abirateron (Zytiga®) het hoogst was. Bij 45 patiëntcontacten werd osimertinib (Tagrisso®) afgehaald waarvan 23 gecounseld werden en 27 patiëntcontacten haalden enzalutamide (Xtandi®) af waarvan 13 gecounseld werden.
Tabel 4.1 Overzicht van de algemene gegevens van de te counselen OAT-patiënten binnen kantooruren
Algemene gegevens te counselen OAT-patiënten binnen kantooruren N=106
Geslacht Aantal (%) Man 77 (72,6) Vrouw 29 (27,4) Leeftijd Aantal (%) 18-30 jaar 2 (1,9) 31-40 jaar 2 (1,9) 41-50 jaar 6 (5,7) 51-60 jaar 13 (12,3) 61-70 jaar 26 (24,5) 71-80 jaar 41 (38,7) >81 jaar 16 (15,1)
Indicatie OAT Aantal (%)
Prostaatcarcinoom 57 (53,8)
Longcarcinoom 36 (34,0)
Coloncarcinoom 8 (7,6)
Volgens figuur 4.3 zijn 101 van de 106 unieke patiënten afkomstig uit België, waarvan 86 patiënten uit Oost-Vlaanderen (81,1%) komen, 11 patiënten uit West-Oost-Vlaanderen (10,4%), 2 patiënten uit Antwerpen (1,9%) en 2 patiënten uit Vlaams-Brabant (1,9%).
Vijf patiënten (4,7%) zijn afkomstig uit het buitenland, nl. 4 patiënten komen uit Nederland en 1 patiënt is afkomstig uit Zwitserland.
Figuur 4.2 Overzicht van de OAT-patiëntcontacten binnen kantooruren en gecounselde OAT-patiëntcontacten per OAT.
83 45 27 27 16 9 7 6 3 2 0 34 23 13 8 6 7 4 3 2 0 0 0 10 20 30 40 50 60 70 80 90 Abira teron ( Zytig a®) Osim ertini b (Ta griss o®) Enza lutam ide (X tand i®) Triflu ridine /tipir acil ( Lons urf® ) Alecti nib (A lecen sa®) Erlot inib ( Tarce va®) Crizo tinib (Xalk ori®) Cladr ibine (Mav elclad ®) Afati nib (G iotrif ®) Gefit inib ( Iressa ®) Cerit inib ( Zyka dia®) Aa nta l ( N) OAT
Patiëntcontacten per OAT
OAT-patiëntcontacten binnen kantooruren Gecounselde OAT-patiëntcontacten 1 3 1 1 1 8 3 2 3 4 2 1 1 2 1 1 1 1 Gent 1 8 Aantal
4.1.2 Gestructureerde medicatieanamnese
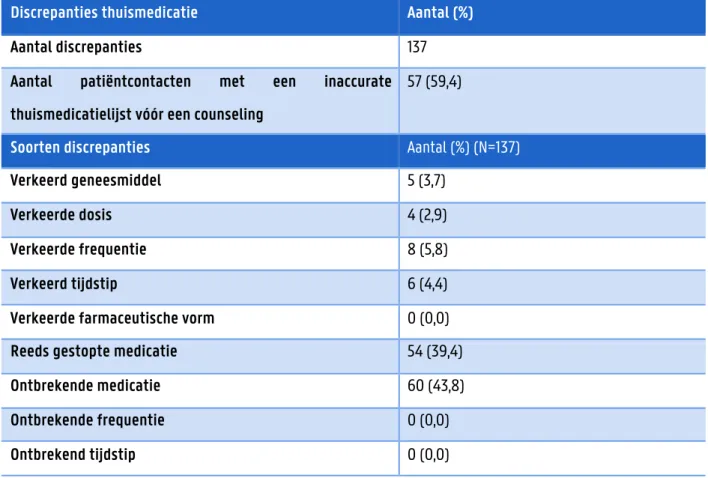
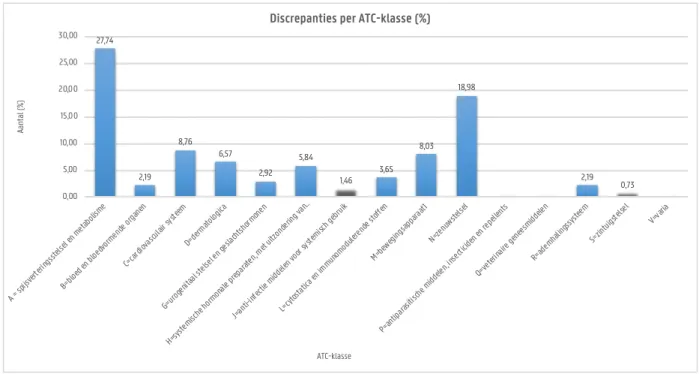
Van de 100 gecounselde OAT-patiëntcontacten werd bij 4 patiëntcontacten (4,0%) de thuismedicatie niet bevraagd door tijdsgebrek, deze werden niet verder meegenomen in de dataverwerking. Per patiëntcontact werd, naast de OAT, gemiddeld 8,11 geneesmiddelen ingenomen, met een minimum van 2 geneesmiddelen en een maximum van 17 geneesmiddelen. In tabel 4.2 is te zien dat van de 96 patiëntcontacten, waarbij de thuismedicatie bevraagd is, bij 57 patiëntcontacten (59,4%) de thuismedicatielijst vóór een counseling niet accuraat bleek te zijn. Er werden in totaal 137 discrepanties geregistreerd, meestal ging dit over ontbrekende medicatie (43,8%) en reeds gestopte medicatie (39,4%).
Tabel 4.2 Overzicht van de discrepanties in de thuismedicatie
Een overzicht van de discrepanties per ATC-klasse wordt weergegeven in fig. 4.4 met een verdere onderverdeling per type discrepantie in figuur 4.5. De meeste discrepanties worden waargenomen in ATC-klasse A (spijsverteringsstelsel
Discrepanties thuismedicatie Aantal (%)
Aantal discrepanties 137
Aantal patiëntcontacten met een inaccurate thuismedicatielijst vóór een counseling
57 (59,4)
Soorten discrepanties Aantal (%) (N=137)
Verkeerd geneesmiddel 5 (3,7)
Verkeerde dosis 4 (2,9)
Verkeerde frequentie 8 (5,8)
Verkeerd tijdstip 6 (4,4)
Verkeerde farmaceutische vorm 0 (0,0)
Reeds gestopte medicatie 54 (39,4)
Ontbrekende medicatie 60 (43,8)
Ontbrekende frequentie 0 (0,0)
medicatie (N=1; 7,1%) en de verkeerde dosis (N=1; 7,1%). Eén discrepantie bij parafarmacie (0,7%) werd veroorzaakt door het reeds stoppen ervan.
Figuur 4.4. Overzicht van het aantal discrepanties per ATC-klasse
27,74 2,19 8,76 6,57 2,92 5,84 1,46 3,65 8,03 18,98 2,19 0,73 0,00 5,00 10,00 15,00 20,00 25,00 30,00 A = sp ijsve rterin gsste lsel e n met aboli sme B=blo ed en bloe dvorme nde o rganen C=ca rdiov ascu lair s ysteem D=de rmato logica G=ur ogen itaal stelse l en g eslac htsh ormo nen H=sy stemi sche horm onale prep arate n, met uitzo ndering van… J=an ti-inf ectie midd elen v oor s ystemi sch ge bruik L=cy tosta tica e n immu nomo duler ende stoff en M=be wegin gsap paraat1 N=ze nuws telse l P=an tipar asitisch e midd elen, insec ticide n en r epell ents Q=ve terina ire ge nees midd elen R=ad emha lings syste em S=zin tuigs telse l V=va ria Aa nta l ( % ) ATC-klasse
Discrepanties per ATC-klasse (%)
7,89 8,33 33,33 20,00 16,67 3,85 2,63 11,11 12,50 9,09 36,84 33,33 41,67 66,67 50,00 60,00 18,18 46,15 66,67 100,00 42,11 66,67 25,00 22,22 50,00 25,00 100,00 20,00 63,64 42,31 0,00 20,00 40,00 60,00 80,00 100,00 120,00 A = sp ijsverte rings stelse l en m etab olism e B=blo ed en bloe dvorme nde o rgan en C=card iovas culai r syste em D=de rmato logica G=ur ogen itaal stelse l en g eslac htsh ormo nen H=sy stemi sche ho rmon ale pr eparate n, met uitzo ndering van i nsuli ne en … J=an ti-inf ectie midd elen v oor s ystemi sch ge bruik L=cytos tatic a en i mmu nomo duler ende stoff en M=be wegin gsap paraat1 N=ze nuws telse l P=an tipar asitisch e midd elen, insec ticide n en r epell ents Q=ve terina ire ge nees midd elen R=ad emha lings syste em S=zin tuigs telse l V=va ria Aa nta l ( % ) ATC-klasse
Type discrepantie per ATC-klasse (%)
verkeerde geneesmiddel verkeerde dosis verkeerde frequentie verkeerde tijdstip verkeerde farmaceutische vorm reeds gestopte medicatie ontbrekende medicatie ontbrekende frequentie ontbrekend tijdstip
4.1.3 Posologie op het voorschrift en afgeleverde medicatie
Tabel 4.3 geeft de correctheid van de posologie op het voorschrift weer, alsook of de hoeveelheid afgeleverde medicatie werd gewijzigd. Van de 100 gecounselde OAT-patiëntcontacten werden bij 11 patiëntcontacten (11,0%) geen gegevens geregistreerd omtrent de correctheid van posologie op het voorschrift en bij 24 patiëntcontacten (24,0%) werden geen gegevens omtrent afgeleverde hoeveelheid geregistreerd. Deze gegevens werden niet verder meegenomen in de dataverwerking.
De posologie op het voorschrift was bij 9 van de 89 patiëntcontacten (10,1%) incorrect. Hierbij werd bij 8 patiëntcontacten (9,0%) een interventie uitgevoerd door de counselende apotheker. Bij 6 patiëntcontacten werd de posologie mondeling uitgelegd door de apotheker, voor 1 patiëntcontact werd de arts gecontacteerd en bij 1 patiëntcontact werd de thuismedicatiefolder direct aangepast.
Bij de meerderheid van de patiëntcontacten (N=72; 94,7%) kwam de afgeleverde hoeveelheid medicatie overeen met de voorgeschreven hoeveelheid. Bij 1 patiëntcontact (1,3%) werd minder medicatie afgeleverd dan voorgeschreven en bij 3 patiëntcontacten (4,0%) werd meer medicatie afgeleverd dan voorgeschreven.
4.1.4 Interactiescreening en apotheekadviezen
Correctheid posologie Aantal (%) (N=89)
Incorrecte posologie 9 (10,1)
Aantal interventies door apotheker
• Mondelinge uitleg over de posologie • Arts contacteren • Aanpassen thuismedicatiefolder 8 (9,0) 6 (75,0) 1 (12,5) 1 (12,5)
Afgeleverde medicatie Aantal (%) (N=76)
Minder afgeleverd 1 (1,3)
Meer afgeleverd 3 (4,0)
Geen afwijking 72 (94,7)
![Fig 1.1 Overzicht van de beïnvloedende factoren op de therapietrouw. [27]](https://thumb-eu.123doks.com/thumbv2/5doknet/3295079.22142/18.892.296.638.603.897/fig-overzicht-beïnvloedende-factoren-therapietrouw.webp)
![Tabel 1..1 Overzicht van de geneesmiddelen waarvoor een counseling kan plaatsvinden op 21 augustus 2019 [50] , [28]](https://thumb-eu.123doks.com/thumbv2/5doknet/3295079.22142/22.892.91.794.158.593/tabel-overzicht-geneesmiddelen-waarvoor-counseling-plaatsvinden-augustus.webp)

![Tabel 1.2 Overzicht van de verschillende niveaus van interactie afhankelijk van de database [57]–[60]](https://thumb-eu.123doks.com/thumbv2/5doknet/3295079.22142/26.892.97.793.275.600/tabel-overzicht-verschillende-niveaus-interactie-afhankelijk-database.webp)