DIAGNOSE
VAN
TYPE
I
OVERGEVOELIGHEID
BIJ
PAARDEN
EN
HONDEN
Aantal woorden: 17813
Astrid Corine Marianne Geel
Studentennummer: 01400333
Promotor: Prof. Dr. Eric Cox
Co-promotor: Dr. Michael Pelst
Onderdeel van de masterproef voorgelegd voor het behalen van de graad master in de diergeneeskunde Academiejaar: 2019 – 2020
Universiteit Gent, haar werknemers of studenten bieden geen enkele garantie met betrekking tot de juistheid of volledigheid van de gegevens vervat in deze masterproef, noch dat de inhoud van deze masterproef geen inbreuk uitmaakt op of aanleiding kan geven tot inbreuken op de rechten van derden.
Universiteit Gent, haar werknemers of studenten aanvaarden geen aansprakelijkheid of verantwoordelijkheid voor enig gebruik dat door iemand anders wordt gemaakt van de inhoud van de masterproef, noch voor enig vertrouwen dat wordt gesteld in een advies of informatie vervat in de masterproef.
Preambule
De COVID-19 crisis heeft weinig impact op het schrijven van deze thesis gehad aangezien het een literatuur studie is. Wel heb ik wegens deze crisis minder kunnen samen komen met mijn promotor, Prof. Dr. Eric Cox, maar dit is opgelost door middel van goed mail contact.
Voorwoord
Graag wil ik hier de kans nemen om verschillende mensen te bedanken die hebben geholpen bij het tot stand brengen van deze thesis en het succesvol afronden van mijn studie.
Als eerste wil ik graag mijn promotor, Prof. Dr. Eric Cox en mijn co-promotor Dr. Michael Pelst bedanken. Zij hebben met veel geduld steeds mijn thesis verbeterd, nuttig commentaar gegeven en mij verschillende nuttige artikelen doorgestuurd. Dit alles heeft een grote meerwaarde gehad bij het tot stand komen van deze thesis.
Daarnaast zou ik ook graag mijn ouders bedanken die mij tijdens de 6 jarige opleiding altijd hebben ondersteund, en altijd in mij blijven geloven. Ook wil ik hen bedanken voor het doorlezen en het geven van nuttige opmerkingen over mijn thesis.
Ook zou ik graag mijn vrienden bedanken om mij altijd te ondersteunen in mijn studie en mijn keuzes. Hierbij wil ik graag Renee Rozemeijer persoonlijk bedanken; we zijn samen op dag 1 begonnen en zullen het nu ook samen afronden! Heel erg bedankt voor alle steun tijdens de opleiding.
Als laatste zou ik graag mijn vriend, Wouter Blokland, bedanken. Hij heeft mij ondersteund bij het schrijven van deze thesis en het afronden van mijn studie.
Inhoudsopgave
Samenvatting ... 6 1 Inleiding ... 7 2 De overgevoeligheidsreactie ... 8 2.1 Types overgevoeligheidsreacties ... 8 2.1.1 Type I ... 8 2.1.2 Type II ... 8 2.1.3 Type III ... 8 2.1.4 Type IV ... 82.2 Productie van IgE ... 9
2.2.1 Antistoffen aanwezig bij veulen ... 9
2.2.2 Antistoffen aanwezig bij de puppy ... 9
2.2.3 IgE productie ... 10
2.3 Types mastcellen ... 10
2.4 Receptoren voor IgE op mastcellen ... 11
2.5 Mechanisme van degranulatie van mastcellen ... 12
2.6 Mediatoren tijdens een type I overgevoeligheidsreactie ... 12
2.7 Regulatie van de respons ... 14
3 Diagnosemethoden ... 15
3.1 Klinische beeld ... 15
3.1.1 Klinische uitingen van een type I overgevoeligheidsreactie bij paard en hond ... 15
3.1.2 Klinische uitingen van een type I overgevoeligheidsreactie bij het paard ... 15
3.1.3 Klinische uitingen van een type I overgevoeligheidsreactie bij de hond ... 18
3.2 Huidtesten ... 21
3.2.1 Epicutane test (plakproef) ... 21
3.2.2 Percutane test (Huid prik test) ... 21
3.2.3 Intradermale testen ... 22 3.3 Serologie ... 29 3.3.1 ELISA ... 29 3.3.2 RAST ... 32 3.3.3 Western blotting ... 32 3.3.4 Basofiele activatietest ... 32
3.4 Passieve cutane anafylaxietest (PCA) ... 34
4 Discussie ... 35
4.1 Vergelijking van de diagnostische methoden ... 35
4.1.1 Vergelijking van het klinische beeld en de andere methoden ... 35
4.1.2 Vergelijking van intradermale allergietesten en serologische allergietesten ... 35
4.1.3 Vergelijking van verschillende serologische testen ... 36
4.1.4 Vergelijking van de basofiele activatietest met de andere diagnostische methoden ... 37
5 Conclusie ... 38
6
Samenvatting
De hond en het paard worden steeds vaker als gezinsleden gezien in tegenstelling tot een gewoon huisdier. Daarom is de eigenaar sneller geneigd, als er iets mankeert aan deze dieren, om het probleem uit te zoeken en op te lossen. De diagnose van een allergie bij deze dieren wordt hierdoor steeds vaker vastgesteld. Hedendaags zijn er verschillende manieren om de diagnose te stellen, waarbij op dit moment de intradermale test als de gouden standaard, bij zowel de hond als het paard, wordt gezien.
Andere methoden die kunnen worden gebruikt zijn bijvoorbeeld de klinische uitingen, andere huidtesten, waaronder de epicutane en percutane huidtesten, en serologische testen. Het grootste nadeel van de huidtesten is dat het over invasieve testen gaat waarbij het dier zowel gedurende een periode stil moet liggen, als geschoren en vaak gesedeerd moet worden. Het voordeel van de serologische testen is dat deze via bloed opname moeten gebeuren, en daardoor door elke dierenarts correct kunnen worden uitgevoerd. De intradermale test wordt op dit moment het meest gebruikt, maar is nog niet volledig betrouwbaar; er zijn nog vele verbeterpunten. Dit zijn punten zoals het ontbreken van correcte richtlijnen voor de te gebruiken dosissen van allergenen, het tijdstip van het verrichten van de test, hoe sedatie en hoe de geografische locatie van het dier een invloed hebben op de dosis allergenen die gebruikt moet worden. Ook zouden er gestandaardiseerde richtlijnen moeten worden overeengekomen met betrekking tot de techniek van het uitvoeren van deze test.
De intradermale test zou dus verder moeten worden onderzocht en worden gestandaardiseerd. Andere methodes zoals de serologische FcεRI gebaseerde ELISA, de percutane test en de basofiele activatietest zouden ook een oplossing kunnen zijn bij het diagnosticeren van type I overgevoeligheid bij de hond en het paard. Daar deze vaak eenvoudiger uitvoerbaar en minder invasief zijn voor het dier, genieten deze de voorkeur, maar uitgebreider onderzoek is wenselijk.
7
1 Inleiding
Bij de hond en het paard wordt steeds vaker de diagnose ‘allergie’ gesteld. Dit is, onder andere, het gevolg van het feit dat deze huisdieren steeds meer aangezien worden als een deel van het gezin, waardoor de eigenaar zich vlugger tot de dierenarts wendt bij problemen en aandringt op grondig onderzoek. Daarnaast beschikken eigenaars nu vaak over meer financiële mogelijkheden om deze onderzoeken te bekostigen. Bovendien neemt met de hedendaagse normen van de diergeneeskunde, het belang in het stellen van een diagnose toe (Mueller et al., 2016). Tenslotte neemt ook de kennis over deze ziekten toe waardoor er ook steeds betere en meer betrouwbare manieren zijn om een diagnose te stellen en de daarop gebaseerde behandeling af te stemmen (Jensen-Jarolim et al., 2015).
In deze thesis wordt er gekeken naar de type I overgevoeligheidsreactie. Basis hiervoor zijn de in de literatuur verschenen publicaties. Het doel is een overzicht te geven van de verschillende diagnosemethoden en hun voor- en nadelen. Tenslotte zal in de conclusie worden aangegeven welke diagnosemethoden worden aanbevolen, gezien de huidige kennis hierover en de behaalde resultaten. Belangrijk hierbij is ook de invloed van de omstandigheden waaronder de testen worden gedaan. De conclusie wordt afgerond met een aanbeveling voor verder onderzoek.
Type I overgevoeligheid is een directe allergische reactie, nadat het dier met het allergeen in aanraking is gekomen. Het is gebaseerd op de aanwezigheid van allergeenspecifiek IgE en het vrijkomen van verschillende mediatoren die zorgen voor de typische kenmerken van een allergie. Het wordt een directe immuunrespons genoemd omdat de IgE’s gebonden zitten aan de hoge affiniteitsreceptor FcεR1 van mastcellen en wanneer een allergeen 2 IgE’s op een mastcel kruis verbindt, er direct een vrijstelling van een hele reeks moleculen gebeurt (Burton en Oettgen, 2011; Rajan, 2003).
8
2 De overgevoeligheidsreactie
Om een duidelijke achtergrond te krijgen van de in de literatuur besproken diagnostische methoden, zal in dit hoofdstuk een korte beschrijving van de vier verschillende types overgevoeligheidsreacties (2.1) worden gegeven. Hierna wordt de type I overgevoeligheidsreactie meer in detail besproken. Er wordt gekeken naar de productie van IgE (2.2), de types mastcelen (2.3), de verschillende receptoren voor IgE op de m astcel (2.4), het mechanisme van degranulatie (2.5) en de verschillende mediatoren die vrijkomen tijdens een type I overgevoeligheidsreactie (2.6). Tenslotte zal de regulatie van de respons worden besproken (2.7). Deze informatie heeft als doel een beter begrip van de besproken diagnostische methoden (3) te kunnen bekomen.
2.1 Types overgevoeligheidsreacties
2.1.1 Type I
De type I overgevoeligheidsreactie is een reactie die direct optreedt na contact met het allergeen. Het allergeen bindt op IgE wat aan mastcellen of basofielen is gebonden via de hoge affiniteitsreceptor (FcεR1), waarna er een vrijstelling is van verschillende mediatoren. Deze mediatoren zorgen voor de typische symptomen, zoals roodheid, warmte en zwelling van de locatie, die we zien bij een type I overgevoeligheid (Lorch et al., 2001b; Popiel en Cekiera, 2015).
2.1.2 Type II
De type II overgevoeligheidsreactie treedt binnen minuten tot uren op na het opnemen van het antigeen. Het is een cytotoxische reactie. Hierbij zal de antistof samen met complement binden op weefsels waar aan het antigeen is gebonden. Deze binding zorgt voor cel afbraak en necrose waardoor de weefselcellen afsterven. Een voorbeeld van een type II overgevoeligheidsreactie is neonatale isoerythrolyse, dat o.a. bij veulens kan optreden (Tizard, 2004).
2.1.3 Type III
Een type III overgevoeligheidsreactie wordt veroorzaakt door immuuncomplexen. Een immuuncomplex is een binding tussen een antistof en een antigeen. Deze zullen in het weefsel, door activatie van complement met vorming van verschillende mediatoren, o.a. chemotactisch werken voor neutrofielen. De neutrofielen zullen vervolgens verschillende enzymen en oxidanten vrijstellen en een acute inflammatie en weefselbeschadiging veroorzaken (Tizard, 2004).
De hevigheid van de reactie is afhankelijk van het aantal immuuncomplexen en de lokalisatie van het weefsel. Er zijn twee verschillende locaties waar deze kunnen ontstaan (Tizard, 2004).
● Lokaal in het weefsel; hier zullen de immuuncomplexen een lokale reactie veroorzaken.
● Algemeen in de bloedbaan. De immuuncomplexen zullen deels neerslaan in de bloedvatwand en zorgen voor een vasculitis. Het andere deel zal in de bloedbaan blijven en kan ter hoogte van de nier zorgen voor glomulaire nierletsels en de filtratie van de nier belemmeren. De immuuncomplexen kunnen ook aan de bloedcellen binden en zorgen voor een anemie, een leukopenie en een thrombocytopenie.
2.1.4 Type IV
Type IV overgevoeligheid is een vertraagde reactie. Dit is de overgevoeligheidsreactie die langzaam optreedt, meestal pas na 48-72 uur of nog later. Het is een cel gemedieerde reactie, terwijl de eerdere besproken types juist antistof gemedieerd zijn. Er is een interactie tussen antigeen, antigeen-presenterende cellen en T-cellen. Er zal hier een overstimulatie zijn van deze cellen. Het is een reactie op antigenen die niet via de normale acute inflammatoire processen verwijderd kunnen worden. Een voorbeeld van deze overgevoeligheidsreactie is de tuberculinatie, die veel bij runderen intradermaal in de hals wordt gedaan (Tizard, 2004, Warrington, 2011).
9
2.2 Productie van IgE
2.2.1 Antistoffen aanwezig bij veulen
IgE is een belangrijke antistof in het lichaam van alle zoogdieren. Jonge dieren hebben in vergelijking met volwassen dieren een minder reactief immuunsysteem (waarbij wordt gezien dat er minder antistoffen, minder T-cel respons en een gemodificeerd cytokine profiel is). Dit alles zorgt zowel voor een verminderde reactie op pathogenen als voor een verminderde stimulatie van het immuunsysteem. Beide zijn nodig om te kunnen onderscheiden tussen niet schadelijke antigenen (van voedsel of commensalen) en schadelijke antigenen (van bijvoorbeeld virussen). Het vaccineren van moederdieren zorgt voor een stimulatie van de aanmaak van immunoglobulines, die dan via het colostrum worden doorgegeven (Perkins en Wagner, 2015).
Bij het paard zien we dat de merrie een epitheliochoriale placenta heeft wat de passage van alle immunoglobulines verhindert tijdens de dracht. Deze passage zal via de opname van colostrum moeten gebeuren na de partus. Hierbij worden immunoglobulines van het colostrum via een speciale neonatale Fc-receptor (FcRn) naar de circulatie van het veulen getransporteerd. Er is ook via andere mechanismen transport van maternale immuuncellen en cytokines naar de circulatie. Tijdens de normale dracht van het paard zal de foetus lage concentraties endogeen IgG1 en IgM produceren. Deze productie blijft doorgaan na de partus maar moet ondersteund worden door de maternale immuniteit (Perkins en Wagner, 2015). Het colostrum van de merrie bevat IgG isotypes 1 tot 7, IgM, IgA en IgE. IgG 4 en 7 en 3 en 5 kunnen moeilijk van elkaar onderscheiden worden. IgG 4 en 7 zijn van belang voor bacteriële en virale infecties en zijn als hoofdcomponent aanwezig in het colostrum. IgG1, IgG3 en 5, IgA en IgE zijn ook aanwezig; deze zorgen voor de algemene immuun bescherming van de neonaat. Na colostrum-opname is het immunoglobuline-profiel voor een groot deel hetzelfde als in een volwassen paard; vooral IgG4 en 7 en ook, zij het in mindere mate, IgG3 en 5, IgG1, IgM en kleine hoeveelheden IgE. Het totaal aantal immunoglobulines daalt door het verbruik ervan, hier zal de endogene immuniteit van het veulen moeten overnemen wat het antistof profiel doet veranderen (Perkins en Wagner, 2015).
Het veulen krijgt IgE via het colostrum dat ongeveer 2-3 maanden aanwezig blijft in de circulatie van het veulen. Nadat de maternale IgE verdwenen is, zien we dat er nog geen endogene productie van IgE op gang is gekomen. De start van IgE productie, is ras afhankelijk, en begint tussen 6 en 11 maand. Het veulen zal dus een aantal maanden (vanaf 2-3 maand tot 6-11 maand) geen IgE in de circulatie hebben (Perkins en Wagner, 2015).
2.2.2 Antistoffen aanwezig bij de puppy
De teef heeft een endotheliochoriale placenta. Dit placenta type verhindert overdracht van de meeste immunoglobulines tijdens de dracht. De immunoglobulines moeten dus via het colostrum en de melk worden opgenomen. De hoeveelheid van overdracht is variabel tussen verschillende nesten en verschilt zelfs voor puppy’s binnen een nest (Chastant en Mila, 2019).
IgG is als hoogste concentratie (60% van de immunoglobulines) aanwezig in het colostrum van de teef. IgA is het tweede meest aanwezige immunoglobuline (35-40%) en IgM zal ongeveer 5% van de aanwezige immunoglobulines representeren. Van IgE wordt gedacht dat het aanwezig is, maar in zulke lage concentraties dat het onmeetbaar is (Chastant-Maillard et al., 2017).
Na ongeveer 48 uur is colostrum overgegaan in melk. Dit wordt gekenmerkt door een daling in IgG en een stijging in IgA. Hierbij wordt IgA nu als hoofdcomponent gezien. IgA zal lokaal in de darm helpen met het bestrijden van pathogenen (pathogenen herkennen of het presenteren van deze pathogenen aan witte bloedcellen), en het wordt ook passief opgenomen door het epitheel, waarna het over de verschillende mucosa wordt verdeeld (Chastant-Maillard et al., 2017; Chastant en Mila, 2019).
Er wordt een verschil gezien in het aantal antistoffen in colostrum per tepel bij de teef. Maar het is niet steeds dezelfde tepel waar meer antistoffen in het colostrum worden vrijgesteld. Doordat een puppy de eerste 12 uur ongeveer aan 5 ±2 tepels zuigt, kan er geen tepel aangeraden worden waar je de puppy aan zou moeten leggen om de hoogste antistofopname te realiseren (Chastant en Mila, 2019).
10
2.2.3 IgE productie
IgE is een antistof dat een grote rol speelt bij het bestrijden van helminthen. IgE is echter ook belangrijk bij type I overgevoeligheid, waar het verantwoordelijk is voor de snelle reactie in geval van een allergie (Burton en Oettgen, 2011; Sutton en Davies, 2015).
Het immuunsysteem bestaat uit T- en B-cellen. Voor de productie van IgE moeten de B-cellen van het immuunsysteem een klasse switch ondergaan. Ze zullen van IgD/IgM positieve B-cellen naar IgE positieve B-cellen switchen om vervolgens te differentiëren naar IgE producerende plasmacellen (Burton en Oettgen, 2011). De klasse switch is afhankelijk van cytokines die door T-helper 2 lymfocyten worden aangemaakt. Onder andere interleukine-4 is één van de belangrijke cytokines. De productie van deze cytokines is afhankelijk van omgevingsfactoren (Fadok, 2013).
Een allergie is deels genetisch bepaald. Dit wordt veroorzaakt door de mogelijkheid van het overerven van polymorfe genen. Polymorfe genen hebben invloed op verschillende immuunfuncties waaronder de aangeboren immuniteit, verworven immuniteit en de structuur en functie van de huid. Door deze aantasting van de structuur van de huid kunnen zo allergenen worden opgenomen. In de huid worden ze opgenomen door dendritische cellen die naar de lymfeknoop migreren. In de lymfeknoop wordt een naïeve T-cel geactiveerd, die differentieert tot een T-helper 2 cel. Vervolgens kan deze zorgen voor de switch van de B cellen naar IgE en stimulatie van de aanmaak van IgE (Fadok, 2013).
IgE is de minst voorkomende antistof in de circulatie. Extravasculair, gebonden aan mastcellen, zal het in hogere concentraties aanwezig zijn. Extravasculair kan het enkele weken tot maanden aanwezig blijven (Burton en Oettgen, 2011). Als IgE aan de mastcel is gebonden, zal dit aan de hoge FcεRI affiniteitsreceptor zijn en is de mastcel hierdoor gesensitiseerd (Langner et al., 2008).
Mastcellen kunnen echter ook worden geactiveerd door niet IgE gemedieerde activators zoals: complement fragmenten, neuropeptiden, substance P, neurotransmitters (adenosine trifosfaat) en medicatie zoals opiaten (Wasserman, 1990). Dit is een nadeel voor de diagnose van allergie omdat er dan hogere concentraties aan mediatoren zijn zonder dat er een allergische reactie is geweest en daardoor worden vals-positieve resultaten veroorzaakt (Langner et al., 2008).
2.3 Types mastcellen
Mastcellen zijn mononucleaire cellen met verschillende cytoplasmatische granules. Een granule is een kleine vacuole met inhoud aanwezig in de mastcel. De granules bevatten mediatoren zoals proteoglycanen en amines. De inhoud van deze granules wordt gebruikt om de verschillende mastcellen van elkaar te differentiëren (Wasserman, 1990).
De onderverdeling van mastcellen wordt gedaan aan de hand van aanwezigheid van tryptase of chymase in de granules. De hond heeft drie gekende types mastcellen (Metcalfe et al., 1997; Van Der Haegen et al., 2005):
1. Mastcellen die tryptase bevatten. Deze zien we vooral terug in de mucosae, alveolaire septa van de long en de dunne darmmucosa.
2. Mastcellen die chymase bevatten.
3. Mastcellen die tryptase en chymase bevatten. De combinatie van tryptase en chymase in de mastcel is het meest voorkomend, en vinden we vooral in de huid en submucosa van de dunne darm.
Bij het paard zijn er nog maar twee soorten mastcellen geïdentificeerd (Metcalfe et al., 1997; Van Der Haegen et al., 2005):
1. Mastcellen die tryptase bevatten, deze worden vooral in de huid, en rond bloedvaten teruggevonden.
2. Mastcellen die chymase bevatten, die vooral in de wand van de bronchiën en bronchiolen gezien worden.
11 De mastcel zal pas zijn fenotype aannemen als hij op zijn eindlocatie, en dus extravasculair, zit. De extracellulaire regulatie van de mastcel wordt lokaal geregeld. Er zijn in het menselijke lichaam ongeveer 74.9 tot 113.1 mastcellen/mm2 extravasculair aanwezig. In de perifere lichaamsdelen (distaal deel van de
extremiteiten) zien we dat er meer mastcellen aanwezig zijn, eerder richting de 113.1 mastcellen/mm2. Ook
al zijn er perifeer meer mastcellen aanwezig, toch heeft dit geen invloed op de graad van allergische reactie (Janssens et al., 2005). De hoeveelheid extravasculaire mastcellen bij hond en paardis nog onbekend, wel zien we een sterke stijging bij een patiënt met een chronische langdurige allergische reactie (Metcalfe et al., 1997).
2.4 Receptoren voor IgE op mastcellen
Er bestaan twee types IgE receptoren op een mastcel. Dit is de hoge (FcεRI) en lage (FcεRII of CD23) affiniteitsreceptor.
Mastcellen en basofielen brengen altijd een hoge affiniteitsreceptor voor IgE, namelijk FcεRI, tot expressie aan hun oppervlak. Aan deze receptor bindt IgE zich zonder dat het een complex gevormd heeft met een allergeen. Eosinofielen kunnen deze receptor ook hebben, maar bij deze cellen wordt hij geïnduceerd. In geval van binding van allergeen-specifieke IgE aan de hoge affiniteitsreceptor spreekt men van sensitisatie van mens of dier. Hierna is enkel een allergeen nodig voor de degranulatie van de mastcellen, basofielen en/of eosinofielen (Wagner et al., 2006).
De hoge affiniteitsreceptor heeft twee vormen (Tizard, 2004):
1. De receptor die voorkomt op de mastcel, basofiel, neutrofiel en eosinofiel. Deze receptor bestaat uit 1 alpha keten, 1 beta keten en 2 gamma ketens (αβγ2). De β keten stabiliseert het complex en
de γ zorgt voor de signaaltransductie. De binding van IgE op deze receptor is heel sterk, bijna irreversibel, wat ervoor zorgt dat IgE altijd op de receptor aanwezig is.
2. De tweede vorm van de hoge affiniteitsreceptor is een trimeer (αγ2). Er is geen β keten aanwezig.
Deze receptor zit op dendritische cellen en monocyten. Bij de allergische patiënt zorgt deze receptor dat IgE aan antigeen-presenterende cellen wordt getoond, en de allergische reactie kan plaatsvinden.
Op B-cellen, natural killer cellen, macrofagen, dendritische cellen, eosinofielen en bloedplaatjes zien we dat er een lage affiniteitsreceptor (FcεRII of CD23) aanwezig is (Sutton en Davies, 2015; Tizard, 2004). De lage affiniteitsreceptor zorgt voor de regulatie van de concentratie van IgE in het serum (Langner et al., 2008). De lage affiniteitsreceptor is normaal aanwezig als homo-trimeer waardoor de affiniteit voor IgE wordt versterkt, en zelfs zo sterk kan zijn als deze van de hoge affiniteitsreceptoren. Deze lage affiniteitsreceptor bestaat in twee vormen CD23a (met verschil in de eerste 7 aminozuren) en de CD23b vorm (verschil in de laatste 6 aminozuren). De CD23a vorm zit op door antigeen geactiveerde B-cellen. De CD23b vorm van de receptor wordt tot expressie gebracht als een reactie op IL-4. Deze expressie gebeurt op verschillende cellen inclusief de B-cel en epitheliale darmcellen (Sutton en Davies, 2015).
Deze vormen kunnen of als membraangebonden vorm of als vrije receptor aanwezig zijn. Als de membraangebonden vorm wordt gestimuleerd zal er minder IgE productie zijn. Als de vrije receptor wordt gestimuleerd, kan er of een stimulatie of een reductie zijn in de productie van IgE, waardoor de concentratie van IgE wordt gereguleerd (Sutton en Davies, 2015).
12 Immunologische mastcelstimulatoren Niet-immunologische mastcelstimulatoren
IgE/antigeen Anafylatoxines (C3a, C4a, C5a)
Histamine releasing factor Peptiden (Substance P)
Interleukines (IL-1, IL-3) Neurotransmitters (adrenaline en noradrenaline)
Cytokines Geneesmiddelen (Opiaten)
Fysieke stimulatie
Zoals gezien wordt in Tabel 1 kan de mastcel ook worden geactiveerd door niet IgE afhankelijke activatoren, dit kan een niet-immuun-gemedieerde degranulatie veroorzaken, wat de diagnose bemoeilijkt (Wasserman, 1990).
Adrenaline en noradrenaline oefenen beide een effect uit op de mastcel. Adrenaline is, in geval van een acute anafylaxtische shock, de standaard behandeling. Adrenaline (aan een hoge dosis) werkt in op de alpha en beta receptoren in het lichaam. Binding (bij paard en hond) op de alfa-receptor zorgt voor vasoconstrictie en een bloeddruk stijging. Hierdoor zal het typische uitzicht van oedeem en erytheem wegtrekken. Door binding op de beta-receptoren zal er een bronchodilatatie zijn. Ook zal er een toename van cyclische adenosinemonofosfaat (cAMP) in de mastcellen zijn, waardoor de degranulatie vermindert. Noradrenaline werkt meer op de alpha-receptor dan op de beta-receptor (Ring et al., 2018).
Histamine releasing factor, kan er ook voor zorgen dat mastcellen een degranulatie zullen ondergaan zonder dat IgE aanwezig is. Deze histamine releasing factor wordt geproduceerd door onder andere neutrofielen, thrombocyten en macrofagen. Er is waargenomen dat er meer histamine releasing factor aanwezig is bij allergische patiënten. Dit zou een link kunnen zijn tussen een niet-IgE immuunactivatie en mastcelactivatie (Wasserman, 1990).
2.5 Mechanisme van degranulatie van mastcellen
De mastcel wordt geactiveerd na kruisverbinding van 2 IgE’s die aan een antigeen zijn gebonden. Door deze kruisverbinding van twee hoge affiniteitsreceptoren (FcεR1) zullen er tyrosinekinases worden geactiveerd, die fosfolipase C activeren wat zorgt voor de productie van diacylglycerol en inositoltrifosfaat. Door de productie van beide zal de intracellulaire concentratie van calcium stijgen. Dit activeert een proteïnkinase dat myosine fosforyleert, waardoor de granules naar het oppervlakte bewegen en versmelten met de celmembraan (Tizard, 2004).
Er worden, uit de mastcel, moleculen met laagmoleculaire en hoogmoleculaire gewichten vrijgegeven. Een voorbeeld van een laagmoleculair gewicht molecule is histamine, dat goed oplost in de waterige omgeving waar het wordt vrijgesteld. Voorbeelden van een hoogmoleculaire gewichten zijn de proteoglycanen, enzymen en grotere eiwitten. Deze moleculen zijn slecht oplosbaar in de omgeving (Wasserman, 1990). Na het vrijstellen van de granules in de omgeving gaat de mastcel regenereren en zullen er nieuwe granules worden gevormd (Tizard, 2004).
2.6 Mediatoren tijdens een type I overgevoeligheidsreactie
De mediatoren kunnen onderverdeeld worden in: intergranulaire en membraan-afgeleide lipide mediatoren. De intergranulaire mediatoren zijn voorgevormd aanwezig in de granules. In de mastcel zijn dit onder meer histamine, protease, heparine proteoglycanen, chondroïtinesulfaat proteoglycanen, eosinofiele chemotactische factoren en neutrofiele chemotactische factoren. In de basofiel zien we vooral histamine, heparineproteoglycanen en chondroïtinesulfaat proteoglycanen (Serafin en Frank Austen, 1987). Hieronder is een uitleg gegeven over deze mediatoren naar Serafin en Frank Austen (1987).
Tabel 1: Verschillende stimulatoren die voor een mastceldegranulatie kunnen zorgen. Tabel naar: Wasserman, (1990).
13 1. Histamine: Histamine is de mediator die het meest aanwezig is in de granules van de mastcel. Niet
gebonden histamine wordt bijna niet aangetroffen. Het zal bij een lage pH, dus in een granule, aan heparine protease zijn gebonden. Bij vrijstelling van histamine naar extracellulair zal het door de hogere pH goed oplosbaar zijn en kan het makkelijk diffunderen in de omgeving. Histamine werkt in op twee receptoren: de H1 en de H2 receptor. Binding van histamine op de H1 receptor zorgt voor contractie van gladde spieren (inclusief de luchtwegen en het gastro-intestinaalstelsel), stijging van de vasopermeabiliteit, meer nasale mucusproductie, pruritus en cutane vasodilatatie. Binding van histamine op de H2 receptor zorgt voor een stijging van de vasopermeabiliteit, mucusproductie, pruritus en erythema.
Histamine zal dus in het algemeen zorgen voor pruritus, en erythema. Een deel van het typische beeld dat we bij een type I overgevoeligheidsreactie zien.
2. Protease: We treffen twee soorten proteasen aan: tryptase en chymase. Deze zijn belangrijk voor de opdeling van de mastcel in subpopulaties. Ze zijn actief en sterk negatief geladen bij een neutrale pH. Omdat de substraten van deze enzymen in de omgeving nog niet goed gekend zijn, is het werkingsmechanisme ook niet gekend. Hun functies zijn waarschijnlijk: stijging van de vasculaire permeabiliteit, degradatie van bindweefsel-proteoglycanen (waardoor de weg voor de secundaire inflammatoire cellen vrijkomt, en deze makkelijker naar de plek van inflammatie kunnen komen), degradatie van debris, activatie van groeifactoren en stimulatie van wondheling.
3. Proteoglycanen: Deze groep mediatoren kan in twee worden verdeeld:
a. Heparine proteoglycanen die rijk in sulfaten zijn en hierdoor sterk zuur zijn. Deze moleculen zullen binden met positief geladen moleculen zoals histamine en neutrale protease. b. Chondroïtinesulfaat proteoglycanen, deze bevatten veel minder sulfaten in de zijketenen
en zijn daardoor ook minder zuur.
Beide proteoglycanen zijn resistent tegen de afbraak door proteolytische enzymen en spelen een rol in de bewaring van protease in de granules. De grote protease-proteoglycanen complex zullen intact blijven na de degranulatie uit de mastcel of basofiel en zorgen er zo voor dat extreme migratie in het weefsel van de enzymen wordt tegen gegaan.
4. Chemotactische factoren: Na degranulatie van mastcellen zien we een snelle influx van secundaire cellen zoals eosinofielen, neutrofielen en lymfocyten. Er zijn twee tetra-peptiden, Val-Gly-Ser-Glu en Ala-Val-Gly-Ser-Glu, verantwoordelijk voor de influx van eosinofielen. Deze zullen worden vrijgesteld uit de mastcel na activatie, en zijn al actief aan een lage concentratie. Ook zijn er peptiden van een langere lengte welke ook zorgen voor aantrekking van eosinofielen. Neutrofielen en lymfocyten worden aangetrokken door een groter eiwit (600 kd). Dit is een chemo-attractant en werkt intravasculair.
Ook zijn er verschillende membraan afgeleide mediatoren. Deze worden gevormd nadat de mastcellen zijn geactiveerd (Serafin en Frank Austen, 1987).
1. Arachidonzuur afgeleide metabolieten: Arachidonzuur wordt uit de membraan vrijgesteld door fosfolipase A2 of C en diacylgylcerol (DAG). De vrije variant van arachidonzuur kan dan op twee verschillende manieren worden verwerkt. Of het wordt afgebroken door cyclo-oxygenase en er wordt prostaglandine D2 gemaakt. Of arachidonzuur wordt afgebroken door lipoxygenase wat voor de productie van leukotriënen zorgt.
2. Prostaglandine D2: Worden gevormd uit arachidonzuur en zorgen voor een sterke vasodilatatie en stijging van vasopermeabiliteit. Beide worden waargenomen bij een anafylactische reactie. 3. Leukotriënen: Worden ook gevormd vanuit arachidonzuur. Bij een allergische reactie zien we de
productie van leukotriënen C4, D4 en E4. Deze zorgen voor bronchospasmen en D4 en E4 specifiek zullen ook zorgen voor een verhoogde mucussecretie.
4. Platelet activating factor (Plaatjes activerende factor, PAF): Deze wordt door de mastcellen gemaakt. Dit wordt verondersteld te zorgen voor een bronchoconstrictie en heeft een chemotactische effect op leukocyten.
14 Na de activatie van de mastcellen en basofielen zullen er mediatoren worden vrijgesteld. Binnen enkele minuten worden de voorgevormde mediatoren zoals: histamine, protease, proteoglycanen, chemotactische factoren, prostaglandine D2 en arachidonzuurmetabolieten vrijgesteld. Hierna hebben we de late IgE reactie (tot 4 uur na de eerste stimulatie) waar leukotriënen en PAF worden vrijgesteld, die de reactie onderhouden. (Fadok, 2013; Wagner et al., 2006; Serafin en Austen, 1987). Deze reactie wordt uiteindelijk gereguleerd (zie 2.7) (Kauffman, 1996).
2.7 Regulatie van de respons
De regulatie van mastcellen wordt deels gedaan door lymfocyten. Lymfocyten maken cytokines die nodig zijn voor de mastcel-differentiatie en -groei. Interleukine-3 wordt gemaakt door T-lymfocyten, en stimuleert de pluripotente hematopoëtische cellen in het beenmerg om zich te differentiëren tot mastcellen. IL-4 zal dit effect van IL-3 versterken. De mastcel maakt zelf ook IL-3 en IL-4 aan, dit is een autocriene positieve feedback. Er zit ook een rem op de productie en stimulatie van de mastcel. Dit wordt gedaan door transforming growth factor B, wat de mucosale mastcel groei en differentiatie inhibeert. Ook spelen GM-CSF, die de algemene mastcel-groei inhiberen en glucocorticoïden, die de proliferatie van mastcellen tegen gaan, een belangrijke rol in de regulatie (Metcalfe et al., 1997; Wasserman, 1990).
15
3 Diagnosemethoden
Omdat het van groot belang is om de juiste diagnose te stellen, zodat de behandeling nadien zo effectief mogelijk kan worden gedaan (Jensen-Jarolim et al., 2015), zullen in dit hoofdstuk verschillende diagnostische methoden met voor- en nadelen worden besproken. Ze zijn gebaseerd op het klinische beeld (3.1), huidtesten (3.2), serologie (3.3) en de passieve cutane anafylaxietest (3.4).
3.1 Klinische beeld
Om een diagnose te stellen, wordt er altijd eerst naar het klinische beeld en de medische geschiedenis van het dier gekeken. Type I overgevoeligheid uit zich bij de hond anders dan bij het paard. Bovendien speelt waarvoor het dier allergisch is ook een rol. Typisch aan een type I reactie is dat de allergische reactie na contact met het allergeen heel snel (binnen enkele minuten tot maximaal 2 uur) plaatsvindt (Burton en Oettgen, 2011). Het klinische beeld is essentieel voor de diagnose en het gebruik van de andere allergietesten. Een allergietest mag nooit worden bekeken zonder naar de klinische symptomen en anamnese van het dier te kijken (Deboer en Hillier, 2001a).
3.1.1 Klinische uitingen van een type I overgevoeligheidsreactie bij paard en hond
3.1.1.1 Acute anafylactische shock
De best gekende type I overgevoeligheid is een acute anafylactische shock. Doordat het lichaam in contact komt met een allergeen, waarvoor het gesensitiseerd is. Dit zorgt dat er tijdens de type I overgevoeligheidsreactie, vasoactieve moleculen worden vrijgesteld. Deze zorgen voor een contractie van de gladde spiercellen en kan het lichaam in shock brengen (Tizard, 2004).
Bij het paard zijn de shockorganen de longen en de darmen. Bij een shockreactie zien we dat het paard in ademnood komt. Ook zien we een oedemateus hemorragische enterocolitis, dit is meestal pas tijdens de autopsie te zien, daar de shockreactie heel snel verloopt en vaak fataal is (Tizard, 2004).
Bij de hond is het shockorgaan de lever, en vooral de hepatische vene. Wat we zien is dat de hond eerst zeer geëxciteerd wordt, dan gaat braken, defeceren en urineren. Hierna treedt een collaps op door spierzwakte. De hond komt in ademnood, wordt hierdoor comateus en kan convulsies krijgen, eventueel gevolgd door de dood (Tizard, 2004).
3.1.1.2 Reactie op medicatie of vaccinatie
Bij het geven van medicatie of vaccinatie moet er altijd rekening gehouden worden met het feit dat de dieren een allergische reactie kunnen krijgen. De allergische reactie gezien bij vaccinatie is meestal veroorzaakt door componenten van het adjuvans, wat vaak aluminiumzouten zijn (Tizard, 2004).
Een allergische reactie op medicatie is het gevolg van binden van het farmacon aan lichaamseigen eiwitten. Dit is omdat het farmacon te klein is om zelf een allergisch reactie te veroorzaken. Het bindt als hapteen aan een carriereiwit waardoor er allergie kan ontstaan. Bij een tweede contact kan het farmacon echter een directe reactie induceren (Tizard, 2004).
De typische symptomen die we bij beiden, paard en hond, zien zijn jeuk, urticaria, erythema, en secundaire letsels zoals alopecia, korsten en hyperpigmentatie van de huid (Tizard, 2004).
3.1.2 Klinische uitingen van een type I overgevoeligheidsreactie bij het paard
3.1.2.1 Zomereczeem
Zomereczeem is een allergische reactie op een insectenbeet, vooral op de insect Cullicoides spp. De reactie is een gemengde overgevoeligheidsreactie van type I en type IV. De locatie van de symptomen is afhankelijk van de steekplaats. De steekplaats van het insect is afhankelijk van Cullicoides spp (Schaffartzik et al., 2012).
De voornaamste locaties van de letsels zijn het hoofd, de basis van de manen, de schoft, de staartbasis, tussen de kaaktakken en ventraal op de buik. Nadat het insect heeft geprikt, zal er een pruritus (jeuk zonder zichtbare huidletsels) optreden, wat dan secundair zal zorgen voor alopecie en korsten. De chronische
16 reactie is meer een type IV overgevoeligheid. Waargenomen wordt een hyperkeratosis, met lichenificatie en verdikking van de huid (Meide et al., 2012).
Zomereczeem is seizoensgebonden. Het komt vooral voor tijdens de warmere maanden, van de lente tot de herfst. Alle paardenrassen kunnen zomereczeem krijgen. Er is een predispositie bij IJslandse paarden die uit IJsland zijn geïmporteerd. Zomereczeem komt bij meer dan 50% van dit ras voor. De oorzaak hiervan is dat deze dieren niet aan de antigenen van Cullicoides spp tijdens het eerste levensjaar blootgesteld zijn geweest. Het voorkomen van zomereczeem bij IJslandse paarden die in Europa zijn geboren, is ongeveer 5%, wat gelijk is aan het voorkomen van zomereczeem bij andere rassen. Veulens die in IJsland zijn geboren, maar na het spenen worden geëxporteerd naar Europa (rond 7-10 maanden) hebben eenzelfde voorkomen van zomereczeem als veulens van het IJslandse paard die in Europa zijn geboren. Dit laat zien dat de periode waarop immunotolerantie kan ontstaan niet alleen in de eerste levensweken gebeurt (Schaffartzik et al., 2012).
3.1.2.2 ‘Recurrent airway obstruction’ (RAO)
RAO werd vroeger COPD (chronic obstructive pulmonary disorder) genoemd, de naam is veranderd omdat de etiologie niet hetzelfde is als de humane COPD, wat voor verwarring zorgde (Davis en Rush, 2002). RAO is een chronische reversibele inflammatie van de luchtwegen. Het wordt vooral gezien bij volwassen paarden op stal die reageren op een allergeen in de omgeving (bv. allergenen uit hooi of bodembedekking) (Davis en Rush, 2002).
De symptomen waarmee de pathologie begint zijn: inspanning intolerantie, en minimaal hoesten bij inspanning. Dit kan evolueren tot paarden die een niet productieve hoest hebben, met open neusgaten ademen, pompend ademhalen en gewichtsverlies hebben. Tijdens auscultatie kunnen er reutels en krakende adem geluiden worden gehoord. Dit is omdat er lucht vast zit in de alveoli, door een bronchoconstrictie. Ook kan er een tracheale reutel worden gehoord als er veel secreties zijn. Als deze symptomen duidelijk zijn bij rust, betekent dit dat het dier erg is aangetast (Davis en Rush, 2002; Leguilelette, 2003).
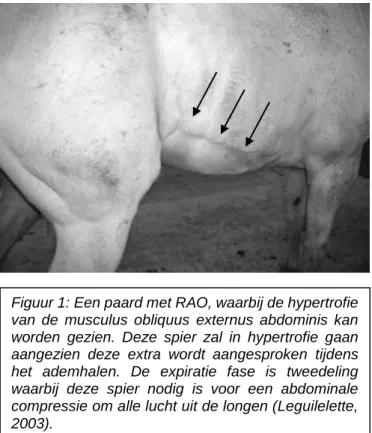
Een typisch symptoom wat we bij deze paarden zien is hypertrofie van de musculus obliquus externus abdominis, zoals zichtbaar op Figuur 1. Dit komt doordat de dieren deze spier gebruiken bij het ademhalen en deze extra wordt aangesproken bij RAO. De expiratiefase is meestal tweedelig, waarbij er eerst een collaps van de thorax wordt gezien en dan een abdominale compressie om alle lucht uit de longen te halen (Leguilelette, 2003).
Zodra de dieren uit de omgeving worden gehaald, bijvoorbeeld uit de stal en terug dag en nacht op de weide, zullen de symptomen verdwijnen. De paarden zijn wel extra gevoelig om symptomen te ontwikkelen zodra ze terug naar de initiële omgeving gaan (Leguilelette, 2003).
Er wordt op dit moment ervan uitgegaan dat RAO bij het paard een gemengde overgevoeligheidsreactie is waar type I en type III overgevoeligheid een rol spelen, wat de diagnose bemoeilijkt. Er is een lokale IgE productie maar die is moeilijk te meten aangezien de productie in de longen plaats vindt (Mcgorum et al., 1993; Tahon et al., 2009).
Figuur 1: Een paard met RAO, waarbij de hypertrofie van de musculus obliquus externus abdominis kan worden gezien. Deze spier zal in hypertrofie gaan aangezien deze extra wordt aangesproken tijdens het ademhalen. De expiratie fase is tweedeling waarbij deze spier nodig is voor een abdominale compressie om alle lucht uit de longen (Leguilelette, 2003).
17 3.1.2.3 Atopische dermatitis bij het paard
Atopische dermatitis heeft een erfelijke voorbeschiktheid bij het paard. Het is een hypersensitiviteit van de huid en de mucosa als reactie op omgevingsallergenen. Deze aandoening wordt gekarakteriseerd door een verhoogde IgE productie tegen deze antigenen. Bij het paard zien we een huid vorm, respiratoire vorm, of een combinatie vorm (Lorch et al., 2001b).
Bij de huidvorm zien we vooral jeuk, waardoor er secundair trauma ontstaat. De secundaire letsels zijn typisch alopecia, korsten, schilfers, erythema en urticaria. Vooral het hoofd, de oren, ventraal op de buik en de benen zijn aangetast. Extreem aangetaste paarden kunnen ook gewichtsverlies vertonen en zelfs gedragsveranderingen (veroorzaakt door de extreme jeuk) (Lane et al., 2017). Er kan secundair een pyodermie ontstaan met veel huidschilfers, collarettes en papulae (White, 2005).
Bij de respiratoire vorm zien we dat de paarden reageren op allergenen in de lucht (airborne allergenen). Hierdoor gaan de dieren hoesten, ontstaan er bronchospasmen, is er verhoogde mucusproductie in de luchtwegen, treedt er inspanning intolerantie op en kan er dyspnee ontstaan (Lane et al., 2017).
Doordat de symptomen niet pathognomonischzijn, wordt deze diagnose vaak bij paarden gesteld met een allergische dermatitis waarbij andere oorzaken zijn uitgesloten. Er zijn geen leeftijd, ras of geslacht predisposities (Rendle et al., 2010).
3.1.2.4 Urticaria
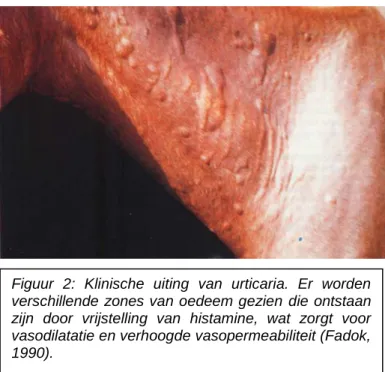
Urticaria bij het paard zijn eerder een symptoom dan een diagnose. Urticaria bij het paard uiten zich als ronde verheven zones op de huid, verspreid over het lichaam. Dit zijn zones van oedeem die ontstaan zijn door histamine vrijstelling, waardoor vasodilatatie en verhoogde vasopermeabiliteit optreden, wat te zien is in Figuur 2 (Fadok, 1990). Deze zones van oedeem zijn in te drukken. De grootte en vorm variëren. Urticaria kan pruritus veroorzaken, maar niet altijd (Lorch et al., 2001a).
De oorzaken van urticaria zijn divers. Urticaria kunnen worden geïnduceerd door medicatie, contact met specifieke allergenen, infecties (zoals een bacteriële infectie), systemische problemen, insecten, ingeademde allergenen, en door voedsel. Het zien van urticaria bij het paard is geen pathognomonisch symptoom (Fadok, 1990).
De exacte pathogenese van urticaria is nog niet gekend. Maar het is wel IgE afhankelijk en er vindt een mastcel degranulatie plaats, wat typisch is voor een type I overgevoeligheid. De meeste letsels verdwijnen 12-24 uur na het contact met het allergeen (Lorch et al., 2001a).
3.1.2.5 Voedselallergie bij het paard Het voorkomen en de symptomen van een
voedselallergie bij het paard zijn nog niet duidelijk beschreven. Ook is het onderscheid tussen een voedselallergie en een voedselintolerantie niet eenvoudig te maken. Een voedselintolerantie kan optreden zonder dat het dier eerder in contact is geweest met het allergeen (Dupont et al., 2015).
Er wordt verwacht dat het een gemengde overgevoeligheidsreactie is, waarbij er een hypersensitiviteitsreactie van het type I, III en IV plaatsvindt. Voedselallergie is gewoonlijk niet seizoensgebonden. Dit zou wel kunnen als er afhankelijk van het seizoen anders wordt gevoerd, wat de diagnose bemoeilijkt (Dupont et al., 2015; Fadok, 1995).
Figuur 2: Klinische uiting van urticaria. Er worden verschillende zones van oedeem gezien die ontstaan zijn door vrijstelling van histamine, wat zorgt voor vasodilatatie en verhoogde vasopermeabiliteit (Fadok, 1990).
18 De paarden zullen op componenten aanwezig in hun eten reageren, zoals granen, luzerne, voeding supplementen et cetera. De symptomen die we kunnen zien zijn pruritus en urticaria, deze symptomen zijn niet indicatief, waardoor de diagnose wordt bemoeilijkt. Door de jeuk zullen de dieren schuren, wat voor alopecie en secundaire infecties door zelftrauma kan zorgen (Fadok, 1995; Marsella, 2013).
Er bestaat een commerciële IgE test waar er met verschillende voedselallergenen wordt getest. Helaas geeft deze test geen eenduidige resultaten en moet dus als niet betrouwbaar worden gezien (Dupont et al., 2015).
3.1.3 Klinische uitingen van een type I overgevoeligheidsreactie bij de hond
3.1.3.1 Allergische reactie op ingeademde allergenen bij de hond
Het inademen van allergenen afkomstig van bomen, onkruiden, grassen, huisstofmijt, huidschilfers van dieren of bepaalde stoffen, zoals wol, kan zorgen voor een allergische reactie. Meestal zien we dat honden op meerdere allergenen tegelijkertijd allergisch reageren. Typisch zien we dat er een atopische dermatitis is met veel jeuk. De letsels kunnen overal op de huid worden gevonden. De dieren zullen met het hoofd tegen objecten aan schuren, likken aan de voeten en jeukende oren hebben. Secundair aan de jeuk zal er erythema, oedeem, korsten, hyperpigmentatie, en lichenificatie ontstaan (Tizard, 2004).
Nasolacrimale urticaria (hooikoorts), zoals bij de mens gekend is, komt niet veel voor bij de hond. De symptomen zijn een rhinitis en conjunctivitis, waarbij er een waterige neusvloei is. De oorzaak hiervan zijn meestal allergenen van pollen. Als deze allergenen klein genoeg zijn, kunnen ze in de bronchiën en bronchiolen komen en daar voor een bronchoconstrictie zorgen. Hierdoor kan de hond ademhalingsmoeilijkheden ontwikkelen en zijn er versterkte ademhalingsgeluiden op auscultatie hoorbaar (Tizard, 2004).
3.1.3.2 Canine atopische dermatitis (CAD)
CAD is een gemengde overgevoeligheidsreactie bij de hond (Tizard, 2004). De hond reageert op omgevingsallergenen zoals huisstofmijt, pollen en schimmelsporen (zoals Malassezia pachydermatis). De eerste symptomen treden meestal op rond de leeftijd van 1 tot 3 jaar. Bepaalde rassen, zoals de Golden Retriever, Labrador, Duitse Herder en de Pug, zijn gepredisponeerd (Bhanu Prakash et al., 2017).
CAD heeft geen pathognomonische symptomen doordat de symptomen variëren, afhankelijk van de genetische predispositie, de uitgebreidheid van de symptomen, hoe lang het al bezig is, en of er secundaire infecties zijn. Ook zien we dat verschillende andere ziektes, zoals een hond met een vlooieninfectie (Ctenocephalides felis of Ctenocephalides canis), Demodex (Demodex canis), Sarcoptes (Sarcoptes scabiei), Cheyletilla (Cheyletilla yasguri), Otodectes (Otodectes cynotis), Staphylococcus (Staphylococcus intermedius, Staphylococcus pseudointermedius, Staphylococcus aureus), Malassezia (Malassezia pachydermatis) of bijvoorbeeld een allergische reactie op voedsel dezelfde symptomen kan laten zien (Hensel et al., 2015).
Een steeds weerkerend symptoom dat we zien bij honden met CAD is jeuk (pruritus). Dit veroorzaakt krabben, wat voor automutilatie kan zorgen. Tijdens de startfase zien we dat de jeukklachten zonder aantasting van de huid kunnen zijn of eventueel met erythema en papulae. In een meer chronische fase zien we dat door het krabben een lichenificatie van de huid ontstaat met alopecia, hyperpigmentatie, seborroïsch eczeem, huidschilfers, korsten en hot spots. 50% van de honden met CAD krijgen een otitis externa, die zeer moeilijk te behandelen is (Hensel et al., 2015).
Een hotspot is een pyotraumatische dermatitis veroorzaakt door automutilatie. Er ontstaat een oppervlakkige tot diepe pyodermie. Het klinisch uitzicht van een hotspot bevat typisch erythema en alopecia en is goed omlijnd en vaak pijnlijk. Aan de randen kunnen papulae en pustels gezien worden, wat een indicatie is voor een secundaire bacteriële infectie (Kersey et al., 2013).
Figuur 3 toont de typische locatie waar we de letsels zien, zijnde het hoofd, de oren, de liesstreek, de perineale regio en ter hoogte van de distale extremiteiten (Hensel et al., 2015).
19 Er bestaan verschillende gestandaardiseerde klinische schalen waarmee de diagnose kan worden gesteld, zoals CADESI-4. Bij het gebruik van de CADESI-4 wordt er gekeken naar de atopisch hond en de verschillende huidletsels, welke via een schaal worden beoordeeld. Deze beoordeling zal vervolgens tot een diagnose leiden. De diagnose kan ook worden gesteld aan de hand van een vragenlijst (bijvoorbeeld de Edinburgh Pruritus Scale) die door de eigenaar wordt ingevuld, met als nadeel een bias van de eigenaar. De vragenlijst kan wel een deel uitmaken van de diagnose van CAD, maar mag niet als enige methode worden gebruikt (Harvey et al., 2019).
De diagnose van CAD mag niet enkel op het klinische beeld worden gesteld omdat de symptomen een grote overlap hebben met andere ziektes (Hensel et al., 2015). De dierenarts kan een lijst met symptomen gebruiken, waarbij als er x aantal symptomen zijn er een grote indicatie is voor CAD. Hier moet ook met enige voorzichtigheid mee worden omgegaan, omdat de symptomen veel variëren tussen de dieren. Ook al voldoet de patiënt niet aan de gegevens op de symptomenlijst kan atopische dermatitis niet worden uitgesloten. De diagnose berust daardoor voor een deel op het uitsluiten van andere ziekten (differentiaal diagnose). In Tabel 2 kan worden gezien waar er aan de hand van verschillende studies de meeste letsels voorkomen (Deboer en Hillier, 2001a; Hensel et al., 2015).
Locatie van letsel Studie A (n=100) (%) Studie B1 (n= 170) (%) Studie B2 (n=38) (%) Studie C (n=46) (%) Poten 85 100 100 100 Aangezicht 79 100 100 100 Ventraal op het lichaam 89 >35 > 18 Niet vermeld Oren en oorontsteking
55 17 (oorschelp) 16 (oorschelp) Niet vermeld
Niezen 0 22 24 48
Conjunctivitis 50 30 29 50
Pyodermie 33 27 11 Niet vermeld
Tabel 2 Klinische uitingen en typische locaties van CAD letsels. Tabel naar: Hensel et al (2015). Informatie van de tabel is verkregen uit de volgende bronnen:
Studie A: Door Scott (1981)
Studie B: Door Willemse en van den Brom (1983). B1 bevat honden met atopische dermatitis en die positief waren op intradermale testen. B2 bevat honden met atopische dermatitis maar die negatief waren op intradermale testen
Studie C: Door Willemse (1984)
Figuur 3: Typische locaties van CAD letsels, zoals het hoofd, de oren, de liesstreek, de perineale regio en ter hoogte van de distale extremiteiten (Hensel et al., 2015).
20 3.1.3.3 Voedselallergie bij de hond
De meest gekende voedselallergie bij de hond is een gemengde overgevoeligheidsreactie, waarbij type I overgevoeligheid een belangrijke rol speelt. Een voedselallergie kan zorgen voor een algemene overgevoeligheidsreactie of een reactie die beperkt blijft tot de mastcellen van het gastro-intestinaal kanaal (Carlotti et al., 1990; Tizard, 2004).
Een algemene overgevoeligheidsreactie zien we als het antigeen in de bloedbaan komt en zo de gesensitiseerde mastcellen of basofielen van de huid bereikt. Een algemene overgevoeligheid kan ook worden bereikt als mastcelmediatoren van het gastro-intestinale kanaal worden vrijgesteld en zo de huid bereiken. Het typische beeld dat we zien is pruritus (jeuk). Deze pruritus is constant en wordt niet beïnvloed door het seizoen. De jeuk uit zich meestal doordat de hond aan de voeten zal bijten, de kop tegen allerlei objecten probeert te schuren, rond de staart regio bijt en vaak een otitis externa aan beide oren krijgt. De locatie van letsels kan gezien worden op Figuur 4. De primaire letsels zoals: urticaria, erythema, papulae en oedeem, worden niet vaak waargenomen. Secundaire letsels, door het krabben van de hond, zoals alopecie, korsten, hyperpigmentatie, lichenificatie en chronische inflammatie worden vaak waargenomen. Ook kan er een oppervlakkige bacteriële pyodermie optreden door zelftrauma van de hond waardoor bacteriën worden binnen gebracht (Carlotti et al., 1990; Verlinden et al., 2006). Een voedselallergie kan ook neurologische symptomen of respiratoire symptomen veroorzaken, dit wordt weliswaar niet vaak waargenomen (Carlotti et al., 1990).
Als de reactie beperkt blijft tot de mastcellen van het gastro-intestinale kanaal, zal de overgevoeligheidsreactie lokaal blijven. De lokale reactie die wordt gezien, is verlies van vloeistof, bloed en plasmaproteïne naar het lumen van het gastro-intestinaal kanaal. Door deze secretie ontstaat een verstoring van de motiliteit en de enzymen die disachariden afbreken in het lumen van de darmen. Dit samen zorgt voor een klinisch beeld van braken, diarree en gewichtsverlies. Het dier kan zelfs hemorragisch diarree krijgen (Tizard, 2004). Bij een chronisch reactie kunnen de mastcellen zorgen voor een eosinofiele gastro-enteritis. Hierdoor worden grotere macromoleculen opgenomen door de darmwand wat kan zorgen voor verschillende bijkomende overgevoeligheidsreacties (Verlinden et al., 2006).
3.1.3.4 Vlooienallergie bij de hond
Een vlooienallergie bij de hond is deels een directe reactie, type I hypersensitiviteit, en deels een uitgestelde reactie, type IV hypersensitiviteit, op een vlooienbeet. Bij een vlooienallergie moet er onderscheid worden gemaakt tussen een allergische reactie, of een hond die jeuk heeft door de vele vlooienbeten. Bij de allergische hond zien we dat één vlooienbeet genoeg is voor een allergische reactie. Deze hond moet gesensitiseerd zijn door eerdere vlooienbeten (Gross en Halliwell, 1985).
Het symptoom dat optreedt bij een allergische hond, na een vlooienbeet, is een goed gedefinieerde erythemateuze verheven ronde zone. De grootte van deze zone varieert tussen 3 mm tot 10 mm. Na 12 uur neemt deze verhevenheid af. De type IV hypersensitiviteit begint dan rond 24-48 uur. De goed gedefinieerde erythemateuze verheven ronde zone wordt vervangen door een kleinere erythemateuze papulae, waar een zone met oedeem rond zit. Na 72 uur zal ook deze reactie weer afgenomen zijn, en zijn er nog nauwelijks letsels te zien als de vlo niet meer bijt (Gross en Halliwell, 1985).
Figuur 4: Typische locaties van jeuk bij een hond met voedselallergie. De jeuk lokaliseert zich meestal aan de voeten, de kop, rond de staart regio. De dieren krijgen ook vaak een otitis externa aan beide oren (Hensel et al., 2015).
21 De honden met een chronische geschiedenis van vlooienallergie kunnen ook alopecia, korsten op de huid, hyperpigmentatie en lichenificatie vertonen. De typische plek waar deze letsels te vinden zijn is ter hoogte van de lumbosacrale wervels op de huid, aan de basis van de staart en caudomediaal van de lies. Dit geeft een kerstboompatroon, wat typisch is voor een vlooienallergie; zie Figuur 5. De locatie waar de hond het meeste jeuk heeft is indicatief voor de aandoening (Bruet et al., 2012).
De pinnal pedal reflex (jeuk reflex waarbij de hond door de mens wordt gekrabd en de hond probeert zelf mee te krabben met het been), wordt gebruikt om een onderscheid te maken tussen CAD of een vlooienallergie en andere aandoeningen die voor pruritus kunnen zorgen, zoals Sarcoptes. We zien dat de honden vaker de pinnal pedal reflex hebben bij andere aandoeningen dan als ze CAD of een vlooienallergie hebben (Bruet et al., 2012).
3.2 Huidtesten
3.2.1 Epicutane test (plakproef)
Een diagnostische methode zijn epicutane testen, die op dit moment nog niet bij het paard worden gebruikt. Epicutane testen worden gebruikt voor de diagnose van een type IV overgevoeligheid waar een hapteen via MHC (major histocompatibility complex) op een Langerhans cel aan T-cellen zal worden gepresenteerd. Er zal een activatie van T-lymfocyten plaats vinden. De reactie die gezien wordt is erythema met eventuele papulae. Er kan hier een irritatiereactie optreden welke snel zal optreden en snel zal verdwijnen na het verwijderen van de plakker met antigeen. Hierdoor kan onderscheid worden gemaakt met een type IV overgevoeligheid (Bond et al., 2006; Sancak et al., 2009).
Het protocol voor het gebruik van epicutane testen bij de hond is nog niet gestandaardiseerd. Het idee achter deze test is een contact overgevoeligheid waarbij een allergeen 48 uur in contact zal staan met de huid. Als de epicutane test vergeleken wordt met de intradermale test wordt gezien dat de resultaten niet overeenkomen. Dit is waarschijnlijk omdat het twee verschillende types van overgevoeligheid zijn die worden gemeten (Bond et al., 2006).
De epicutane test kan pas na 48 uur worden afgelezen en het ter plaatse houden van de verschillende allergenen kan moeilijkheden geven bij de hond. De epicutane test mag ook niet worden gebruikt voor het stellen van een diagnose omdat de test een lage specificiteit heeft. De huid mag niet geïrriteerd zijn. Sommige dieren gaan te heftig reageren op de epicutane test waardoor deze vroegtijdig moet worden gestopt, zonder adequate resultaten. De hond heeft een dunnere epidermis in vergelijking met de mens waardoor te heftige allergische reacties vaker worden gezien (Bethlehem et al., 2012; Johansen et al., 2017; Sancak et al., 2009).
3.2.2 Percutane test (Huid prik test)
De percutane test is de meest gebruikte test in de humane geneeskunde voor de diagnose van een type I overgevoeligheidsreactie. Hierbij worden allergenen op de huid (gezonde huid zonder eczeem, of andere aandoeningen) aangebracht (> 2 cm uit elkaar) en met een klein prikje intracutaan ingebracht. Er is ook een positieve (bv. Histamine hydrocholoride 9%) en negatieve (zout oplossing) controle. De positieve controle
Figuur 5: Typische locaties van vlooienallergie-letsels. De letsels zijn te vinden ter hoogte van de lumbosacrale wervels op de huid, aan de basis van de staart en caudomediaal van de lies. Dit geeft een kerstboompatroon (Hensel et al., 2015).
22 moet het liefst een diameter van gelijk of meer dan 3mm hebben. Vervolgens wordt er 15-20 minuten gewacht en kan de test worden afgelezen. Als de diameter meer dan 3 mm is, dan wordt de test als positief beschouwd (Heinzerling et al., 2013).
Percutane testen bij de huisdieren worden minimaal gebruikt. De meest gebruikte methode is de intradermale test. De intradermale test wordt meer gebruikt dan de percutane test omdat voor de percutane test het dier 15-20 minuten stil moet zitten. Ook zijn er nog weinig studies naar gedaan, waardoor er geen betrouwbare referentie waardes zijn (Carmona-Gil et al., 2019).
Er is wel onderzoek gedaan naar de percutane test bij de hond. Voordelen ten opzichte van de intradermale testen zijn dat de hond niet hoeft te worden gesedeerd en dat er heel snel een uitslag is die ook duidelijk zichtbaar is voor de eigenaar, waardoor deze sneller kan worden overtuigd van een passende therapie. In het onderzoek verricht door Carmona-Gil (2019) werden antigeen concentraties gebruikt vanuit de humane geneeskunde. Om deze test te kunnen gebruiken voor de hond moet er meer onderzoek naar de juiste concentraties van allergenen worden gedaan en moeten deze worden getest op een veel groter aantal honden (Carmona-Gil et al., 2019).
3.2.3 Intradermale testen
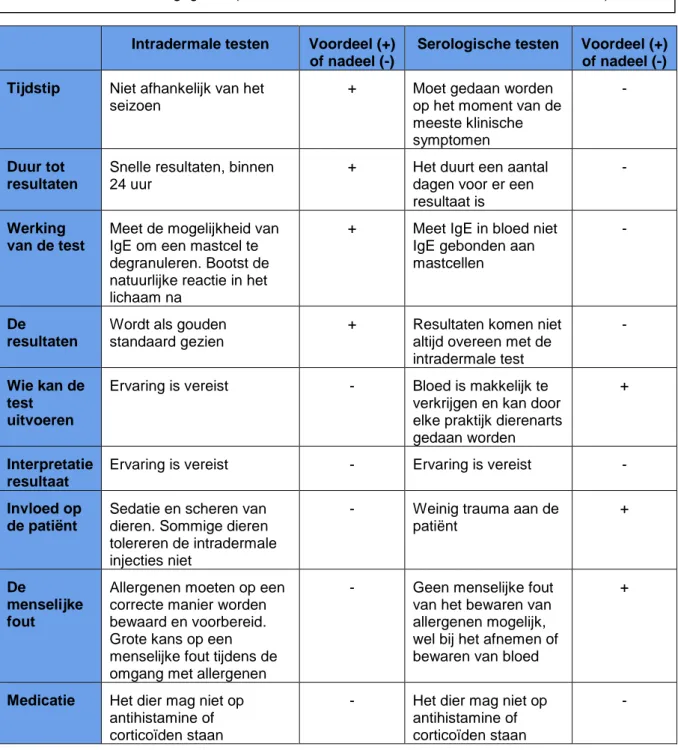
Intradermale testen zijn, samen met de klinische symptomen, op dit moment de gouden standaard voor de identificatie van allergenen bij het allergische paard en de allergische hond (Foster et al., 2003; Hillier en Deboer, 2001; Lorch et al., 2001b; Popiel en Cekiera, 2015; Rendle et al., 2010). Intradermale testen worden gebruikt als de gouden standaard voor vergelijking met andere testen. Het nadeel hiervan is dat intradermale testen zelf nog niet compleet gestandaardiseerd zijn (Foster et al., 2003).
Intradermale testen werken doordat de mastcel degranuleert als er een allergeen aanwezig is. Dit wordt gedaan doordat IgE bindt op de FcεRI receptor van de mastcellen. Deze reactiviteit is meestal een indicatie voor een allergische reactie (Deboer en Hillier, 2001a; Foster et al., 2003).
In de praktijk worden de intradermale testen, vooral bij het paard, gedaan door dermatologen die op een gespecialiseerde kliniek werken. Dit bemoeilijkt de beschikbaarheid voor deze test bij het paard (Oldenhoff et al., 2014).
Het is van groot belang voor de behandeling om de allergenen die een type I overgevoeligheidsreactie veroorzaken te identificeren. De therapie, immunotherapie, zal deels mislukken indien dit niet correct wordt gedaan (Baxter en Vogelnest, 2008).
3.2.3.1 Uitvoering van de intradermale testen bij het paard
Intradermale testen worden bij het paard uitgevoerd op nek of op de schouder. Dit is omdat, zelfs als het paard beweegt, dit een makkelijke locatie is om antigeen te injecteren en de huid hier dik is. Deze locatie wordt geschoren en gedesinfecteerd. Hierna wordt er met een permanente stift een rooster getekend van 3 bij 3 cm. Het paard wordt vervolgens, (dosis afhankelijk van het karakter), gesedeerd met detomedine (Domosedan®, 0,02 mg/kg). Hierna worden de antigenen, elk in een apart rooster, intradermaal ingespoten
(Lebis et al., 2002).
3.2.3.2 Uitvoering van de intradermale testen bij de hond
Bij de hond worden intradermale testen routinematig gebruikt in de diergeneeskunde. Bij intradermale testen wordt er gebruikgemaakt van waterige allergeenextracten. De hond wordt gesedeerd voorafgaand aan de testen; bij voorkeur met xylazine (Sedazine®, 0,5-3 mg/kg) of medetomedine (Domitor®, 0,01-0,04 mg/kg).
Meestal wordt de test uitgevoerd op de laterale thorax of abdomen (locatie heeft geen invloed op resultaat), nadat deze is geschoren (Hillier en Deboer, 2001; Jensen-Jarolim et al., 2015).
23 Zoals gezien wordt op Figuur 61, wordt dan op de hond met een permanente stift een rooster van 3 cm bij
3 cm getekend of stippen 3 cm uit elkaar gezet om de verschillende te injecteren allergenen uit elkaar te houden (Hillier en Deboer, 2001).
3.2.3.3 Positieve intradermale test
Als de intradermale test een positieve reactie vertoont, wordt er snel (binnen 4 uur) een huidreactie (“wheal and flare”) gezien. Zichtbaar is een rode verheven zone, wat een reactie is van de mastcellen die gesensitiseerd zijn (IgE gebonden aan hun oppervlakte) (Wagner et al., 2008). Als er een allergeen is waar IgE op kan reageren, zal er een degranulatie van de mastcellen zijn. Hierbij worden verschillende mediatoren, cytokines, leukocyten en chemo-attractieve factoren vrijgesteld. Bovendien zal er uitwendig binnen 15-60 minuten een reactie te zien zijn (Lorch et al., 2001).
Bij beide hond en paard wordt er gebruik gemaakt van een positieve en negatieve controle voor de intradermale test. De positieve controle is een sterke verdunning van histamine en de negatieve controle is 0.9% fosfaat gebufferde zoutoplossing (Hillier en Deboer, 2001; Lebis et al., 2002). De resultaten worden vervolgens 30 min, 1 uur (directe reactie), 4 uur (late fase reactie) en dan nog eens 24 uur (vertraagde fase reactie) na het injecteren van de antigenen afgelezen (Jose-Cunilleras et al., 2001).
Het verschil tussen een vertraagde fase reactie en een type IV overgevoeligheid kan gemaakt worden door het tijdstip van optreden van de symptomen. De symptomen van een type IV overgevoeligheid treden op na 48-72 uur terwijl een vertraagde fase I overgevoeligheid wordt gezien rond 24 uur. Als er toch twijfel is over welk type overgevoeligheid plaatsvindt, kan er een biopt worden genomen. Bij een type I overgevoeligheid is het hoofdaandeel van de cellen eosinofielen en bij een type IV overgevoeligheid zijn het vooral lymfocyten, monocyten en macrofagen. Daarbij wordt een vertraagde type I fase reactie niet gezien zonder een reactie te geven na 30-60 min en na 4 uur (Jose-Cunilleras et al., 2001; Warrington et al., 2011).
De verdunning van histamine die wordt gebruikt, is anders in Europa dan in Amerika. In Europa wordt er een verdunning gebruikt van 1:10 000 (0,1 mg/ml) en in Amerika wordt er een verdunning gebruikt van 1:100 000 (0,01 mg/ml). Om een betrouwbare test te hebben, moet de positieve controle meer dan 10 mm zijn. Als dit minder dan 10 mm is, dan is de gehele test onbetrouwbaar, en is er een groot risico op misinterpretatie. De verdunning van 0,01 mg/ml histamine, gaf af en toe een te zwakke positieve controle. Hierdoor is het aangeraden om een verdunning van 0,1 mg/ml te gebruiken omdat dit nooit tot uitzonderlijk een te zwakke positieve controle geeft, en de test vaker betrouwbaar is (Hensel et al., 2004; Scott at al., 2001).
1https://www.mcvoordieren.nl/allergieonderzoek-huid (laatst geconsulteerd in mei 2020)
24 3.2.3.4 Interpretatie van een positieve intradermale test
De interpretatie voor de directe fase reactie kan op twee verschillende manieren worden (Hillier en Deboer, 2001):
1. Subjectief: er wordt hier gekeken naar de intensiteit van de erythema, de rood verkleuring van de huid, en hoe groot het letsel wordt.
2. Objectief: hierbij wordt de diameter en/of de oppervlakte van de erythema gemeten.
Het nadeel is dat er in de diergeneeskunde nog geen vaste richtlijnen zijn wanneer een directe fase reactie als positief mag worden gezien. In het algemeen wordt er aangenomen dat een reactie als positief mag worden beoordeeld als ze groter of gelijk is dan de halve diameter van de positieve controle, histamine (Jensen-Jarolim et al., 2015). Of als de reactie op zijn minst 3 mm groter is dan de negatieve controle. Voor de late en de vertraagde fase reactie zijn er nog mindere duidelijke richtlijnen wanneer deze als positief mogen worden beoordeeld (Hillier en Deboer, 2001).
Bij de subjectieve beoordeling wordt er gekeken naar het uitzicht van de reactie. Dit wordt gedaan met een score systeem. Er wordt gekeken naar hoe uitgesproken het erytheem is (Lane et al., 2017). Een score systeem dat bij de hond wordt gebruikt, is een systeem dat werkt met cijfers van 0 tot 4. Hierbij staat een score van 0 gelijk aan de negatieve controle en 4 aan de positieve controle. Als het resultaat, groter is dan 4, dan wordt er gebruik gemaakt van 4+. Hierbij wordt aangenomen dat alles vanaf een score van 2 als positief wordt gezien (Hillier en Deboer, 2001). Als de huidtest zo wordt beoordeeld wordt er wel aangeraden om dit te laten doen door iemand die hier veel ervaring in heeft (Lane et al., 2017). Er is ook waargenomen dat de dierenartsen sneller een huidtest als positief beoordelen als het dier klinische symptomen heeft. Hier is dus weer een bias, waar met voorzichtigheid mee moet worden omgegaan. Er wordt aangeraden om te werken met objectieve meetmethoden (Layne, 2019).
3.2.3.5 De drie reactief fases: de directe fase, de late fase en de vertraagde fase
Bij beide paarden en honden zien we dat de intradermale testen voor een directe fase reactie, gezien na 30-60 minuten, late fase reactie, gezien na 4 uur, en een vertraagde fase reactie, gezien na 24 uur, kunnen zorgen. Het nadeel van de late en vertraagde fase reacties te beoordelen, is dat de positieve controle reactie, histamine reactie, meestal al verdwenen is na 4 uur (Baxter en Vogelnest, 2008).
De directe fase reactie, na 30-60 minuten, zijn de type I overgevoeligheidsreacties. Het beste is om deze reactie af te lezen na 60 minuten in plaats van na 30 minuten, omdat dan de reactie het duidelijkst is. Het aflezen kan sneller gedaan worden (15-20 minuten), maar het resultaat is duidelijker naarmate men dichter bij de 60 minuten komt (Rendle et al., 2010).
De late fase reacties, zijn reacties die duidelijk worden na 4 uur. Deze reactie worden veroorzaakt doordat mastcellen stoffen vrijstellen die een chemoattractie veroorzaken. Hierdoor worden inflammatoire cellen aangetrokken. Dit zijn cellen zoals eosinofielen, basofielen, neutrofielen en mononucleaire cellen (Lane et al., 2017; Lorch et al., 2001a).
De vertraagde fase reacties zijn meestal meer concentratie en allergeen afhankelijk dan patiënt afhankelijk (Baxter en Vogelnest, 2008). De vertraagde fase is waarschijnlijk een irritatiereactie, interpretatiefout of een traumatische letsel (Lane et al., 2017). Het is dus meestal een niet immuun gemedieerde reactie (Bond et al., 2002).
Het beste wordt er gecontroleerd na 30 minuten, 1 uur en 4 uur. De reacties zijn dan het duidelijkste. Na 4 uur is er een optimale sensitiviteit en specificiteit voor paarden met aandoeningen zoals RAO, urticaria en atopische dermatitis (Jose-Cunilleras et al., 2001). Het wordt aangeraden om zeker na 4 uur nog eens te controleren, omdat soms de directe fase reactie nog niet duidelijk genoeg is, maar de late fase reactie het resultaat duidelijk maakt. Door na 4 uur na antigeen injectie af te lezen krijg je zo een idee van het spectrum van allergenen waar het dier op reageert (Lorch et al., 2001a).
Als er geen directe fase reactie is maar, wel een late fase of vertraagde reactie wordt er aangenomen dat dit meer een type III overgevoeligheidsreactie is die gemedieerd wordt door IgG. Er kunnen IgE late fase reacties optreden, maar die gaan meestal gepaard met een directe fase reactie. Het verschil tussen de twee