Universiteit Gent
Faculteit Geneeskunde en gezondheidswetenschappen
Academiejaar: 2018 – 2020
“ANALE DYSPLASIE BIJ HIV-SEROPOSITIEVE MANNEN. PREVALENTIE
IN DE GENTSE HIV-POPULATIE.”
Emine Gökce
Stamnummer: 01508636
Promotor: Prof. dr. Danny De Looze
Co-Promotor: Prof. dr. Steven Callens
Masterproef voorgelegd in het kader tot het behalen van de graad
Master of Medicine in de Geneeskunde
Deze pagina is niet beschikbaar omdat ze persoonsgegevens bevat.
Universiteitsbibliotheek Gent, 2021.
This page is not available because it contains personal information.
Ghent University, Library, 2021.
Voorwoord
Deze masterproef is het resultaat van een zeer interessant leerproces, waaraan veel mensen hebben bijgedragen. Langs deze weg wil ik hen nogmaals bedanken voor hun hulp, steun en medewerking.
Graag zou ik als eerst mijn promotor prof. dr. Danny De Looze willen bedanken voor het mogelijk maken van deze masterproef. Zijn expertise, begeleiding en feedback waren van zeer grote waarde bij het tot stand brengen van deze thesis. Ook het enthousiasme en het vertrouwen dat hij toonde, was zeer stimulerend. Bovendien wil ik ook mijn appreciatie uitdrukken voor een aantal bijzondere kansen die ik gekregen heb, zoals het indienen van een abstract voor het congres van de ‘Belgian Week of Gastroenterology’ (bijlage I) en het bijwonen van de ‘IANS scientific meeting’ in Amsterdam (bijlage II).
Vervolgens wil ik professor Anne Hoorens en Jo Van Dorpe bedanken voor het ter beschikking stellen van enkele cruciale gegevens. Daarnaast wil ik dokter Jolanda Pelgrom en Beatrijs Van Der Gucht bedanken voor het beantwoorden van mijn vragen en Stefanie de Buyser van cel biostatistiek voor haar hulp bij de statistische analyse. Natuurlijk wil ik ook de patiënten bedanken die een vragenlijst opstuurden en hun toestemming gaven voor deelname aan de studie, zonder hun medewerking was deze studie niet mogelijk. Tot slot wil ik mijn familie en vrienden bedanken voor hun medeleven, motiverende woorden en steun. Emine Gökce December 2019, Gent
Afkortingen
AIN: anale intra-epitheliale neoplasie ASC-H: atypische squameuze cellen waarbij HSIL niet kan uitgesloten worden ASCUS: atypische squameuze cellen met een onbekende betekenis cART: combinatie antiretrovirale therapie HIV: humaan immunodeficiëntievirus HPV: humaan papillomavirus HR HPV: hoog risico humaan papillomavirus HRA: hoge resolutie anuscopie HSIL: hooggradige squameuze intra-epitheliale laesie LR HPV: laag risico humaan papillomavirus LSIL: laaggradige squameuze intra-epitheliale laesie MSM: mannen die seks hebben met mannen NILM: negatief voor intra-epitheliale laesie of maligniteit SCC: spinocellulair carcinoom
Inhoudstafel
1. ABSTRACT ... 1INTRODUCTIE ... 1 DOELSTELLING ... 1 METHODOLOGIE ... 1 RESULTATEN ... 1 CONCLUSIE ... 2 2. INLEIDING: PROBLEEM EN DOELSTELLING ... 3
3. LITERATUURSTUDIE ... 4
3.1 EPIDEMIOLOGIE EN RISICOFACTOREN ... 4 3.2 ANATOMIE, HISTOLOGIE EN HISTOPATHOLOGIE ... 6 3.3 PATHOGENESE ... 8 3.4 SCREENING EN DIAGNOSE ... 10 3.4.1 Anale cytologie ... 11
3.4.2 Hoge resolutie anuscopie (HRA) ... 12
3.4.3 HPV-typering ... 13
3.5 BEHANDELING ... 14 3.5.1 Topische therapie ... 14
3.5.2 Lokale ablatieve therapie ... 15
3.5.3 Alternatieven ... 15
3.5.4 Chirurgische therapie ... 16
3.5.5 Adjuvant HPV-vaccin ... 16
3.5.6 Richtlijnen behandeling ... 16
3.6 PREVENTIE ... 17 3.7 CONCLUSIE ... 17 4. METHODOLOGIE ... 18
4.1 LITERATUURONDERZOEK ... 18 4.2 STUDIEDESIGN ... 18 4.3 STUDIEPOPULATIE ... 18 4.4 DATAVERZAMELING ... 19 4.4.1 Vragenlijst ... 19
4.4.2 Elektronisch patiëntendossier (EPD) ... 19
4.5 DATAVERWERKING EN STATISTISCHE ANALYSE ... 19 5. RESULTATEN ... 20
5.1 KARAKTERISTIEKEN VAN DE STUDIEPOPULATIE ... 20 5.1.2 Socio-demografie ... 20
5.1.3 Middelengebruik ... 20
5.1.4 Seksueel (risico)gedrag ... 20
5.1.5 HPV-gerelateerde kenmerken ... 21
5.1.6 HIV-status ... 21
5.1.7 Anale problematiek ... 22
5.2 CYTOLOGISCH ONDERZOEK ... 22 5.3 EVOLUTIE VAN DE CYTOLOGIE ... 23 5.3.1 Visite één en twee ... 23
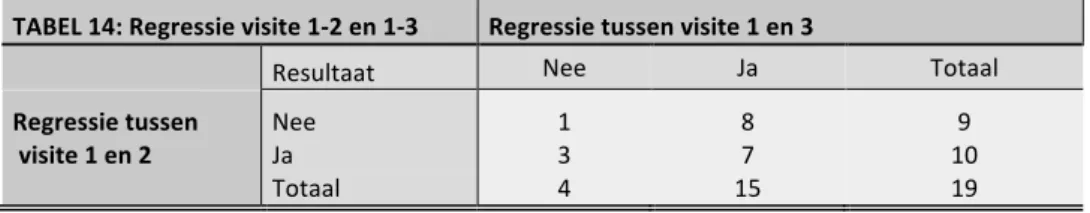
5.3.2 Visite één en drie ... 24
5.3.3 Visite twee en drie ... 24
5.3.4 Visite vier ... 24
5.4 REGRESSIE VAN HSIL NAAR NON HSIL ... 25
5.6 CARCINOMA IN SITU ... 26
5.7 HOGE RESOLUTIE ANUSCOPIE (HRA) ... 27
5.7.1 HRA versus cytologie ... 27
5.7.2 Statistische Analyse ... 28
5.8 BIOPSIE ... 29 5.9 RISICOFACTOREN ... 29 5.9.1 HSIL ≥ 2 ... 30
5.9.2 HR HPV ... 32
6. DISCUSSIE ... 33
6.1 KRITISCHE REFLECTIE STUDIEDESIGN ... 33 6.2 KRITISCHE REFLECTIE RESULTATEN ... 34 6.2.1 Resultaten cytologie ... 34
6.2.2 Resultaten HRA ... 35
6.2.2 Risicofactoren ... 36
7. SCREENING IN BELGIË ... 41
7.1 WIE SCREENEN? ... 41 7.2 SCREENINGSINSTRUMENTEN ... 42 7.2.1 Lichamelijk onderzoek ... 42
7.2.2 Cytologie ... 42
7.2.3 HRA ... 43
7.3 HAALBAARHEID VAN SCREENING IN BELGIË ... 43 8. CONCLUSIE ... 45
9. REFERENTIES ... 46
10. BIJLAGEN ... 49
BIJLAGE I: ABSTRACT BELGIAN WEEK OF GASTROENTEROLOGY ... 49
BIJLAGE II: IANS MEETING AMSTERDAM ... 51
BIJLAGE III: GOEDKEURING ETHISCH COMITÉ ... 54
BIJLAGE IV: INFORMATIE- EN TOESTEMMINGSFORMULIER ... 56
BIJLAGE V: VRAGENLIJST ... 59
BIJLAGE VI: OVERZICHT VAN PREVALENTIE HSIL IN DE LITERATUUR ... 62
1
1. Abstract
Introductie
Hoewel anale kanker zeldzaam is, neemt de incidentie hiervan steeds verder toen. De stijging in incidentie is het meest uitgesproken bij HIV-seropositieve mannen. Dit is te verklaren door het feit dat deze patiënten een verhoogd risico hebben om anale intra-epitheliale neoplasie (AIN) te ontwikkelen, wat als een premaligne HPV-gerelateerde letsel wordt beschouwd. In België is de prevalentie van AIN en de rol van screening bij hoog risicopatiënten nog niet onderzocht geweest.Doelstelling
Het doel van deze studie is het bepalen van de prevalentie van AIN bij HIV-patiënten, die een anale screening hebben ondergaan in het universitair ziekenhuis van Gent. Hierbij wou men de verdere evolutie van de hooggradige letsels analyseren en de resultaten van cytologie en hoge resolutie anuscopie (HRA) onderling vergelijken. Tot slot wou men nagaan welke risicofactoren een rol kunnen spelen bij het ontwikkelen van een persisterend hooggradig letsel en/of een infectie met hoog risico HPV (HR HPV).Methodologie
Het design van de studie is een retrospectieve cohortstudie. HIV-positieve mannen, die minstens twee keer anale screening hebben ondergaan en waarbij er gelijktijdig een anaal uitstrijkje en een HRA-onderzoek was gebeurd, zijn geïdentificeerd geweest. 48 patiënten werden geïncludeerd in de studie, na het verkrijgen van een informed consent en een ingevulde vragenlijst. Bij deze patiënten zijn tussen 2010 en 15 november 2019 166 uitstrijkjes afgenomen, 6 uitstrijkjes hadden onvoldoende celmateriaal waardoor ze niet geïncludeerd zijn in de analyse.De evolutie van de cytologie tussen verschillende visites is geanalyseerd met behulp van de McNemar test. Voor het kunnen identificeren van risicofactoren die voorspellend zijn voor een persisterend hooggradig letsel en/of HR HPV maakte men gebruik van de ROC-curve analyse en de binair logistische regressieanalyse. Deze testen werden ook gebruikt om de resultaten van cytologie te vergelijken met de resultaten van HRA.
Resultaten
De gemiddelde leeftijd van de studiepopulatie was 49,7 jaar (mediaan 51 jaar). Deze patiënten hadden een follow-up duur van gemiddeld 47,1 maanden (mediaan 44 maanden) en hadden gemiddeld 3,4 uitstrijkjes en HRA-procedures per patiënt (mediaan 3). Van de 160 geanalyseerde uitstrijkjes vertoonden 47 (29,4%) HSIL of ASC-H en 113 (70,6%) NILM, ASCUS of LSIL. 43,8% van de patiënten heeft ooit een cytologie met resultaat HSIL gehad, wanneer men ASC-H ook beschouwde als potentiële hooggradige dysplasie liep dit cijfer op tot 56,3%. De meeste patiënten kenden wel een spontane regressie naar non HSIL (NILM, ASCUS of LSIL), gedurende de follow-up duur. Desalniettemin was er 1 patiënt die evolueerde naar een carcinoma in situ.
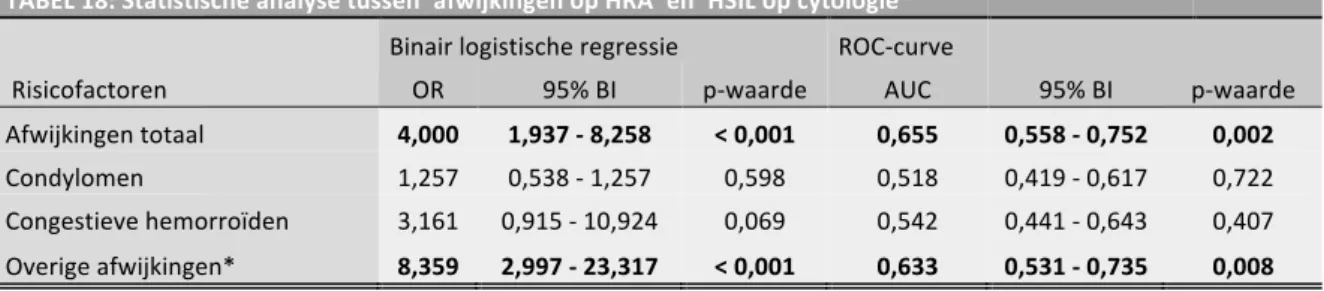
Hoewel men een significantie vindt tussen het hebben van afwijkingen op HRA en het hebben van een uitstrijkje met HSIL of ASC-H (p < 0,001), geldt niet wanneer condyloma en congestieve
2
hemorroïden als afzonderlijk factoren worden geanalyseerd. Het beschouwen van condyloma en congestieve hemorroïden als afwijkingen deed de sensitiviteit stijgen, maar de specificiteit dalen.
Bij de analyse van de afzonderlijke risicofactoren vond men een significantie tussen het hebben van minstens twee uitstrijkjes met HSIL en het opgelopen hebben van een chlamydia-infectie (p= 0,036). Als risicofactor voor het hebben van HR HPV vond men significantie voor het opgelopen hebben van andere soa’s buiten HIV (p= 0,009), voor het doorgemaakt hebben van een chlamydia-infectie (p= 0,021) en het hebben van minstens één uitstrijkje met HSIL (p=0,048). De overige risicofactoren gaven geen significante relatie.
Conclusie
Men vond een hoge prevalentie van hooggradige dysplasie bij de HIV-seropositieve mannen die opgevolgd worden in het universitair ziekenhuis van Gent. Hoewel de meeste patiënten een spontane regressie kennen naar non HSIL, hebben we ook een patiënt geïdentificeerd met een carcinoma in situ. Dit benadrukt het belang van een screeningsprogramma waarbij de patiënten met een hoge kans op progressie nauw opgevolgd en/of behandeld worden, terwijl de patiënten met een hoge kans op regressie kunnen gescreend worden over grotere tijdsintervallen. Door de te kleine steekproefgrootte en het feit dat de verzamelde gegevens afkomstig zijn uit slechts één centrum, kunnen we onze bevindingen niet generaliseren voor de hele Belgische HIV-populatie. Er is nood aan grootschaligere studies op nationaal niveau om de prevalentie van AIN in België te kunnen inschatten en om het belang van screening te kunnen bepalen. Ook moet men aandacht hebben voor preventieve maatregelen zoals HPV-vaccinaties en educatieve programma’s rond veilige seks.3
2. Inleiding: probleem en doelstelling
Hoewel anale kanker een relatief zeldzame aandoening is en slechts voor 2% deel uitmaakt van de gastro-intestinale tumoren, ziet men het aantal nieuwe gevallen steeds meer toenemen (zie figuur 1, § 3.1). (1-10) Deze stijging in incidentie is het meest uitgesproken bij HIV-seropositieve mannen, die lijden aan een chronische infectie met humaan papillomavirus (HPV). (3, 4, 7, 9-13) Bovendien voorspellen onderzoekers dat de toename in incidentie ook de komende jaren zal aanhouden. Dit kan grotendeels toegeschreven worden aan het feit dat HIV-patiënten gemiddeld ouder worden, dankzij de adequate combinatie antiretrovirale therapie (cART).(7, 9, 12) Door de toename in levensverwachting, stijgt ook de kans op het oplopen van maligniteiten, wat anuskanker een grotere bezorgdheid maakt. Het klinisch belang van anale kanker binnen de HIV-populatie kan benadrukt worden door het feit dat ongeveer 1,5% van deze patiënten anale kanker zal doorgemaakt hebben op de leeftijd van 75 jaar, dit in vergelijking met 0,05% bij HIV-negatieve individuen. (7, 10)Humaan papillomavirus (HPV) wordt bij 85% van de gevallen als oorzakelijke factor van anale kanker gezien. (1, 3, 4, 6, 7, 9, 13) Hoewel de meeste mensen in aanraking komen met HPV, zal dat bij HIV-seronegatieve individuen vaak geen probleem stellen omdat het virus bij hen snel geklaard kan worden. Helaas hebben HIV-seropositieve patiënten meer moeite met het klaren van het virus, waardoor een chronische infectie met HPV jarenlang kan blijven bestaan. (4, 7, 10, 14) Een chronische HPV-infectie kan vervolgens aanleiding geven tot anale intra-epitheliale neoplasie (AIN), wat een voorstadium kan zijn van anale kanker. Hierbij ontstaan histopathologische veranderingen in de transitiezone van het anaal kanaal, waar het cilindrisch epitheel overgaat in het plaveiselepitheel, wat kan leiden van laag- tot hooggradige letsels (zie verder, § 3.2). (3, 7, 9, 13)
Aangezien HIV-patiënten een hogere kans hebben op het ontwikkelen van anale dysplasie en anuskanker ten gevolge van een chronische HPV-infectie, wordt bij deze patiënten aangeraden om jaarlijks een anaal onderzoek met cytologie en/of een hoge resolutie anuscopie (HRA) te ondergaan. (13) Aan de hand van deze studie wil men de resultaten van het cytologisch en het HRA-onderzoek bij deze patiënten beoordelen. Op die manier kan men nagaan of het regelmatig uitvoeren van anale screening bij HIV-seropositieve mannen aanleiding geeft tot het vroegtijdig detecteren van AIN en/of anuscarcinoom. Hierbij kan opgespoord worden of er al een vorm van AIN aanwezig is en wat de progressie hiervan is. Bovendien kan men ook onderzoeken welke risicofactoren een rol kunnen spelen bij het ontwikkelen van AIN, bijvoorbeeld: roken, alcohol, leeftijd, immunosuppressiva, passieve anale seks… Ook het belang van vroegtijdige behandeling voor het verbeteren van de prognose, kan nagegaan worden. (2, 4-7, 9, 15)
Met behulp van deze studie kan men meer inzicht krijgen in dit onderwerp, wat van belang kan zijn voor verdere onderzoeken. Zo kan het belang van screening en vroegtijdige therapie maatschappelijk interessant zijn om verder te onderzoeken. Daarnaast kan er verder onderzocht worden of preventieve maatregelen, zoals HPV-vaccinatie bij jonge mannen, een rol kunnen spelen bij het doen dalen van de incidentie. In verdere studies kan er eventueel ook nagegaan worden welke factoren voor een daling van de mortaliteit en de morbiditeit kunnen zorgen. Ten slotte lijkt het ook interessant zijn om de kosteneffectiviteit hiervan te bestuderen. (3, 16)
4
3. Literatuurstudie
Via een systematische literatuuranalyse wordt een overzicht gegeven van de beschikbare wetenschappelijke kennis over AIN. De volgende onderwerpen worden achtereenvolgens beschreven: epidemiologie en risicofactoren; anatomie, histologie en histopathologie; pathogenese; screening en diagnose en ten slotte behandeling en preventie van AIN.
3.1 Epidemiologie en risicofactoren
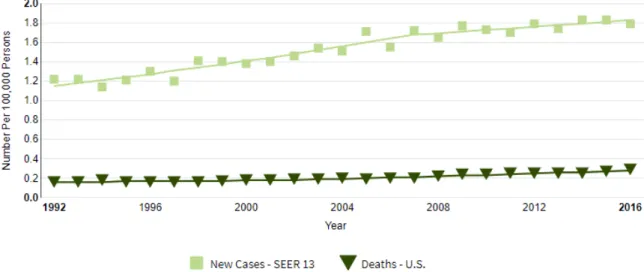
Zoals eerder vermeld stijgt de incidentie van anale kanker steeds maar verder (figuur 1). In het laatste decennium zien deskundigen een toename van 2,2% per jaar. (2, 3, 7-10, 12, 13, 17) Deze stijging in incidentie is bovendien nog sterker bij HIV-seropositieve mannen, hierbij wordt jaarlijks een gemiddelde stijging van 3,8% geobserveerd. (10) Zo ziet men bij HIV-patiënten 34,6 tot 100 gevallen van anale kanker per 100 000 persoonsjaren, wat enorm hoog is in vergelijking met de algemene bevolking waarbij dit aantal slechts 0,3 tot 1 is. (7, 12, 16)
Fig. 1: De incidentie en stertecijfers van anale kanker per jaar volgens de ‘National Cancer Institute’s Surveillance, Epidemiology, and End Results (SEER) program’. De incidentie- en stertecijfers worden uitgedrukt per 100000 persoonsjaren. (Overgenomen van referentie 17) Het is al in meerdere studies aangetoond dat HIV-seropositiviteit geassocieerd wordt met een verhoogd risico op AIN, een potentieel precancereus letsel. (1, 2, 7, 8, 10, 12, 16, 18) Er is een stijging van het relatieve risico met factor 60 voor het ontwikkelen van een hooggradige laesie of een carcinoma in situ bij HIV-positieve mannen. Bovendien zijn HIV-positieve mannen in vergelijking met HIV-negatieve mannen tot 2 decennia jonger wanneer de diagnose van anale kanker wordt gesteld. (7, 12) Daarom wordt HIV-infectie als één van de belangrijkste risicofactoren beschouwd voor het ontwikkelen van AIN. AIN kan gedetecteerd worden in een groot en steeds toenemend aantal geïnfecteerde patiënten. Afhankelijk van de HIV-subgroep zag men een prevalentie van hooggradige AIN bij 13-52% van de mannen die seks hebben met mannen (MSM) en bij 15% van de heteroseksuele patiënten. (7, 12, 16) In sommige studies zag men ook dat het voorkomen van hooggradige AIN bij HIV-patiënten omgekeerd evenredig was met het aantal CD4-cellen, de incidentie was hoger wanneer het CD4-aantal kleiner was dan 200/mm3. (1, 2, 7, 10, 12, 16)
5
Aangezien AIN vaker voorkomt bij HIV-seropositieve mannen, is ook de associatie tussen AIN en hoog risico seksueel gedrag onderzocht geweest. Verschillende studies hebben aangetoond dat ook hoog risico seksueel gedrag gepaard gaat met een hogere percentage AIN. Hierbij zijn de volgende factoren onderzocht geweest: MSM, passief anale seks, aantal seksuele partners, een voorgeschiedenis van andere seksueel overdraagbare aandoeningen zoals gonorroe, syfilis, condylomata acuminata, herpes simplex type 2 en hepatitis B. (1, 2, 7, 8, 10) De significante relatie tussen AIN en de afzonderlijke risicofactoren wordt verder besproken in paragraaf 6.2.2.
Het feit dat zowel patiënten met hoog risico seksueel gedrag, als patiënten met HIV een verhoogd risico hebben om AIN te ontwikkelen, is hoogstwaarschijnlijk door het feit dat beide risicofactoren een verhoogde kans geven om HPV-infectie op te lopen. Bovendien vinden clinici bij deze groepen meestal verschillende HPV-types tegelijkertijd en vaak kunnen deze patiënten de HPV-infectie niet klaren waardoor ze meestal te maken hebben met een persisterende HPV-infectie. (2, 4, 6, 8, 16, 18) Een persisterende HPV-infectie wordt in de meeste gevallen als de oorzakelijke factor van AIN en anale kanker gezien. (2, 3, 7-10, 13, 16) Een HPV-infectie komt zeer vaak voor, 75% van de bevolking raakt minstens één keer in hun leven besmet met een HPV-infectie en de meeste bronnen spreken van een prevalentie van 45% bij de algemene bevolking. Vaak kunnen mensen de infectie spontaan klaren, maar bijvoorbeeld HIV-patiënten en andere patiënten, die immunosuppressiva nemen na een orgaantransplantatie kunnen deze infectie veel moeilijker klaren, waardoor het evolueert naar een persisterende infectie. De prevalentie van HPV-infectie was 90% bij HIV-positieve MSM en dit cijfer liep op tot 98% wanneer er een hooggradige laesie aanwezig was. (3, 6, 7, 9, 10, 13, 14) In het kader van AIN en anale kanker bij HIV-positieve MSM is HPV-16 het meest voorkomende type (>70%), gevolgd door HPV-18 (8%). (4, 6, 7, 10) Bovendien is de aanwezigheid van meerdere HPV-typen geassocieerd met een verhoogd risico op abnormale cytologie, detectie van AIN en anale kanker. (7) De sterke associatie tussen HPV-infectie met AIN en anale kanker heeft geleid tot het besef dat anale kanker gelijkenissen vertoont met andere HPV-gerelateerde urogenitale maligniteiten, zoals cervix-, vagina- en peniskanker. De anus en de cervix hebben een gelijkaardige embryologische origine en dezelfde vatbaarheid voor HPV-infectie, wat de gelijkenissen tussen beide maligniteiten kan verklaren. De identificatie van een gemeenschappelijke ziektepathway en risicofactoren leidde tot het overnemen van dezelfde pathologische terminologie bij anogenitale kanker. (2, 3, 7, 10, 12, 16) De Bethesda-classificatie met de termen 'LSIL' en 'HSIL' wordt als meest geschikt beschouwd voor de cytologische gradering van laesies, terwijl men voor histologie gebruik maakt van de AIN 1, AIN 2 en AIN 3 gradatie. (Zie tabel 2, § 3.2) Deze laesies kunnen een regressie vertonen of chronisch aanwezig blijven. (6, 12, 16) De aanwezigheid van een HPV-gerelateerde dysplasie in een andere anatomische site, wordt ook als een duidelijke risicofactor van AIN gezien. Vermits het ontwikkelen van HPV-gerelateerde maligniteiten een chronische infectie met hoog risico HPV (bv. type 16 of 18) doet vermoeden, wat vervolgens AIN kan veroorzaken. (4, 6, 7)
Tot slot wordt roken ook als een risicofactor gezien van AIN en anale kanker. Hoewel het mechanisme erachter nog niet helemaal duidelijk is, identificeren verschillende studies roken als een duidelijke risicofactor van anale kanker. (7, 10, 16) In studies werd gezien dat de regressie van AIN na therapie faalde bij alle rokers, terwijl er bij niet-rokende patiënten een regressie was bij 63% van de patiënten. (16)
6 TABEL 1: Risicofactoren voor anale intra-epitheliale neoplasie Persisterende HPV-infectie Anogenitale wratten HIV-seropositiviteit MSM Roken Het gebruik van immunosuppressiva Verhoogd aantal seksuele partners Voorgeschiedenis van andere HPV-gerelateerde maligniteiten Voorgeschiedenis van seksueel overdraagbare aandoeningen (Gebaseerd op referenties 1-3, 6-8, 10, 12, 14, 16, 18)
3.2 Anatomie, histologie en histopathologie
Het anaal kanaal (figuur 2) is een fibro-elastische buisvormige structuur met een lengte van 3 à 5 cm. Het wordt gedefinieerd als het laatste deel van de gastro-intestinale tractus en bevindt zich tussen het rectum en de perianale huid. (1, 10, 19) De linea dentata verdeelt het anaal kanaal in twee delen en markeert zowel de histologische als de embryologische overgang. Het bovenste ⅔ van het anaal kanaal is bekleed met cilindrisch epitheel en is ontstaan uit het endoderm. Terwijl het onderste ⅓ van het anaal kanaal uit meerlagig plaveiselepitheel is opgebouwd en ontstaan is uit het ectoderm. Hiertussen bevindt zich net boven de linea dentata een overgangszone, waarbij het cilindrisch epitheel overgaat in het plaveiselepitheel, deze wordt daarom de transitiezone genoemd. Bijgevolg kan het anaal kanaal aan de hand van het epitheel onderverdeeld worden in drie niveaus, namelijk het cilindrisch epitheel, het overgangsepitheel en het plaveiselepitheel. Dit is van belang bij het beoordelen van anale tumoren. (1, 10, 12) Meer dan 80% van de anale carcinomen ontstaan in de transitiezone. (2, 10)
Fig. 2 Het anaal kanaal.
Deze schematische weergave van het anale kanaal toont de epitheliale bekleding van het rectum (cilindrisch epitheel), het anale kanaal (niet-keratiniserend meerlagig plaveiselepitheel) en de anale huid (verhoornde epidermis rijk aan haarfollikels, eccriene en apocriene klieren). Er is een variabele epitheliale overgangszone rond het pecten. (Overgenomen van referentie 19)
7
Door een persisterende HPV-infectie kunnen in de transitiezone een reeks histopathologische veranderingen plaatsvinden, wat kan variëren van atypische plaveiselcellen met een onbepaalde betekenis (ASCUS) tot anale intra-epitheliale plaveiselcel laesies (ASIL). ASIL kan verder onderverdeeld worden in enerzijds laaggradige intra-epitheliale plaveiselcel laesies (LSIL) en anderzijds hooggradige intra-epitheliale plaveiselcel laesies (HSIL). In de context van anale intra-epitheliale neoplasie kunnen ze respectievelijk laaggradige anale intra-anderzijds hooggradige intra-epitheliale plaveiselcel laesies (HSIL). In de context van anale intra-epitheliale neoplasie (LGAIN) en hooggradige anale intra-epitheliale neoplasie (HGAIN) genoemd worden (tabel 2). (3, 6, 12, 13, 20)
In figuur 3 en 4 worden de verschillende stadia systematisch weergegeven. LSIL of LGAIN komt histologisch overeen met anale intra-epitheliale neoplasie graad 1 (AIN I), hierbij is de onderste 1/3de van het epitheliale laag aangetast. Een geringe celkernatypie (koïlocytose) is hierbij zichtbaar, de cellen vertonen een vergrote en onregelmatige kern en zijn omgeven door een halo. Onder HSIL of HGAIN valt anale intra-epitheliale neoplasie graad 2 (AIN II) met 1/3de tot 2/3de van het epitheliale laag die is aangetast en anale intra-epitheliale neoplasie graad 3 (AIN III o), waarbij meer dan 2/3de van het epitheliale laag aangetast is. Een bijkomend kenmerk van HSIL is de micro-invasie doorheen het basale membraan, waardoor de epitheelcellen worden vervangen door basaloïde cellen met een toegenomen kern-cytoplasma ratio. Wanneer er nog geen doorbraak is van het basale membraan spreekt men van een carcinoma in situ (CIS). Wanneer het basale membraan wel doorbroken is en er een invasie is in de onderliggende structuren zoals de lamina propria of de muscularis mucosa, spreekt men van een carcinoom. Anuscarcinoom kan onderverdeeld worden in drie soorten: het plaveiselcelcarcinoom, het adenocarcinoom en het anorectale melanoom. (1, 2, 4, 6, 7, 10, 12, 13, 16, 21-23) Epidemiologische studies bekrachtigen de theorie dat anale kanker ontstaat uit een stapsgewijze progressie van een persisterende subklinische infectie met hoog risico HPV naar LSIL en HSIL en vervolgens naar een invasieve anale kanker. Elke stap gaat gepaard met moleculaire en immunologische veranderingen. (12, 16) TABEL 2: De cytologische en histologische terminologie van anale intra-epitheliale neoplasie Cytologische classificatie volgens Bethesda (gebruikt voor screening) Histologische classificatie (gebruikt voor diagnose) Graad van dysplasie
NILM Normaal Normaal
ASCUS Atypie Atypie
ASC-H Atypie Atypie
LSIL AIN I Milde dysplasie
HSIL AIN II Matige dysplasie
HSIL AIN III Ernstige dysplasie
HSIL AIN III Carcinoma in situ
Invasief carcinoom Invasief carcinoom Invasief carcinoom
AIN: anale intra-epitheliale neoplasie; NILM: negatief voor intra-epitheliale laesies of maligniteit; LSIL: laaggradige squameuze intra-epitheliale laesie; HSIL: hooggradige squameuze intra-epitheliale laesie; ASCUS: atypische squameuze cellen met een onbekende betekenis; ASC-H: atypische squameuze cellen waarbij HSIL niet kan uitgesloten worden.
8
Fig. 3: Schematische voorstelling van anale intra-epitheliale neoplasie.
Met de toenemende ernst van de anale intra-epitheliale laesie, neemt de proportie van epitheelcellen toe die vervangen worden door basaloïde cellen met een toegenomen kern-cytoplasma ratio. Een invasieve anale kanker ontstaat uit één of meerdere hooggradige dysplastische letsels (HSIL) en vertoont een doorbraak van het basaal membraan. (Overgenomen van referentie 22)
Fig. 4: De histologische classificatie van anale intra-epitheliale neoplasie (AIN). De histologische preparaten van het anaal weefsel zijn gekleurd met Hematoxyline-eosinekleuring en 200 maal vergroot. (Overgenomen van referentie 23)
3.3 Pathogenese
Zoals hierboven vermeld, is het al in diverse studies aangetoond dat de histopathologische veranderingen in het anaal kanaal geassocieerd zijn met een chronische infectie met hoog risico HPV (HR HPV). (3, 7, 9, 13, 16) Een persisterende HR HPV-infectie is de initiële stap voor het ontstaan van anale dysplasie, maar is op zich niet voldoende. De mogelijke gevolgen van een infectie met HR HPV zijn klaring, een klinische infectie (bv. wratten), latentie en persistentie. Uiteindelijk kan de persistentie van HR HPV AIN en vervolgens anale kanker veroorzaken. Hiervoor zijn bijkomende mutaties en/of epi-genetische modificaties vereist, aangezien ze noodzakelijk zijn om cellulaire apoptose tegen te gaan en om een ongecontroleerde groei en proliferatie te kunnen induceren (10, 12, 16)
Humaan papillomavirussen zijn dubbelstrengige DNA-virussen die geclassificeerd kunnen worden in genotypen op basis van hun DNA-sequentie. Zo kunnen ze onderverdeeld worden in laag risico HPV (LR HPV) en hoog risico HPV (HR HPV) volgens hun potentieel om respectievelijk benigne hyperproliferatieve letsels of neoplastische aandoeningen te veroorzaken. (10, 14) Aangezien HPV uitsluitend repliceert in het epitheliaal compartiment is de levenscyclus van HPV afhankelijk van de epitheliale differentiatie. (14) De infectie wordt geïnitieerd op het epitheliale
9
basaalmembraan waar HPV zich richt tot basale keratinocyten. Onderzoek toont aan dat er in het basaalmembraan proteoglycanen aanwezig zijn, die als receptoren functioneren. Binding van het virus op deze receptoren leidt tot structurele veranderingen van het viraal capside, waardoor het HPV-virus de keratinocyten gemakkelijker kan binnendringen en hierin kan persisteren. (7, 10, 14)
HPV brengt latente fase genen tot expressie die ervoor zorgen dat het virus persisteert en dat het aantal latent geïnfecteerde cellen toeneemt. (14) Deze HPV-genen worden genummerd volgens het moment waarin ze tot expressie gebracht worden in de virale replicatie cyclus en worden vervolgens geclassificeerd als vroege en late genen. (10, 14) De vroege genen staan in voor de regulatie van de virale DNA-replicatie, transcriptieregulatie en cellulaire transformatie, terwijl de late genen coderen voor de structurele capside eiwitten. (10, 12, 14)
Bepaalde HR HPV-genotypen, waaronder HPV type 16, 18, 31, 33 en 35, zijn geassocieerd met anogenitale infecties, dysplasieën en maligniteiten. Dit is mogelijk omdat deze genotypen de vroege HPV genen E6 en E7 tot expressie brengen. Wanneer E6 en E7 genen gecodeerd worden door HR HPV vertonen deze extra functies, die kenmerkend zijn voor neoplastische aandoeningen, waardoor een ongecontroleerde proliferatie van de onderste epitheliale cellen kan optreden. (4, 6-8, 10, 12, 14, 24) Dit wordt mogelijk gemaakt omdat de HR HPV-gecodeerde E6 en E7 genen aanleiding kunnen geven tot een ongecontroleerde proliferatie van de drive cellen, tot resistentie tegen apoptose en tot de overschrijding van de replicatie limieten. (10)
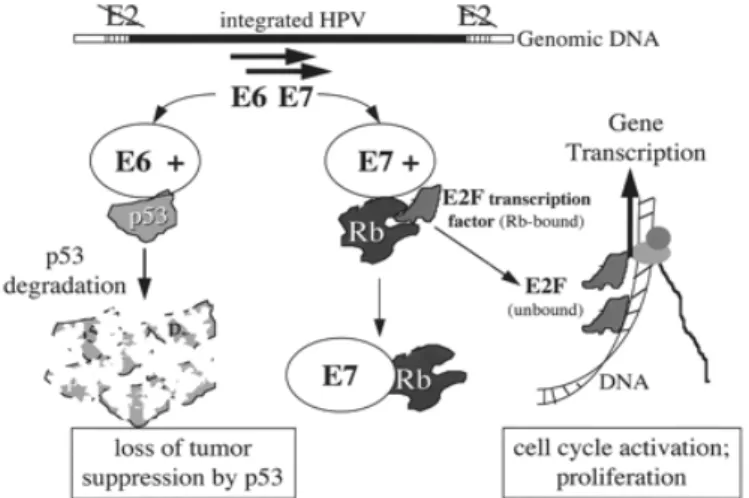
Fig. 5 HPV-geïnduceerde oncogenese.
HR HPV-gecodeerde E6 bindt aan het p53-gen en induceert de degradatie ervan. Het HR HPV-gecodeerde E7 bindt het Rb-eiwit waardoor het E2F-gen vrijkomt dat de celcyclus activeert en de proliferatie induceert. (Overgenomen van referentie 21)
HR HPV-gecodeerde E6 en E7 binden respectievelijk aan de cellulaire p53 en de retinoblastoom (Rb) tumorsuppressorgenen en induceren de proteolytische degradatie van deze eiwitten (figuur 5). (8, 10, 12, 14, 24) Het tumorsuppressorgen p53 initieert een anti-neoplastische reactie, afhankelijk van de opgelopen genomische schade. Zo kan p53 de initiatie van de DNA-synthese blokkeren, het DNA-herstelmechanisme activeren en apoptose induceren. Na de binding van het HR HPV gecodeerde E6 aan het p53 gen treedt er een deregulatie op van dit systeem, waardoor DNA-schade blijft bestaan. Het E6 gen geeft ook een upregulatie van de telomerase activiteit, wat kan bijdragen aan de transformatie en de immortalisatie van deze cellen. (10, 14, 24)
10
Door de inactivatie van het Rb tumorsuppressorgen treden in deze cellen verdere afwijkingen op tijdens de celdeling en proliferatie. Na de binding van het HR HPV-gecodeerde E7 gen aan het Rb eiwit, wordt het E2F gen vrijgesteld. Vervolgens activeert het E2F gen de transcriptie van de genen die essentieel zijn voor de DNA-replicatie en voor de progressie van de cellen vanuit de G1-fase naar de S-fase van de celcyclus. (10, 12, 14) Het E7 gen richt zich ook op het DNA methyltransferase, waardoor het CpG-methylatiepatroon na celreplicatie verstoord wordt, wat vervolgens genomische instabiliteit kan veroorzaken. (10, 14)
HR HPV richt zich dus op de twee belangrijkste regulatoren van de cellulaire proliferatie, namelijk het p53 gen en het Rb gen. De expressie van HR HPV gecodeerde E6 en E7 genen in de epitheliale cellen lijkt voldoende te zijn voor het induceren van een ongecontroleerde groei en proliferatie en voor de inhibitie van apoptose, maar het is niet voldoende voor het doen ontstaan van anale dysplasie. Deze bevinding komen overeen met het klinisch bewijs dat de ontwikkeling van een maligne fenotype pas optreedt na een langdurige infectie met HR HPV. (12) Door een persisterende HR HPV infectie, waarbij de cellen chronisch geïnfecteerd zijn, zullen vermoedelijk de mutaties accumuleren. Een langdurige infectie met HR HPV kan gezien worden bij HIV-seropositieve patiënten, omdat ze het virus niet kunnen klaren en waardoor zij een risicogroep vormen voor het oplopen van anale intra-epitheliale neoplasie en anale kanker. (6, 7, 9, 10, 12, 13, 16)
3.4 Screening en Diagnose
De klinische presentatie van AIN is meestal asymptomatisch, sommige patiënten kunnen wel klagen over vage anale klachten zoals: pruritus, bloeding, pijn of tenesmus. Maar deze klachten zijn eerder te wijten aan een geassocieerde pathologie dan aan de HPV-infectie zelf. (7, 12) Door het vaak asymptomatisch karakter, wordt AIN dikwijls laattijdig ontdekt, waardoor het dan al geëvolueerd kan zijn in een carcinoma in situ of een anuscarcinoom. Daarom is de rol van screening cruciaal voor het vroegtijdig stellen van de diagnose en dit vooral bij de hoog risico populatie (zie tabel 2, §3.1). (7, 10, 12)
De hogere incidentie van anale kanker bij de hoog risico populatie, geeft het belang van screening op AIN binnen deze groep weer. (5, 7, 9, 13, 15, 16) Verschillende studies suggereren dat de screening en behandeling van AIN binnen de hoog risico populatie de incidentie van anale kanker doet dalen en in verschillende onderzoeken naar kostenanalyse bleek screening binnen deze groep ook kosteneffectief te zijn. (3, 7, 16) Ondanks deze bevindingen is er nog steeds geen eenduidigheid over de screening bij de hoog risico populatie, aldus wordt het niet aangeraden door de ‘American society of colon and rectal surgeons’, maar wel door de ‘HIV medicine Association of Infectious disease society of America’. (16) Deze tegenstrijdigheid, kan verholpen worden door het bekomen van wetenschappelijke evidentie met behulp van gerandomiseerde studies. Maar een dergelijke studie waarin het effect van screening op de incidentie en/of de mortaliteit wordt beoordeeld, is moeilijk door de lage incidentie van anale kanker en omdat het aantal patiënten en de duur van de follow-up belemmerend en/of onbetaalbaar zouden zijn. Er is momenteel wel een aanzet tot een aantal grote internationale cohortestudies zoals de ANCHOR-, SPANC- en SEPAC-studies. Men hoopt dat deze studies meer verduidelijking zullen geven over het nut van screening en behandeling van anale dysplasie bij hoog risicopatiënten. Voor verdere info rond deze studies, zie bijlage II. (3, 5, 16)
Hoewel er nog geen officiële richtlijnen bestaan in verband met de screening van AIN, lijkt de combinatie van anale cytologie, eventueel met HPV-typering, gevolgd door een hoge resolutie
11
anuscopie (HRA) met 3% lugolzuur en/of azijnzuur met vervolgens een biopsie van de zichtbare letsels, een degelijke strategie om op AIN te screenen. (3, 4, 7, 10, 12, 16) In figuur 6 is het screenings-algoritme weergegeven dat voorgesteld is door Palefsky en Rubin. In centra met een voldoende aantal aan anuscopisten, kunnen hoog risicopatiënten ook rechtstreeks doorverwezen worden voor een HRA-onderzoek in plaats van eerst een anaal uitstrijkje te laten nemen. Maar door de beperkte beschikbaarheid van clinici die getraind zijn in HRA, is het in veel ziekenhuizen de gewoonte geworden om anale cytologie te gebruiken als een triage-instrument, waarbij de patiënten pas een HRA-onderzoek krijgen wanneer ze een abnormaal resultaat hebben op cytologie. (25) Hieronder worden deze screeningsmethodes verder besproken.
Fig. 6 : Algoritme voor het diagnosticeren, behandelen en opvolgen van AIN, voorgesteld door Palefsky en Rubin. ASCUS: atypische squameuze cellen met een onbekende betekenis; ASC-H: atypische squameuze cellen waarbij HSIL niet kan uitgesloten worden; LSIL: laaggradige squameuze intra-epitheliale laesie; HSIL: hooggradige squameuze intra-epitheliale laesie; HRA: hoge resolutie anuscopie; AIN: anale intra-epitheliale neoplasie; LGAIN: laaggradige anale intra-epitheliale neoplasie; HGAIN: hooggradige anale intra-epitheliale neoplasie. (overgenomen van referentie 25)
3.4.1 Anale cytologie
Anale cytologie is momenteel één van de meest gehanteerde manieren om op AIN te screenen. Hierbij wordt een met water bevochtigde polyester wattenstaafje 4 à 5 cm diep in het anaal kanaal gebracht, voor een correcte sampling wordt vervolgens het wattenstaafje met draaiende bewegingen verwijderd terwijl er een zijwaartse druk wordt geoefend. Het cytologisch staafje wordt hierna verwerkt volgens de methode van Papanicolaou en uiteindelijk geanalyseerd door een patholoog met expertise in cytologie. (7, 16) De eventueel gevonden cytologische afwijkingen kunnen vervolgens gerapporteerd worden volgens de Bethesda-classificatie (figuur 7). (10)
Bij de hoog risicogroep is de gevoeligheid van anale cytologie lager dan deze van cervicale cytologie, de specificiteit is wel gelijkaardig. (2, 10, 12) Palefsky et al. vonden in een onderzoek bij HIV-positieve mannen een sensitiviteit van 69% bij de eerste visite en een sensitiviteit van 81% bij alle visites samen. Daarnaast rapporteerden ze ook een specificiteit van 59%. In deze studie werd ASCUS ook beschouwd als abnormale cytologie, waardoor de sensitiviteit steeg en de specificiteit daalde. (12) Nahas et al. rapporteerden gelijkaardige cijfers, namelijk een sensitiviteit van 61% en een specificiteit van 60%. Fox rapporteerde een hogere sensitiviteit van
12
83% en een lagere specificiteit van 38%. Ook Cuming analyseerde de resultaten van anale cytologie en rapporteerde een sensitiviteit tussen 54-89% en een specificiteit van 37-76%. Door de verschillen in sensitiviteit en specificiteit is er een blijvende onzekerheid over de waarde van anale cytologie als screeningsinstrument. (26-28)
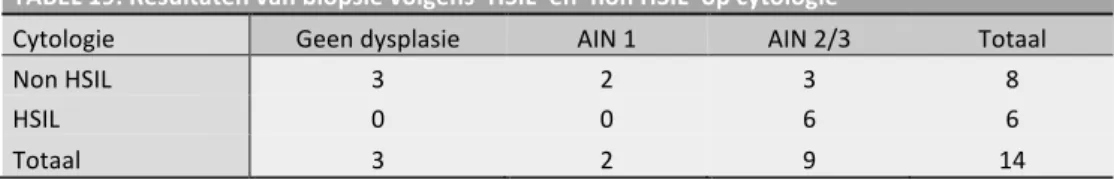
Bovendien moeten de clinici zich ervan bewust zijn dat er bij HSIL een goede correlatie bestaat tussen de anale cytologie en histologie. De histologie kan nagegaan worden met behulp van biopsie. Jammer genoeg is deze correlatie niet meer zo goed bij ASCUS en LSIL, aangezien de kans dat er bij histologisch onderzoek LGAIN gevonden wordt even groot is als de kans op het vinden van HGAIN. Hierdoor wordt er aanbevolen om bij een abnormale cytologie een HRA-onderzoek met biopsie uit te voeren. (10, 12)
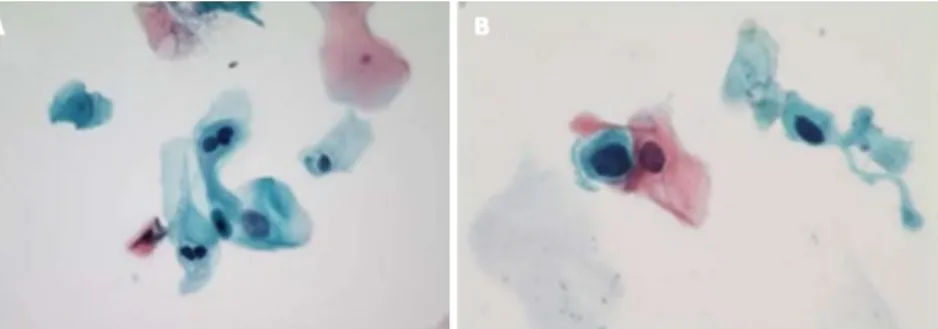
Fig. 7 Cytologie van anale intra-epitheliale laesies.
A: LSIL, met tweekernige hyperchromatische cellen (koïlocyten) en nucleaire vergroting (Papanicolaou-kleuring, vergroting x400). B: HSIL, duidelijk toegenomen kern-cytoplasma ratio in vergelijking met LSIL (A) (Papanicolaou-kleuring, olie-immersie, vergroting x1000). LSIL: laaggradige squameuze intra-epitheliale laesies; HSIL: hooggradige squameuze intra-epitheliale laesies. (Overgenomen van referentie 16)
3.4.2 Hoge resolutie anuscopie (HRA)
Volgens de meeste richtlijnen moet men bij een normale cytologie niets doen, maar bij afwijkende anale cytologie is er wel nood aan verdere onderzoek. Cytologie kan de aanwezigheid van AIN detecteren, maar het identificeert niet de locatie of de uitgebreidheid van de laesie. (3, 6, 7, 10, 16)
Bij afwijkende anale cytologie is HRA dus de volgende stap in de diagnose van AIN. Met HRA worden de transitiezone, het anaal kanaal en de perianale huid onder vergroting geïnspecteerd met behulp van een colposcoop. Op die manier probeert men de afwijkende zone met atypische cellen te lokaliseren. (2, 3, 6, 16) Vervolgens wordt een wattenstaafje gedrenkt in 3%-5% azijnzuuroplossing in het anale kanaal gebracht. (2, 6, 16) Na het appliceren van azijnzuur wordt de anale mucosa zorgvuldig geïnspecteerd. Onder invloed van het azijnzuur zal het dysplastisch epitheel opzwellen en treedt er een wit verkleuring op van het letsel doordat er meer licht gereflecteerd wordt. Hierna wordt er gezocht naar veranderingen die kenmerkend zijn voor AIN, waaronder vlakke of lichtjes verheven zones van verdikte mucosa met of zonder afwijkingen van het vaatpatroon. Vervolgens wordt lugol jodium op soortgelijke wijze aangebracht, maar hierbij zal het dysplastisch weefsel net niet aankleuren, omdat jodium glycofiel is en het dysplastisch weefsel geen glycogeen meer bevat. Het normaal epitheel van het anaal kanaal dat wel glycogeen bevat, kleurt daarom donkerbruin aan, terwijl het dysplastisch weefsel niet volledig aankleurt en eerder een mosterdkleurig aspect krijgt. Gebieden die kleurverandering vertonen bij azijnzuurkleuring, die vervolgens niet aankleuren met lugol jodium, zijn zeer verdacht voor dysplasie (Figuur 8). De kleuring is niet specifiek voor AIN en/of carcinoom. De anuscopist zal moeten detecteren of er nog andere tekenen zijn van dysplasie, zoals mozaïcisme, condyloma,
13
punctuaties of atypische vaten. Er wordt aangeraden om alle verdachte laesies te biopteren tijdens het HRA-onderzoek. (2, 3, 7, 10-12, 16)
HRA wordt beschouwd als superieur aan standaard anuscopie, zo bleek in studies dat slechts 1/3de van alle laesies die met HRA waren waargenomen, zichtbaar waren tijdens een standaard anuscopisch onderzoek. (16) Daarnaast faciliteert HRA ook de behandeling van AIN, dit wordt in paragraaf 3.5 meer in detail besproken. Hoewel HRA in het algemeen als veilig wordt beschouwd voor de patiënten en niet moeilijk is voor de clinici om uit te voeren, is er toch een aanzienlijke trainingstijd vereist om anale laesies te kunnen herkennen, want deze kunnen soms zeer subtiel zijn. Vanwege het beperkte aantal patiënten met AIN in de algemene populatie en de beperkte beschikbaarheid van een colposcoop, wordt HRA idealiter uitgevoerd in gespecialiseerde centra met ervaren artsen. (2, 3, 16) Fig. 8: Hoge resolutie anuscopie met voorbeelden van anale intra-epitheliale neoplasie. A: witverkleuring van laaggradige AIN na azijnzuur applicatie; B: laaggradige AIN na Lugol Jodium applicatie met mosterdkleuring van het dysplastisch weefsel en bruinkleuring van het glycogeen bevattend normaal epitheel; C: dense witverkleuring van hooggradige AIN na azijnzuur applicatie; D: hooggradige AIN met mogelijks invasie; E: perianale hooggradige AIN na het aanbrengen van azijnzuur; F: hooggradige AIN met mogelijks invasie. (Overgenomen van referentie 16)
3.4.3 HPV-typering
HPV-typering in combinatie met anale cytologie kan een belangrijke screeningstool zijn voor het opsporen van AIN bij de hoog risico populatie. Hetzelfde uitstrijkje kan zowel voor cytologie als voor HPV-typering gebruikt worden. Gezien het succes van HPV-typering bij de screeningprogramma’s voor cervixkanker, verwachtten onderzoekers dat HPV-typering op anale cytologiestalen ook hier de diagnostische sensitiviteit kon verbeteren. Maar tot nu toe zag men nog geen spectaculaire verhoging van de sensitiviteit bij het combineren van anale cytologie met HPV-moleculaire testen. Daarom is HPV-typering nog niet opgenomen in de huidige voorgestelde richtlijnen. Dankzij de HPV-moleculaire testen zou het misschien in de toekomst mogelijk zijn om een besluit te gaan vormen over de screeningsfrequentie en/of de behandeling van AIN op basis van de HPV-type. Op die manier zou men kunnen beslissen om patiënten die drager zijn van bepaalde type(s) HR HPV frequenter te screenen en sneller te behandelen. Daarom wordt het aanbevolen om het gebruik van HPV-typering bij anale dysplasie verder te onderzoeken. (2, 4, 7, 10, 13, 16)14
3.5 Behandeling
Doordat AIN en anale kanker relatief zeldzame aandoeningen zijn en dus een bepaald niveau van expertise vereisen, wordt het aanbevolen om individuen met positieve anale cytologie rechtstreeks te verwijzen naar een gespecialiseerde centra. Aangezien AIN bij sommige patiënten spontaan een regressie kan vertonen en bij andere verder kan evolueren tot anale kanker, zijn expertisecentra het best geplaatst om te bepalen bij welke patiënten een behandeling noodzakelijk is en welke behandelingsmogelijkheden hierbij het best geschikt zijn. (16)
De beste behandeling voor AIN is nog niet vastgesteld. De evolutie van AIN en de progressie tot anale kanker wordt nu wat beter begrepen, waardoor expertisecentra beter kunnen beslissen tussen een conservatieve afwachtende houding of een actieve behandeling. Een actieve behandeling wordt vooral aangeraden bij de hoog risico populatie om de progressie tot anale kanker te vermijden. Aangezien AIN een premaligne aandoening is, is de kennis rond de verschillende behandelingsopties van belang. Hieronder worden topische therapie, lokale therapie en chirurgische excisie besproken. Ook de eventuele rol van een profylactisch HPV-vaccin wordt bediscussieerd. (7, 10, 15, 16)
3.5.1 Topische therapie
Topische therapie is het direct toedienen van een medicatie aan een specifieke laesie of aan het hele anale kanaal. Trichloorazijnzuur (TCA), 5-fluorouracil (5-FU) en imiquimod zijn topicale medicaties die door de patiënt zelf kunnen worden aangebracht aan het letsel. (1, 6, 7, 15, 16) Topische crèmes blijken beter te zijn voor de behandeling van wijdverspreide multifocale laesies bij zeer gemotiveerde patiënten, waarvan artsen veronderstellen dat ze compliant zijn. (10) De duur van de behandeling is vaak lang en vereist een intra-anale toediening door de patiënt zelf gedurende twee of meer dagen per week of soms dagelijks. (10) Bijwerkingen worden gezien bij langdurig gebruik (vaak vanaf week vijf à zeven) en ze kunnen de compliantie verminderen. De meest voorkomende bijwerkingen zijn pijn, bloeding en jeuk. Bij 5-FU kan ook een verhoogde aandrang tot ontlasting voorkomen en bij het gebruik van imiquimod crème kan er soms vermoeidheid opgemerkt worden. (6, 10)
TCA wordt over het algemeen goed getolereerd, kan ook relatief eenvoudig toegepast worden zonder speciale apparatuur en is doeltreffend. Voor de meeste patiënten zijn 12 behandelingsbeurten vereist, indien nodig kan het langduriger toegepast worden. Twee retrospectieve studies toonden een regressie van HSIL naar LSIL of een volledige regressie bij 71-79% van de patiënten. Helaas was er bij een aanzienlijk deel van deze patiënten herval. (16)
In een andere prospectieve studie waarbij 46 patiënten met 5-FU werden behandeld, had 39% van de patiënten een volledige klaring, 17% had een gedeeltelijke klaring en bij 37% was er geen respons. Echter bij 50% van de patiënten met een volledige klaring zag men na 6 maanden opnieuw AIN. (16) Vanwege de lage efficaciteit en de mogelijke bijwerkingen, wordt 5-FU niet meer aanbevolen voor de behandeling van AIN. (7)
Imiquimod stimuleert via T-lymfocyten en monocyten de productie van verschillende interleukinen en cytokinen, waardoor uiteindelijk apoptose tot stand komt. (6) Imiquimod therapie werd geëvalueerd in een dubbelblinde gerandomiseerde gecontroleerde studie. Hierbij was er bij 43% van de patiënten ofwel een volledige klaring ofwel een downgradering van de laesie, 61% van de patiënten die gunstig reageerden op imiquimod hadden gedurende 36
15
maanden een aanhoudende respons, dus geen herval. (16) In een gerandomiseerde prospectieve studie zag men na 12 tot 16 weken behandeling een lagere efficaciteit, namelijk bij 24%. (7) Het probleem van recidief kon dus ook niet hiermee overwonnen worden. (7, 15, 16)
Daarnaast zijn ook eerste gevallen van succesvolle AIN-behandeling met ingenol mebutat gepubliceerd. Het gebruik van het groene thee extract epigallocatechinegallaat is toegelaten voor de plaatselijke behandeling van goedaardige HPV-laesies. Verdere studies hieromtrent zijn uiteraard nog nodig. (7)
Kortom kunnen we aannemen dat topische therapie over het algemeen goed wordt verdragen en een redelijke efficaciteit kent, maar een aanzienlijk deel van de patiënten vertonen geen antwoord of hervallen. Om deze redenen kan topicale therapie het best worden gebruikt als aanvulling bij lokale ablatieve therapie. (6, 16)
3.5.2 Lokale ablatieve therapie
Lokale ablatieve therapieën zoals radiofrequentie-ablatie (RFA) en elektrocauterisatie zijn gerichte destructieve therapieën, die worden toegepast op de anale laesies tijdens een HRA-onderzoek. Hierbij wordt het naburig weefsel niet beschadigd. (1, 6, 7, 10, 16) De eventuele bijwerkingen zijn pijn, bloeding, verlittekening en strictuurvorming, soms dient de behandeling zelfs onder algemene narcose toegepast worden, maar in het algemeen wordt lokale ablatieve therapie wel goed verdragen. (5, 7, 10) Elektrocauterisatie therapie is het meest onderzocht geweest. Een enigszins gunstige reactie met elektrocauterisatie werd gerapporteerd voor HGAIN. Bij 32.5% zag men een volledige klaring, bij 33,7% een partiële regressie van de laesie en bij 33,7% was er geen respons. (16) Herhaalde therapie-interventies kunnen het slaagpercentage verbeteren. Een verhoogd succes werd gezien bij de patiënten die twee tot vier sessies ondergingen in vergelijking met diegene die slechts één sessie hadden gekregen. (7, 16) Er was een recidiefpercentage van 25% na 30 maanden. In een prospectieve vergelijkende studie bij HIV-seropositieve mannen, zag men dat lokale eradicatie van HPV geassocieerde laesies met elektrocauterisatie superieur was aan de topische immunotherapie met imiquimod en aan lokale chemotherapie. In de dagelijkse routine, wordt elektrocauterisatie uitgevoerd als eerstelijnsbehandeling voor condylomata accuminata en AIN. (7)
RFA toegepast op anale mucosa om AIN te behandelen, blijkt veilig te zijn en wordt goed verdragen door de meeste patiënten. Maar de evidentie omtrent de efficaciteit is op dit moment beperkt. Bij een retrospectieve klinische studie bij 74 patiënten met HGAIN zag men na 140 dagen follow-up een volledige of een partiële regressie van de laesie bij 64%. Gelijkaardige resultaten werden aangetoond bij andere studies met een langere termijn follow-up. Helaas zag men dat de laesie terugkeerde bij 91% van de HIV-seropositieve patiënten gedurende een gemiddelde periode van 17 maanden. (16)
3.5.3 Alternatieven
Alternatieve behandelingsmogelijkheden omvatten infrarood coagulatie (IRC), laser ablatie, cryotherapie en fotodynamische therapie. IRC is een goed gekende en veilige therapie, maar het percentage van een persisterende eradicatie is laag. In een onderzoek naar IRC bij HIV-seropositieve individuen, werd verdwijning van AIN waargenomen bij 63%, maar 38% hiervan had een recidief. Een vergelijkbare efficaciteit werd gepubliceerd voor laser ablatie en cryotherapie. Ten slotte werden in retrospectieve studies inferieure resultaten gerapporteerd voor fotodynamische therapie. (7, 29)
16
3.5.4 Chirurgische therapie
Door de opkomst van topische en lokale ablatieve therapieën die hierboven besproken zijn geweest, is chirurgische therapie grotendeels verlaten in het kader van AIN. Het is wel nog steeds een belangrijke therapiemogelijkheid van gelokaliseerd anuscarcinoom. (10, 16) Het voordeel van een chirurgische excisie is de mogelijkheid om het verwijderde weefsel histopathologisch te onderzoeken. (7) Echter gaat dit samen met een significante morbiditeit, aangezien het kan leiden tot complicaties zoals: fecale incontinentie, anale stenose, abcesvorming, anaal spasme of dyschezie. (10, 12) Bovendien is er een recidief percentage van 9%-63%. Aangezien het recidief van AIN vermoedelijk gemedieerd wordt door een voortdurende blootstelling aan predisponerende risicofactoren, namelijk een persisterende HPV-infectie, wordt chirurgische excisie niet aanbevolen als standaardbehandelingsoptie. (16) Daarom zijn niet-chirurgische ablatieve technieken en topische crèmes de eerstelijnsbehandeling. Een lange termijn follow-up wordt aangeraden bij alle patiënten die behandeld worden, ongeacht het type behandeling. (10)
3.5.5 Adjuvant HPV-vaccin
Anderson et al. hebben al reeds kunnen aantonen dat een therapeutische HPV-vaccinatie veilig en immunogeen is bij HIV-seropositieve MSM met een HR HPV-infectie en een abnormale anale cytologie. Zo zagen ze dat het therapeutische vaccin een sterke en blijvende antilichaamrespons induceerde. (8) Het gebruik van een HPV-vaccinatie bij HIV-positieve MSM, na het behandelen van HGAIN, doet het lifetime-risico voor het ontwikkelen van anale kanker met 63% dalen. Bovendien kon er besloten worden dat het gebruik van een HPV-vaccinatie bij deze groep kosteneffectief is. (18) De studies, die de werkzaamheid van een adjuvante HPV-vaccinatie bij HIV-seropositieve MSM met therapieresistentie of een recidiverende HGAIN onderzoeken, zijn nog lopende. (8)
3.5.6 Richtlijnen behandeling
Vooraleer men beslist voor welke behandelingsvorm men zal kiezen, is het belangrijk om de patiënt zeer goed te informeren. Er moet begrepen worden dat er geen genezende behandeling bestaat voor een persisterende HPV-infectie. De behandeling is gericht op de precancereuze laesies om de morbiditeit te verminderen en om de progressie tot maligniteit te voorkomen, terwijl de anale functie bewaard blijft. Patiënten moeten ook ingelicht worden dat de kans op recidief van AIN op een andere locatie groot is, ongeacht de gekozen behandeling. Daarom is bij sommige patiënten een afwachtende houding aanvaardbaar. (10) Zo wordt het aanbevolen om bij asymptomatisch AIN I een afwachtende houding aan te nemen met een halfjaarlijkse controle. Indien symptomen ontstaan zoals anale pijn, anorectale zwelling of bloedverlies, moet er aanvullend onderzoek en behandeling gebeuren. In Amerikaanse studies zagen onderzoekers bij 50% van de HIV-patiënten met AIN I een progressie naar AIN II en AIN III binnen een periode van 2 tot 4 jaar. (12) Bij AIN II en AIN III laesies wordt een meer agressieve aanpak geadviseerd. Hierbij kan men één van de bovenstaande behandelingsvormen toepassen, rekening houdend met de complicaties en de kans op herval. (6, 12, 16) De behandelingsmogelijkheden bij een invasief anuscarcinoom zijn laser ablatie, radiochemotherapie of chirurgische resectie. De huidige consensus rond anale kankerbehandeling is een multimodale therapie waarbij immunotherapie gecombineerd wordt met radio- en chemotherapie. (8)
17 Er bestaan nog geen vaste richtlijnen voor de behandeling van AIN. Hoewel er in het verleden een aantal prospectieve studies gepubliceerd zijn in verband met de behandeling van AIN, zijn er tot nu toe slechts enkele gerandomiseerde studies uitgevoerd. Daarom is de evidentie rond de besproken behandelingsopties onvoldoende en is verdere onderzoek rond AIN-therapie dus noodzakelijk. (7, 16)
3.6 Preventie
Zoals eerder vermeld worden AIN en anale kanker geassocieerd met een persisterende HPV-infectie. Gezien de gelijkenissen met de HPV-geassocieerde baarmoederhalskanker, wordt er gesuggereerd dat een HPV-vaccin ook de incidentie van AIN en anuscarcinoom kan verminderen. Daarom wordt er geadviseerd om kinderen van beide geslachten op de leeftijd van 11 of 12 jaar te vaccineren, zodat de vaccin wordt toegediend vooraleer ze seksueel actief worden. Ook wordt er door de ‘Amerikaans Centrum voor Ziektecontrole en Preventie’ aanbevolen om mannen met verhoogd risico op AIN te vaccineren. Recent zijn nonavalente vaccins ontwikkeld, die bescherming bieden tegen HR HPV-types 6, 11, 16, 18, 31, 33, 45, 52 en 58. (1, 2, 6, 10, 16)
Daarnaast wordt er ook gepleit voor educatieve preventieprogramma's om veilig seks aan te moedigen met als doel de overdracht van HPV en HIV te minimaliseren. Hiermee kunnen deze onafhankelijk geassocieerde en potentieel synergetische virussen, die mogelijks bijdragen tot de carcinogenese, worden geëlimineerd. (1)
Evenzeer worden screeningprogramma's als secundaire preventie aanbevolen bij mensen met een verhoogd risico op AIN en anuscarcinoom. (1-3, 7, 10, 12, 16)
3.7 Conclusie
AIN is een premaligne voorloper letsel van anale kanker. Hoewel het risico op progressie onduidelijk is, is het in studies aangetoond dat dit risico hoger is in bepaalde hoog risicogroepen zoals HIV-seropositieve mannen, vooral degenen met een laag CD4-gehalte; MSM; individuen met verhoogd risico seksueel gedrag; rokers; patiënten met een persisterende HR HPV-infectie en tot slot personen met een voorgeschiedenis van andere HPV-gemedieerde kankers. Het zijn deze hoog risicogroepen, die het meest voordeel zullen halen uit een screeningsprogramma voor AIN. (3, 5-7, 10, 13, 15, 16)
AIN diagnosticeren en een adequate behandeling starten vergt ervaring, daarom is het essentieel om patiënten door te sturen naar een expertisecentrum waar de cytologie en de histologie goed kunnen geïnterpreteerd worden. Het uitvoeren van een HRA en het behandelen van AIN zijn essentieel. (3, 5, 10, 16) De optimale behandelingsmogelijkheden en behandelingsduur zijn nog niet definitief vastgelegd. De richtlijnen zijn eerder gebaseerd op de expertise van deskundigen. Maar ongeacht de behandeling blijft het recidiefpercentage van HGAIN hoog, waardoor het wordt aanbevolen om deze patiënten goed op te volgen. (1, 2, 7, 10, 12, 13, 15, 16)
Samengevat is AIN een klinisch belangrijke laesie die door veel artsen vaak onderschat wordt. Hoewel anale kanker relatief zeldzaam blijft, neemt de incidentie van deze maligniteit steeds meer toe. (1-3, 7, 9, 10, 12, 13, 16) Met de beschikbaarheid van de effectieve HPV-vaccins is het belangrijk dat de clinici op de hoogte zijn van AIN, vooral bij de hoog risicogroepen die mogelijk het meeste baat zullen hebben bij een vaccinatie. (1, 2, 6, 16)
18
4. METHODOLOGIE
4.1 Literatuuronderzoek
Een inleidend wetenschappelijk literatuuronderzoek werd verricht via de online databases Pubmed en Web of Science. Hierbij werd in verschillende combinaties gebruik gemaakt van de volgende zoektermen: ‘HIV’, ‘MSM’, ‘anal cytology’, ‘anal intraepithelial neoplasia screening’, ‘anal pap test’, ‘anal dysplasia’, ‘Anal squamous cell carcinoma’, ‘HPV’, ‘HPV vaccine’, ‘risk factors’ en ‘cost-effectiveness’. Een eerste selectie werd gemaakt door het toepassen van filters voor taal (Engels en Nederlands) en datum van publicatie (vanaf 2010). Na het lezen van het abstract van de resterende artikels werd er opnieuw een selectie gemaakt van de meest relevante artikels. Deze werden hierna gescreend op nuttige referenties (sneeuwbalmethode). En tot slot werden nog een aantal artikels gevonden met behulp van de functie ‘related articles’.
4.2 Studiedesign
Het design van de studie is een retrospectieve cohortstudie. De bedoeling van de studie is het nagaan van de prevalentie en de evolutie van anale dysplasie bij HIV-seropositieve mannen. Hiervoor hebben we de resultaten van het cytologisch onderzoek en het HRA-onderzoek bij deze patiënten geanalyseerd, die verzameld zijn tussen 2010 en 15 november 2019. In de studie werd ook onderzocht welke risicofactoren eventueel kunnen bijdragen tot de vorming van hooggradige dysplasie. Hiervoor hebben we de patiënten een vragenlijst gestuurd (details, zie §4.4.1).
Dit onderzoek is uitgevoerd in overeenstemming met de richtlijnen van ICH/GCP opgesteld in de verklaring van Helsinki en goedgekeurd door het ethisch comité van het Universitair Ziekenhuis Gent met als Belgisch Rijksregisternummer: B670201837370 (bijlage III). Zowel het daarbij horend studieprotocol, de informatie- en toestemmingsformulieren (bijlage IV) als de vragenlijst voor de patiënten (bijlage V) werden voorgelegd ter goedkeuring.
4.3 Studiepopulatie
Aan de dienst pathologie heeft men gevraagd om de namen van de patiënten bij wie anale cytologie is onderzocht, door te geven. Na het krijgen van een namenlijst, heeft men 78 patiënten geselecteerd die in aanmerking kwamen voor deze masterproef. Deelname aan de studie was mogelijk als er aan enkele criteria werd voldaan: een HIV-seropositieve man was geschikt voor deelname, indien hij minstens twee uitstrijkjes heeft gehad. Aan deze patiënten werd een vragenlijst en een informatie- en toestemmingsformulier opgestuurd. 48 patiënten werden geïncludeerd in de studie, na het verkrijgen van informed consent en een ingevulde vragenlijst.
19
4.4 Dataverzameling
4.4.1 Vragenlijst
Door middel van bestaande literatuur en de medewerking van professor De Looze werd een vragenlijst opgesteld met betrekking tot risicofactoren voor HPV-geassocieerde anale dysplasie (bijlage V). Volgende gegevens werden bevraagd:
§ Socio- demografische kenmerken: leeftijd, opleiding.
§ Middelengebruik: rookgedrag, aantal pakjaren, frequentie en hoeveelheid alcohol,
intraveneuze drugs, immunosuppressiva en HIV-medicatie.
§ Gegevens over seksueel (risico)gedrag: seksuele oriëntatie, totaal aantal sekspartners,
aantal sekspartners afgelopen twee jaar, seks met hetzelfde geslacht, passief anale seks, frequentie van condoomgebruik, opgelopen SOA’s buiten HIV en anogenitale wratten. § HPV-gerelateerde kenmerken: maligniteit van de keel- of mondholte, maligniteit van de
slokdarm, maligniteit op de penis en HPV-vaccin.
Elke vragenlijst kreeg een unieke cijfercode zodat de gegevens konden worden gepseudonimiseerd. De patiëntengegevens werden bijgevolg strikt vertrouwelijk verwerkt.
4.4.2 Elektronisch patiëntendossier (EPD)
De overige informatie over de studiepopulatie werd gehaald uit het elektronisch patiëntendossier van het UZ Gent. Men heeft data uit het EPD gehaald van 2010 tot en met 15 november 2019. Volgende gegevens zijn verzameld:
§ Duur van follow-up
§ Resultaten van het cytologisch onderzoek: aantal uitstrijkjes, graad van dysplasie en al
dan niet besmetting met hoog of laag risico HPV.
§ Resultaten van het HRA-onderzoeken: klinisch verdachte letsels zoals ulceraties,
toegenomen vascularisatie, erosieve letsels, verhevenheden, zones die niet aankleuren met lugol jodium, congestieve hemorroïden, condyloma...
§ Gegevens over de HIV-status: datum van diagnose van HIV-seropositiviteit, de virale
lading van HIV en het minimum, maximum en gemiddeld CD4-aantal tijdens de follow-up.
§ Gegevens over anaal problematiek: anale fissuur, anale fistel, SOA’s…
4.5 Dataverwerking en statistische analyse
Met de verzamelde gegevens werd er een database aangemaakt, die geanonimiseerd is overgebracht naar SPSS 25. De resultaten van de cytologie en het al dan niet plaatsvinden van regressie of progressie tussen verschillende visites, is geanalyseerd met behulp van de McNemar test. De relatie tussen de individuele risicofactoren en HSIL ≥ 2 enerzijds en tussen de risicofactoren en HR HPV anderzijds, is geanalyseerd met de ROC-curve. De OR en het 95%-betrouwbaarheidsinterval zijn berekend met de binair logistische regressieanalyse. Men heeft ROC-curve en binair logistische regressieanalyse ook gebruikt om de relatie tussen HSIL en afwijkingen op HRA te onderzoeken. Alle testen waren tweezijdig en als significantieniveau werd
20
5. Resultaten
5.1 Karakteristieken van de studiepopulatie
5.1.2 Socio-demografie
In totaal werden 48 patiënten geïncludeerd in de studie. De gemiddelde leeftijd van de studiepopulatie was 49,7 jaar (Md=51,0; SD=10,8; min=26; max=67). Er was één patiënt die geen diploma secundair onderwijs had. 26 Patiënten hadden als hoogst behaalde diploma het diploma secundair onderwijs. En van de overige 21 patiënten die hoogopgeleid waren, hadden veertien mensen een bachelor en zeven mensen een master diploma.
5.1.3 Middelengebruik
Van de 48 patiënten waren er negen actieve rokers en zeventien ex-rokers. Het gemiddeld aantal pakjaren bij de studiepopulatie was 7,8 jaar (Md=1,5; SD= 10,8; min=0; max=67). Twee patiënten gaven aan dat ze ooit intraveneus drugs hebben gespoten en één patiënt gebruikte immunosuppressiva. 10,4% van de patiënten drinkt geen alcohol. De overige details in verband met middelengebruik kunnen teruggevonden worden in de onderstaande tabel (tabel 3). TABEL 3: Middelengebruik bij de studiepopulatie Variabelen Categorieën N % Roken Roker nee 39 81,3 ja 9 18,8 Niet roker nooit gerookt 22 45,8 ex-roker 17 35,4 Alcohol Frequentie alcohol nooit 5 10,4 maandelijks of minder 6 12,5 2 à 4 keer per maand 12 25 2 à 3 keer per week 17 35,4 4 of meer keer per week 8 16,7 Aantal glazen per keer geen 5 10,6 1 à 2 31 66 3 à 4 11 23,4 ≥ 5 0 0 Intraveneus drugs nee 46 95,8 Ja 2 4,2 Immunosuppressiva nee 47 97,9 Ja 1 2,1
5.1.4 Seksueel (risico)gedrag
Driekwart van de patiënten hebben meer dan 30 sekspartners gehad gedurende hun leven. 46 van de 48 patiënten zijn homo- of biseksueel en geven aan seks te hebben gehad met iemand van hetzelfde geslacht. Ook is er een grote variabiliteit in condoomgebruik, zie tabel 4.
21
79,2% van de studiepopulatie heeft ooit een andere SOA buiten HIV opgelopen. De meest zelf-gerapporteerde SOA bij deze patiënten was condylomata accuminata (62,5%). In de onderstaande tabel (tabel 5) zijn de prevalenties van de verschillende zelf gerapporteerde SOA’s afzonderlijk weergegeven. TABEL 4: Seksualiteit bij de studiepopulatie Variabelen Categorieën N % Seksuele oriëntatie Homoseksueel 43 89,6 Heteroseksueel 2 4,2 Biseksueel 3 6,3 Totaal aantal ≤5 1 2,1 sekspartners 6 à 10 6 12,5 11 à 20 5 10,4 ≥30 36 75 Aantal ≤1 16 33,3 sekspartners 2 à 4 6 12,5 afgelopen 2 jaar ≥5 26 54,2 MSM nee 2 4,2 Ja 46 95,8 Passief anale seks nee 3 6,3 Ja 45 93,8 Condoomgebruik nooit 5 10,4 zelden 12 25 soms 10 20,8 vaak 12 25 altijd 9 18,8 TABEL 5: Zelf gerapporteerde SOA' Variabelen Categorieën N % Andere SOA’s nee 10 20,8 buiten HIV Ja 38 79,2 Chlamydia nee 27 56,3 Ja 21 43,8 Syfilis nee 20 41,7 Ja 28 58,3 Gonorroe nee 29 60,4 Ja 19 39,6 Hepatitis B nee 43 89,6 Ja 5 10,4 Hepatitis C nee 42 87,5 Ja 6 12,5 Schurft nee 45 93,8 Ja 3 6,3
Condylomata nee 18 37,5 accuminata Ja 30 62,5
5.1.5 HPV-gerelateerde kenmerken
43 van de 48 patiënten zijn bij cytologisch onderzoek getest geweest op het al dan niet aanwezig zijn van hoog risico HPV (HR HPV). 36 hiervan waren positief voor HR HPV (83,7%). Bij 33 van de 48 patiënten vonden we geen informatie over laag risico HPV (LR HPV). Van de 15 patiënten waarover we wel informatie hadden, waren er 11 positief voor LR HPV. Wat betreft HPV-gerelateerde maligniteiten, was er geen enkele patiënt met slokdarmkanker en één patiënt had zowel keel- en mondkanker als peniskanker doorgemaakt. Elf patiënten uit de studiepopulatie hebben reeds een therapeutisch nonavalent HPV-vaccin, namelijk Gardasil 9, ontvangen.5.1.6 HIV-status
De gemiddelde duur van HIV-seropositiviteit bij de studiepopulatie was 14,2 jaar (Md= 14; SD=6,7; min=4; max=32). Alle patiënten nemen dagelijks hun cART medicatie en buiten één patiënt hebben ze allemaal een ondetecteerbare virale lading (<50 kopieën/ml). De details over het CD4-aantal per patiënt gedurende de follow-up periode zijn te vinden in tabel 6.
22
TABEL 6: CD4-aantal/mm3 per patiënt Gemiddelde Mediaan SD Minimum Maximum
Minimum CD4-aantal/mm3 per patiënt 626,27 579,00 202,68 326 1170 Maximum CD4-aantal/mm3 per patiënt 800,67 732,50 260,083 378 1470 Gemiddeld CD4-aantal/mm3 per patiënt 713,469 680,00 221,109 378 1305
5.1.7 Anale problematiek
Zoals eerder vermeld zijn condylomata accuminata zeer prevalent bij de studiepopulatie, namelijk 30 van de 48 patiënten geven aan dat ze ooit anogenitale wratten hebben gehad. Dankzij het elektronisch patiëntendossier weten we van 11 patiënten dat ze ooit last hebben gehad van hemorroïden en van 3 patiënten dat ze ooit een anale fistel hadden.
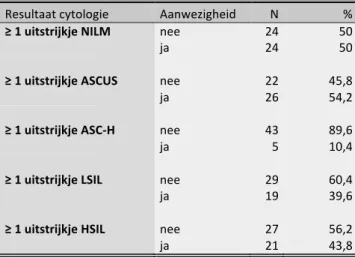
5.2 Cytologisch onderzoek
De gemiddelde duur van follow-up bij de studiepopulatie was 47,1 maanden (Md=44; SD=26,7; min=8; max=140). Er werden in totaal 166 uitstrijkjes afgenomen bij de 48 patiënten die we hebben geïncludeerd in de studie. Hierbij waren er 6 uitstrijkjes met onvoldoende celmateriaal, waardoor ze niet beoordeeld en niet in de analyse geïncludeerd konden worden. Hoewel de inclusiecriteria minstens twee uitstrijkjes vereisten, zijn er hierdoor vijf patiënten met slechts één uitstrijkje. Wegens de reeds kleine studiepopulatie, worden deze patiënten toch behouden. De patiënten hadden gemiddeld 3,4 uitstrijkjes (Md=3; min=1; max=9). In tabel 7 kan men de prevalentie van de resultaten van het cytologisch onderzoek per Bethesda-classificatie terugvinden. Hierbij ziet men dat 43,8% minstens één uitstrijkje met HSIL heeft gehad. De details in verband met het totaal aantal uitstrijkjes per patiënt en het aantal uitstrijkjes per Bethesda-classificatie per patiënt zijn terug te vinden in respectievelijk tabel 8 en tabel 9. TABEL 7: Aanwezigheid ≥ 1 uitstrijkje bij de studiepopulatie Resultaat cytologie Aanwezigheid N % ≥ 1 uitstrijkje NILM nee 24 50 ja 24 50 ≥ 1 uitstrijkje ASCUS nee 22 45,8 ja 26 54,2 ≥ 1 uitstrijkje ASC-H nee 43 89,6 ja 5 10,4 ≥ 1 uitstrijkje LSIL nee 29 60,4 ja 19 39,6 ≥ 1 uitstrijkje HSIL nee 27 56,2 ja 21 43,8 TABEL 8: Aantal uitstrijkjes per patiënt Aantal uitstrijkjes N % 1 5 12,5 2 13 27,1 3 15 31,3 4 6 12,5 5 2 4,2 6 2 4,2 7 3 6,3 9 2 4,2