EEN BIOACTIEF PEPTIDE IN MELK: BETA-
CASOMORFINE 7 EN HAAR EFFECT OP
DARMGEZONDHEID VAN HET KALF
Aantal woorden: 11.394
Sophie Smit
Studentennummer: 01708088
Promotor: Prof. Dr. Filip Van Immerseel
Promotor: Drs. Jill Derix
Onderdeel van de Masterproef voorgelegd voor het behalen van de graad master in de diergeneeskunde Academiejaar: 2019 – 2020
Universiteit Gent, haar werknemers of studenten bieden geen enkele garantie met betrekking tot de juistheid of volledigheid van de gegevens vervat in deze masterproef, noch dat de inhoud van deze masterproef geen inbreuk uitmaakt op of aanleiding kan geven tot inbreuken op de rechten van derden. Universiteit Gent, haar werknemers of studenten aanvaarden geen aansprakelijkheid of verantwoordelijkheid voor enig gebruik dat door iemand anders wordt gemaakt van de inhoud van de masterproef, noch voor enig vertrouwen dat wordt gesteld in een advies of informatie vervat in de masterproef.
PREAMBULE
2020 is het jaar geworden waarin COVID-19 centraal staat. De corona-crisis heeft gelukkig geen impact gehad op het schrijven van mijn masterproef. Aangezien dit een literatuurstudie is, waar geen uitvoerend onderzoek bij hoort, kon ik mijn masterproef tot een goed einde brengen.
VOORWOORD
Ik ben van mening dat het schrijven van een masterproef een zeer relevante en leerzame toevoeging is aan de opleiding Diergeneeskunde. Het zorgt ervoor dat wij, naast de praktische kant van de opleiding, ook de academische wereld beter leren kennen. Het schrijven van mijn masterproef heeft tevens gezorgd voor een uitbreiding aan theoretische kennis en een vooruitgang in academisch schrijven.
Ik wil graag mijn dank betuigen aan iedereen die mij heeft geholpen en/of gesteund tijdens het schrijven van deze literatuurstudie. Allereerst zou ik graag mijn co-promotor Jill Derix bedanken voor haar goede begeleiding. Dankzij de snelle feedback, vele tips en kritische opmerkingen heb ik mijn masterproef tot een goed einde kunnen brengen. Daarnaast wil ik mijn promotor Prof. Dr. Van Immerseel bedanken voor zijn kritische blik en feedback bij het nalezen van deze literatuurstudie. Als laatst wil ik graag mijn ouders en mijn vriendin bedanken voor hun steun, aanmoediging en voor het nalezen van mijn tekst.
INHOUDSOPGAVE
SAMENVATTING ... 6 INLEIDING ... 7 LITERATUURSTUDIE ... 8 1 BIOACTIEVE PEPTIDEN ... 8 1.1 Definitie ... 8 1.2 Ontstaan ... 91.2.1 Hydrolyse tijdens gastrointestinale vertering ... 9
1.2.2 Enzymatische hydrolyse bij synthetische productie ... 10
1.2.3 Hydrolyse door microbiële fermentatie... 10
1.3 De rol van bioactieve peptiden ... 11
1.3.1 Overzicht van alle functies ... 11
1.3.2 Effecten op het gastro-intestinaal stelsel ... 12
1.3.3 Effecten op het zenuwstelsel... 12
1.3.4 Effecten op het cardiovasculair stelsel ... 13
1.3.5 Effecten op het immuunsysteem ... 14
2 BETA-CASOMORFINE 7 ... 15
2.1 Definitie ... 15
2.2 Ontstaan ... 15
2.2.1 Genetische oorsprong: A1 versus A2 melk ... 15
2.2.2 Digestie en absorptie ... 16
2.2.3 A2-melk ... 18
2.3 Effecten ... 18
2.3.1 Neuronaal ... 18
2.3.2 Gastro-intestinaal ... 19
3 DARMGEZONDHEID VAN HET KALF ... 23
3.1 Definitie darmgezondheid... 23
3.2 Factoren die darmgezondheid beïnvloeden ... 23
3.2.1 Normale en stabiele intestinale microbiota ... 24
3.2.2 Effectieve immuunstatus ... 25
3.2.3 Effectieve digestie en absorptie ... 26
3.2.4 Goed welzijn ... 27
DISCUSSIE ... 29
SAMENVATTING
In deze literatuurstudie zal nagegaan worden of beta-casomorfine 7 (BCM7) een effect heeft op de darmgezondheid van het kalf. Zo zal er ingegaan worden op de algemene effecten van bioactieve peptiden, waarna specifieker naar algemene effecten van BCM7 gekeken wordt om vervolgens af te sluiten met de effecten van BCM7 op de darmgezondheid. Om goed te begrijpen wat darmgezondheid inhoudt, wordt dit, voorafgaand aan de effecten van BCM7 op darmgezondheid, besproken. BCM7 is een bekend bioactief peptide en kan hierdoor een biologische functie uitoefenen in het lichaam. Het begint bij de opname van melk waarin beta-caseïnes (melkeiwitten) zitten. Uit deze beta-caseïnes kan, door enzymatische hydrolyse in het gastro-intestinaal stelsel, BCM7 ontstaan. Er is reeds beschreven dat BCM7 betrokken zou zijn bij een aantal humane aandoeningen, zoals diabetes type 1, autisme, schizofrenie, constipatie, apneu en wiegendood. Helaas is er weinig literatuur die de relatie tussen bioactieve peptiden en het effect bij dieren beschrijft. Vanwege de darmproblematiek bij kalveren in de eerste levensweken, is het nuttig om na te gaan of BCM7 hier een rol in speelt. Uit literatuur is gebleken dat BCM7 verschillende effecten heeft op het gastro-intestinaal stelsel. Ten eerste kan BCM7 zorgen voor een vertraagde darmtransit bij ratten. Daarnaast is ook aangetoond dat BCM7 de lymfocytenproliferatie in het lamina propria van het colon kan inhiberen. BCM7 kan tevens een inflammatoire reactie uitlokken door verhoging van ontstekingsmediatoren en infiltratie van leukocyten. Tot slot zijn een verhoogde mucusproductie en een verbetering van de mucosale immuniteit door verhoging van IgA productie en een afname van ontstekingsmediatoren aangetoonde effecten van BCM7. Om te concluderen of dit de darmgezondheid beïnvloedt, worden vijf criteria gebruikt waarvan de darmgezondheid afhankelijk is. Het is hierbij gebleken dat BCM7 een effect op de microbiota, de immuunstatus en het welzijn. Aangezien de beschreven resultaten gebaseerd zijn op in vitro onderzoek met intestinale cellijnen of in vivo onderzoek bij andere diersoorten, kan alleen gesuggereerd worden dat BCM7 de darmgezondheid van kalveren ook kan beïnvloeden.
INLEIDING
De darmgezondheid van zowel koe als kalf wordt tegenwoordig steeds belangrijker. Zo loopt de darmgezondheid van niet-gespeende kalveren het meeste gevaar om aangetast te worden. Deze dieren vormen namelijk de grootste risicogroep op de boerderij voor het oplopen van malfuncties van het gastro-intestinale epitheel, wat gepaard gaat met verteringsproblemen en ziektes (USDA, 2007). Kalverdiarree vormt hierbij één van de grootste gezondheidsproblemen. Dit resulteert in het grootste economische verlies in deze leeftijdsgroep (Torsein et al., 2011). Daarom is dit wereldwijd één van de grootste uitdagingen voor zowel de vlees- als zuivelindustrie (Lorenz et al., 2011). Er zijn manieren nodig om de algemene- en darmgezondheid van het kalf te verbeteren om deze gevoeligheid voor enterische infecties en malfuncties te beperken, met name tijdens de niet-gespeende fase (Malmuthuge, 2017). Omwille van deze darmproblematiek is het interessant om te bekijken of er factoren zijn die de darmgezondheid van het kalf beïnvloeden.
De niet-gespeende kalveren hebben met elkaar gemeen dat ze afhankelijk zijn van een melkdieet. Een melkdieet bestaande uit volle melk of kunstmelk (op basis van magere melkpoeder) bevat melkeiwitten die voor 80% uit caseïnes (-caseïne, -caseïne en -caseïne) en voor 20% uit wei-eiwitten bestaan. Uit sommige van deze melkwei-eiwitten kunnen bioactieve peptiden ontstaan (Korhonen & Pihlanto, 2003a; Givens & Kliem, 2009). De term ‘bio-actief’ houdt in dat ze een invloed kunnen uitoefenen op lichaamsfuncties (Meisel, 1998; Kitts en Weiler, 2003). Een belangrijk bioactief peptide is beta-casomorfine 7 (BCM7). Ze staat voornamelijk bekend om haar functie als opioïde -receptor agonist (Brantl et al., 1981; Brantl et al., 1982; Sun & Cade, 1999). BCM7 ontstaat uit beta-caseïne, maar om vrijgesteld te worden, moeten de melkeiwitten verteerd worden door enzymen van het gastro-intestinaal stelsel. Elastase, pepsine en leucine aminopeptidase zijn verantwoordelijk voor de enzymatische vertering van beta-caseïne (Jinsmaa & Yoshikawa, 1999). De vertering kan reeds beginnen in de maag door de productie van pepsine. Vervolgens kan -caseïne gehydrolyseerd worden in de dunne darm door de pancreasenzymen trypsine en leucine aminopeptidase (Blanco & Blanco, 2017). Het is gebleken dat deze enzymen enkel BCM7 kunnen afsplitsen van beta-caseïne als het aminozuur ‘histidine’ op de 67e plaats van de keten zit (Jinsmaa & Yoskikawa, 1999). De variatie van
het aminozuur op deze plek is afhankelijk van het genotype van de koe die de melk produceert (Kaminski et al., 2007).
Na het ontstaan van BCM7 uit de enzymatische hydrolyse kan ze verschillende kanten op. BCM7 kan lokaal inwerken op de -receptoren van het enterisch zenuwstelsel, afgebroken worden door het brushborder enzym dipeptidyl peptidase 4 (DPP4) (Kreil et al., 1983) of geabsorbeerd worden door het intestinale epitheel en zo in de bloedbaan terecht komen (Umbach et al., 1985; Iwan et al., 2008; Osborne et al., 2014). Er wordt gesuggereerd dat deze absorptie plaatsvindt door transcellulair transport (Ganapathy & Miyauchi, 2005; Iwan et al., 2008). Doordat BCM7 op verschillende plekken kan inwerken, zijn er zeer uiteenlopende effecten beschreven in de huidige literatuur. Er is reeds aangetoond dat BCM7 invloed kan hebben op de gezondheid van onder andere mensen, konijnen, muizen en ratten (Tome et al., 1987; Trompette et al., 2003; Barnett et al., 2014; Ul Haq et al., 2014). Echter, is er nog geen onderzoek uitgevoerd over de invloed van BCM7 op de (darm)gezondheid van het kalf. Naar aanleiding van de eerder beschreven effecten van BCM7 en de toegenomen interesse omtrent darmgezondheid staat in deze literatuurstudie de volgende onderzoeksvraag centraal: ‘Heeft BCM7 een effect op de darmgezondheid van het kalf?’
LITERATUURSTUDIE
1 BIOACTIEVE PEPTIDEN
1.1 Definitie
Bioactieve peptiden worden gedefinieerd als specifieke peptidefragmenten die een impact hebben op lichaamsfuncties (Meisel, 1998; Kitts en Weiler, 2003). Het zijn dus fracties van eiwitten die biologisch actief zijn in het lichaam. Ze spelen daarom een belangrijke rol in de algemene gezondheid van het lichaam.
Deze bioactieve peptiden ontstaan bij de afbraak van eiwitten. Ze kunnen zeer variëren in grootte. Deze grootte varieert van 2 tot 50 aminozuur residuen (Meisel & Fitzgerald, 2003). De voornaamste bron voor het ontstaan van bioactieve peptiden zijn de melkeiwitten (Korhonen & Pihlanto, 2001; Meisel, 2001). Koeienmelk bestaat voor 3,5% uit eiwitten, waarvan 80% caseïnes en 20% wei-eiwitten (Korhonen & Pihlanto, 2003a). Bioactieve peptiden kunnen uit beide melkeiwitten ontstaan (Korhonen & Pihlanto, 2003a). Lactoferrine, Lactoglobuline (IgA) en Lactalbumine in Tabel 1 behoren tot de wei-eiwitten, de overige precursoren behoren tot de caseïnes. Er worden tegenwoordig steeds meer soorten bioactieve peptiden geïdentificeerd die ontstaan bij de vertering van melkproducten of tijdens de verwerking van melkproducten in de zuivelproductie (Meisel, 1998; Korhonen & Pihlanto, 2006; Daliri et al., 2017). Tabel 1 laat zien welke bioactieve peptides wanneer zijn ontdekt en welke bioactieve functie zij uitoefenen.
Tabel 1. Overzicht van de geïdentificeerde bioactieve peptides ontstaan uit melkeiwitten (Naar: Meisel, 1998; Pihlanto-Leppäla, 2000)
Bioactieve peptiden Precursor eiwit Bioactiviteit
Casomorfines -, -Caseïne Opioïde agonist
- Lactorfines -Lactalbumine Opioïde agonist
- Lactorfines -Lactoglobuline Opioïde agonist
Lactoferroxines Lactoferrine Opioïde antagonist
Casoxines -Caseïne Opioïde antagonist
Casokinines -, -Caseïne ACE-inhibitor
Immunopeptiden -, -Caseïne Immunomodulator
Lactoferricine Lactoferrine Anti-microbieel
Casoplatelines -Caseïne, Transferrine Anti-thrombotisch
1.2 Ontstaan
De vrijstelling of activatie van bioactieve peptiden kan op verschillende manieren gebeuren, namelijk in vivo tijdens gastrointestinale vertering of tijdens de verwerking van melk in de zuivelproductie (Silva & Malcata, 2005). Deze productie kan gebeuren via enzymatische hydrolyse door verteringsenzymen, via fermentatie van melk met proteolytische startculturen of via proteolyse door enzymen die afkomstig zijn van micro-organismen of planten (Meisel, 1998; Meisel & Fitzgerald, 2003; Korhonen & Pihlanto, 2006). Deze drie manieren worden verder toegelicht in de volgende paragrafen.
1.2.1 Hydrolyse tijdens gastrointestinale vertering
Het is inmiddels bekend dat bioactieve peptiden uit diverse voedseleiwitten kunnen ontstaan tijdens vertering. Zo ontstaan -casomorfines en caseïnofosfopeptiden (CPPs) tijdens vertering in vivo als gevolg van orale opname van zuivelproducten (Chabance et al., 1998; Ferranti et al., 2004; Meisel & Frister, 1989; Parrot et al., 2003; Svedberg et al., 1985). De voedseleiwitten worden onderworpen aan hydrolyse tijdens de digestie in het gastro-intestinale stelsel (Shimizu, 2004; Vermeirssen et al., 2004). Eerst worden ze gehydrolyseerd door endogene proteinases, zoals pepsine, trypsine en chymotrypsine. Aangezien pepsine wordt geproduceerd door de maag kan de hydrolyse hier al starten. Vervolgens kan de vertering doorgaan in de dunne darm onder de aanwezigheid van trypsine en chymotrypsine, die door de pancreas zijn geproduceerd (Blanco & Blanco, 2017). Deze enzymen zorgen ervoor dat peptiden van verschillende groottes ontstaan (Phelan et al., 2009). Tabel 2 toont aan door welke enzymen een aantal specifieke bioactieve peptiden worden vrijgesteld. Kleinere eiwitten die ontstaan worden vervolgens verteerd door brush border peptidases. Ze worden op de oppervlakte van de intestinale epitheliale cellen afgebroken tot aminozuren. Toch blijven sommige oligopeptiden bestaan (Shimizu, 2004; Phelan et al., 2009). De absorptie kan op verschillende manieren gebeuren. De aminozuren, di- en tripeptiden kunnen geabsorbeerd worden door actief, carrier-gemedieerd, transport. De oligopeptiden kunnen ook door paracellulaire diffusie of door transcytose geabsorbeerd worden (Shimizu, 2004).
Tabel 2. Overzicht van de ontstaanswijze van een aantal bioactieve peptiden (Naar: Maruyama et al.,
1985 (1); Jolles et al., 1986 (2); Chiba et al., 1989 (3); Bellamy et al., 1992 (4); Meisel & Schlimme, 1994 (5); Yamamoto et al., 1994 (6); Yoshikawa et al., 1994 (7); Schlimme & Meisel, 1995 (8); Mullally et al., 1996 (9); Mullally et al., 1997 (10); Miyauchi et al., 1998 (11). Geciteerd vanuit Clare &
Swaisgood, 2000).
Naam bioactief peptide
Klasse bioactief peptide
Vrijstelling door Bioactieve functie Referentie
s1-Casokinine-5 s1-Caseïne Proline
endopeptidase
ACE inhibitor (1)
-Casokinine-7 -Caseïne Trypsine ACE inhibitor (1)
-Casokinine-10 -Caseïne Synthetisch ACE inhibitor/ immunomodulator
(5)
-Lactorfine -Lactalbumine Synthetisch ACE inhibitor/ opioïde agonist
-Lactorfine -Lactoglobuline Trypsine ACE inhibitor (10)
Casoplateline -Caseïne Trypsine en
synthetisch peptide Anti-thrombotisch (2) Caseïnofosfopeptide (CPP) s1-Caseïne, - Caseïne
Trypsine Mineralen binder (8)
-Lactorfine (amide) -Lactoglobuline Synthetisch of trypsine
Opioïde agonist (9)
Casoxine C -Caseïne Trypsine Opioïde agonist (3)
Casoxine D -Caseïne Pepsine-
chymotrypsine
Opioïde agonist (7)
Lactoferroxine A Lactoferrine Pepsine Opioïde agonist (6) Lactoferricine B Lactoferrine Pepsine Immunomodulator/
antimicrobieel
(4,11)
1.2.2 Enzymatische hydrolyse bij synthetische productie
De meest voorkomende manier om bioactieve peptiden te produceren is door middel van enzymatische hydrolyse met behulp van verteringsenzymen. Dit is dus een synthetische manier om bioactieve peptiden te produceren, gebaseerd op de vertering die in het gastro-intestinaal stelsel doorgaat. De enzymen die hiervoor gebruikt worden zijn meestal ook pepsine of trypsine. Trypsine stelt onder andere ACE-inhibitorische peptiden en CPPs vrij (Maruyama & Suzuki, 1982, Meisel & Fitzgerald, 2003). Andere verteringsenzymen en enzymcombinaties waaronder alkalase, chymotrypsine, pancreatine, pepsine en thermolysine en enzymen van bacteriën en schimmels, worden gebruikt om andere bioactieve peptiden te genereren (Kilara & Panyam, 2003; Korhonen & Pihlanto, 2003b).
1.2.3 Hydrolyse door microbiële fermentatie
Er is de afgelopen jaren veel onderzoek gedaan over het ontstaan van bioactieve peptiden bij de verwerking van zuivel. Bij de productie van gefermenteerde zuivelproducten worden namelijk startculturen van bacteriën gebruikt. Een startcultuur bestaat uit een samenstelling van levende micro-organismen die worden gebruikt voor de fermentatie bij de verwerking van voedsel (Bevilacqua et al., 2017). Veel startculturen die gebruikt worden in de zuivelindustrie zijn sterk proteolytisch. Dit betekent dat ze een verscheidenheid aan enzymen bevatten die in staat zijn om eiwitten af te breken tot fragmenten en aminozuren (Korhonen & Pihlanto, 2006).
Lactaat producerende bacteriën (LPB’s) worden bijvoorbeeld gebruikt in een startcultuur bij de verwerking (microbiële fermentatie) van melk. LPB’s zijn bijvoorbeeld Lactococcus lactis, Lactobacillus helveticus en Lactobacillus delbrueckii spp. bulgaricus. Van deze bacteriën is hun proteolytische werking goed gekend (Pihlanto-Leppälä, 2000; Korhonen & Pihlanto, 2006). De bacteriën gebruiken
melkeiwitten, voornamelijk caseïnes, bij de fermentatie als primaire bron voor essentiële aminozuren. De meerderheid van de onderzoeken beschrijven het ontstaan van ACE-inhibitoren of antihypertensieve peptiden tijdens deze microbiële fermentatie. Het is ook aangetoond dat immunomodulatorische, antioxidatieve en antimicrobiele peptiden bij deze fermentatie van melkeiwitten kunnen vrijkomen (Korhonen & Pihlanto, 2006).
1.3 De rol van bioactieve peptiden
De afgelopen tijd is de interesse in bioactieve peptiden gestegen omwille van hun beschreven effecten. Er bestaan dan ook veel publicaties rondom deze verscheidenheid aan hun fysiologische functies. Het blijkt dat, eenmaal geactiveerd, ze fysiologische functies in dieren en mensen kunnen reguleren. Deze functies zijn gerelateerd aan het gezond functioneren van een lichaam, bijvoorbeeld een verminderd risico voor bepaalde chronische ziektes (Korhonen & Pihlanto, 2006).
Bioactieve peptiden oefenen effecten uit op het gastro-intestinaal stelsel (1.3.2), het zenuwstelsel (1.3.3), het cardiovasculair stelsel (1.3.4) en op het immuunsyteem (1.3.5). Om een overzicht te geven van de functies binnen elk stelsel volgt een schema met hierin de functies.
1.3.1 Overzicht van alle functies
Figuur 1. Overzicht van de functies van bioactieve peptiden (Naar: Silva & Malcata, 2005).
Bi
o
ac
tiev
e
p
ept
id
en
Cardiovasculair Antitrombotische peptiden Casoplatelines Antihypertensieve peptiden CasokininesNeuronaal Opioïde peptiden
Exorfines Casoxines Gastro-intestinaal Caseïnofosfopeptiden (CCP) Glycomacropeptiden (GMP) Immuungemedieerd Immunomodulatorische peptiden Beta-casomorfine 7 Casokinine 10
1.3.2 Effecten op het gastro-intestinaal stelsel
Sommige bioactieve peptiden hebben het vermogen om calcium en andere mineralen te binden. Hierdoor kunnen ze fungeren als bio-carriers. De bioactieve peptiden die het vermogen hebben om dit te doen, zijn de caseinofosfopeptiden (CPPs). In tabel 1 staan ze aangeduid als fosfopeptiden. CPPs kunnen ontstaan uit zowel - als -caseïne door vertering met trypsine en pepsine (Schlimme & Meisel, 1995; Ono et al., 1998). Er wordt verondersteld dat CPPs, die een complex vormen met Ca3(PO4)2 in vitro, kunnen leiden tot een verhoogde calciumabsorptie in het distale ileum door het
alkalisch milieu dat daar voorkomt. Deze veronderstelling is bevestigd door onderzoek van Meisel et al. (2003) waarbij aanwezigheid van CPP is aangetoond in de inhoud van het ileum bij mensen. De inhoud van het ileum is onderzocht na het uitvoeren van een ileostomie na de inname van melk. Een ander onderzoek heeft aangetoond dat CPPs uit zuigelingenvoeding vrijgesteld konden worden door het nabootsen van de gastro-intestinale vertering (Miquel et al., 2006). De CPPs zijn verkregen door hydrolyse waarbij pepsine en pancreatine zijn gebruikt. De CPPs overleefden de verdere hydrolyse door de twee enzymen. Dit suggereert dat deze CPPs gedeeltelijk resistent zijn aan proteolyse, waardoor ze verder kunnen passeren in het gastro-intestinaal stelsel. Dit zou de aanwezigheid van CPPs in het ileum tevens verklaren. Hierdoor kunnen ze hun functie als bio-carrier uitvoeren (Miquel et al., 2006).
Aangezien CPPs mineralen kunnen binden, hebben ze een voordelige rol in de preventie van osteoporose, dentale cariës en hypertensie. CPPs kunnen binden aan zowel macro-elementen, zoals calcium, magnesium en ijzer als aan oligo-elementen, zoals zink, barium, chroom, nikkel, cobalt en selenium (Meisel, 1998; Silva & Malcata, 2005). Ze hebben tevens een voordelige rol in de preventie van anemie. IJzer is essentieel voor rode bloedcellen. Doordat CPPs ijzer kunnen binden, wordt ijzer beter geabsorbeerd. CPPs worden daarom ook wel gebruikt bij behandeling van ijzerdeficiëntie. Hieruit zou geconcludeerd kunnen worden dat de consumptie van caseïne houdende producten indirect leiden tot een betere ijzerabsorptie.
Ten slotte is aangetoond dat CPPs, buiten de rol als bio-carrier, ook een cytomodulatorische functie kunnen benutten. Dit betekent dat ze cellen kunnen veranderen (Meisel & Fitzgerald, 2003). Het blijkt dat CPPs apoptose kunnen induceren van HT-29 cellen en Caco-2 cellen. Dit zijn humane colon adenocarcinoma cellijnen die worden gebruikt in onderzoek van colorectale kanker (Perego et al., 2013). Het hebben van deze eigenschap (apoptose van tumorcellen) kan veel potentie hebben in de oncologische geneeskunde. Het is daarom ook interessant om meer onderzoek te doen, onder andere experimentele omstandigheden, om te ontdekken wat CPPs te bieden hebben als mogelijk anti-kanker middel (Perego et al., 2013).
1.3.3 Effecten op het zenuwstelsel
Er zijn de afgelopen jaren veel onderzoeken uitgevoerd die de rol van bioactieve peptiden in het zenuwstelsel beschrijven. Dit gaat vooral over liganden voor opioïde receptoren uitgaande van caseïnes, oftewel exogene opioïde peptiden. De belangrijkste en eerste opioïde peptiden die ontdekt zijn, zijn de beta-casomorfines. Beta-casomorfine is een afbraakproduct van caseïne (Brantl et al., 1979; Brantl et al., 1981; Brantl et al., 1982). Opioïde peptiden kunnen in vitro uit melk vrijgesteld worden door proteolyse van -, - en -caseïnes (Pihlanto-Leppälä et al., 1994).
Beta-casomorfines en hun precursoren zijn reeds gedetecteerd in het plasma van pasgeboren kalveren, in het plasma van puppy’s en in het duodenaal mesenchym en in de dunne darm van mensen (Singh et al., 1989; Meisel, 1998; Fitzgerald & Meisel, 2000; Meisel & Fitzgerald, 2003). Opioïde
caseïne-afkomstige peptiden zijn tot op heden nog niet gedetecteerd in plasma van volwassen zoogdieren. Op basis hiervan wordt er gesuggereerd dat enkel de neonatale darmwand permeabel is voor de passage van casomorfines aangezien de permeabiliteit hoger is bij neonaten dan bij volwassen zoogdieren (Thomson & Keelan, 1986; Korhonen & Pihlanto, 2006). Hoewel beta-casomorfines bekend staan om hun resistentie tegen de afbraak door proteolytische enzymen, worden ze toch snel geïnactiveerd door het brush border-enzym ‘dipeptidyl-peptidase 4’ (DPP4) bij hun passage richting de bloedbaan. Dit zorgt ervoor dat de plasmaconcentratie van beta-casomorfine snel afneemt (Kreil et al., 1983).
Er bestaan drie soorten opioïde receptoren, namelijk het μ-, - en -type. Ze liggen wijdverspreid in zowel het centrale zenuwstelsel als in de intestinale tractus. Ze interageren tevens met zowel endogene als exogene liganden (Mansour & Watson, 1993). De lichaamseigen (endogene) opioïde peptiden zijn de enkefalines, endorfines en dynorfines. Zij zijn afgeleid van de precursormoleculen pro-opiomelanocortine, pro-enkefaline en pro-dynorfine die allemaal eindigen op dezelfde aminozuursequentie bij het N-uiteinde: Tyr-Gly-Gly-Phe. De exogene opioïde peptiden hebben ofwel een agonistische (exorfines) ofwel een antagonistische werking (casoxines). Zij worden getypeerd door verschillende aminozuursequenties. Wat de endogene en exogene opioïde peptiden met elkaar gemeen hebben is dat ze beide eindigen op een Tyr-residu aan het N-uiteinde in combinatie met de aanwezigheid van een ander aromatisch residu op de 3e of 4e positie. Door deze eigenschap passen
beide opioïde peptiden op de bindingsplaats van de opioïde receptoren. Dit verklaart het gelijkaardig effect van de endogene en exogene opioïde peptiden (Meisel, 1998; Silva & Malcata, 2005). Als morfine, enkefalines of endorfines binden aan een opioïde receptor openen kaliumkanalen waardoor de membraanpotentiaal wordt verhoogd tot dat het kaliumevenwicht bereikt wordt op -90 mV. Dit zorgt ervoor dat er geen actiepotentialen kunnen ontstaan die nodig zijn om neurotransmitters vrij te stellen in de synapsen, neuromusculaire overgangen en in de neuro-epitheliale overgangen. Op deze manier onderdrukken opioïde peptiden de neuronale prikkelbaarheid (Wood & Galligan, 2004). Exorfines vertonen farmacologische eigenschappen die vergelijkbaar zijn met die van morfine. Tevens induceren ze apneu en onregelmatige ademhaling, moduleren ze slaappatronen en intestinale motiliteit en stimuleren ze insuline- en somatostatine vrijstelling, intestinale absorptie van elektrolyten en water en stimuleren ze de voedselopname. De werking van opioïde peptiden komt in het volgende hoofdstuk uitgebreider aan bod.
1.3.4 Effecten op het cardiovasculair stelsel
Één van de effecten op het cardiovasculair stelsel is de antitrombotische functie. Casoplateline is een voorbeeld van een bioactief peptide dat een anti-trombotische functie uitoefent. De peptide ontstaat uit -caseïne bij coagulatie door rennine in de maag. Rennine is een melkstremmend enzym dat voorkomt in de maagsecreten (Fiat et al., 1993). De werking van casoplateline bestaat uit het inhiberen van zowel de aggregaat vorming van bloedplaatjes als de binding van fibrinogeen aan receptoren op het oppervlak van bloedplaatjes. Hierdoor wordt de vorming van aggregaten en dus de bloedstolling geïnhibeerd.
Een tweede effect op het cardiovasculair stelsel is de antihypertensieve functie. De bloeddruk wordt geregeld door het renine-angiotensine systeem. In deze cascade wordt angiotensine I omgezet tot angiotensine II door ACE (angiotensin converting enzyme) (Reid et al., 1978). Inhibitie van ACE resulteert in een antihypertensief effect (Korhonen & Pihlanto, 2006). Bioactieve peptiden kunnen fungeren als ACE-inhibitoren. Zij remmen de werking van ACE waardoor deze cascade niet doorgaat
en zo een hoge bloeddruk vermeden wordt. ACE-inhibitoren kunnen ontstaan uit zowel wei-eiwitten als uit caseïne. De ACE-inhibitoren die ontstaan uit wei-eiwitten zijn de lactokinines. Degene die ontstaan uit caseïne zijn de casokinines (Meisel & Schlimme; 1994; Fitzgerald & Meisel, 2000).
1.3.5 Effecten op het immuunsysteem
Immunopeptiden zijn bioactieve peptiden die verschillende aspecten van het immuunsysteem kunnen beïnvloeden. Er zijn verschillende effecten van deze immunopeptiden beschreven. Ze kunnen de functie van immuuncellen versterken. Onder deze functies vallen de proliferatie van lymfocyten, de aanmaak van antistoffen en cytokine productie (Gill et al., 2000). Kayser en Meisel (1996) hebben aangetoond dat de immunoreactiviteit van humane perifere bloed lymfocyten (PBLs) gestimuleerd of onderdrukt kon worden afhankelijk van de concentratie aan bioactieve peptiden. Het ging hier specifiek om BCM7 en casokinine-10. In hoge concentraties hadden ze een stimulerend effect op de proliferatie van PBLs en in lage concentraties een onderdrukkend effect op de proliferatie van PBLs. Tevens schijnt BCM7 een onderdrukkend effect te hebben op de proliferatie van (humane) lymfocyten die zich bevinden in de lamina propria van het colon. Dit effect wordt opgeheven door de opioïde antagonist naloxone (Elitsur & Luk, 1991). Tevens is gebleken dat caseïne-hydrolyseproducten een Th1-cel respons kunnen opwekken door het versterken van ConA-geïnduceerde IL-2 productie (Phelan et al., 2009). Bovendien hebben Kawahara en Otani (2004) het effect van CPP’s-III, een commercieel beschikbaar caseïnofosfopeptide, op de mRNA expressie van cytokines in Caco-2 cellen onderzocht. Hieruit is gebleken dat deze caseïnofosfopeptiden de mRNA expressie van IL-6 en TNF- versterken (Kawahara & Otani, 2004). Dit zijn voorbeelden van beschreven effecten van immunopeptiden. Een andere functie van bioactieve peptiden is het vertonen van antimicrobiële activiteit. De lactoferricines, afkomstig van het wei-eiwit lactoferrine, zijn hierbij het meest bestudeerd (Kitts & Weiler, 2003; Korhonen & Pihlanto, 2006). Lactoferricine vertoont antimicrobiële activiteit tegen diverse gram-positieve en gram-negatieve bacteriën, namelijk Escherichia, Helicobacter, Listeria, Salmonella en Staphylococcus, gisten en schimmels. Het blijkt dat deze antibacteriële activiteit start met een elektrostatische interactie met de negatief-geladen membranen van de bacteriën (Bellamy et al., 1993). In deze interactie blijken LPS (onderdeel van de celwand van gram-negatieve bacteriën) en teichoïnezuur (onderdeel van de celwand van gram-positieve bacteriën) de bindingsplaatsen te zijn. In een recenter onderzoek is aangetoond dat de bacteriële eiwitsynthese geremd wordt wanneer lactoferricine het cytoplasma bereikt en dat dit een bacteriostatisch effect heeft (Korhonen & Pihlanto, 2006). Hoe dit precies werkt, is onbekend (Ulvatne et al., 2004).
Habing et al. (2017) hebben het (antimicrobiële) effect van lactoferrine bij ongespeende kalveren met diarree onderzocht. Kalveren werden betrokken bij het onderzoek als ze zijn gediagnosticeerd met diarree (via een scoresysteem). Dit onderzoek was een gerandomiseerde klinische studie, wat wil zeggen dat kalveren ad random zijn geselecteerd voor de lactoferrine of controlegroep. De mortaliteit in de kalvergroep die lactoferrine kreeg was significant lager dan de controlegroep (P<0,05), namelijk 9,1% (18/198) kalversterfte in de controlegroep tegenover 1,6% (3/185) kalversterfte in de lactoferrine groep. Hieruit is dus gebleken dat Lactoferrine een significant reducerend effect had op de mortaliteit bij kalveren gediagnosticeerd met diarree. Bijkomende onderzoeken die dezelfde resultaten behalen, kunnen nuttig zijn voor de toekomst als mogelijke tool om het antibiotica gebruik te verminderen (Habing et al., 2017).
2 BETA-CASOMORFINE 7
2.1 Definitie
Zoals reeds besproken zijn caseïnes eiwitten die voorkomen in de melk. Er bestaan verschillende soorten caseïnes: -caseïne, -caseïne en -caseïne (Givens & Kliem, 2009). Uit beta-caseïne kan vervolgens casomorfine 7 ontstaan. Dit is het gevolg van de enzymatische vertering van beta-caseïne door elastase, pepsine en leucine aminopeptidase in het gastro-intestinaal stelsel (Jinsmaa & Yoshikawa, 1999). Beta-casomorfine 7 is een specifiek bioactief peptide die behoort tot de groep beta-casomorfines. De sequentie van BCM7 is als volgt: Tyr-Pro-Phe-Pro-Gly-Pro-Ile (7 aminozuren), ook wel f60-66 (Asledottir et al., 2018). Om het belang van BCM7 uit te leggen, is het nodig om eerst zijn ontstaan en functies te beschrijven.
2.2 Ontstaan
2.2.1 Genetische oorsprong: A1 versus A2 melk
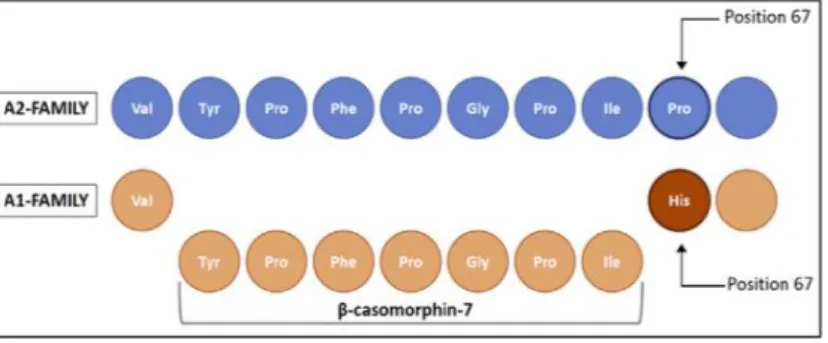
Er is aangetoond dat de vrijstelling van BCM7 uit beta-caseïne wordt bepaald door de aminozuursamenstelling van beta-caseïne (Jinsmaa & Yoshikawa, 1999). Het blijkt dat het aminozuur op positie 67 kan verschillen per ras, oftewel: er is sprake van genetisch polymorfisme. Voor beta- caseïne bestaan er 13 genetische varianten: A1, A2, A3, B, C, D, E, F, H1, H2, I, G en A4 (Kaminski et al., 2007). De varianten A1 en A2 komen het meest voor onder de populaire melkveerassen, zoals Holstein-Friesian. Variant B komt daarentegen minder voor en G en A4 zijn zeldzaam (Farell et al., 2004). Bij A1 beta-caseïne bevindt het aminozuur ‘histidine’ zich op 67e plaats in de keten, terwijl dit bij
beta-caseïne A2 het aminozuur ‘proline’ is (Jinsmaa & Yoskikawa, 1999). Het codon dat staat voor proline op de 67e plek van de A2 variant van het beta- caseïne gen (CSN2) is CCT, terwijl het codon dat staat
voor histidine op de 67e plek bij de A1 variant CAT is (Groves, 1969; Roginski et al., 2002). Het gen voor
beta-caseïne ligt op chromosoom 6 van het rundergenoom (Sahin et al., 2018a). Hieruit kan geconcludeerd worden dat runderen met het A1A1 genotype ‘A1 melk’ produceren, oftewel melk waarbij enkel beta-caseïne voorkomt met histidine op plaats 67. Runderen met het A2A2 genotype produceren ‘A2 melk’. In A2 melk komt enkel beta-caseïne voor waarbij proline zich op plaats 67 bevindt. Runderen met het A1A2 genotype produceren zowel A1 als A2 melk. Dat betekent dat hierin zowel beta-caseïne met histidine als beta-caseïne met proline voorkomt. Dit is te wijten aan het optreden van codominantie bij de A1A2 genotypes (Sahin et al., 2018a). Figuur 2 laat zien wat het verschil is tussen beta-caseïne van de A2- en de A1 genotypes en hoe BCM7 hieruit ontstaat.
Figuur 2. Aminozuursequentie van bovine beta-caseïne in de regio waar de vrijstelling van BCM7 plaatsvindt (Uit: Asledottir et al., 2018).
Originele koemelk is A2 melk, dus van het A2A2 genotype. Sahin et al. (2018a) suggereren dat een puntmutatie in het codon voor proline (CCT) verantwoordelijk is voor de substitutie door histidine (CAT). Op deze manier zou A1 melk zijn ontstaan. De frequentie van A1 beta- caseïne is veel hoger bij zwart-witte koeien dan bij andere kleuren rassen. Toch blijkt dat al een behoorlijk deel van de zwartbonte populatie (in België en Nederland) het A2A2 genotype heeft. De Cooperatie Rundveeverbetering (CRV) heeft ongeveer 100.000 koeien met een merkertest onderzocht. Hieruit is gebleken dat 41% in de zwartbontpopulatie A2A2 is (Stienezen, 2016). De A1 variant komt niet voor onder de pure Aziatische- en Afrikaanse rassen (Ng-Kwai-Hang & Grosclaude, 2003), maar komt wel veel voor bij Noord-Europese melkrassen, zoals Friesian, Ayshire, British Shorthorn en Holstein. A2 beta-caseïne komt voornamelijk voor bij Zebu runderen van Afrikaanse origine, Zuid-Franse rassen, zoals Charolais en Limousin, maar ook bij Channel Island rassen, zoals Guernsey en Jersey (Truswell, 2005; Mishra et al., 2009).
2.2.2 Digestie en absorptie
BCM7 wordt, zoals eerder benoemd, vrijgesteld uit beta-caseïne door de pancreasenzymen elastase, pepsine en leucine aminopeptidase (Jinsmaa & Yoshikawa, 1999). Elastase zorgt voor de afsplitsing tussen aminozuur 66 en 67, oftewel het carboxyl-uiteinde. Bijkomend zorgen pepsine en leucine aminopeptidase voor de afsplitsing aan de andere kant van het eiwitfragment, oftewel het amino- uiteinde (Jinsmaa & Yoshikawa, 1999; De Noni & Cattaneo, 2010). Het vervangen van histidine door proline heeft als gevolg dat het eiwitfragment niet meer afgesplitst kan worden tussen plek 66 en 67. Met dit gegeven zou in de toekomst bijvoorbeeld geselecteerd kunnen worden op bepaalde genotypes. Daarentegen is de vrijstelling van BCM7 niet volledig afhankelijk van de genetische varianten met histidine op de 67e positie. Asledottir et al. (2017) hebben namelijk aangetoond dat
BCM7 vrijkomt uit zowel de (homozygote) A1-variant als uit de A2-variant na ex vivo gastro-intestinale digestie. Echter de concentraties BCM7 zijn hoger bij de A1A1 variant. Hoe dit mogelijk is, is vooralsnog onbekend (Asledottir et al., 2017).
Na de digestie van beta-caseïne volgen de degradatie en absorptie van BCM7. Beta-casomorfines zijn rijk aan proline, waardoor ze resistent zijn aan veel proteolytische enzymen. Dit maakt het lastiger om ze af te breken. Het is bekend dat BCM7 kan worden afgebroken door het brush border enzym ‘dipeptidyl peptidase 4’ (DPP4) (Kreil et al., 1983). DPP4 is aanwezig in intestinale mucosa, meconium (Caporale et al., 1985), plasma (Kreil et al., 1983; Koch et al., 1988) en andere weefsels, zoals placenta, exocriene klieren en de nieren (Caporale et al., 1985). Dit betekent dat, als BCM7 in zijn geheel door de darmwand geabsorbeerd wordt, BCM7 nog steeds afgebroken kan worden op andere locaties in het lichaam. De absorptie van BCM7 doorheen het intestinale epitheel is reeds bevestigd door verschillende in vivo en in vitro onderzoeken. Umbach et al. (1985) hebben irBCM7 (vermoedelijk een precursor van BCM7) in het plasma van pas geboren kalveren teruggevonden na opname van koeienmelk. Er wordt gespeculeerd dat de intestinale mucosa van neonaten meer permeabel is voor BCM7 en grotere peptiden vanwege hun immature tight junctions. Hierdoor zouden ze ontsnappen aan de hydrolyse (Singh et al., 1989). Tight junctions vormen de verbinding tussen de membranen van de epitheliale cellen (Balda & Matter, 1998). Deze situatie zou ook kunnen optreden in het geval van een ‘leaky gut’. Leaky gut is een dysfunctie van de darmbarrière waarbij veranderingen in de intestinale permeabiliteit optreden. Dit komt voor bij alle species en kan ontstaan door verschillende oorzaken. Onder deze oorzaken vallen stress, ischemie (door een letsel) van de darmen, pathogenen die de darmbarrière aantasten, inflammatie en microbiota, dieet en gastro-intestinale gezondheid. Bij het ontstaan van een leaky gut wordt de darmbarrière meer permeabel voor veel substanties, waarbij ook
pathogenen en toxines plots in de bloedbaan terecht kunnen komen (Stewart et al., 2017). Het is dus belangrijk om rekening te houden met de intestinale permeabiliteit bij de distributie van BCM7. IrBCM7 is tevens gedetecteerd in de dunne darm van volwassen mensen na opname van koeienmelk. De absorptie van deze peptiden vanuit de dunne darm is echter tot op heden niet waargenomen bij volwassenen (Svedberg et al., 1985; Korhonen & Pihlanto, 2006). Dit zou betekenen dat BCM7 enkel een lokaal effect (gastro-intestinaal) en geen systemisch effect kan uitoefenen bij mensen. Hier staat tegenover dat er caseïne-afkomstige peptiden zijn ontdekt in urine (Koch et al., 1988; Reichelt et al., 1990; Cade et al., 2000) en bloed (Lindström et al., 1984; Lindström et al., 1990; Reichelt et al., 1990) van patiënten met schizofrenie, autisme en postpartum psychoses. Er moet dus toch rekening gehouden worden met de mogelijkheid dat opioïde bioactieve peptiden de darmwand bij volwassenen kunnen passeren. Als ze toch in de bloedbaan terecht komen, kunnen ze elders in het lichaam hun opioïde effect uitoefenen, mits ze niet worden afgebroken door DPP4. Op deze manier zouden ze effectief een rol kunnen spelen in de hiervoor genoemde aandoeningen.
Iwan et al. (2008) hebben in vitro onderzoek gedaan naar het transport van BCM5 en BCM7 door de intestinale wand. Hierbij hebben ze een cellijn gebruikt die afkomstig is van humane colorectale adenocarcinoma’s (CaCo2-cellen). Ze hebben geconcludeerd dat de BCMs (vermoedelijk via de transcellulaire route) door de intestinale wand zijn getransporteerd, ook in de aanwezigheid van DPP4. Desondanks was de concentratie geabsorbeerde BCMs aan de basolaterale zijde twee keer zo hoog na het toevoegen van een DPP4-inhibitor (Iwan et al., 2008). DPP4 speelt dus een belangrijke rol in het beperken van transport doorheen het intestinale epitheel. Osborne et al. (2014) hebben eenzelfde in vitro onderzoek uitgevoerd met een CaCo2-model om het transport van BCM7 en zijn metabolieten te bestuderen. Er is een snelle hydrolyse vastgesteld van BCM7 aan de apicale zijde waarbij tevens drie metabolieten ontstonden: YP, GPI en FPGPI. Deze metabolieten zijn met een hogere transportsnelheid gedetecteerd aan de basolaterale zijde dan BCM7. Deze resultaten suggereren dat de aanwezigheid van BCM7 aan de basolaterale zijde vooral wordt bepaald door het al dan niet optreden van hydrolyse dan door gelimiteerde transportroutes. Dit zou een mogelijke verklaring zijn voor het niet voorkomen van BCM7 in het bloed volwassenen (Osborne et al., 2014). Tevens hebben Jarmolowska et al. (2013), via in vitro onderzoek met Caco2-cellen, ook bevestigd dat de activiteit van DPP4 de belangrijkste factor is die de biologische beschikbaarheid van BCM7 reguleert. Aangezien dit nu meermaals is bevestigd, is dit gegeven wellicht interessant voor mogelijk gebruik in de toekomst om de concentratie BCM7 die ontstaat uit melk te reduceren.
Zoals eerder vermeld in H1.2.1. kunnen oligopeptiden (peptiden met 10 of minder aminozuren) via de paracellulaire of via de transcellulaire route getransporteerd worden (Shimizu, 2004; Ganapathy & Miyauchi, 2005). Er wordt gesuggereerd dat het transport van BCM via de transcellulaire route verloopt wegens hun hoge hydrofobiciteit (door de aanwezigheid van twee proline moleculen) en hun specifieke -turn structuur (Ganapathy & Miyauchi, 2005; Iwan et al., 2008). De paracellulaire route, die verloopt via tight-junctions in de intercellulaire ruimte, is vooral voor hydrofiele deeltjes (Anderson, 2001). Deze route mag echter niet uitgesloten worden als mogelijke transportroute voor BCMs (Iwan et al., 2008). Teven is gebleken dat de efficiëntie van het transport van BCM7 wordt beïnvloed door zowel glucose als calcium (Jarmolowska et al., 2013). Het is bekend dat ze beiden het paracellulaire transport beïnvloeden door het verhogen van de permeabiliteit van intestinale tight-junctions waardoor de paracellulaire route toegankelijker wordt (Turner et al., 1997; Brown & Davis, 2002; Jarmolowska et al., 2013). Hierdoor wordt er meer BCM7 getransporteerd als er glucose en calcium
aanwezig is. Ook dit zijn eventuele aangrijpingspunten voor mogelijke reductie van de concentratie BCM7 in de darm.
2.2.3 A2-melk
Omdat BCM7 in veel lagere concentraties voorkomt bij A2 melk is de interesse in A2 melk toegenomen. In Australië en Nieuw- Zeeland is dit meer bekend. De A2 melk heeft zelfs in Australië al een marktaandeel van 10%. Sinds de zomer van 2016 ligt er A2-melk in een aantal winkels in Nederland, uitgebracht voor Veco Zuivel BV (Mons, 2016; Stienezen, 2016). De toegenomen interesse is ontstaan doordat er wordt verondersteld dat A2-melk gezonder is dan A1 melk. Aangezien er weinig bekend is over de directe betrokkenheid van BCM7 in multifactoriële ziektes is het twijfelachtig of deze interesse terecht is.
2.3 Effecten
2.3.1 Neuronaal
Het is reeds bekend dat BCM7 een rol heeft als een agonist van de opiaatreceptor, voornamelijk via μ-type opiaatreceptoren (Brantl et al., 1981; Brantl et al., 1982; Sun & Cade, 1999). Dit betekent dat BCM7 de functie van een opiaat kan nabootsen. Opioïde eiwitten zijn aanwezig in het centrale zenuwstelsel en voeren effect uit op het neuro-endocriene systeem (Grossman, 1983). Deze eiwitten binden op opiaatreceptoren met een hoge affiniteit, waardoor ze een morfine-achtig effect kunnen genereren. Morfine, codeïne, fentanyl, heroïne en methadon zijn volle agonisten en behoren tot de meest bekende agonisten van de μ-receptoren (Fudin, 2018). Binding op een opioïde receptor zorgt ervoor dat er geen actiepotentialen ontstaan. Hierdoor worden er geen neurotransmitters vrijgesteld worden en gaat de betreffende actie niet door. Dit is het achterliggende mechanisme voor de beschreven effecten van opiaten (Wood & Galligan, 2004). De opioïde receptoren liggen onder andere wijdverspreid in de hersenen, ruggenmerg en in perifere- en autonome zenuwen (Mansour & Watson, 1993). Binnen het centrale zenuwstelsel zijn deze receptoren betrokken bij verschillende acties waaronder: analgesie, sedatie, euforie, dysforie, eetlust en eetgedrag, depressie van het ademhalingsstelsel, hoestreflex, misselijkheid en braken, en pupilconstrictie. Andere fysiologische functies die geregeld worden door de μ-receptoren zijn o.a. cardiovasculaire functies, gastro-intestinale motiliteit, emotionele status, thermoregulatie, hormoon secretie en immune functies (Chang & Cuatrecasas, 1979). De beschreven effecten van μ-agonisten voor deze functies zijn: bradycardie en hypotensie, vertraagde gastro-intestinale motiliteit, hypothermie en inhibitie van het gonadotropine-releasing hormoon en corticotropine-releasing hormoon (Waldman, 2007; Aarnes & Muir, 2011).
Een mogelijk neuronaal effect van BCM7 wordt beschreven in het voorkomen van apnee in ‘Sudden Infant Death Syndrome’ (SIDS). SIDS omvat het plots overlijden van een baby die gezond lijkt en die jonger is dan 1 jaar oud. De oorzaak van SIDS bevat onder andere maternale factoren, zoals slechte voedingstoestand, roken tijdens zwangerschap en verslaving van narcotica. Andere factoren zijn zwangerschap van meerlingen, vroeggeboorte en genetische aspecten. Deze baby’s hebben met elkaar gemeen dat ze allemaal afhankelijk zijn van een melkdieet. Door het immature centrale zenuwstelsel van neonaten kunnen BCMs na absorptie uit de darmen, gemakkelijk de bloed-hersen-barrière (BHB) passeren om een opioïde effect uit te oefenen. Het is aangetoond dat BCM7 de BHB kan passeren, maar het mechanisme hiervan is nog onbekend (Sun et al., 2003). Zoals benoemd, zijn er μ-receptoren aanwezig in de hersenen en zijn deze betrokken bij het onderdrukken van het ademhalingsstelsel (Chang & Cuatrecasas, 1979). Aangezien BCM7 op de μ-receptor kan binden en activeren, kan er apneu
ontstaan als gevolg van het onderdrukken van het ademhalingsstelsel. Dit kan vervolgens resulteren in plotse sterfte. Hierdoor is BCM7 een mogelijke risicofactor voor SIDS (Sun et al., 2003).
Daarnaast is gebleken dat BCM7 een invloed heeft op de productie van mucus in het gastro-intestinale stelsel en op de gastro-intestinale transittijd. Ook deze effecten worden bewerkstelligd door stimulatie van de opioïde receptoren. In dit geval betreft het de opioïde receptoren van het enterisch zenuwstelsel. Aangezien het (neuronaal) effect wordt uitgeoefend op het gastro-intestinaal stelsel wordt dit in H2.3.2. uitgebreider besproken.
2.3.2 Gastro-intestinaal
2.3.2.1 MucusproductieOm de invloed van BCM7 op de mucusproductie te verklaren, moet de rol van mucus eerst besproken worden. De mucuslaag bestaat uit mucines, de bouwstenen van mucus. Dit zijn geglycosyleerde eiwitten die geproduceerd worden door de slijmbekercellen in het intestinale epitheel. Het voornaamst geproduceerde mucine is MUC2 (Johansson et al., 2013). In de dunne darm is de mucus doorlaatbaar voor bacterien. In de dikke darm bestaat de mucuslaag uit twee lagen, waarbij de diepe, compacte laag mucus niet doorlaatbaar is voor bacteriën (Johansson et al., 2011b; Johansson & Hansson, 2016). De mucuslaag is de eerste fysische barrière en bevat gesecreteerde stoffen (Johansson et al., 2011a; Johansson et al., 2011b). Deze gesecreteerde stoffen (IgA, antimicrobiële eiwitten) beperken de groei van microbiota in de mucuslaag (Johansson et al., 2011a; Johansson & Hansson, 2016). Op deze manier vervult de mucuslaag haar functie als defensiemechanisme tegen pathogenen. Het is gebleken dat BCM7 een effect uitoefent op de intestinale mucusproductie via de opioïde receptoren in jejunum en colon van ratten. Door haar agonistische effect op de opioïde receptoren wordt de mucusproductie verhoogd (Trompette et al., 2003; Zoghbi et al., 2006). Trompette et al. (2003) hebben in vitro onderzoek gedaan naar het effect van verschillende caseïne-afkomstige opioïde peptiden, onder andere BCM7, op de intestinale mucusproductie. Hierbij werd geïsoleerd, doorbloed jejunum van ratten gebruikt. Luminale toediening van BCM7 (1,2 x10-4 mol/L) heeft geresulteerd in
een significant verhoogde mucussecretie (500% van de mucussecretie bij de controlecellen) (P<0,05). Ook is er in vitro onderzoek uitgevoerd op de invloed van BCM7 op mucine-producerende coloncellen (DHE-cellen) van ratten en (HT29-MTX cellen) van mensen (Zoghbi et al., 2006). De -receptoren werden gelokaliseerd en gemarkeerd op het oppervlak van de DHE-cellen. De DHE-cellen werden 30 minuten to 24 uur blootgesteld aan BCM7 (10-4 mol/L). Met behulp van ELISA werd aangetoond dat na
acht uur een maximum werd bereikt. Er was een significante toename (P<0,05) van muccussecretie door de BCM7-behandelde cellen (225% van de mucussecretie bij de controlecellen). Tevens blijkt dat deze verhoogde mucussecretie op zowel een directe manier als op een indirecte manier plaatsvindt. De directe manier omvat de werking van BCM7 op de expressie van mucines (de bouwstenen van mucus) door slijmbekercellen. Dit werd gemeten door de DHE-cellen 24 uur lang bloot te stellen aan BCM7 (10-4 mol/L). Vervolgens werd het totale RNA geïsoleerd en werd mucine mRNA geanalyseerd
door RT-PCR (real time polymerase chain reaction). Er is geconcludeerd dat BCM7 heeft gezorgd voor een verhoging van mRNA concentraties van rMuc2 en rMuc3 (rat mucine). Dit betekent dat BCM7 de expressie van mucinegenen kan verhogen. De indirecte manier bestaat uit de activatie van -receptoren in het enterisch zenuwstelsel doordat BCM7 op de -receptor bindt. Hierdoor worden de bekercellen neuronaal gestimuleerd tot productie van mucus. Beide manieren werken door de agonistische werking van BCM7 op de opioïde receptoren (Bagnol et al., 1997; Zoghbi et al., 2006).
Dezelfde effecten werden waargenomen bij de humane (HT29-MTX) cellen in dit onderzoek. Dit suggereert dat deze effecten in meerdere species kunnen voorvallen (Zoghbi et al., 2006).
Aangezien de mucuslaag een belangrijke beschermende functie heeft en de eerste fysische barrière is, zou de toename in productie de intestinale bescherming kunnen verbeteren (Trompette et al., 2003; Zoghbi et al., 2006).
2.3.2.2 Vertraagde darmtransit
Een vertraagde darmtransit is een aangetoond effect dat door BCM7 wordt bewerkstelligd. Dit effect ontstaat tevens als gevolg van activatie van de μ-receptoren door BCM7 (Daniel et al., 1990; Barnett et al., 2014). Opioïde receptoren komen namelijk ook voor in de intestinaal stelsel. Deze receptoren zijn vooral gelegen in de myenterische- en submucosale plexus (Bagnol et al., 1997). De aanwezigheid van deze receptoren in de darm is reeds beschreven bij knaagdieren en mensen (Kurz & Sessler, 2003; Patierno et al., 2004; Holzer, 2007). Opioïde peptiden (endogeen en exogeen) beïnvloeden de gastro-intestinale functie door hun interactie met opioïde receptoren in het enterisch zenuwstelsel die motiliteit en secretie besturen (Holzer, 2007). Bekende effecten van μ-receptor agonisten zijn onder andere inhibitie van de maaglediging, verhogen van de tonus van de pylorus, onderbreken van het migrerende motorcomplex, vertragen van de motiliteit van dunne en dikke darm en verhogen van de druk op de anale sfincter (Kurz & Sessler, 2003; Wood & Galligan, 2004; Holzer, 2007). Het resultaat van al deze effecten is constipatie en ileus (Kurz & Sessler, 2003; Holzer, 2007). Zoals bekend is de continue propulsie van darminhoud een belangrijk proces dat gestuurd wordt door het enterisch zenuwstelsel. De peristaltiek weerhoudt de bacteriën ervan om zich snel te kunnen vermenigvuldigen. Dit is vooral belangrijk in de dunne darmen waar de opname van voedingsstoffen nog maar net begonnen is en de hoeveelheid voedingsstoffen erg groot is (Johansson et al., 2011). Een vertraagde intestinale motiliteit wordt daarom verdacht bij te dragen aan de ontwikkeling van ‘small intestinal bacterial overgrowth’ (SIBO). Roland et al. (2015) hebben onderzoek gedaan naar de relatie tussen SIBO en vertraagde darmtransit. De transittijd is gemeten door een ‘wireless motility capsule’ (SmartPill). Deze SmartPill meet tevens de druk, pH en temperatuur in het gastro-intestinaal stelsel. De individuen met SIBO hadden een significant langere GITT in vergelijking met individuen zonder SIBO (Roland et al., 2015). In bestaande literatuur wordt tot nu toe enkel gesuggereerd dat een vertraagde gastro-intestinale activiteit resulteert in een bacteriële overgroei.
Daniel et al. (1990) hebben het in vivo effect van verschillende beta-casomorfines op darmtransit onderzocht. Dit hebben ze gedaan door ratten te voeren met caseïne- of wei-eiwitoplossingen die gemerkt waren met het niet-absorbeerbare 114Ce. Uit het onderzoek is gebleken dat er een significant
verschil was tussen de twee groepen, waarbij de caseïne groep een langere gastro-intestinale transittijd (GITT) had dan de wei-eiwit groep (P<0,001). Bij de caseïne groep werd 50% van de merker (T50%) waargenomen in de faeces na 10,8 uur terwijl de gemiddelde T50% bij de wei-eiwit groep 6,5 uur
was. Om aan te tonen dat dit effect door beta-casomorfines werd bewerkstelligd, werden er vervolgens BCMs toegevoegd aan de wei-eiwitoplossing. Ook hier werd de GITT significant verlengd bij de BCM-gevoederde groep. Dit suggereert dus dat de BCMs, die ontstaan uit beta-caseïne, zorgen voor de verlengde GITT (Daniel et al., 1990).
In een recenter onderzoek hebben ook Barnett et al. (2014) aangetoond dat er bij in vivo onderzoek met ratten een vertraagde darmtransit optreedt na de opname van A1 beta-caseïne in vergelijking met A2 beta-caseïne. Dit onderzoek is uitgevoerd op basis van het ontstaan van BCM7 uit A1 beta-caseïne. Hierbij is melk gebruikt van homozygote A1 en homozygote A2 koeien. TiO2 werd gebruikt als merker
voor het meten van de GITT. De groepen werden opgedeeld in A1S (S = met zoutoplossing behandeld), A1N (N = met naloxone behandeld), A2S en A2N. Naloxone, een opioïde receptor antagonist met specifieke affiniteit voor de μ-receptor, is hierbij gebruikt om de effecten te inhiberen. Er werd waargenomen dat de GITT bij de A1S groep gemiddeld drie uur langer was. Bij dit onderzoek is tevens de activiteit van MPO, merker voor neutrofiel activatie, getest als indicatie voor inflammatie. De MPO activiteit was 65% hoger in de A1S groep dan de A2S groep. Dit is een indicatie voor verhoogde inflammatoire respons (Barnett et al., 2014). Deze bevinding komt overeen met de bevindingen uit het onderzoek van Ul Haq et al. (2014).
Samengevat zorgt BCM7 ervoor dat de darmtransit vertraagd wordt, wat zorgt voor constipatie en wat er mogelijk voor kan zorgen dat er bacteriële overgroei kan plaatsvinden (Barnett et al., 2014; Roland et al., 2015). Dit zijn belangrijke gegevens met betrekking tot de darmgezondheid van het kalf. 2.3.2.3 Andere gastro-intestinale effecten
Er wordt gesuggereerd dat BCM7 een inflammatie van de darmen kan uitlokken (Ul Haq et al., 2014). Naar aanleiding hiervan is er in vivo onderzoek gedaan naar de invloed van BCM5 en BCM7 op het uitlokken van een inflammatie in de darmen. Hierbij werden onder andere myeloperoxidase (MPO) en interleukine-4 (IL-4) gemeten. MPO wordt namelijk geproduceerd door polymorfonucleaire neutrofielen bij inflammatie en is daarom een merker voor inflammatie. De MPO activiteit was verhoogd (P<0,001) met 130% ten opzichte van de controle groep. De concentratie IL-4 was tevens verhoogd (P<0,001) met 175% in vergelijking met de controle groep. CD4 T-cellen secreteren IL-4 waardoor Th0-cellen differentiëren tot Th2-cellen en een omschakeling van IgG naar IgE veroorzaakt.
De resultaten hebben dus bewezen dat BCM7 de expressie van ontstekingsmoleculen (o.a. MPO en IL-4) verhoogt (P<0,01). Tevens is gebleken dat BCM7 de leukocyten infiltratie in intestinale villi bevordert. BCM7 wekt dus een immuunrespons op, waarschijnlijk via de Th2-pathway (Ul Haq et al.,
2014). Daarentegen werden er geen veranderingen in concentratie sIgA en aantal slijmbekercellen waargenomen. De inflammatoire effecten hangen nauw samen met de opioïde effecten die reeds in H2.3.1. besproken zijn. Het is mogelijk dat de verhoogde mucusproductie, die wordt uitgelokt door BCM7, een compensatie kan vormen tegen de uitgelokte ontstekingsreactie van BCM7 (Barnett et al., 2014).
Een ander effect van BCM7 is het inhiberen van de proliferatie van lymfocyten in de lamina propria van het colon. Elitsur & Luk (1991) hebben het in vitro effect van BCM7 op de humane, mucosale immuunrespons door lymfocytenproliferatie onderzocht. Hierbij werden humane colon- en ileumstalen gebruikt. Het is gebleken dat BCM7 de DNA-synthese inhibeert in ConA-gestimuleerde humane colon- en ileum lamina propria lymfocyten. Door het inhiberen van de DNA-synthese wordt de proliferatie van de cellen geremd. Het effect hiervan wordt opgeheven bij het gebruik van naloxone, een opioïde antagonist. Of dit effect in vivo ook zou plaatsvinden is de vraag. Een daling in aantal lymfocyten zou nadelig kunnen zijn voor de intestinale immuniteit (Elitsur & Luk, 1991). Hierdoor zou de intestinale permeabiliteit kunnen toenemen en op die manier toegankelijker worden voor toxische substanties (Elliott et al., 1999; Thorsdottir et al., 2000; McLachlan, 2001; Laugesen & Elliott 2003; Sun et al., 2003).
Tot slot hebben Yin et al. (2019) het effect onderzocht van BCM7 op intestinale, mucosale immuniteit bij bejaarde muizen. Bij dit onderzoek werden vijf onderzoekgroepen opgesteld: jonge controle muizen van twee maanden oud (groep 1), bejaarde controle muizen van 11 maanden oud (groep 2), bejaarde muizen met een lage dosis BCM7 (intra-gastrisch 2x10-7 mol/dag gedurende 30 dagen) (groep 3),
bejaarde muizen met een matige dosis BCM7 (1x10-6 mol/dag gedurende 30 dagen) (groep 4) en
bejaarde muizen met een hoge dosis BCM7 (5x10-6 mol/dag gedurende 30 dagen) (groep 5). Het is
reeds beschreven dat veroudering schade kan veroorzaken aan de weefselstructuur van de dunne darmen, de intestinale villi kan verkorten en de ratio villi lengte/crypt diepte kan verkleinen. Uit dit onderzoek is gebleken dat BCM7 de villi kan vergroten, de ratio lengte/diepte kan vergroten en de schade aan de intestinale mucosa kan beperken. Verschillende onderzoeken hebben geconcludeerd dat veroudering gepaard kan gaan met een toename in pro-inflammatoire cytokines, zoals IL-6, IL-1 en TNF-. De TNF- concentratie was significant hoger bij de bejaarde controlegroep in vergelijking met groep 1. Dit ondersteunt de hiervoor genoemde conclusie. Een significante daling van de TNF- concentraties werd waargenomen bij groep 3 ten opzichte van de groep 2 (P<0,01). Er werd tevens een daling waargenomen bij groep 4 en 5, maar deze was niet significant. De concentraties sIgA (immunoglobuline A) waren significant gestegen in groep 3, 4 en 5 in vergelijking met de groep 2. Dit wijst erop dat BCM7 de productie van pro-inflammatoire cytokines kan beperken en de productie van sIgA verbetert. Op deze manier zou BCM7 de mucosale immuniteit van de dunne darmen verbeteren (Yin et al., 2019). Deze resultaten spreken de resultaten van Ul Haq et al. (2014) tegen. Hier wordt namelijk geconcludeerd dat BCM7 geen verandering in de sIgA concentratie veroorzaakt en zorgt voor een stijging van ontstekingsmediatoren. Het zou daarom interessant zijn om deze effecten uitgebreider te onderzoeken onder andere experimentele omstandigheden.
3 DARMGEZONDHEID VAN HET KALF
3.1 Definitie darmgezondheid
Om meer inzicht te krijgen in de relatie tussen darmgezondheid en de invloed van bioactieve peptiden moet darmgezondheid eerst besproken worden. ‘Darmgezondheid’ is een term die steeds meer gebruikt wordt in zowel de medische literatuur als in de voedingsindustrie. De term omvat verschillende aspecten van het gastro-intestinaal stelsel, zoals normale vertering en absorptie van voedsel, de afwezigheid van gastro-intestinale ziektes, normale en stabiele intestinale microbiota, een goed werkend immuunsysteem en een goed welzijn. Elke aantasting van de gastro-intestinale barrière kan het risico verhogen op het ontwikkelen van infectieuze, inflammatoire en functionele gastro-intestinale ziekten. Dit geldt tevens voor het risico op extra-gastro-intestinale ziekten, zoals immuun-gemedieerde ziekten en metabole stoornissen (Bischoff, 2011).
De niet-gespeende kalveren vormen de grootste risicogroep op de boerderij voor het oplopen van malfuncties van het gastro-intestinale epitheel, wat gepaard gaat met ziektes en verteringsproblemen (USDA, 2007). Neonatale kalverdiarree is hierbij wereldwijd één van de grootste uitdagingen voor zowel de vlees- als zuivelindustrie (Lorenz et al., 2011). Dit betekent dat er verbeteringen nodig zijn betreffende de algemene gezondheid en darmgezondheid van het kalf (Malmuthuge, 2017). Het is daarom belangrijk om na te gaan welke factoren de darmgezondheid beïnvloeden om te kunnen concluderen of BCM7 hier een mogelijk effect op heeft.
3.2 Factoren die darmgezondheid beïnvloeden
In de figuur hieronder is geïllustreerd van welke criteria een goede darmgezondheid afhangt.
Figuur 3. Criteria die de darmgezondheid beïnvloeden (Naar: Bischoff, 2011)
Vijf criteria lijken de basis te vormen voor een goede darmgezondheid. Hieronder vallen: de afwezigheid van gastro-intestinale ziektes (1), een normale en stabiele intestinale microbiota (2), een
Darmgezondheid Afwezigheid van gastro-intestinale ziektes (2) •Geen enzymdeficiënties • Geen gastro-intestinale infecties Normale en stabiele microbiota (1) •Commensale bacteriën •Pathogenen •Aantallen, virulentie Effectieve immuunstatus (3) •Mucusproductie •IgA levels •Activiteit van immuuncellen •Functionele darmmucosa: barrière functie Effectieve digestie en absorptie (4) •Nutritionele status -dieet
•Absorptie van voedsel, mineralen en water •Fecale consistentie
Goed welzijn(5) •Normale kwaliteit van
leven •Gebalanceerde serotonine productie en normale functie van EZS
effectieve immuunstatus (3), effectieve digestie en absorptie van voedsel (4) en een status van goed welzijn (5) (Bischoff, 2011). Een aantal van deze factoren dienen nader toegelicht te worden. Zie hiervoor H3.2.1. tot en met H3.2.4.
Deze factoren/criteria dienen als indicatie om op een overzichtelijke manier de darmgezondheid te kunnen evalueren. Het is momenteel namelijk niet mogelijk om de darmgezondheid van kalveren op bedrijfsniveau te beoordelen (Marquez, 2014). Er heerst nog steeds onduidelijkheid over de definitie van darmgezondheid en hoe dit gemeten kan worden. Dit zorgt ervoor dat er weinig onderzoek in het veld wordt uitgevoerd (Bischoff, 2011). Een deel van het probleem is het ontbreken van goed beschreven methoden voor het beoordelen van de darmgezondheid bij het voor niet-gespeende kalveren op bedrijfsniveau. De ontwikkeling van een model die de darmgezondheid wel kan evalueren, kan wellicht helpen voor het voorkomen van darmproblematiek (Marquez, 2014). In de humane geneeskunde is het aanbevolen dat een beoordeling van de darmgezondheid zowel subjectieve metingen, zoals een scoringssysteem, als objectieve metingen, zoals biologische parameters, bevat. Onder deze biologische parameters vallen: mucussecretie, inflammatie en ontstekingsmediatoren, permeabiliteit, histologie, immunoglobulines en bacteriële culturen (Bischoff, 2011).
3.2.1 Normale en stabiele intestinale microbiota
De cruciale rol van de darmmicrobiota in de ontwikkeling en de functie van de gastro-intestinale tractus en in darmgezondheid van diersoorten is algemeen erkend. Voor een goede darmgezondheid is een normale en stabiele intestinale microbiota belangrijk. Dit betekent dat er geen bacteriële overgroei en geen gastro-intestinale infecties aanwezig mogen zijn. Tevens betekent dit dat er een normale compositie en vitaliteit van het microbioom aanwezig moet zijn (Bischoff, 2011).
Het microbioom van het gastro-intestinale stelsel bevat ongeveer 1014 bacteriën die zich voornamelijk
bevinden in de dikke darm (Macfarlane & Macfarlane, 1997; Mai & Morris, 2004). De informatie omtrent intestinale microbiota, vooral bij neonatale kalveren, is beperkt aangezien er voornamelijk onderzoek is gedaan naar de microbiota in de pens. De kolonisatie van het (nog steriele) gastro-intestinaal stelsel van het kalf vindt plaats tijdens en na de geboorte (Malmuthuge et al., 2015). Smith (1965) heeft cultuur-afhankelijk onderzoek gedaan naar de bacteriële kolonisatie in het pre-ruminale gastro-intestinale stelsel. Volgens de resultaten van dit onderzoek begint de kolonisatie met de facultatief anaërobe kiemen Escherichia coli en Streptococcus binnen acht uur na de geboorte. Nadat alle zuurstof verbruikt is en er een anaëroob milieu is ontstaan, wordt gesuggereerd dat Lactobacillus de overhand neemt voor de rest van de eerste levensweek. Bacteroides is pas de tweede dag na de geboorte waargenomen, enkel in caecum en feces. De kolonisatie van Clostridium is gedetecteerd in het caecum binnen 8 uur na de geboorte (Smith, 1965). Latere onderzoeken hebben een grotere hoeveelheid van Bifidobacterium en Lactobacillus in het gehele gastro-intestinaal stelsel aangetoond (Rada et al., 2006; Vlková et al., 2006). Nog recenter zijn er cultuuronafhankelijke onderzoeken uitgevoerd om de diversiteit en overvloed aan bacteriën in het neonatale gastro-intestinaal stelsel beter te begrijpen. Er is een grotere hoeveelheid van de Bacteroides-Prevotella en Clostridium-coccoides-Eubacterium rectale groepen in de feces van melkkalveren (12 weken postpartum) waargenomen. Faecalibacterium was het meest aanwezig in kalveren van een week oud (Uyeno et al., 2010). De samenstelling stijgt in complexiteit en diversiteit naarmate het kalf ouder wordt en wanneer er veranderingen in dieet optreden (Mayer et al., 2012). Daarbij zijn de samenstelling en diversiteit van de intestinale microbiota sterk afhankelijk van verschillende factoren, zoals leeftijd, dieet, voedermethode, voederadditieven, plaats van staalname en darmregio (Malmuthuge et al., 2015).
De rol van het microbioom in de intestinale immuniteit omvat verschillende functies. Het is gebleken dat de aanwezigheid van darmmicrobiota nodig is voor de ontwikkeling van het intestinale epitheel (Sharma et al., 1995), de ontwikkeling van de lymfoïde structuren (Mebius, 2003) en voor de differentiatie van de immuuncellen (Smith & Garrett, 2011). Tevens draagt de microbiota bij aan energiehomeostase door energie te produceren uit onverteerd voedsel (koolhydraten en andere nutriënten) (Mai & Draganov, 2009). Ook voorkomen ze kolonisatie van pathogenen en zijn ze essentieel voor de ontwikkeling en regulatie van het mucosale immuunsysteem en het intestinale epitheel (Sommer & Bäckhed, 2013). De regulatie bestaat onder andere uit het stimuleren van de productie van mucosale immunoglobulines (IgA) (Bischoff, 2011). Aan de ene kant betekent dit dat wanneer de werking van de microbiota van de darm verstoord wordt, de functionaliteit van het afweermechanisme aangetast wordt. Echter, elke malfunctie van het epitheel, immuunsysteem of enterisch zenuwstelsel tast tevens de microbiota aan (Bischoff, 2011).
3.2.2 Effectieve immuunstatus
Naast het behouden van een gezonde darmmicrobiota, is het behouden van een effectief werkend immuunsysteem tevens een belangrijke factor bij darmgezondheid. De darmmicrobiota speelt een cruciale rol in de ontwikkeling, rijping en homeostase van het mucosale immuunsysteem. Het immuunsysteem moet in staat zijn om pathogenen te voorkomen, te detecteren en te elimineren (Bischoff, 2011). In de eerste levensweken zijn de kalveren afhankelijk zijn van een melkdieet (de niet-gespeende fase). In deze fase ondergaat het gastro-intestinale stelsel intense veranderingen. Dit betreft zowel structurele als microbiële veranderingen. Dit is daarom een cruciale periode met betrekking tot de gezondheid van het kalf. Een effectief werkend immuunsysteem is hierbij cruciaal (Meale et al., 2017). Een eerste grote verandering is het mogelijk maken van de absorptie van antistoffen uit colostrum. Het blijkt dat colostrum, buiten het bieden van o.a. antistoffen, ook de darmontwikkeling beïnvloedt. Het bevat namelijk groeifactoren (insuline-like growth factor (IGF1) en hormonen) waarvan aangetoond is dat ze de groei van de intestinale villi stimuleren (Baumrucker et al., 1994; Blättler et al., 2001). Ook neemt, zoals eerder gezegd, de microbiële diversiteit van de darmflora toe naarmate het speenmoment nadert (Meale et al., 2017).
Nu de functie van het mucosale immuunsyteem behandeld is, moet de structuur van het mucosale immuunsysteem toegelicht worden. De structuur bestaat uit: fysische barrières (mucuslaag, epitheel), chemische barrières (antimicrobiële peptiden, immunoglobulines), patroon-herkennende receptoren (TLR, NOD-like receptoren) en immuuncellen die bij de hiervoor genoemde onderdelen betrokken zijn (Hooper et al., 2012). De fysische barrières spelen een belangrijke rol in de preventie van de invasie van microbiota die aanwezig zijn in het lumen van de darmen. Om deze barrière te begrijpen, moet de samenstelling van de darmmucosa verder uitgelegd worden.
3.2.2.1 Darmmucosa
De darmmucosa bestaat uit een epitheelcellen, mucus-secreterende cellen (slijmbekercellen), immuuncellen (GALT) waaronder de Peyerse platen, Paneth cellen, dendritische cellen en lymfocyten en ten slotte enteroendocriene cellen (Peterson & Artis, 2014). De situering hiervan is weergegeven in figuur 4. Deze gespecialiseerde cellen vervullen essentiële processen, zoals het secreteren van beschermende substanties (o.a. mucus, antistoffen) in het lumen, het secreteren van enzymen in het lumen, het faciliteren van absorptie van voedingsstoffen en het secreteren van hormonen (Steele et al., 2016).