EVALUATIE VAN [
18
F]ALF-PSMA-11 EN PSMA EXPRESSIE IN
LNCAP CELLEN
Merel Laleman
Masterproef in de opleiding Master in de Farmaceutische Zorg
EVALUATIE VAN [
18
F]ALF-PSMA-11 EN PSMA EXPRESSIE IN
LNCAP CELLEN
Merel Laleman
Masterproef in de opleiding Master in de Farmaceutische Zorg
AUTEURSRECHT
“De auteur en de promotor geven de toelating deze masterproef voor consultatie beschikbaar te stellen en delen ervan te kopiëren voor persoonlijk gebruik. Elk ander gebruik valt onder de beperkingen van het auteursrecht, in het bijzonder met betrekking tot de verplichting uitdrukkelijk de bron te vermelden bij het aanhalen van de resultaten uit deze masterproef.”
22 mei 2020
Promotor Auteur
PREAMBULE
Zoals veel zaken tijdens de Covid-19 crisis, is ook deze masterproef beïnvloed door de uitzonderlijke omstandigheden. Bijgevolg kon niet alles uitgevoerd worden zoals oorspronkelijk gepland. De bedoeling was om [18F]AlF-PSMA-11 in vitro te evalueren waarbij er gekeken werd naar zowel de expressie van de PSMA-receptor als naar
de internalisatie van deze tracer met deze receptor a.d.h.v. celtesten. Daarnaast was het de bedoeling om ook de androgeenreceptor expressie te evalueren in functie van de LNCaP celsplitsingen a.d.h.v. western blot en dit in correlatie te brengen met de PSMA-receptor expressie. Een ander doel was om [18F]AlF-PSMA-11 in vivo te evalueren
door muizen te inoculeren met LNCaP cellen zodat deze daaropvolgend een PET scan konden ondergaan met het gebruik van deze tracer.
Vooraleer de maatregelen van kracht waren, was het mogelijk om een groot deel van de celtesten uit te voeren. Van sommige cellijnen was het niet mogelijk om meerdere resultaten te bekomen waardoor er niet kon gekeken worden naar de variaties binnen deze cellijnen. Voor de in vivo evaluatie is enkel de inoculatie van de muizen uitgevoerd. In de tijdspanne dat er in het labo mocht gewerkt worden, kregen de LNCaP tumoren niet voldoende tijd om te groeien en kon bijgevolg een PET-scan nog niet uitgevoerd worden. Voor de western blot is enkel een deel van de optimalisatie gerealiseerd kunnen worden maar was het niet meer mogelijk om de oorspronkelijke geplande test hiermee uit te voeren.
Door de maatregelen is deze masterproef gebaseerd op de reeds voorhanden resultaten en is de literatuurstudie iets uitgebreider dan wat oorspronkelijk de bedoeling was. Ook dient vermeld te worden dat door de korte tijd in het labo niet alle details van de gebruikte producten en materiaal zoals firma etc. vermeld kunnen worden. Deze preambule werd in overleg tussen de student en de promotor opgesteld en door beiden goedgekeurd.
SAMENVATTING
PSMA is een transmembranair proteïne dat tot overexpressie komt in prostaatkankerweefsel en daardoor in de laatste jaren een aandeel heeft gewonnen in het onderzoeksveld naar de diagnose en behandeling van prostaatkanker. PSMA kan als target gebruikt worden om radiotracers te binden en deze kunnen via een PET-scan zichtbaar gemaakt worden. [18F]AlF-PSMA-11 is een recente PSMA PET tracer die omwille van de betere fysische
eigenschappen van 18F, ontwikkeld is naar analogie met [68Ga]PSMA-11. PMSA vertoont een verhoogde expressie bij
stijgende tumoragressiviteit, herval van prostaatkanker en bij castratie-resistente prostaatkanker. Het doel van deze masterproef was om meer inzicht te krijgen in de PSMA expressie in functie van de progressie naar castratie-resistente prostaatkanker. Verder werd [18F]AlF-PSMA-11 in vitro geëvalueerd als PET tracer en werd er hierbij een onderscheid
gemaakt tussen automatisch en manueel gesynthetiseerd [18F]AlF-PSMA-11.
Om dit te bereiken werden LNCaP, C4-2 (PSMA positief) en PC3 (PSMA negatief) cellen in kweek gehouden en werden verschillende LNCaP celsplitsingen gemaakt in compleet medium. Hieruit werden er ook twee cellijnen gemaakt die konden prolifereren in androgeenvrij medium. Al deze cellijnen werden vervolgens gebruikt om zowel de androgeenreceptor als de PSMA expressie te evalueren d.m.v. western blot en opname in functie van de cellijnen, respectievelijk. Daarnaast is ook de internalisatie capaciteit van [18F]AlF-PSMA-11 in vitro geëvalueerd in LNCaP cellen.
In dit onderzoek naar de PSMA expressie in LNCaP cellen en verschillende LNCaP celsplitsingen, waren er geen statistisch significante verschillen bij de manuele synthese van [18F]AlF-PSMA-11. Bij de automatisch synthese
van de tracer kon er niet veel opgemaakt worden doordat maar één proef werd opgenomen in de analyse en hieruit geen besluit kon gevormd worden. [18F]AlF-PSMA-11 vertoonde goede internalisatie eigenschappen in vitro waarbij de
specifieke opname van de tracer bleef stijgen gedurende een incubatieperiode van drie uur. De androgeenreceptor expressie kon niet geëvalueerd worden omdat de optimalisatie van de western blot nog niet voltooid was.
De PSMA expressie in de verschillende cellijnen kon niet in correlatie gebracht worden met de androgeenreceptor expressie doordat dit laatste niet kon bepaald worden. Bij de optimalisatie kon geconcludeerd worden dat het primair antilichaam voor de androgeenreceptor de vermoedelijke oorzaak was. Ook dient de PSMA expressie in functie van de verschillende cellijnen via verder onderzoek geëvalueerd te worden doordat er in deze masterproef geen statistisch significant verschil bekomen werd. [18F]AlF-PSMA-11 vertoonde goede internalisatie in
vitro wat een goede eigenschap is voor laattijdige PET-scan. Dit moet echter nog bevestigd worden met in vivo onderzoek.
DANKWOORD
Tijdens het schrijven van deze masterproef heb ik kunnen rekenen op een aantal mensen die samen met mij deze masterproef hebben mede mogelijk gemaakt. Daarom wil ik toch even mijn dank uiten.
Eerst en vooral zou ik Prof. dr. apr. Filip De Vos willen bedanken om mij de kans te geven mijn praktisch werk te kunnen uitvoeren in zijn labo en om met enthousiasme zijn lessen radiochemie en radiofarmaca te geven. Ten tweede zou ik graag Apr. Sarah Piron in het bijzonder bedanken voor haar uitstekende begeleiding en voor de tijd die ze nam om mijn werk te lezen en te verbeteren. Ook wil ik haar bedanken voor haar goede en vele uitleg. Ik wens haar nog veel succes toe bij het behalen van haar doctoraat.
Ten derde een dikke merci aan mijn broer die slechts een telefoontje verwijderd was om mij op te fleuren wanneer de eenzame dagen door de coronacrisis zijn tol begonnen te eisen.
Ten laatste zou ik heel graag mijn vriend, vrienden en familie willen bedanken om mij te steunen tijdens deze periode. Zij hebben ervoor gezorgd dat ik eens mijn gedachten kon verzetten toen het nodig was.
Merel Laleman Mei 2020
INHOUDSOPGAVE
1. INLEIDING ... 1 1.1. DE PROSTAAT ... 1 1.2. PROSTAATKANKER ... 1 1.2.1. Epidemiologie ... 3 1.2.2. Diagnose ... 3 1.2.2.1. Screening ... 3 1.2.2.2. Biopsie ... 4 1.2.3. Behandeling ... 7 1.3. BEELDVORMING ... 81.3.1. Bot scintigrafie (botscan) ... 9
1.3.2. Computed tomografie ... 9
1.3.3. Magnetische resonantie imaging ... 9
1.3.4. Positron emissie tomografie ... 10
1.4. PET tracers ... 13 1.4.1. Fluorodeoxyglucose ... 13 1.4.2. [18F]NaF ...14 1.4.3. Choline ... 15 1.4.4. [18F]FACBC ... 15 1.4.5. PSMA tracers ... 16 1.4.5.1. [68Ga]PSMA-11 ... 16
1.4.5.2. [18F] gelabelde PSMA liganden ... 17
2. OBJECTIEVEN ... 20 3. MATERIAAL EN METHODEN ... 21 3.1. REAGENTIA ... 21 3.2. CELLIJNEN ... 22 3.3. METHODEN... 22 3.3.1. Isotoop [18F] ... 22
3.3.2. Western blot ... 23
3.3.3. Celtest ... 25
3.3.4. Inoculatie in muizen ... 26
3.4. PROTOCOLS ... 27
3.4.1. Synthese van [18F]AlF-PSMA-11 ... 27
3.4.2. BCA proteïne assay ... 27
3.4.3. Celculturen ... 27
3.4.4. Western blot ... 28
3.4.4.1. Gel maken ... 29
3.4.4.2. Elektroforese ... 29
3.4.4.3. Transfer ...30
3.4.4.4. Blocking en incubatie met antilichaam...30
3.4.5. Celtest ... 31 3.4.6. Inoculatie in muizen ... 33 4. RESULTATEN... 35 4.1. WESTERN BLOT ... 35 4.2. CELTEST ... 36 4.2.1. Expressie ...36 4.2.2. Internalisatie ... 38 5. DISCUSSIE ... 40 5.1. WESTERN BLOT ... 40 5.2. CELTEST ... 41 5.2.1. Expressie ...41 5.2.2. Internalisatie ... 43 6. CONCLUSIE ... 44 7. LITERATUURLIJST ... 45 8. APPENDIX... I
LIJST MET GEBRUIKTE AFKORTINGEN
ADT Androgeen deprivatie therapie
AlCl3 Aluminium chloride
BCA Bicinchonine zuur
BCR Biochemisch herval
BGO Bismut germanium oxide
BPH Benigne prostaat hyperplasie
BSA Bovine serum albumine
CT Computed tomografie
d.c. Decay corrected
DCFBC N-[N-[1,3-dicarboxypropyl]carbamoyl]-4-[18F]fluorobenzyl-L-cysteïne
DCFPyL 2-(3-{1-carboxy-5-[(6-[18F]fluoro-pyridine-3-carbonyl)-amino]-pentyl}-ureido)-pentaandizuur
DRE Digitaal rectaal onderzoek
FACBC Anti-1- amino-3-fluorocyclobuaat-1-carbonzuur
FDG Fluorodeoxyglucose
FOLH Folaat hydrolase
GCPII Glutamaat carboxypeptidase II
GLUT Glucosetransporter
GnRH Gonadotropine releasing hormoon
LSO Lutetium oxyorthosilicaat
MDP Methyleen difosfonaat
MP-MRI Multiparameter magnetische resonantie imaging
MRI Magnetische resonantie imaging
n.d.c. Non decay corrected
NAALADase N-geacetyleerd-alpha-gelinked zuur dipeptidase
NaOAc Natriumacetaat
PBS Fosfaat gebufferde saline
PET Positron emissie tomografie
PMT Fotomultiplierbuis
PSA Prostaat specifiek antigen
PSMA Prostaat specifiek membraan antigen
SDS Natrium dodecyl sulfaat
TNM Tumor, node, metastase
TRUS Transrectale ultrasound biopsie
1
1. INLEIDING
1.1. DE PROSTAAT
De prostaat is een klier die een rol speelt in het mannelijk voorplantingsstelsel. Deze klier bevindt zich voor het rectum, rond de urethra en onder de blaas (Figuur 1.1). De voornaamste functie is het secreteren van prostaatvloeistof in de urethra tijdens de ejaculatie. Hierbij worden spermacellen, die geproduceerd worden in de testes, via de vas deferens naar de zaadblaasjes gebracht. Deze secreteren een vloeistof die samen met de prostaatvloeistof en spermacellen het semen vormt. De prostaatvloeistof heeft als functie de spermacellen te beschermen en te ondersteunen in hun levensduur en beweeglijkheid en bevat bovendien het enzyme prostaat specifiek antigen (PSA). Dit wordt geproduceerd door de secreterende epitheelcellen van de prostaatklier en zorgt ervoor dat het semen minder viskeus wordt zodat spermacellen geholpen worden in hun transport om een eitje te bevruchten. Hierdoor stijgt de kans op een succesvolle bevruchting (1,2).
1.2. PROSTAATKANKER
Prostaatkanker ontstaat door abnormale mutaties in het DNA van prostaatcellen, hierdoor kunnen deze cellen zich ongecontroleerd prolifereren. Deze kankercellen kunnen door infiltratie via de bloedbaan en het lymfevaatsysteem de prostaat verlaten om zich te verspreiden naar andere organen van het lichaam zoals de lymfeknopen, de longen, de lever en het bot. Op deze plaatsen kunnen kankercellen zich opnieuw ongecontroleerd prolifereren en zo metastasen vormen. De specifieke oorzaken waarom bepaalde cellen mutaties ondergaan zijn niet gekend. Voor prostaatkanker zijn er wel bepaalde factoren die het risico kunnen verhogen zoals leeftijd, etniciteit en familiale voorgeschiedenis. De incidentie van prostaatkanker stijgt met de
2
leeftijd, vooral vanaf 50 jaar. De incidentie is ook hoger bij mannen van het zwarte ras dan bij Kaukasische mannen. Naarmate een man één of meerdere eerstegraads familieleden heeft met prostaatkanker stijgt ook zijn risico op prostaatkanker (3–6).
Prostaatkanker kan gediagnosticeerd worden indien mannen met symptomen van de lage urinewegen zich presenteren in eerstelijnszorg zoals de huisarts. De symptomen kunnen omschreven worden als verhoogde frequentie en drang om te plassen maar ook onvolledige lediging, aarzeling om te plassen, nachtelijk plassen en de noodzaak om te persen vooraleer men kan plassen. Alhoewel mannen vaak ongerust zijn bij de aanwezigheid van deze symptomen is er nog geen duidelijke associatie aangetoond met prostaatkanker. In een studie van Martin et al. (7) werd er geen bewijs gevonden van een positieve associatie tussen de ernst van de symptomen van de lage urinewegen en gevorderde prostaatkanker. Desondanks werd er toch een positieve associatie gevonden tussen symptomen van de lage urinewegen en het later vaststellen van de diagnose van primaire prostaatkanker. Hieruit kan er geconcludeerd worden dat deze symptomen eerder als aanzetpunt worden gebruikt om te screenen voor vroegtijdige detectie van prostaatkanker en zo detectiebias veroorzaken. Dit komt vooral doordat deze symptomen conventioneel werden gebruikt om verder onderzoek te doen voor het bestaan van de PSA test ontwikkeld in de jaren ’90. Er moet dus opgemerkt worden dat screening enkel en alleen op basis van deze symptomen niet verantwoord is. Het wordt dan ook aangeraden om samen met de patiënt een weloverwogen keuze te maken door zowel de voor-en nadelen van verder onderzoek als ook de aanwezigheid van risicofactoren van prostaatkanker te bespreken (zie 1.2.2.1. Screening). Verder dient ook opgemerkt te worden dat deze symptomen ook een teken kunnen zijn van benigne prostaat hyperplasie (BPH) en prostatitis. Deze twee ziektebeelden kunnen obstructie van de urethra veroorzaken door respectievelijk een vergrote of ontstoken prostaatklier. Andere symptomen van niet-gediagnosticeerde prostaatkanker zijn hematurie en erectiestoornissen. Prostaatkanker kan echter ook asymptomatisch zijn en per toeval ontdekt worden tijdens systematische controles van PSA levels (zie 1.2.2.1. Screening)(6–10).
De mediaan leeftijd van het voorkomen van prostaatkanker wordt gesteld op 68 jaar. Echter worden meer en meer mannen met een leeftijd jonger dan 55 jaar gediagnosticeerd met prostaatkanker. Dit kan te wijten zijn aan verhoogde screening met behulp van PSA (zie 1.2.2.1. screening). Prostaatkanker die ontstaat op jongere leeftijd dient anders benaderd te worden dan deze die ontstaat op oudere leeftijd. Grote populatiestudies hebben namelijk aangetoond dat de overleving bij patiënten onder de 50 jaar in vergelijking met oudere patiënten veel lager is in het geval van gevorderde prostaatkanker. Dit verwacht men niet aangezien jonge mensen weerbaarder zijn en ook minder comorbiditeiten hebben waardoor dit niet moet meegenomen
3 worden in de behandelingskeuze. Mannen onder de 50 jaar hebben vaker een agressievere kanker en zullen ook, doordat ze een hoger levensverwachting hebben, meer kans hebben op progressie van hun ziekte. Ook zullen er in deze groep meer therapie gerelateerde morbiditeiten zijn doordat ze meestal in aanmerking komen voor radicalere behandelingsstrategieën (11).
1.2.1. Epidemiologie
Volgens gegevens van de Wereldgezondheidsorganisatie (WGO) anno 2018, waren wereldwijd 13,5% van alle kankerdiagnoses bij mannen in 2018 toe te schrijven aan prostaatkanker. Dit zorgt ervoor dat prostaatkanker met zijn tweede plaats tot de top drie behoort van meest voorkomende kanker bij mannen, samen met long- en colorectale kanker (12). Toch zijn de sterftecijfers van prostaatkanker relatief laag in de totale bevolking aangezien het maar verantwoordelijk is voor 3,8% van de mortaliteit door kanker, hiermee staat prostaatkanker op de achtste plaats (Figuur 1.2)(12). De incidentie in Europa is 20%, wat ervoor zorgt dat deze op nummer één staat bij mannen (13). Dezelfde tendens is te zien in België met een incidentie van 17,9% (Figuur 1.2)(14). (15)
1.2.2. Diagnose
1.2.2.1. Screening
Overleving gaat nauw samen met vroegtijdige diagnose. Vergelijkt men dit met de diagnose van vergevorderde kanker dan is de overleving binnen de 5 jaar respectievelijk bijna 100% en 33% (16). Screening kan een oplossing bieden om prostaatkanker in een vroeg stadium vast te stellen zodat zowel de kans op een succesvolle behandeling als de levenskwaliteit van de patiënt stijgt (17).
Verhoogde PSA levels worden nagegaan via een bloedtest en kunnen gebruikt worden als een screeningsmerker om prostaatkanker te detecteren. PSA is echter niet prostaatkanker specifiek doordat deze Figuur 1.2: De globale mortaliteit (links) en incidentie (rechts) van prostaatkanker in België anno 2018 volgens WGO (14,15).
4
waarden ook kunnen verhoogd zijn door bv. BPH en prostatitis. Bij een cut-off waarde ≥ 4 ng/mL zal men verder onderzoek uitvoeren. Een serumwaarde < 4 ng/mL wordt als normaal beschouwd maar men dient rekening te houden met het feit dat de waarde kan stijgen naarmate een man ouder wordt. Toch is screening m.b.v. PSA waarden controversieel. Enerzijds door de onvoldoende sensitiviteit waardoor 20% van de mannen met een waarde lager dan 4 ng/mL toch prostaatkanker hebben (18). Anderzijds zorgt een specificiteit van 36% voor overdiagnose en onnodige complicaties bij verder onderzoek bv. biopsie (19). Figuur 1.3 toont de kans op prostaatkanker diagnose vastgesteld m.b.v. digitaal rectaal onderzoek (DRE) indien men een bepaalde PSA waarde heeft. Dit toont aan dat PSA niet ideaal is om prostaatkanker vast te diagnosticeren (20,21).
Naast controle van PSA levels kan DRE ook gebruikt worden als screeningstest. Bij DRE zal de arts met zijn vinger de prostaat aftasten zodat info verkregen wordt over de grootte en de textuur van de prostaat. Op deze manier kan ook een onderscheid gemaakt worden of men te maken heeft met BPH of prostaatkanker. Dit is echter wel een subjectieve methode waarvan het resultaat kan variëren tussen artsen onderling (22).
1.2.2.2. Biopsie
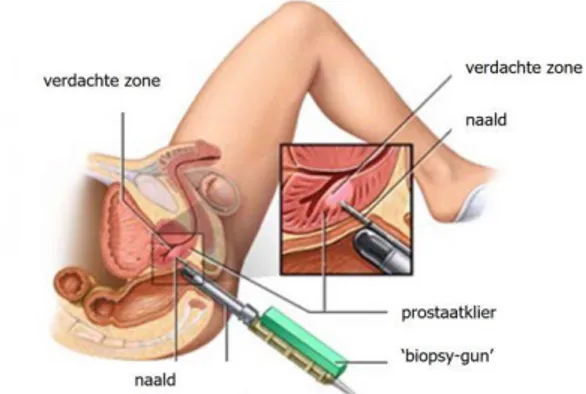
Indien de DRE en PSA test een abnormaliteit detecteren kan een biopsie gedaan worden ter bevestiging. Momenteel wordt transrectale ultrasound biopsie (TRUS) gezien als de gouden standaard voor diagnose. Bij TRUS worden er m.b.v. ultrasone transducers in het rectum golven gestuurd in de prostaat en omliggende weefsels. Deze golven zullen botsen met het oppervlak van de prostaat en worden terug gedetecteerd door een apparaat die dit omzet in een beeld van de prostaat. Bij een TRUS zal dit beeld helpen om een naald via het rectum te begeleiden naar plaatsen van interesse om daar stukjes weefsels te isoleren, conventioneel zijn dit er 10 tot 12 (Figuur 1.4). TRUS gaat gepaard met nadelen zoals pijn, bloedingen en infectie waaronder sepsis en urineweginfecties. Andere nadelen van TRUS biopsie zijn de beperkte sensitiviteit en specificiteit doordat de
5 biopsie gerandomiseerd gebeurt over de volledige prostaat. Dit kan zorgen voor veel vals negatieve resultaten als ook voor misdiagnose van de reële tumor (23,24). (25)(26)
De stukjes die geïsoleerd worden ondergaan histologisch onderzoek zodat een Gleason score kan toe gekend worden aan deze stukjes. Bij de Gleason score wordt er gekeken naar de twee dominerende histologische patronen die elk een cijfer van 1-5 krijgen naargelang de microscopische architectuur en voorkomen van deze patronen. De uiteindelijke Gleason score is de som van deze cijfers en geeft een beoordeling van de graad van het kankerweefsel. Graadgroep 1 wordt toegekend voor een Gleason score < 6, graadgroep 2 voor Gleason score 7 (3+4), graadgroep 3 voor Gleason score 7 (4+3), graadgroep 4 voor Gleason score 8 en graadgroep 5 voor Gleason score 9-10 (Figuur 1.5). Door enkel naar de som te kijken kunnen er problemen ontstaan in de prognose en behandeling van prostaatkanker. Zo kan een Gleason score 7 toegekend worden aan 3+4 maar ook aan 4+3. In het eerste geval is het meest dominerende weefsel, het eerste cijfer, minder afwijkend dan in het tweede Figuur 1.5: Weergave en beschrijving van de microscopische patronen ingedeeld volgens het Gleason patroon. Bijhorend wordt ook de indeling van de Gleason score en de graadgroep weergegeven (26).
6
geval maar hebben ze toch éénzelfde Gleason score waardoor het kan gebeuren dat niet altijd de gepaste therapie gegeven wordt. Het is dus belangrijk dat er gekeken wordt naar de graadgroep of de twee aparte scores zelf i.p.v. naar de som (27,28). (29)
Een andere manier om het stadium of de graad van prostaatkanker te bepalen kan a.d.h.v. van het tumor, node, metastase (TNM) classificatie systeem, ook wel klinische classificatie genoemd. TNM maakt gebruikt van de grootte van de tumor, de verspreiding naar lymfeknopen en de aanwezigheid van metastasen om te bepalen in welke groep de kanker behoort (I-IV). Deze groepen geven weer in welk stadium de kanker zich bevindt. In stadium I is de kanker beperkt tot het oorspronkelijk weefsel, bij stadium II is het doorgegroeid naar de omliggende weefsels maar blijft het gelokaliseerd rond de prostaat. Stadium III wordt toegekend indien er verspreiding is naar de lymfeklieren die zich rond de prostaat bevinden en stadium IV vertoont metastasen over het hele lichaam. Het TNM classificatie systeem is de gouden standaard om vooral solide tumoren te beoordelen terwijl Gleason score specifiek gebruikt wordt voor prostaatkanker. Door deze standaardisering zorgt een klinische beoordeling ervoor dat de vergelijkbaarheid gewaarborgd wordt tussen verschillende zorgverstrekkers en onderzoekers. Het zorgt bovendien ook voor de nodige informatie om de prognose en verdere behandeling van de patiënt te kunnen bepalen. Deze klinische beoordeling kan samen met de Gleason score en de PSA waarde
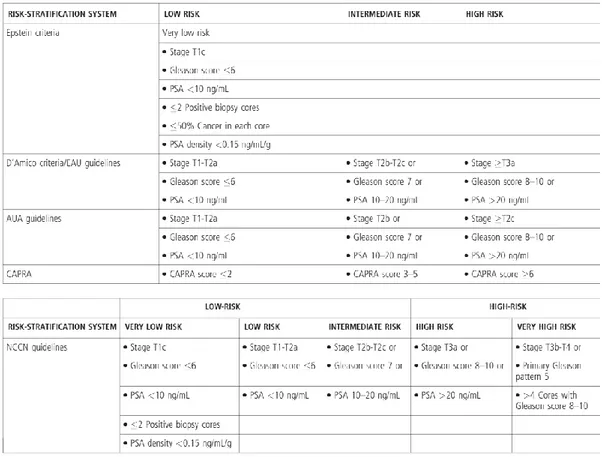
7 gebruikt worden om aan risicostratificatie te doen van de prostaatkanker. Hierbij zijn er lichte verschillen in de indeling naargelang welke richtlijnen er geraadpleegd worden (Figuur 1.6)(29,30).
1.2.3. Behandeling
Bij diagnose van gelokaliseerde prostaatkanker zijn er drie behandelingsopties mogelijk naargelang de risicogroep van de tumor: actieve monitoring, een operatie (prostatectomie) of radiotherapie. Bij monitoring wordt de progressie van de prostaattumor nauwlettend opgevolgd d.m.v. PSA bloed testen, fysieke onderzoeken en/of biopsies. Hierbij is het de bedoeling dat enkel deze met een progressie naar een klinisch significante tumor behandeld worden. Ook kan er additioneel magnetische resonantie imaging (MRI) uitgevoerd worden ter controle van metastasen en de grootte van de prostaattumor. Mannen die geen gunstige levensverwachting hebben, zullen toegewezen worden aan de afwachtende methode, waarbij er wel de nodige waakzaamheid is maar geen verdere actie genomen wordt naast een symptomatische behandeling. Bij prostatectomie wordt de prostaat verwijderd als ook de zaadblaasjes, een stuk van de urethra en de blaashals. Hierbij wordt er een nieuwe verbinding gemaakt zodat de urethra en de blaas terug met elkaar verbonden zijn en zo een vesico urethrale anastomose vormen. Radiotherapie voor de behandeling van prostaatkanker kan opgedeeld worden in twee categorieën: brachytherapie en externe beam therapie. Brachytherapie houdt in dat er radio-isotopen binnenin het lichaam worden gebracht in de nabijheid van de tumor. Dit type radiotherapie wordt voornamelijk gebruikt in geval van intermediaire prostaatkanker. Bij externe beam radiotherapie worden foton stralen of proton stralen van buiten af gefocust op de tumor. Deze aanpak wordt gebruikt bij eender welke risicogroep (27,31,32). In de ProtecT studie werden de drie verschillende behandelingsopties voor mannen met lokale prostaatkanker vergeleken. Hierbij was de mortaliteit bij de drie groepen niet significant verschillend, maar er werden wel meer metastasen en progressie van de ziekte gedetecteerd in de monitoringsgroep in vergelijking met de operatie- en radiotherapiegroep (33). Toch heeft actieve monitoring de voorkeur bij zeer laag tot laag risico kanker doordat patiënt gerapporteerde outcomes betreffende darm-, seksuele en urinaire functie in deze groep minder beïnvloed waren dan in de andere twee groepen (34). Indien de prostaatkanker zich in de intermediaire risico groep bevindt dan zijn prostatectomie en radiotherapie effectieve behandelingsmethodes. Deze twee behandelingen vertonen in de ProtecT studie geen verschil in mortaliteit maar hebben elk nadelen. Zo vertonen mannen behandeld met radiatie meer nocturie en darmstoornissen maar minder urinaire en seksuele dysfunctie dan deze in de prostatectomiegroep (34). Een combinatie van therapieën is ook mogelijk waarbij radiotherapie kan gecombineerd worden met androgeen deprivatie therapie (ADT) in het geval van intermediair risico en hoog risico. Indien een man een prostatectomie heeft ondergaan kan radiotherapie een
8
bijkomend voordeel bieden bij hoog risicokanker om de ziekte onder controle te houden en om biochemische herval (BCR) te voorkomen. Dit wordt gekenmerkt door verhoogde PSA waarden (35–37).
Voor de behandeling van metastatische prostaatkanker wordt er gewoonlijk gekozen voor androgeen deprivatie therapie (ADT). De groei van een prostaattumor wordt beïnvloed door androgenen, hieronder behoren testosteron en dihydrotestosteron. Dit laatste ontstaat uit testosteron maar heeft een hogere affiniteit voor de androgeenreceptor. ADT kan operatief of farmacologisch uitgevoerd worden d.m.v. respectievelijk orchiectomie, waarbij één of meerdere testes worden verwijderd, of door het innemen van geneesmiddelen zoals gonadotropine releasing hormoon (GnRH) agonisten of androgeenreceptor inhibitoren. De klinische praktijk maakt het meest gebruik van GnRH agonisten. Deze behandelingsstrategie wordt geassocieerd met metabolische veranderingen zoals verhoogde insulineresistentie, toegenomen gewicht en verminderde spiermassa, maar ook verminderde botdensiteit en seksuele stoornissen. Daarbovenop is er in veel gevallen sprake van ongevoeligheid voor ADT bij metastatische prostaatkanker of dat het resistent wordt tegen ADT, in dat geval wordt er gesproken van castratie-resistente prostaatkanker (27,38,39).
Docetaxel wordt gebruikt als cytostaticum voor chemotherapie en werd in eerste instantie voornamelijk toegepast voor mannen met een castratie-resistente prostaatkanker. Nu zijn er ook gerandomiseerde studies zoals CHAARTED en STAMPEDE die aantonen dat de combinatie van docetaxel en ADT leidt tot een verhoogde overleving (40).
Zowel bij prostatectomie als bij radiotherapie kan er sprake zijn van BCR binnen de 10 jaar in respectievelijk 40% en 50% van de gevallen (41). Dit herval kan geassocieerd worden met lokaal herval maar ook met metastaseringen die zich voornamelijk in de lymfeknopen en het bot bevinden. De plaats van herval wordt standaard gediagnosticeerd m.b.v. beeldvormingstechnieken zoals een MRI, bot- of CT-scan. Echter is de sensitiviteit van MRI en CT-scan om lokaal herval of metastasen in lymfeknopen te detecteren laag (41,42).
1.3. BEELDVORMING
Beeldvorming kan gebruikt worden om te onderzoeken of mannen met een intermediair tot hoog risico kanker metastasen vertonen maar zal vooral gebruikt worden in geval van BCR. Hierbij is het belangrijk dat de locatie correct wordt bepaald omdat dit de verdere behandeling bepaalt. Zo zal bij lokaal herval in de prostaat fossa of in lymfeknopen die zich in de pelvis bevinden, een lokale therapie gebruikt worden zoals chirurgie of
9 radiotherapie. Terwijl systemische behandelingen zoals ADT of chemotherapie gebruikt worden bij metastasen verder verwijderd van de prostaat. De conventionele beeldvormingstechnieken zijn bot-, CT- en MRI-scan (43).
1.3.1. Bot scintigrafie (botscan)
Botscans ook wel bot scintigrafie genoemd, worden voornamelijk toegepast bij BCR na prostatectomie en radiotherapie maar tonen een lage sensitiviteit doordat een positief resultaat in veel gevallen maar verkregen wordt indien de PSA waarde > 40 ng/mL is (44). Bij een bot scintigrafie wordt er gebruik gemaakt van
een fosfaat analoog (methyleen difosfonaat) gelabeld met technetium-99m (99mTc-MDP). Doordat deze analoog
naast een hoge opname in het skelet ook een snelle klaring uit zachte weefsel vertoont, kan deze tracer in functie van de bloeddoorstroming en remodellering van het bot op deze plaats accumuleren en op die manier pathologiën aantonen zoals kanker en infecties (45).
1.3.2. Computed tomografie
Computed tomografie (CT) maakt gebruik van een bron die röntgenstralen uitstuurt die roteren rond de patiënt. Door deze roterende röntgenstraal kunnen er m.b.v. een computer telkens vanuit een verschillende hoek een serie aan beelden gevormd worden. Deze cross-sectionele beelden tonen zowel beenderen als weefsels en organen en kunnen dan gereconstrueerd worden zodat zowel een 2D- als 3D-beeld kan gevormd worden. Deze techniek zorgt er dan ook voor dat een anatomisch beeld wordt bekomen waarop structurele veranderingen kunnen waargenomen worden (46).
CT kan gebruikt worden in de stadiëring van prostaatkanker en zal als functie hebben om kanker te detecteren in lymfeknopen t.h.v. de pelvis en retroperitoneale ruimte. Deze detectie gebeurt enkel o.b.v. de vergroting of vorm van lymfeknopen. Er is echter geen consensus over de treshold van de vergroting waarbij er kan gesproken worden over prostaatkanker in de lymfeknoop. Daarbovenop zal ongeveer 80% van de gemetastaseerde lymfeknopen nog een normale grootte vertonen (47). Bij BCR kan CT geen uitsluitsel geven doordat de sensitiviteit gelimiteerd is bij lage PSA waarden (42,48).
1.3.3. Magnetische resonantie imaging
Bij magnetische resonantie imaging (MRI) wordt er gebruik gemaakt van de magnetische eigenschappen van de waterstofatomen in het lichaam om een beeld te verkrijgen. Dit kan toegepast worden bij de detectie, stadiëring en als follow-up na behandeling. Net zoals bij CT wordt er een anatomisch beeld bekomen
10
en zal de detectie van kanker in de lymfeknopen gebeuren a.d.h.v. structurele veranderingen waarbij hier ook dezelfde beperking is met betrekking tot de laesie grootte (48,49).
Het gebruik van MRI voor beeldvormingstechniek in de prostaat biedt meer en meer potentieel door de vooruitgang die geboekt wordt met multiparameter MRI (mpMRI). Hierbij worden anatomische en functionele beeldvormingstechnieken gecombineerd (49). Dit kan gebruikt worden als een alternatief om te beslissen wie baat heeft bij een biopsie indien ze een verhoogd PSA level hebben. Zo kan de detectie van klinisch onbelangrijke prostaatkanker worden verminderd en deze van klinisch belangrijke prostaatkanker verbeterd. Wanneer mpMRI vergeleken werd met TRUS-begeleide biopsie in de PROMIS studie, werd aangetoond dat de sensitiviteit en negatieve predictieve waarde significant hoger ligt bij mpMRI (50). Echter vertoont mpMRI wel een lagere specificiteit en positieve predictieve waarde waardoor nog steeds een biopsie moet uitgevoerd worden indien er een verdacht mpMRI resultaat bekomen wordt (49,50). Deze techniek kan ook gebruikt worden bij BCR om lokaal herval op te sporen. Panebianco et al. heeft aangetoond dat mpMRI in staat is om dit te doen bij PSA waarden tussen 0,2–1 ng/mL (51). Er dient ook rekening te worden gehouden met de praktische nadelen van MRI. Zo zullen patiënten gedurende een lange tijd stil moeten liggen, de kleinste beweging kan namelijk zorgen voor een verstoring van de beelden. Ook is de investering in een MRI-scan duur waardoor de kosten van deze scan kunnen oplopen (52).
1.3.4. Positron emissie tomografie
Positron emissie tomografie (PET) is een beeldvormingstechniek die voornamelijk wordt gebruikt om een functionele beoordeling te maken van organen o.b.v. radiotracers die intraveneus geïnjecteerd worden. PET maakt gebruik van radio-isotopen die protonen op overschot hebben en daardoor bèta plus (β+) verval vertonen
(Formule 1.1). Hierbij wordt er een positron uitgestuurd dat dezelfde eigenschappen heeft als een elektron met het enige verschil dat deze positief geladen is. Dit positron krijgt een bepaalde energie mee die kan variëren van 0 tot Emax, waardoor het een bepaalde snelheid vertoont. Naast een positron wordt ook een neutrino uitgestuurd.
Dit laatste heeft noch massa, noch lading maar krijgt de overige energie die niet aan de positron wordt gegeven. Naarmate het positron verder reist, zal het door botsingen met elektronen in de omgeving snelheid verliezen. Als de energie van het positron gelijk wordt met deze elektronen zal het annihilatie vertonen. Hierbij zal het positron met een willekeurig elektron een interactie vertonen waarbij de massa van deze twee wordt omgezet naar energie onder de vorm van twee fotonen, ook gammastralen genoemd. De ontstane fotonen krijgen elk een energie van 511keV en gaan uit elkaar in een tegengestelde richting onder een hoek van 180° (Figuur 1.7)(53– 55). (55)
11 𝑋
𝑍
𝐴 → 𝑌
𝑍−1𝐴 + 𝛽++ 𝜈 + (𝛾)
Formule 1.1: Formule van bèta-plus verval waarin massagetal (A), protonengetal (Z), moederisotoop (X), dochterisotoop (Y), positron (β+), neutrino (ν) en gammastralen (γ) (56).
Deze gammastralen worden opgevangen door een scintillatiedetector die bestaat uit bismut germanium oxide (BGO) of lutetium oxyorthosilicaat (LSO). Dit zijn ionaire bestanddelen die een kristalstructuur zullen vormen. Elektronen van deze atomen kunnen door absorptie van energie, afkomstig van de gammastralen, geëxciteerd worden van de valentieband (grondtoestand) naar de conductieband (excitatietoestand) (Figuur 1.8). Deze elektronen zullen nadien terugvallen naar de valentieband waarbij ze terug energie vrijstellen onder de vorm van een lichtfoton. BGO en LSO bevatten allebei activators die een hogere energie voor de grondtoestand hebben maar een lagere energie voor de excitatietoestand (Figuur 1.8). Hierdoor zullen er extra energiebanden gecreëerd worden waarnaar elektronen kunnen terugvallen indien ze geëxciteerd zijn. Ze kunnen er op die manier voor zorgen dat de uitgestuurde fotonen zich in het zichtbaar spectrum bevinden doordat de energie die vrijkomt bij het terugvallen kleiner is en hierdoor de golflengte langer wordt dan bij een zuiver kristal. Dit licht wordt dan vervolgens omgezet naar een elektrisch signaal m.b.v. een fotonmultiplierbuis (PMT). Een PMT is een vacuümbuis waarbij het foton door de fotokathode gaat en op die manier een foto-elektron produceert, doordat de energie afkomstig van het foton geabsorbeerd wordt door elektronen aanwezig in deze kathode. Het foto-elektron zal vervolgens versnellen door een spanningsverschil tussen de fotokathode en de eerste dynode, op deze plaats zullen ook secundaire elektronen vrijgesteld worden. Deze zullen vervolgens ook versneld worden naar de volgende dynode en opnieuw elektronen vrijstellen. Hierdoor zal het signaal zodanig versterkt worden Figuur 1.7: Schematische voorstelling van het werkingsmechanisme van PET. Deze figuur is echter niet helemaal correct aangezien de fotonen in 180° worden uitgezonden en dit is hier niet het geval (55).
12
dat t.h.v. een anode een meetbaar elektrisch signaal zal worden gedetecteerd. Verschillende van deze detectoren zullen samen een cirkel rond de patiënt vormen zodat gammastralen kunnen opgevangen worden, onafhankelijk van de richting waarin ze worden uitgestuurd. Door de combinatie van de verschillende gammastralen en doordat ze de detector simultaan bereiken maar aan de tegenovergestelde kant kan de positie van de bron achterhaald worden (57,58).
Doordat MRI en CT elk apart te kort komen om BCR met goede accuraatheid te detecteren zijn er andere technieken ontwikkeld zoals PET. PET zal samen met MRI of CT uitgevoerd worden wat ervoor zorgt dat er samen met een functionele beeldvorming ook een anatomisch beeld verkregen wordt. Op die manier kan de precieze locatie van abnormale opname achterhaald worden. Er bestaan verschillende radiotracers die prostaatkanker kunnen detecteren. Zo zijn er die een rol spelen in de cellulaire processen die instaan voor de metabolische activiteiten in kanker en andere die kunnen binden aan oppervlakte receptoren specifiek voor kanker zoals prostaat specifiek membraan antigen (PSMA). Sommige van deze PSMA tracers kunnen ook dienst doen als therapie om op een doelgerichte manier de kanker te behandelen bv. PSMA-617. Tracers voor diagnostische doeleinden kunnen gebonden worden met verschillende radio-isotopen zoals koolstof (11C), fluor (18F) of gallium
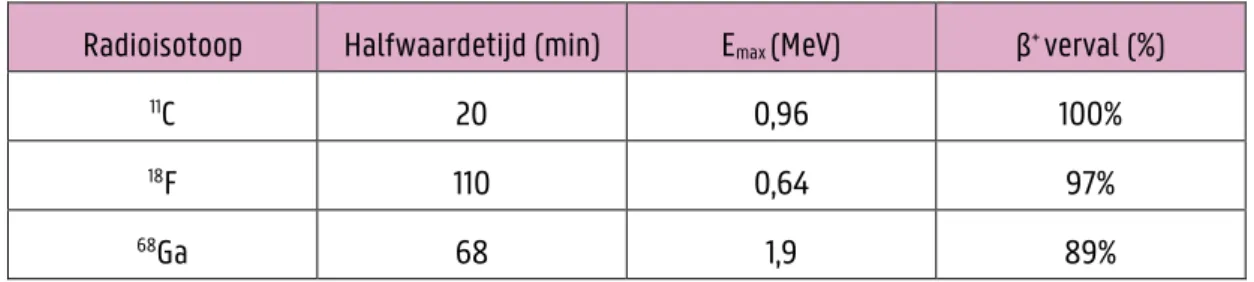
(68Ga) met elk voor- en nadelen. De halfwaarde tijd van 11C is korter dan deze van 18F en 68Ga, wat het minder
praktisch maakt om te gebruiken (Tabel 1.1). Het voordeel dat 18F biedt t.o.v. 68Ga is dat het met een cyclotron
gemaakt kan worden i.p.v. met een generator zoals het geval is bij 68Ga. Hierdoor kan er voor meerdere patiënten
een dosis gemaakt worden per dag terwijl bij een generator het aantal dosissen afhankelijk is van de staat van de generator. Een generator heeft ook voordelen doordat de investering minder groot is dan bij een cyclotron en daarbovenop is een generator draagbaar. Een cyclotron daarentegen is een grote installatie. Een ander voordeel van 18F, naast productie van het radio-isotoop, zijn de fysische eigenschappen van het isotoop. Zo heeft
deze radio-isotoop in vergelijking met 68Ga een hogere positron yield, 96,86% vs. 89,14%, wat voor een hogere
Figuur 1.8: Weergave van de energieniveau's van een scintillator met a = de conductie- en valentieband weergegeven bij een puur kristal zonder een activator en b = bijkomende weergave van de grond-en excitatietoestand indien een activator aanwezig is (57).
13 sensitiviteit zorgt (59). Ook heeft 18F een kortere positron range doordat positronen met een lagere energie
uitgestuurd worden en er zo voor zorgen dat de spatiale resolutie van 18F beter is (43,59–62).
Tabel 1.1: Overzicht van de fysische eigenschappen van 11C, 18F en 68Ga (63).
Radioisotoop Halfwaardetijd (min) Emax (MeV) β+ verval (%)
11C 20 0,96 100%
18F 110 0,64 97%
68Ga 68 1,9 89%
1.4. PET tracers
1.4.1. Fluorodeoxyglucose
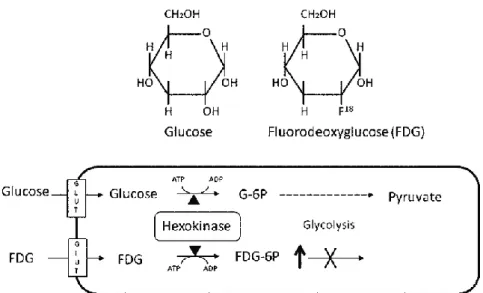
Een glucose analoog [18F]FDG (fluorodeoxyglucose) is de meest gebruikte PET radiotracer in de
oncologie en maakt gebruik van het Warburg Effect (Figuur 1.9). Dit houdt in dat het metabolisme van kankercellen aangepast is om te kunnen instaan voor de groei, proliferatie en overleving van de kankercellen. Het wordt gekarakteriseerd door verhoogde glucoseopname en glucosefermentatie tot lactaat. Glucose wordt opgenomen via de membranaire glucose transporter 1 (GLUT 1) die tot een verhoogde expressie komt in tumoren. Ook vertoont hexokinase II een verhoogde activiteit, dit is een enzyme in de glycolyse dat instaat om glucose te fosforyleren naar glucose-6-fosfaat. Volgens hetzelfde mechanisme wordt [18F]FDG opgenomen en omgezet
naar [18F]FDG-6-fosfaat maar zal het i.p.v. verder te worden gemetaboliseerd, accumuleren in de tumor (Figuur
1.9). [18F]FDG wordt doorgaans niet gebruikt om prostaatkanker te diagnosticeren of te stadiëren doordat
prostaatkanker weinig glucosemetabolisme vertoont in tegenstelling tot andere kankers. Ook is er interferentie bij de interpretatie van de beelden doordat deze tracer geëxcreteerd wordt door de blaas die zich dicht bij de prostaat bevindt. Deze tracer kan echter in bepaalde settings toch gebruikt worden voor diagnose en stadiëring. Zo vertoont [18F]FDG een verhoogde opname in lokale tumoren die een gevorderd klinisch stadium hebben, een
hoge Gleason score (>7) en hoge PSA waarden hebben. Dit werd aangetoond door Oyama et al. (64) die een
sensitiviteit van 64% heeft gerapporteerd bij mannen met een gemiddelde PSA waarde van 251 ng/mL en klinisch gevorderde kanker. Het kan ook gebruikt worden bij BCR maar er dient opgemerkt te worden dat de sensitiviteit stijgt met de PSA waarde (64–66). (67)
14
[18F]FDG kan voornamelijk gebruikt worden om te beoordelen of androgeen deprivatietherapie (ADT)
aanslaat of niet. De [18F]FDG opname in metastasen zal bij ADT verlagen doordat glucose metabolisme
afhankelijk is van de androgeenreceptor. Indien een man een castratie-resistente kanker heeft zal de [18F]FDG
opname stijgen. In de praktijk wordt [18F]FDG hiervoor echter niet gebruikt doordat er nieuwe PET tracers bestaan
die meer sensitief en specifiek zijn in zowel de diagnose en stadiëring van gelokaliseerde tumor en herval als in het monitoren van een behandeling (60,65,66,68).
1.4.2. [18F]NaF
Deze tracer kan gebruikt worden bij botmetastases, een veel voorkomende plaats voor prostaatkankermetastasen maar is niet prostaatkanker specifiek. Het zal enkel botmetastasen zichtbaar maken maar met een goede sensitiviteit. Deze radiotracer zal ook meer botmetastasen detecteren dan [99m
Tc]-gebaseerde botscans (61). Bij beiden is er sprake van vals positieven doordat de tracers ook zullen opgenomen worden door inflammatoire en degeneratieve botziekten bv ziekte van Paget, maar dit is minder het geval voor [18F]NaF (69). Ook dient de kosteneffectiviteit in rekening gebracht worden. Zo zal [18F]NaF PET scan ongeveer
twee maal duurder zijn dan [99mTc]-gebaseerde botscans waardoor bij initiële evaluatie van botmetastasen
vooral dit laatste zal gebruikt worden (61,69,70).
Figuur 1.9: Chemische structuur en werkingsmechanisme van glucose in vergelijking met dat van FDG. Beide worden door GLUT1 opgenomen in de cel en door hexokinase gefosforyleerd. Enkel glucose-6-fosfaat zal verder kunnen gemetaboliseerd worden en FDG zal accumuleren in de cel (67).
15
1.4.3. Choline
Choline is een belangrijke precursor van fosfolipiden en dus ook van het celmembraan. Doordat kankercellen een verhoogde proliferatie vertonen zullen ze meer choline opnemen. Bovendien zal kankerweefsel het enzyme choline kinase tot overexpressie brengen waarvoor choline het substraat is. Verhoogde opname van choline kan echter ook het gevolg zijn van bv. benigne prostaat hyperplasie wat de lage specificiteit van deze tracer verklaart. Zowel 11C als 18F gelabelde choline wordt gebruikt, maar [11C]choline heeft als voordeel dat het
chemisch identiek is aan het endogeen choline terwijl [18F]fluorocholine dit niet is waardoor er
farmacokinetische verschillen zijn (Figuur 1.10). Zo zal [11C]choline via de lever geklaard worden en
[18F]fluorocholine via de nieren. Deze tracer wordt voornamelijk gebruikt om bij BCR de plaats van herval te
lokaliseren, hierbij was de sensitiviteit van [11C]choline hoger dan [18F]FDG (61). Choline wordt niet gebruikt voor
de diagnose en stadiëring van primaire kanker doordat er een brede range is van sensitiviteit en specificiteit. De choline tracer kan ook gebruikt worden om botmetastases op te sporen doordat ze zowel een hogere sensitiviteit als specificiteit heeft dan [99mTc]botscan. Ten opzichte van [18F]NaF heeft choline enkel een hogere specificiteit
(61,70). (71)
1.4.4. [18F]FACBC
Anti-1-amino-3- [18F]- fluorocyclobuaat-1-carbonzuur ([18F]FACBC) dat een leucine analoog is (Figuur 1.11)
en ook als fluciclovine bekend staat, zal verhoogde opname vertonen doordat aminozuur transporters upgereguleerd zijn in prostaatkanker. Fluciclovine wordt ook renaal geëxcreteerd maar de tracer zal zich niet meteen in de nieren bevinden zodat er tijdens de beeldvorming van de prostaat een bepaalde tijd geen interferentie mogelijk is. Deze tracer wordt net zoals choline vooral gebruikt bij BCR om de plaats van herval te lokaliseren maar is sensitiever dan choline. Voor primaire diagnose wordt deze tracer niet gebruikt doordat het ook bij BPH positieve resultaten kan opleveren (61,70). (72)
16
1.4.5. PSMA tracers
Prostaat specifiek membraan antigen (PSMA) is een transmembranair proteïne dat tot overexpressie komt in prostaatkankerweefsel t.o.v. andere weefsels en normaal prostaatweefsel, waardoor het kan gebruikt worden als target voor zowel diagnose als voor therapie. Het komt ook tot overexpressie in tumor neovasculatuur. PSMA heeft verschillende namen toegekend gekregen naargelang de locatie in het lichaam zoals N-geacetyleerd-alpha-gelinkt zuur dipeptidase (NAALADase) in het centraal zenuwstelsel en folaat hydrolase (FOLH1) in de dunne darm. Het staat ook gekend als glutamaat carboxypeptidase II (GCPII) omdat PSMA als katalysator optreedt bij de klieving van glutamaat van peptiden. De functie van PSMA in de prostaat is tot nu toe echter nog niet gekend. Tumor agressiviteit, herval en castratie-resistentie laten de expressie van PSMA stijgen. PSMA radiotracers kunnen gebruikt worden om specifiek te binden met de PSMA-receptor op prostaattumoren en minder op normaal weefsel waardoor gunstige tumor/achtergrond signaal ratio’s kunnen worden bekomen. Een PSMA ligand kan op drie manieren opgebouwd worden: fosfor, thiol of ureum gebaseerd. De ureum gebaseerde liganden zijn de meest onderzochte die meestal bestaan uit de bindingsplaats glutamaat-ureum-lysine (Glu-urea-Lys), een linker en een chelator waaraan het radio-isotoop kan binden. Gelabelde PSMA liganden worden in de klinische setting het meest gebruikt voor BCR doordat ze een goede detectie vertonen bij lage PSA waarden. De volgende die besproken zullen worden zijn: [68Ga]PSMA-11, [18F]DCFBC, [18F]DCFPyL, [18F]PSMA-1007
en [18F]AlF-PSMA-11 (47,70,73–75).
1.4.5.1. [68Ga]PSMA-11
[68Ga]PSMA-HBED-CC, ook [68Ga]PSMA-11 genoemd (Figuur 1.12), is de meest gebruikte PSMA tracer en
wordt doorgaans met een generator gesynthetiseerd. Het kan echter ook via een semi-geautomatiseerde module aangemaakt worden waarbij een radiochemisch rendement wordt bekomen van 95% (76). Momenteel wordt deze tracer voornamelijk gemaakt via een steriele cold kit waarbij een vergelijkbaar rendement kan bekomen worden (77). Deze tracer toont bij de detectie van lymfeknoop metastasen in intermediair tot hoog
17 risico kanker een betere sensitiviteit dan de conventionele beeldvormingstechnieken zoals CT en MRI. Mauer et al. (78) rapporteerde een sensitiviteit en specificiteit van respectievelijk 65,9 en 98,9% voor [68Ga]PSMA-11 PET
vs. 43,9 en 85,4% voor de conventionele beeldvormingstechnieken, CT en MRI. Het voordeel aan [68Ga]PSMA-11 is
dat het kan gebruikt worden bij lage PSA waarden. Calais et al. (79) heeft aangetoond dat deze tracer een hogere detectie gaf in vergelijking met [18F]FACBC bij patiënten met een PSA waarde variërend tussen 0,2 tot 2,0 ng/mL.
Bij BCR rapporteerde Schwenck et al. (80) voor [68Ga]PSMA-11 een hogere detectie voor lymfeknopen en
botmetastasen dan [11C]choline (70). (81)
1.4.5.2. [18F] gelabelde PSMA liganden
De eerste [18F] PSMA radiotracer die ontwikkeld werd is [18F]DCFBC
(N-[N-[1,3-dicarboxypropyl]carbamoyl]-4-[18F]fluorobenzyl-L-cysteïne) (Figuur 1.13) en was ook de eerste die gebruikt werd
in de mens. Echter door de trage klaring uit het bloed zorgt het voor hoge activiteit in het bloed en op die manier voor een hoog achtergrondsignaal. Deze trage klaring is te wijten aan hoge plasma proteïnebinding. 18F kan via
Figuur 1.13: Chemische structuurvan [18F]DCFBC (84).
18
de prothetische groep [18F]fluorobenzylbromide (4-[18F]FBB) gekoppeld worden aan DFCBC. Maese et al. (82)
heeft dit product gesynthetiseerd met een radiochemisch rendement van 16% non decay corrected (n.d.c.). [18F]DCFBC toont in vergelijking met conventionele beeldvorming, zoals CT en botscan, een hogere sensitiviteit
voor BCR. Er werden namelijk bij 60,3% van de patiënten, die voorheen met conventionele beeldvorming negatief testten, minstens één positieve laesie aangetoond (83). (84)
Een andere tracer is ontwikkeld doordat [18F]DCFBC door het hoge achtergrondsignaal in het bloed,
interferentie kan vertonen bij de detectie van laesies in lymfeknopen die zich naast grote bloedvaten bevinden. Deze tracer is [18F]DCFPyL
(2-(3-{1-carboxy-5-[(6-[18F]fluoro-pyridine-3-carbonyl)-amino]-pentyl}-ureido)-pentaandizuur) (Figuur 1.14) en heeft in vitro aangetoond een tot vijf keer hogere affiniteit te hebben voor PSMA
dan [18F]DCFBC. Daarbovenop vertoont deze tracer verhoogde klaring waardoor een betere tumor/achtergrond
ratio wordt bekomen in vergelijking met DCFBC. Het radio-isotoop 18F kan via 6-[18F]fluoronicotine zuur
tetrafluorofenyl ester ([18F]F-Py-TFP) geïntroduceerd worden. Chen et al. (85) rapporteerde met hun synthese
een radiochemisch rendement van 36,0–53,0% decay corrected (d.c.) op basis van de startende hoeveelheid 18F.
Deze tracer is ook bruikbaar voor detectie van metastasen. Szabo et al. (86) heeft namelijk aangetoond in patiënten met prostaatkanker dat deze tracer hoge opname vertoont in zowel metastasen als in de primaire prostaatkanker zelf. Dietlein et al. (87) heeft gerapporteerd dat [18F]DCFPyL in staat was om minstens één laesie
meer te detecteren in drie patiënten dan [68Ga]PSMA-11 in een totaal van 14 patiënten met BCR waardoor
[18F]DCFPyL als een goed alternatief kan beschouwd worden.(88)
Een recentere tracer is [18F]PSMA-1007 (Figuur 1.14) waarbij het radio-isotoop via ([18F]F-Py-TFP)
gekoppeld wordt aan de precursor. Dit werd door Cardinale et al. (89) gesynthetiseerd met een radiochemisch rendement van 1,5–6,0% n.d.c.. Deze synthese werd geoptimaliseerd door geautomatiseerde syntheses, waarbij radiochemische rendementen van 24,3–82,4%; 43,3–52,8%; 59,5–72,8% kunnen worden bereikt afhankelijk van
19 welke radiosynthesizer er gebruikt wordt (90). Deze tracer wordt geklaard door de lever i.p.v. de nieren wat een voordeel biedt voor beeldvorming van laesies in de pelvisstreek. Giesel et al. (91) heeft een sensitiviteit van 81,3%
gerapporteerd doordat [18F]PSMA-1007 in minstens 204 van de 251 patiënten met BCR na prostatectomie één
laesie aangaf die suggestief was voor herval van prostaatkanker. Bij PSA waarden 0,2–0,5 ng/mL heeft deze tracer nog een detectiegraad van 61,5% terwijl dit in vergelijking met [68Ga]PSMA-11 in de literatuur 46–58% is
(91). Giesel et al. (92) heeft deze tracer ook vergeleken met [18F]DCFPyL in 12 patiënten, met net
gediagnosticeerde kanker die nog niet behandeld werd, d.m.v. een cross-over studie. Hierbij zijn alle laesies die gedetecteerd zijn bij de ene ook te zien bij de andere tracer. De twee tracers zijn enkel verschillend in hun distributie karakteristieken doordat [18F]PSMA-1007 lagere opname vertoont in de nieren, blaas en
speekselklieren dan [18F]DCFPyL. Het vertoont wel hogere opname in de lever, galblaas, spleen, pancreas, spieren,
sublinguale en submandibulaire klieren. Doordat [18F]PSMA-1007 dus een verhoogde leveropname heeft maar
een lagere renale klaring, kan volgende hypotheses gesteld worden dat [18F]PSMA-1007 gevoeliger zou zijn voor
laesies in de nabijheid van de nieren en [18F]DCFPyL gevoeliger zou zijn voor levermetastasen (70)(92).
[18F]DCFBC, [18F]DCFPyL en [18F]PSMA-1007 binden het radio-isotoop 18F op een covalente manier. De
eerder besproken tracer, PSMA-11 bindt 68Ga op een coördinatieve manier doordat er hier sprake is van een
chelatie. Hierbij treedt HBED-CC op als chelator. PSMA-11 kan echter ook via deze chelator binden met 18F via
aluminium om zo [18F]AlF-PSMA-11 te vormen (Figuur 1.14). Studies van Malik et al. (93) en Boschi et al. (94)
hebben de optimalisatie van [18F]AlF-PSMA-11 in kaart gebracht door verschillende parameters te testen zoals de
concentratie aan halogeniden, precursor, temperatuur, hoeveelheid ethanol en reactietijd. Hierbij zijn goede verval gecorrigeerde radiochemische rendementen bekomen maar was dit slechts in lage hoeveelheden. Om opschaling mogelijk te maken heeft Kersemans et al. (95) een geautomatiseerde methode ontwikkeld die wel een lagere radiochemisch rendement geeft van 21%. Deze waren echter niet verval gecorrigeerd waardoor rechtstreekse vergelijking niet mogelijk is. Lütje et al. (96) heeft [18F]AlF-PSMA-11 vergeleken met [68Ga]PSMA-11
waarbij de tumoropname niet verschillend was. De nieren en bot daarentegen toonden wel een verschil, zo was de opname in de nieren groter voor [68Ga]PSMA-11 en de opname in het bot groter voor [18F]AlF-PSMA-11 wegens
defluorinatie. Piron et al. (97) heeft deze defluorinatie verder onderzocht en toonde aan dat deze defluorinatie niet gecorreleerd is aan botactiviteit doordat vrij 18F snel geklaard wordt (88).
20
2. OBJECTIEVEN
Beeldvorming is belangrijk in de stadiëring van primaire prostaattumoren, detectie van metastasen als ook bij de evaluatie van BCR. PSMA kan als target gebruikt worden voor de PET-scan. De expressie van PSMA is ruimschoots onderzocht in functie van tumoragressiviteit en castratie-resistentie. Er is echter nog weinig onderzoek gedaan naar PSMA expressie tijdens de natuurlijke progressie van hormoongevoelige naar castratie-resistente prostaatkanker. De meest onderzochte diagnostische PSMA tracer is [68Ga]PSMA-11, maar omwille van
de productiemethode en fysische eigenschappen geniet labeling met 18F toch de voorkeur. Om deze redenen is
er naar analogie [18F]AlF-PSMA-11 ontwikkeld. In deze masterproef wordt [18F]AlF-PSMA-11 verder in vitro
geëvalueerd.
Ten eerste wordt de androgeenreceptor expressie in functie van de LNCaP celsplitsingen onderzocht m.b.v. de western blot methode. Hiervoor worden er verschillende celsplitsingen gemaakt uit LNCaP cellen die worden opgegroeid in compleet medium. Er wordt ook een androgeenonafhankelijke LNCaP cellijn opgegroeid in androgeenvrij medium om de vergelijking te maken met de eerder bekomen androgeenreceptor expressies.
Ten tweede wordt de PSMA expressie in LNCaP cellen in functie van de androgeengevoeligheid geëvalueerd. Hiervoor worden dezelfde LNCaP celsplitsingen gebruikt als bij de evaluatie van de androgeenreceptor expressie. Het is de bedoeling om de expressie van de androgeenreceptor en de PSMA-receptor te kunnen correleren met elkaar.
Ten laatste wordt de internalisatiecapaciteit van [18F]AlF-PSMA-11 in vitro geëvalueerd in LNCaP cellen.
De internalisatie wordt onderzocht in functie van verschillende incubatietijden met [18F]AlF-PSMA-11. Deze
informatie kan inzicht geven over een ideale duurtijd tussen de intraveneuze injectie met de tracer en het uitvoeren van de PET scan.
21
3. MATERIAAL EN METHODEN
3.1. REAGENTIA
Product Specificatie Producent lotnummer
Acrylamide : N,N’-Methyleenbisacrylamide
37,1 : 1 oplossing Sigma-Aldrich, Steinheim,
Duitsland
# BCCB3204
Ammonium persulfaat ≥98% Sigma-Aldrich, Steinheim,
Duitsland
# MKCK1276
Bovine Serum Albumine Gelipofiliseerd poeder, in
essentie vetzuur vrij, ≥96%
Sigma-Aldrich, Steinheim, Duitsland
# SLBL9834V
Calciumchloride Anhydrisch, granulair, ≤ 7,0 mm,
≥93%
Sigma-Aldrich, Steinheim, Duitsland
# BCBM3835V
D-(+)-glucose Minimum 99,5% Sigma-Aldrich, Steinheim,
Duitsland
89H0150
Dulbecco’s fosfaat gebufferd saline (DPBS)
Gibco 2169397
Glycine ≥99,0% Sigma-Aldrich, Steinheim,
Duitsland
# SLBX4949
HEPES ≥99,5% Sigma-Aldrich, Steinheim,
Duitsland
# SLBV3740
Kaliumchloride Sigma-Aldrich, Steinheim,
Duitsland
053K0104
Magnesiumchloride Anhydrisch, ≥98% Sigma-Aldrich, Steinheim,
Duitsland
# SLBQ9064V
Natriumchloride ≥99,5% Sigma-Aldrich, Steinheim,
Duitsland
# SLBQ5226V
Odyssey blocking buffer Li-cor , Nebraska, VS 927-40000
Phosphate buffered saline (PBS) pH 7,4 voor 1L oplossing te maken Sigma-Aldrich, Steinheim, Duitsland # SLCC6084
22
Product Specificatie Producent lotnummer
RPMI medium 1640 (1X) Gibco 2131868
Sodium dodecyl sulfate (SDS)
≥98,5% Sigma-Aldrich, Steinheim,
Duitsland
# SLBW7157
Tromethamine (TRIS) Sigma-Aldrich, Steinheim,
Duitsland
# 068H0096
Trypan blauw 0,4% 0,85% NaCl Lonza 0000687109
Trypsine-EDTA (1X) 0,05% Gibco 25300-054
3.2. CELLIJNEN
Bij de experimenten wordt er gebruik gemaakt van LNCaP, C4-2 en PC-3 cellijnen. De LNCaP cellijn zijn menselijke cellen afkomstig van een 50-jarige Kaukasische man die geïsoleerd werden uit een metastase van prostaatkanker in de linker supraclaviculaire lymfe knoop. C4-2 cellen ontstaan door subcutane xenotransplantatie van LNCaP cellen in gecastreerde muizen. Zowel C4-2 als LNCaP cellen zijn PSMA positieve cellen. PC-3 cellen werden geïsoleerd uit beenmetastasen van een graad IV prostaatkanker van een 62-jarige Kaukasische man en dienen als negatieve controle doordat deze cellen PSMA niet tot expressie brengen (98– 100).
3.3. METHODEN
3.3.1. Isotoop [18F]
Door de fysische eigenschappen van 18F biedt dit isotoop een goede optie voor radiolabeling van PET
tracers. Het heeft een halfwaarde tijd van 109,7 min, een positron energie van 635keV en vertoont voor 97% β+
verval. De productie van 18F gebeurt a.d.h.v. een cyclotron waarbij er gebruik kan gemaakt worden van H 218O, 18O2
of Neongas als target. Naargelang de target die gebruikt wordt zal de aggregatietoestand van het bekomen 18F
verschillen. Zo zullen versnelde protonstralen via de reactie 18O(p,n)18F op H
218O vloeibaar [18F]fluoride geven,
indien 18O
2 gas als target wordt gebruikt zal [18F]fluorine onder gasvorm worden bekomen als [18F]F2. Dit laatste
kan ook gevormd worden uit Neongas via 20Ne(D,α)18F indien deze door deuterium ionen zijn beschoten. De keuze
23 nucleofiele of elektrofiele substitutiereactie of een chelatie. Zo zal [18F]fluoride kunnen gebruikt worden in een
nucleofiele reactie terwijl [18F]fluorine gebruikt wordt in een elektrofiele reactie. De verschillende
productiemethodes zullen ook een verschil geven in de specifieke activiteit van het bekomen 18F. De specifieke
activiteit van [18F]fluoride zit in een range van 100 GBq/µmol en is daarmee hoger dan dat van [18F]fluorine, dat
100-600 MBq/µmol is. [18F]fluoride zal echter in waterig milieu HF vormen en onreactief worden waardoor er
voor nucleofiele substitutie een anhydrisch milieu nodig is. Indien [18F]fluoride gebruikt wordt voor chelatie is er
geen anhydrisch milieu nodig. Deze zal binden met een bindingsenergie van 670 kJ/mol aan aluminium dat vervolgens kan complexeren met chelatoren waaraan een peptide gebonden is. Op deze manier kan er makkelijk en op een snelle manier een gewenste peptide met 18F gelabeld worden. Daarbovenop is er hier geen nood aan
een droogstap wat wel nodig is bij [18F]fluoride voor een nucleofiele substitutiereactie (101,102).
3.3.1. BCA proteïne assay
De Pierce BCA proteïne assay kit (Thermo Fisher Scientific, Illinois, VS) wordt gebruikt om een proteïnebepaling uit te voeren op cellen. Deze assay maakt gebruik van de reductie van Cu2+ naar Cu1+ door
proteïnen die zich in een alkalisch medium bevinden. Meer specifiek zullen de peptidebindingen ervoor zorgen dat er een chelatie optreedt met Cu2+ in alkalisch milieu, waardoor de reductie naar Cu1+ gebeurt en een
lichtblauw complex gevormd wordt. De kleur van het complex hangt af van de concentratie aan peptidebindingen. Het gevormde ion Cu1+ kan vervolgens met twee moleculen van bicinchonine zuur een chelatie
vormen die leidt tot een paarse kleur. Deze kleur kan vervolgens met UV detectie gemeten worden op 562nm. Deze kit bevat ook een stockoplossing bovine serum albumine (BSA) die kan gebruikt worden om een standaardreeks te maken (103).
3.3.2. Western blot
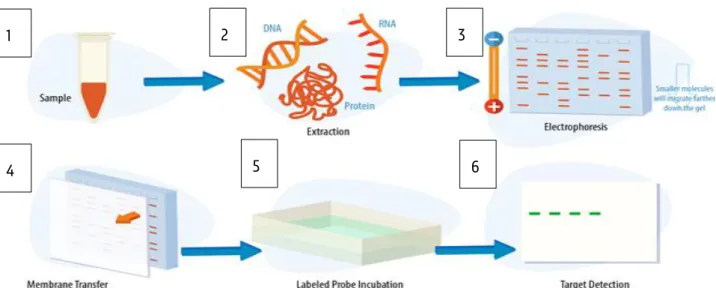
Western blot is een techniek die gebruikt wordt om proteïnen van elkaar te scheiden en te identificeren. Hierbij wordt een staalvoorbereiding uitgevoerd door de proteïnen te extraheren (stap 1 en 2 Figuur 3.1). Door middel van gel elektroforese worden proteïnen vervolgens van elkaar gescheiden op basis van moleculair
gewicht en ladingwaardoor er banden worden verkregen (stap 3 Figuur 3.1). Meer specifiek wordt er gebruik
gemaakt van natrium dodecyl sulfaat polyacrylamide gel elektroforese (SDS-PAGE). PAGE zal als zeef fungeren waardoor peptiden migreren. Hierbij zullen kortere peptiden verder kunnen migreren dan langere peptiden om op die manier te worden gescheiden. In deze masterproef wordt gebruik gemaakt van een discontinue buffer systeem wat inhoudt dat er boven op de scheidingsgel een ladingsgel komt. Deze gel zorgt ervoor dat er een
24
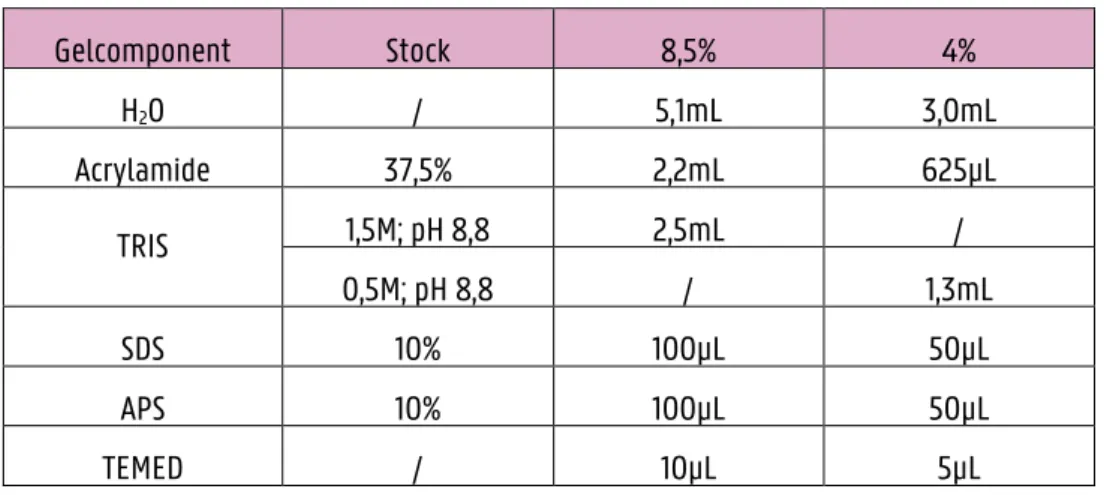
betere resolutie wordt bekomen doordat de proteïnen op elkaar worden gestapeld. Op die manier zullen de proteïnen op hetzelfde moment de scheidingsgel bereiken wat niet het geval is bij het gebruik van een scheidingsgel alleen. SDS is een negatief geladen surfactans en zal ervoor zorgen dat proteïnen extra gedenatureerd worden doordat het bindt met positief geladen aminozuren van het peptide. Daarbovenop zorgt SDS er zo voor dat proteïnen negatief geladen worden met als gevolg dat de scheiding vlotter kan verlopen en enkel gebeurt o.b.v. moleculair gewicht wanneer een elektrisch veld wordt aangelegd. Er kan gekozen worden voor verschillende gelpercentages waarbij de concentratie van acrylamide en het gewichtspercentage van bisacrylamide een rol spelen. Dit percentage bepaalt de poriegrootte en wordt gekozen in functie van het moleculair gewicht van het gewenste proteïne (Tabel 3.1)(104). (105)
Tabel 3.2: Moleculair gewicht van het gewenst proteïne bepaalt het percentage van de gel (106).
Moleculair gewicht proteïne (kDa) Gel percentage (%)
4-40 20
12-45 15
10-70 12,5
15-100 10
25-100 8
De banden die verkregen worden door elektroforese, worden getransfereerd op een membraan (stap 4 Figuur 3.1) zodat deze na incubatie met een gelabeld antilichaam zichtbaar kunnen gemaakt worden. Er bestaan Figuur 3.1: Schematische voorstelling van de stappen die uitgevoerd worden bij western blot met 1 = staal, 2 = extractie van DNA, RNA of proteïnen, 3 = elektroforese, 4 = transfer naar membraan, 5 = incubatie met antilichaam en 6 = detectie van gewenste proteïne (105).
1 2
6 5
3
25 twee soorten membranen: nitrocellulose of polyvinylideen fluoride (PVDF). Indien gebruik gemaakt wordt van een PVDF membraan dient deze eerst geactiveerd te worden met methanol. Het membraan wordt vervolgens m.b.v. een blockingbuffer geblokkeerd zodat niet-specifieke bindingsplaatsen op het membraan bezet worden en niet meer beschikbaar zijn om te binden met het antilichaam. Er bestaan verschillende blockingbuffers voor western blotting zoals gelatine, niet-vettig gedroogde melk, bovine serum albumine en tween 20. Allemaal kunnen ze gebruikt worden bij een nitrocellulose membraan maar slechts niet-vettig gedroogde melk en BSA kunnen gebruikt bij een PVDF membraan. Na blocking wordt het membraan geïncubeerd met een primair antilichaam dat specifiek zal binden aan het proteïne waarin men geïnteresseerd is (stap 5 Figuur 3.1). Nadien gebeuren er wasstappen om ervoor te zorgen dat het overtollig primair antilichaam wordt verwijderd en wordt er geïncubeerd met een gelabeld secundair antilichaam. Dit zal binden op een herkenningsplaats van het primair antilichaam en zorgt voor de visualisatie van het proteïne bij detectie (stap 6 Figuur 3.1). Hiervoor kan een fluorescent ligand gebruikt worden dat gebonden is aan het secundair antilichaam. Een andere optie is een enzyme dat in staat is om een toegevoegd substraat om te zetten in een gekleurd product (colorimetrie) of dat ervoor zorgt dat er bij de reactie van het substraat naar het overeenkomstig product licht vrijkomt (luminescentie). Om identificatie van het proteïne mogelijk te maken, wordt een proteïneladder als referentie gebruikt. Dit bestaat uit een combinatie van proteïnen met een gekend moleculair gewicht uitgedrukt in kDa. Western blot kan ook gebruikt worden als een semi-kwantitatieve methode doordat de intensiteit van een bandje kan gebruikt worden om de hoeveelheid proteïne te bepalen. In deze masterproef wordt de western blot gebruikt om de androgeenreceptor te scheiden en te kwantificeren en zal de detectie gebeuren a.d.h.v. een infrared dye fluorescent label (106–108).
3.3.3. Celtest
Bij de celtest worden er twee zaken onderzocht: de expressie van de PSMA-receptor in LNCaP cellen in functie van celsplitsingen en de internalisatie van [18F]AlF-PSMA-11 met de PSMA-receptor in één bepaalde LNCaP
cellijn in functie van de incubatietijd met de tracer. Bij expressie wordt de specifieke opname van de tracer geëvalueerd. Naarmate de celsplitsingen stijgen zal de androgeensensitiviteit dalen samen met de expressie van de PSMA-receptor. De androgeenreceptor fungeert indien het gebonden is met het overeenkomstig ligand, als transcriptiefactor en zal de expressie van de receptor downreguleren. Hierdoor zal bij ADT de PSMA-receptor expressie upreguleren. Om de expressie van de PSMA-PSMA-receptor te bepalen worden de cellen van elke cellijn twee maal uitgeplaat in poly-D-lysine gecoate platen en worden ze respectievelijk geïncubeerd met [18F]AlF-PSMA-11 en [18F]AlF-PSMA-11 gecombineerd met 2-(fosfonomethyl)pentaandizuur (2-PMPA). 2-PMPA is
26
een selectieve en potente inhibitor van glutamaat carboxypeptidase en dus ook van de PSMA-receptor en heeft een inhibitie constante van 0,3nM. Op deze manier zal deze inhibitor ervoor zorgen dat [18F]AlF-PSMA-11 niet
meer kan binden op de PSMA-receptor. Indien [18F]AlF-PSMA-11 hierbij toch opname vertoont in de cellen, zal er
radioactiviteit gemeten worden en wordt er gesproken van aspecifieke opname. Dit resultaat wordt vervolgens gebruikt om de specifieke opname te berekenen (Formule 3.1). Hetzelfde wordt gedaan voor internalisatie om de specifieke opname van [18F]AlF-PSMA-11 in LNCaP cellen te bepalen bij verschillende incubatieperiodes met
de tracer. De gebruikte methode bij internalisatie is hetzelfde als bij expressie, maar hierbij wordt één extra stap uitgevoerd voordat de cellen gelyseerd worden met NaOH. Er wordt namelijk glycine toegevoegd aan de cellen wat ervoor zal zorgen dat de gebonden tracer loskomt van de PSMA-receptor. Deze stap wordt uitgevoerd zodat men enkel de radioactiviteit meet die zich in de cel bevindt en niet de activiteit die gebonden is aan het celoppervlak via de PSMA-receptor. Tijdens de celtest wordt er ook een BCA test uitgevoerd zodat de gemeten radioactiviteit kan gecorrigeerd worden voor de hoeveelheid cellen (109–111).
𝑠𝑝𝑒𝑐𝑖𝑓𝑖𝑒𝑘𝑒 𝑜𝑝𝑛𝑎𝑚𝑒 = 𝑡𝑜𝑡𝑎𝑙𝑒 𝑜𝑝𝑛𝑎𝑚𝑒 − 𝑎𝑠𝑝𝑒𝑐𝑖𝑓𝑖𝑒𝑘𝑒 𝑜𝑝𝑛𝑎𝑚𝑒
Formule 3.1: Specifieke opname van [18F]AlF-PSMA-11 wordt bepaald door de totale opname te verminderen met
de aspecifieke opname.
3.3.4. Inoculatie in muizen
Voor de in vivo evaluatie van [18F]AlF-PSMA-11 wordt er gebruik gemaakt van mannelijk naakte muizen
die niet beschikken over een thymus waardoor deze muizen T-cel deficiënt en ook deels B-cel deficiënt zijn. Deze muizen worden geïnjecteerd met LNCaP cellen gecombineerd met Matrigel matrix (Corning, Massachusetts, VS). Deze Matrigel matrix is een oplosbaar basaal membraanpreparaat dat geëxtraheerd is uit een extracellulair matrixproteïne rijke tumor, een Engelbreth-Holm-Swarm muissarcoom. Deze proteinen zijn onder meer collageen, laminine, groeifactoren, heparansulfaat proteoglycanen en entactine. Dit zijn elk belangrijke elementen van het basale membraan, behalve de groeifactoren. Deze Matrigel matrix zal helpen om een sarcoom, een kankervorm die groeit in bindweefsel, te laten opgroeien in muizen. De menselijke prostaatkankercellen worden namelijk niet ingebracht in de prostaat van de muis maar worden ter hoogte van de schouderbladen geïnjecteerd. De muis zal op elke schouder geïnoculeerd worden met 5 miljoen LNCaP cellen per tumor (112,113).

![Figuur 1.11: Chemische structuur van [ 18 F]FACBC) (72).](https://thumb-eu.123doks.com/thumbv2/5doknet/3295089.22146/34.892.325.571.123.292/figuur-chemische-structuur-van-f-facbc.webp)
![Figuur 1.13: Chemische structuur van [ 18 F]DCFBC (84).](https://thumb-eu.123doks.com/thumbv2/5doknet/3295089.22146/35.892.264.635.366.601/figuur-chemische-structuur-van-f-dcfbc.webp)
![Figuur 1.14: Chemische structuren van respectievelijk [ 18 F]DCFPyL, [ 18 F]PSMA-1007 en [ 18 F]AlF-PSMA-11 (88)](https://thumb-eu.123doks.com/thumbv2/5doknet/3295089.22146/36.892.90.812.740.930/figuur-chemische-structuren-respectievelijk-dcfpyl-psma-alf-psma.webp)