BESTAANDE MISCONCEPTEN ROND
OPLOSBAARHEID
IN
WATER
BIJ
LEERLINGEN UIT DE TWEEDE GRAAD
ASO IN VLAANDEREN
Aantal woorden: 9722
Jorku Hanssen
Studentennummer: 01502151Promotor(en): Prof. dr. Katrien Strubbe, dr. Hans Vanhoe
Masterproef voorgelegd tot het behalen van de graad van de Educatieve Master in de “engineering en technologie”
2
Inhoudstabel
Voorwoord ...4
Corona preambule ...5
Lijst met afkortingen ...6
Lijst met figuren ...7
Lijst met tabellen ...7
Abstract ...8
Inleiding ...9
Onderzoeksvragen ... 10
Literatuurstudie ... 11
1
Inleiding ... 11
2
Algemene kenmerken binnen het vak chemie ... 12
2.1 De opbouw van het vak chemie ... 12
2.2 De scheikundige driehoek ... 13
3
Misconcepten rond oplosbaarheid van stoffen in water ... 14
3.1 Opbouw van de materie ... 14
3.1.1 De ionbinding ... 17
3.1.2 De covalente binding ... 18
3.1.3 Het begrip elektron ... 19
3.2 De rol van water bij het oplosproces ... 20
3.2.1 Water als molecule ... 20
3.2.2 Waterstofbruggen en intermoleculaire krachten ... 20
3.2.3 Oplossen van ionverbindingen in water ... 21
3.3 Notatiefouten ... 22
3.3.1 Dissociatievergelijking... 22
3.3.2 Index en coëfficiënt ... 24
3
3.4.1 Definitie ENW ... 24
3.4.2 Polariteit bepalen verbindingen ... 24
Onderzoeksdesign ... 25
Resultaten en discussie foutenanalyse ... 27
1
Opbouw van de materie ... 27
2
Rol van water bij het oplosproces ... 30
3
Notatiefouten ... 35
4
Polariteit ... 39
5
Vergelijken klasgroepen ... 42
6
Opbouw cursussen ... 43
7
Voorkomen en wegwerken van misconcepten in de chemie ... 45
7.1 EXPlainistry ... 45 7.2 Meerdere representaties ... 46
Besluit ... 48
Reflectie ... 49
Verder onderzoek ... 49
Referenties ... 50
Bijlage A: Foutenanalyse ... 52
Bijlage B: Opbouw van het leermateriaal ... 58
Leerwerkboek ION 4.1 uitgeverij Van In (pg 67-89) ... 58
Leerwerkboek ION 4.2 uitgeverij De Boeck (pg 97-130) ... 59
4
Voorwoord
Beste lezer van deze masterproef.
Dit eindwerk handelt over veelvoorkomende fouten die gemaakt worden door leerlingen van de 2de graad algemeen secundair onderwijs (ASO) bij het onderdeel ‘oplosbaarheid van stoffen in water’. Door middel van een foutenanalyse van toetsen en examens wordt een beeld geschetst van de bestaande misconcepten bij deze leerlingengroep.
Ik heb dit onderwerp gekozen omdat hoe deeltjes zijn opgebouwd de basis is bij het begrijpen van vele processen in waterig milieu. Het lijkt mij interessant om na te gaan welke misconcepten hier heersen. Dit onderzoek heeft mij inzicht gegeven in veelvoorkomende misconcepten en preconcepten van leerlingen en hoe deze kunnen worden vermeden. Leerlingen hebben vaak moeilijkheden bij het visualiseren van processen die plaatsvinden op het submoleculair niveau. Hiermee kan ik in de toekomst rekening houden bij de lesvoorbereidingen bij de lessen natuurwetenschappen (chemie, fysica en biologie). Omdat gebruik wordt gemaakt van toetsen en examens van een vorig schooljaar, kan deze foutenanalyse bovendien thuis worden uitgevoerd.
Ik wil Dr. Hans Vanhoe en Ilse Mariën bedanken voor het bezorgen van de toetsen en examens van de klasgroepen, alsook het leermateriaal gebruikt door de chemieleerkrachten. Daarnaast wil ik Prof. Dr. Katrien Strubbe bedanken voor de begeleiding gedurende deze educatieve masterproef, alsook Hans Vanhoe en Ilse Mariën. Zij waren alle drie online beschikbaar bij vragen en hebben mij tips, feedback en sturing gegeven, waarvoor dank.
5
Corona preambule
Deze masterproef handelt over misconcepten binnen de chemie, meer specifiek over het gedeelte oplosbaarheid van stoffen in water. De onderzoeksopzet van deze masterproef bestaat uit twee delen, namelijk een literatuurstudie en een foutenanalyse.
Om de bestaande misconcepties in kaart te brengen, is eerst een literatuurstudie uitgevoerd. Er wordt bekeken welke misconcepten algemeen bestaan over het gedeelte oplosbaarheid in water. De gevonden misconcepten worden opgedeeld in vier categorieën. Via de Universiteit Gent heb ik toegang tot wetenschappelijke artikels, dus dit gedeelte kon thuis worden uitgewerkt.
Vervolgens wordt een foutenanalyse uitgevoerd van toetsen en examens die handelen over het gedeelte ‘oplosbaarheid van stoffen in water’ uit het leerplan chemie van de 2de graad ASO. Er wordt gebruik gemaakt van toetsen en examens uit het GO! Onderwijs Vlaanderen (Instituut van Gent (IVG-Gent)) en het KOV (Don Boscocollege Zwijnaarde). De leerlingen die de toetsen en examens gemaakt hebben zijn de leerlingen die 1u of 2u chemie volgen in het 4de jaar ASO. De toetsen en examens heb ik gekregen voor de Corona periode, dus dit heeft de onderzoeksopzet niet gehinderd.
Om de resultaten van de klasgroepen en scholen met elkaar te vergelijken, zal het gebruikte leermateriaal worden vergeleken. Voor de Corona periode was er sprake van een lesobservatie bij de desbetreffende leerkrachten. Dit is helaas niet kunnen doorgaan wegens overmacht, maar zal nauwelijks invloed hebben op het resultaat van deze masterproef. De invloed van corona was dus eerder beperkt.
6
Lijst met afkortingen
ASO: Algemeen secundair onderwijs
ENW: Elektronegatieve waarde
GO !: Gemeenschapsonderwijs
IVG : Instituut van Gent
KOV: Katholiek onderwijs Vlaanderen
LPD: Leerplandoelstellingen
7
Lijst met figuren
Figuur 1: Vakstructuur chemie ... 12
Figuur 2: Scheikundige driehoek van Johnstone ... 13
Figuur 3: Misconceptie zouten en zoutoplossingen ... 15
Figuur 4: Het speciale periodiek systeem ... 16
Figuur 5: Conceptenkaart soorten verbindingen ... 16
Figuur 6: Samenvatting formule-eenheid en molecule ION 3 GO! ... 18
Figuur 7: Bindingscontinuüm ... 18
Figuur 8: Elektronendichtheidskaart NaCl (links) en H2 (rechts) ... 19
Figuur 9: Waterstofbruggen ... 21
Figuur 10: Misconcepten dissociatie NaCl in water. Geen interactie tussen NaCl en water (links); Wel interactie (rechts) ... 22
Figuur 11: Symbolische visualisatie zouten en zoutoplossingen ... 23
Figuur 12: Misconcept structuur NaCl ... 27
Figuur 13: Misconcept oplossen ionverbinding water (antwoord toets) ... 30
Figuur 14: Visualisatie oplosproces NaCl in water cursus mevr. Pottie ... 44
Figuur 15: Visualisatie waterstofbruggen ION GO! 4.2 (links) en cursus mevrouw Pottie (rechts)... 44
Figuur 16: Procedure van de EXPlainistry methode ... 45
Figuur 17: Gebruik visualisatie apps door leerkrachten ... 46
Figuur 18: Visualisatie voor een stopmotion video ... 46
Figuur 19: Tekeningen water in de verschillende aggregatietoestanden: voor instructie (links) en na instructie (rechts) ... 47
Lijst met tabellen
Tabel 1: Klasgroepen foutenanalyse ... 25Tabel 2: Voorbeeld uitwerking foutenanalyse ... 26
Tabel 3: Foutieve antwoorden: Opbouw van de materie ... 29
Tabel 4: Foutieve antwoorden: Rol van water ... 32
Tabel 5: Foutieve antwoorden: Notatiefouten ... 37
8
Abstract
Een algemeen probleem binnenin het chemieonderwijs is de relatie leggen tussen de echte wereld (macroscopisch niveau), het moleculair niveau en het symbolisch niveau. Beginnende leerlingen chemie vertonen zeer veel moeilijkheden bij het heen-en-weer denken tussen deze niveaus.
Het doel van deze masterproef is het identificeren van misconcepten bij leerlingen uit Vlaanderen uit de 2de graad algemeen secundair onderwijs (ASO) over het onderdeel “oplosbaarheid van stoffen in water”. Er werd een kwalitatieve foutenanalyse uitgevoerd bij vier klasgroepen van gemiddeld 25 leerlingen uit twee verschillende scholen uit Vlaanderen.
Uit deze foutenanalyse blijkt dat Vlaamse leerlingen soortgelijke misconcepten vertonen dan reeds geweten uit de literatuur. Enkele voorbeelden van veelvoorkomende misconcepten uit dit onderzoek zijn: het begrip elektronegatieve waarde , atomen/ionen/moleculen en deeltjes door elkaar gebruiken, ladingen vergeten noteren bij dissociatie- en ionisatievergelijkingen, het δ-symbool noteren bij een gehydrateerd ion, intermoleculaire bindingen zijn hetzelfde als intramoleculaire bindingen,… Veel van deze misconcepten houden verband met een verkeerd inzicht in de opbouw van de materie, waarbij leerlingen in bepaalde contexten geen onderscheid maken tussen ionverbindingen en moleculen.
Deze misconcepten ontstaan wanneer leerlingen geen linken kunnen leggen tussen de verschillende verwerkingsniveaus (macroscopisch, submicroscopisch en formalistisch). Dit blijkt ook uit de foutenanalyse. Om deze misconcepten weg te werken zijn er bepaalde suggesties gedaan die kunnen worden toegepast tijdens het lesgeven, bijvoorbeeld het gebruik van de leermethode EXPlainistry en het gebruik maken van meerdere representaties. Beide methodes focussen op het tekenen van representaties op het submicroscopisch niveau.
9
Inleiding
Elke leerling heeft preconcepten over onderwerpen die in de klas worden behandeld. Dat zijn opvattingen die leerlingen hebben over elk onderwerp dat behandeld zal worden tijdens de lessen. Het doet er niet toe in welk vak dit onderwerp wordt behandeld, als het onderwerp belangrijk is, zullen de leerlingen er altijd een eigen mening over hebben. Vaak zijn die eigen meningen of opvattingen anders dan de werkelijkheid. Soms zijn ze ook helemaal verkeerd en dan hebben we het over misconcepties. [1, 2]
Het is bekend onder chemieleerkrachten, maar ook onderzoekers in het domein van (natuur-) wetenschappelijk onderwijs, dat chemie een moeilijk vak is voor de meeste leerlingen. Dat is toe te schrijven aan verschillende redenen, o.a.: chemie behandelt onderwerpen die een abstracte denkwijze vereisen en leerlingen hebben vaak moeite met deze denkwijze. Het abstracte zit hem vooral in het feit dat moleculen en deeltjes op submicroscopisch niveau worden gebruikt om chemische verschijnselen op macroscopisch niveau te verklaren. Hiervoor worden formules en notaties gebruikt, die alles abstract maken. Het chemieonderwijs situeert zich op drie verwerkingsniveaus (macroscopisch, submicroscopisch en formalistisch) en leerlingen zijn niet zo sterk in het heen-en-weer denken tussen deze niveaus. [3]
Eén van de onderwerpen waar de leerlingen moeite mee hebben is: ‘oplosbaarheid van stoffen in water’. In dit onderzoek zullen een aantal van deze misconcepties in kaart worden gebracht via een literatuurstudie. Vervolgens wordt een foutenanalyse van toetsen en examens van Vlaamse leerlingen uit het 4de jaar ASO uitgevoerd. Daarna wordt nagegaan of de misconcepties, aangetroffen in de literatuur, ook terug te vinden zijn bij deze Vlaamse leerlingen en of er eventueel andere misconcepten worden teruggevonden. Ten slotte wordt nagegaan hoe deze misconcepties kunnen worden voorkomen of weggewerkt.
10
Onderzoeksvragen
Deze educatieve masterproef handelt over misconcepten die Vlaamse leerlingen uit de tweede graad ASO hebben over het onderdeel “oplosbaarheid van stoffen in water”. Het doel is te onderzoeken welke misconcepten voorkomen, hoe deze ontstaan en of ze geremedieerd of voorkomen kunnen worden. De probleemstelling van dit onderzoek kan geformuleerd worden aan de hand van de volgende drie vragen.
1. Welke problemen/misconcepten vertonen leerlingen in Vlaanderen uit het 4de jaar ASO bij het onderdeel ‘oplosbaarheid van stoffen in water’?
2. Zijn deze misconcepten vergelijkbaar met de misconcepten uit de literatuur?
11
Literatuurstudie
1 Inleiding
Vanaf het moment dat iemand geboren wordt, begint het proces van leren. Een persoon leert door ervaringen, afkomstig uit het dagelijks leven of met opzet op school. De manier waarop dit leren plaatsvindt, is onderwerp van vele onderzoeken geweest en is nog steeds een vraag waarop een volledig antwoord gezocht wordt. Tijdens dit leerproces ontstaan misconcepten, die ontstaan uit ‘personal theories’ van leerlingen. [1]
In het Vlaamse onderwijs wordt in de eerste graad het vak natuurwetenschappen opgenomen in het curriculum van de leerlingen. De natuurwetenschappen worden vanaf de tweede graad voor een aantal richtingen opgesplitst in chemie, fysica en biologie. Het vak chemie verschijnt dus vanaf het derde jaar van het secundair onderwijs en is dus een nieuw vak. De leerlingen duidelijk maken wat chemie inhoudt en motiveren voor het vak, is cruciaal om deze specifieke discipline te willen ontdekken. Daarmee hangt samen dat het, voornamelijk bij het beginnend chemie onderwijs, belangrijk is dat er relatief minder aandacht besteed wordt aan het leren van algoritmes en feiten, maar meer aan het verklaren van macroscopische verschijnselen met behulp van theorieën en modellen die zich situeren op het submoleculair niveau. Als deze laatste aanpak niet wordt gehanteerd, ontwikkelen de leerlingen een puur algoritmische aanpak van het vak, wat kan leiden tot demotivatie. [4]
Aan de hand van een literatuurstudie zullen eerst de algemene kenmerken binnen het vak chemie worden besproken, zoals de opbouw van het vak en de scheikundige driehoek. Vervolgens zullen de misconcepten, die betrekking hebben op het gedeelte ‘oplosbaarheid van stoffen in water’, uitgebreid worden besproken.
12
2 Algemene kenmerken binnen het vak chemie
2.1 De opbouw van het vak chemie
De opbouw van het vak chemie gebaseerd op de leerstof uit de tweede graad ASO, wordt weergegeven in figuur 1. Uit de figuur wordt duidelijk dat de bespreking van het ene onderwerp vereist dat andere onderwerpen ook worden besproken. Elk nieuw begrip hangt samen met een reeds gezien concept. Het vak vereist dus dat er linken worden gelegd tussen concepten. [4]
Figuur 1: Vakstructuur chemie [2]
Een voorbeeld: twee centrale begrippen in de scheikunde zijn “stof” en “chemische reactie”. Voordat het begrip “chemische reactie” kan worden besproken, zal eerst duidelijk moeten zijn wat een stof is en daarvoor moet weer duidelijk zijn hoe je een stof kan identificeren. Als deze twee begrippen worden aangeleerd, komen andere begrippen aan bod om deze twee te verduidelijken. [4]
13 Wanneer leerlingen enkele basisconcepten niet begrijpen, wordt het vak zeer vaag en zullen ze nieuwe leerstof van buiten leren in plaats van deze af te leiden uit concepten of voorstellingen uit voorgaande hoofdstukken. Deze leerlingen linken het vak chemie vaak aan het maken van wiskundige berekeningen, bijvoorbeeld mol berekeningen, in plaats van verbanden te leggen tussen verschillende leerstofonderdelen. Leerkrachten kunnen dit verhelpen door veel te herhalen en gebruik te maken van conceptenkaarten. Deze conceptenkaarten helpen de leerlingen om nieuwe informatie te structureren in het langetermijngeheugen. [3, 4]
2.2 De scheikundige driehoek
Tijdens de lessen chemie kunnen de chemische gegevens worden gesitueerd op drie verwerkingsniveaus:
Het macroscopisch of waarneembare niveau: de direct waarneembare verschijnselen.
Het submicroscopisch, onzichtbare of corpusculaire niveau: de submicroscopische deeltjes zoals moleculen, atomen en ionen.
Het formalistisch-symbolische niveau: de wijze waarop scheikundige processen en objecten (zowel macro als submicro) worden weergegeven: symbolen, formules en vergelijkingen. [3]
Men spreekt hierbij van de scheikunde driehoek (‘chemistry triangle’ van Johnstone), weergegeven in figuur 2.
Johnstone stelt dat, hoewel ervaren leerkrachten zonder problemen kunnen ‘heen-en weer-denken’ (het micro-macro denken) tussen de verschillende niveau’s, leerlingen hier erg veel moeite mee hebben. Blijkbaar is het vermogen om te kunnen denken en ook om gebruik te kunnen maken van deze drie niveaus, een competentie die karakteristiek genoemd kan worden voor het denken en werken in het chemieonderwijs. Johnstone pleit voor een opbouw van het scheikundeprogramma waarin wordt vertrokken van het macro-aspect en waar vervolgens de andere twee verwerkingsniveau aan worden gekoppeld. [3] Ook heeft extra aandacht voor het visualiseren van macroscopische verschijnselen op submicroscopisch niveau, een significant positief leereffect bij leerlingen. [2]
14 Wanneer de verschillende verwerkingsniveaus worden gelinkt aan elkaar, worden sterkere netwerken1 gecreëerd, wat resulteert in betere leerprestaties. [5]
Te eenzijdige aandacht voor één van de drie bovenstaande niveaus, leidt tot gescheiden netwerken waarin nieuwe data steeds moeilijker kunnen worden opgevraagd. Het traditioneel onderwijs, waarin de chemische symboliek (formalistisch niveau) centraal staat, leidt ertoe dat veel leerlingen moeilijkheden hebben met het vak chemie. Het zou beter zijn om te kiezen voor het leren waarnemen en begrijpen van macroscopische waarnemingen met een beperkter aanbod van chemische basisconcepten. Zoals reeds eerder vermeld kan het gebruik van conceptenkaarten ervoor zorgen dat de nieuwe informatie in sterke netwerken wordt opgeslagen in het langetermijngeheugen. Hierdoor zal nieuwe informatie makkelijker worden gelinkt aan reeds verworven kennis. [3]
3 Misconcepten rond oplosbaarheid van stoffen in water
Leerlingen hebben misconcepten over nagenoeg alle onderdelen van de chemie. In dit deel worden misconcepten gerelateerd aan oplosbaarheid van stoffen in water besproken. Deze misconcepten worden onderverdeeld in vier categorieën: opbouw van materie, rol van water bij het oplosproces, notatiefouten en polariteit.
Er wordt in deze thesis gekozen voor het bespreken van misconcepten rond “oplosbaarheid van stoffen in water”, omdat een goed inzicht in de manier waarop stoffen in een waterige oplossing aanwezig zijn, belangrijk is voor een goed begrip van andere onderwerpen zoals bijvoorbeeld oplossingen van zuren en basen, zuur-base reacties, neerslagreacties, pH-berekeningen,… Een goede basiskennis over dit gedeelte resulteert in een juister preconcept2 over nieuwe leerstof. Een andere reden is dat in tegenstelling tot andere misconcepten in de chemie, over dit onderwerp relatief weinig te vinden is.
3.1 Opbouw van de materie
Veel misconcepten rond oplosbaarheid van stoffen in water zijn gekoppeld aan een verkeerd beeld van de opbouw van materie op submoleculair niveau. Deze misconcepten hebben te maken met de aard van de deeltjes in een stof, alsook met de aard van de bindingen in een bepaalde stof.
Bij de opbouw van de materie kunnen drie groepen stoffen worden onderscheiden, namelijk moleculaire, metalen en zouten of ionverbindingen. In bovenstaande indeling worden de edelgassen als uitzondering beschouwt. Als men de edelgassen niet als uitzondering wilt beschouwen, dan kan er een indeling worden gemaakt volgens de soort binding: Covalente of atoombinding, ionbinding en metaalbinding.
1 Netwerken zorgen ervoor dat nieuwe informatie wordt opgeslagen in het geheugen. Sterke netwerken zijn
netwerken die informatie aan meerdere representaties linken.
2 Een preconcept is een concept dat leerlingen hebben over welbepaalde verschijnselen gebaseerd op reeds
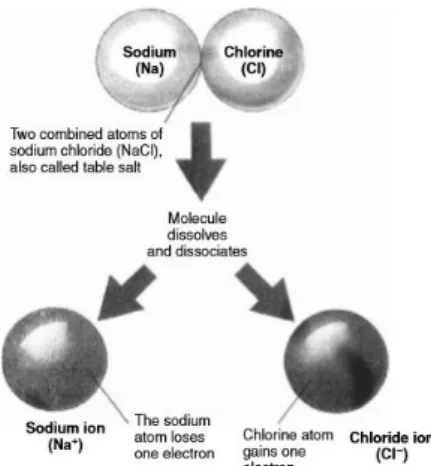
15 Moleculaire stoffen zijn stoffen die uitsluitend bestaan uit niet-metaalatomen en zijn opgebouwd uit moleculen. Metalen zijn stoffen die opgebouwd zijn uit metaalatomen die zich rangschikken in een metaalrooster. Zouten zijn stoffen die bestaan uit metaalatomen en niet-metaalatomen. Zouten zijn opgebouwd uit positieve en negatieve ionen die zich in een ionrooster rangschikken, waarbij de positieve ionen zich omgeven door negatieve ionen en andersom. Een bekende misconceptie die op school ontstaat, komt overeen met wat wordt verteld in de dissociatie theorie van Arrhenius: “Een zoutmolecule is het kleinste partikel in de vaste fase en valt uiteen in ionen door deze op te lossen in water”. Het misconcept hier is dat er een covalente binding bestaat tussen atomen in een “zoutmolecule” en dat deze atomen pas elektronen uitwisselen bij het oplossen in water en dat er zo ionen worden gevormd. Deze misconceptie wordt voorgesteld in figuur 3. [2]
Figuur 3: Misconceptie zouten en zoutoplossingen
Dit misconcept wordt later versterkt wanneer de elektronenuitwisseling, de octet-regel en de edelgasconfiguratie worden behandeld. Barke suggereert dat deze moeilijkheid kan worden vermeden door het gewoon periodiek systeem van de elementen (PSE) te vervangen door het speciale PSE (zie figuur 4), waarin voor elk atoom een corresponderend ion wordt getoond. Deze ionen zijn bouwstenen voor ionverbindingen en atomen zijn de bouwstenen voor moleculen.
16
Figuur 4: Het speciale periodiek systeem [2]
Zoals eerder vermeld kan het gebruik van conceptenkaarten helpen om ervoor te zorgen dat leerlingen bepaalde concepten beter van elkaar kunnen onderscheiden. Uit een onderzoek van Barke blijkt dat leerlingen begrippen zoals ionverbindingen, ionen, atomen, deeltjes en moleculen vaak door elkaar gebruiken en uit deze verwarring ontstaan zeer veel misconcepten. Op figuur 5 wordt een conceptenkaart afgebeeld die duidelijk een onderscheid maakt tussen beide groepen van verbindingen en waarin bovenstaande begrippen duidelijk worden gelinkt aan de soort verbinding. [6]
17
3.1.1 De ionbinding
Hieronder worden enkele voorbeelden van misconcepten van leerlingen gegeven over ionbindingen.
“Bij ionen is er overdracht van elektronen”[7] “Een ionbinding wordt gevormd door elektronenoverdracht van het ene atoom naar het andere atoom.”[8]
Het is de elektrostatische kracht tussen een negatief en een positief ion die de drijvende kracht is om een ionbinding te vormen. De ionbinding ontstaat dus niet omdat er een elektronenoverdracht gebeurt van het ene atoom naar het andere atoom. Bijvoorbeeld tijdens een neerslagreactie zijn de ionen reeds aanwezig in de oplossing. De ionbinding ontstaat door de elektrostatische aantrekkingskracht of de coulombkracht tussen de aanwezige ionen in de oplossing, die vervolgens neerslaan als een zout. Taber rapporteerde dat 60% van hogeschool studenten uit een chemische richting zich een zout voorstelt als een enkele ionbinding tussen één kation en één anion. Hierdoor ontstaat bovenstaand misconcept dat NaCl ontstaat door de elektronenoverdracht van het Na-atoom naar het Cl-atoom. [2]
Om bovenstaande misconcepten te vermijden suggereert Gruijter om een ionbinding te verklaren op basis van de elektrostatische krachten in het ionrooster. Hij pleit om te vertrekken vanuit een neerslagreactie om de opbouw van een dergelijk ionrooster te verklaren. Je ziet een vaste stof neerslaan op macroscopisch niveau. Om dit te verklaren op submicroscopisch niveau, kan zoals eerder gesuggereerd door Barke, worden gebruikgemaakt van het speciale PSE. Vervolgens kan men nogmaals duidelijk het verschil uitleggen tussen de opbouw van een molecule en een ionverbinding. Om alsook het formalistische niveau uit de scheikundige driehoek van Johnstone bij dit voorbeeld te betrekken, worden de neerslagreactievergelijking en dissociatievergelijking genoteerd. [2, 7] Douglas raadt aan om op een krijtbord, whiteboard of een interactief bord te illustreren hoe deze binding wordt gevormd met als basisdeeltjes (als “startdeeltjes”) de ionen. [8]
Tip: “Een ion streeft naar een volle buitenste schil”, wordt vaak gezegd tijdens een les chemie. In veel
artikelen wordt afgeraden om een woord zoals ‘streven’ te gebruiken omdat een dergelijk woord suggereert dat atomen menselijke eigenschappen vertonen, terwijl atomen onderhevig zijn aan de natuurkundige wetten die de leerlingen langzamerhand volledig door beginnen te krijgen. [7]
“Een ionbinding wordt gevormd tussen een metaal en een niet-metaal en covalente bindingen tussen twee niet-metalen.”[8, 9]
Dit misconcept is een schoolgemaakt misconcept. Leerlingen die pas begonnen zijn met het leren van chemie krijgen en nog niet weten wat elektronegatieve waarde (ENW) is, kunnen het onderscheid tussen een molecule of ionverbinding alleen maken op basis van het metaal of niet-metaalkarakter van atomen. In handboeken van het derde jaar (bijvoorbeeld ION 3 GO) wordt dit onderscheid ook effectief op deze manier gemaakt. Hier gebruikt men de term zout in plaats van ionverbinding en wordt de samenstelling
18 weergegeven in een formule-eenheid Een samenvattend stukje over dit gedeelte uit het handboek ION 3 GO wordt weergegeven op figuur 6. [10]
Figuur 6: Samenvatting formule-eenheid en molecule ION 3 GO! [10]
Vanaf het 4de jaar wordt het begrip ENW geïntroduceerd, waarna vervolgens de begrippen ionbinding, polair covalente binding en covalente binding worden aangeleerd. Het bindingscontinuüm wordt voorgesteld in figuur 7. [8] Een ander misconcept gerapporteerd door Chemsource is het volgende: “Een binding is ofwel ionisch ofwel covalent. “ [11]
Figuur 7: Bindingscontinuüm [8]
Het begrip ENW is cruciaal om het bindingstype te kunnen bepalen. ENW, bindingstype en visualisaties op moleculair niveau, zijn de cognitieve sleutels die leerlingen nodig hebben om de submicroscopische wereld te openen. [12] Zoals eerder vermeld door Johnstone is dit het verwerkingsniveau waarmee de meeste leerlingen problemen ondervinden. [3]
3.1.2 De covalente binding
Hieronder worden enkele voorbeelden van misconcepten van leerlingen gegeven over covalente bindingen.
“Het bepalen van een covalente binding wordt bekeken op basis van de interactie tussen twee niet-metalen. “ [9] Dit misconcept ontstaat analoog als reeds vermeld in 3.1.1. Het verschil in ENW bepaalt het bindingstype, niet het soort atoom (metaal of niet-metaal). [8]
“Het lage kookpunt wordt veroorzaakt door een zeer zwakke kracht tussen de atomen van de covalente bindingen.”
19 Dit misconcept ontstaat wanneer studenten denken dat de aantrekkingskracht tussen de atomen in de covalente binding erg zwak is (intramoleculair). In feite is de aantrekkingskracht in covalente bindingen sterk, maar de vanderwaalskrachten tussen de moleculen zijn relatief zwak (intermoleculair). Deze zwakke vanderwaalskrachten zorgt ervoor dat het kookpunt van stoffen met covalente bindingen, lager ligt dan dit van de ionverbindingen. [2, 9]
Gruijter suggereert volgende aanpak om een goed begrip over covalente en ionbindingen te verwerven: “Bij het ontwikkelen van een goed begrip van een covalente binding en ionbinding helpt een elektronendichtheidskaart. Een elektronendichtheidskaart laat lijnen zien die punten met elkaar verbinden waar de elektronendichtheid gelijk is (vergelijkbaar met luchtdruklijnen op een weerkaart). Voor leerlingen wordt direct duidelijk dat bij een ionbinding zoals in natriumchloride (zie figuur 8) de elektronendichtheid anders verdeeld is dan bij een covalente binding zoals in een waterstofgasmolecule. Bij een ionbinding is het opmerkelijk dat de lijnen van gelijke elektronendichtheid rond de kernen van zowel de positieve als de negatieve ionen liggen en er geen gemeenschappelijke lijnen rond beide kernen zijn zoals bij een covalente binding. Je kunt dit interpreteren als dat er bij een ionbinding geen gemeenschappelijke elektronen zijn.”[7]
Figuur 8: Elektronendichtheidskaart NaCl (links) en H2 (rechts) [7]
3.1.3 Het begrip elektron
Een zelfgemaakt misconcept omtrent het begrip elektron is dat, in bepaalde contexten, elektronen door leerlingen als elementaire basisdeeltjes worden geschouwd. Elektronen zijn geen gewone basisdeeltjes van de materie zoals atomen, ionen en moleculen, maar worden meer herkend als geladen wolken of orbitalen. Dit zelfgemaakt misconcept ontstaat doordat het begrip ‘elektron’ anders wordt gebruikt of verwoord afhankelijk van de context. [2]
20 Wanneer men spreekt over het aantal elektronen van een atoom of molecule, dan worden
elektronen meer als elementaire deeltjes beschouwd.[2]
Als echter de elektronen worden beschouwd in een chemische binding, moet men het elektron bespreken als ladingswolk, zodat het bindingstype en vervolgens de polariteit van de molecule kan worden besproken. [2]
3.2 De rol van water bij het oplosproces
Hieronder worden misconcepten besproken die bestaan bij de rol van water bij het oplosproces.
Water wordt gebruikt als oplosmiddel, is een dipoolmolecule en vormt waterstofbruggen. Hoe leerlingen zich water voorstellen verschilt naargelang de context en het is dus niet vreemd om te stellen dat er misconcepten bestaan/ontstaan over water. Om deze misconcepties te minimaliseren, gebruikt de leerkracht voor startende leerlingen chemie best volgende tips in verband met vaktaal. [2]
Gebruik de woorden ijs, water en stoom op macroniveau – spreek dus niet van H2O.
Spreek over waterdeeltjes of H2O-moleculen op submicroscopisch niveau en gebruik op dit niveau respectievelijk witte en rode bollen als model voor H-atomen en O-atomen.
Als de watermolecule wordt besproken, gebruik één H2O-molecule en spreek niet over het model voor water, maar over het H2O molecuulmodel.
3.2.1 Water als molecule
De uitspraak: “Water bevat waterstof en zuurstof”, moet vermeden worden bij beginnende chemieleerlingen om schoolse misconcepties te vermijden. De leerlingen zullen denken dat water bestaat uit zuurstofgas, omdat ze zich water op macroscopisch niveau voorstellen. Leerlingen hebben de neiging om hun kennis op macroscopisch niveau toe te passen op microscopisch niveau. Hierdoor hebben leerlingen moeilijkheden bij het internaliseren 3van het deeltjesmodel en het molecuulmodel.
Als leerlingen weten wat ionen en atomen zijn, kan men deze uitspraak aanpassen. Water bestaat uit watermoleculen, waarbij één watermolecuul twee H-atomen en één O-atoom bevat. Deze atomen zijn met elkaar verbonden via bindingen. [2]
3.2.2 Waterstofbruggen en intermoleculaire krachten
Waterstofbruggen (figuur 9) worden vaak verward met de polaire covalente bindingen tussen de H-atomen en O-H-atomen in het H2O molecuul. Waterstofbruggen zijn voorbeelden van intermoleculaire krachten en dit zijn krachten tussen de moleculen onderling, geen krachten in de molecule zelf. [2, 13] Leerlingen vertonen deze verwarring tussen intermoleculaire en intramoleculaire krachten, en ze kan
21 veralgemeend worden naar volgend misconcept: “Intermoleculaire bindingen zijn hetzelfde als intramoleculaire bindingen”[2, 11]
Figuur 9: Waterstofbruggen [2]
“Wanneer een verbinding smelt of kookt worden de bindingen gebroken” is een misconcept opgemerkt door Douglas et. al. Sommige leerlingen denken dat wanneer water kookt, de H-O bindingen worden gebroken. Om dit misconcept weg te werken suggereert Douglas dat de leerkracht de aggregatietoestanden herhaalt vanuit de fysica en benadrukt dat aard van de stof die kookt of smelt niet verandert. Een verandering van aggregatietoestand is dus een fysisch proces en geen chemisch proces. De intermoleculaire krachten veranderen wel bij de overgang van de ene naar de andere aggregatietoestand. [8] : De intermoleculaire krachten tussen watermoleculen in de gasfase zijn zwakker dan de intermoleculaire krachten in de vloeistoffase.
3.2.3 Oplossen van ionverbindingen in water
Misconcepten over de dissociatie van ionverbindingen in water ontstaan uit een zwakke of niet bestaande visualisatie van de structuur van een ionverbinding (in een ionrooster), zoals reeds vermeld in 3.1. Uit een studie van Izzati et. al., waarbij vragen gesteld werden aan 10 leerlingen van 16-17 jaar uit het secundair onderwijs in Bogor, bleek dat 40% van deze leerlingen misconcepten vertonen op submicroscopisch niveau bij het tekenen een oplossing van NaCl in water. Deze misconcepten worden weergegeven op figuur 10.
22
Figuur 10: Misconcepten dissociatie NaCl in water. Geen interactie tussen NaCl en water (links); Wel interactie (rechts) [14]
Links: NaCl en water vertonen geen onderlinge interactie en de NaCl deeltjes worden voorgesteld door bolletjes en water door een vloeistof. [14]
Rechts: NaCl en water worden voorgesteld door deeltjes en vertonen interactie. NaCl en water gaan een ‘binding’ aan. Het NaCl blijft dus aanwezig in het ionrooster en valt niet uiteen in zijn ionen. Er wordt geen gehydrateerd ion getekend. [14]
In bovenstaande figuur wordt aangetoond dat de leerlingen zich dit proces niet op het niveau van moleculen en ionen voorstellen, maar zich beperken tot het tekenen van deeltjes. Deze laatste visualisatie geeft geen verklaring op submicroscopisch niveau van de waarneming dat zout oplost in water. Zoals eerder vermeld is dit het niveau waar leerlingen het moeilijkst mee hebben. [2, 3, 14]
En andere preconcept/misconcept over oplosbaarheid dat werd vastgesteld bij 10 leerlingen van 16-17 jaar uit Brits-Colombia is het volgende (pilootstudie van Jazlin Ebenezer): alle leerlingen dachten vóór de lessenreeks dat het oplossen van een zout in water hetzelfde is als eensmeltproces. Nadat deze leerlingen de lessenreeks hadden gekregen, is dit misconcept bij 80% van de leerlingen weggewerkt. [15]
3.3 Notatiefouten
Notatiefouten volgen uit misconcepten gelinkt aan de opbouw van materie en het incorrect gebruik van het PSE. Hierdoor kunnen leerlingen het formalistische niveau niet koppelen aan de andere twee niveaus en begrijpen ze de “chemische formuletaal” niet. Als gevolg hiervan ontwikkelen deze leerlingen een negatieve houding tegenover het vak chemie. [2]
3.3.1 Dissociatievergelijking
Een ionverbinding of een zout dissocieert in water, waardoor de ionen loskomen uit het ionrooster (submicroscopisch niveau). Het zout lost op in water (macroscopisch niveau). Het ontbreken van een sterk inzicht in de structuur van ionverbindingen, leidt in vele gevallen tot notatiefouten (symbolistisch niveau). Dit werd in 3.1 uitgebreid besproken.
23 Als voorbeeld wordt de dissociatie van natriumfosfaat (Na3PO4) bekeken. Leerlingen stellen zich voor dat één natriumfosfaat-deeltje bestaat uit Na+ , Na3+, Na
33+, PO43-, PO4-, NaPO42-, of Na2PO4-, ,P5+ en zelfs uit de molecule O2.Veel leerlingen zijn dan ook niet in staat om de juiste ionen in de ionverbindingen te herkennen. [2]
Volgens Barke kan deze fout vermeden worden door de leerlingen een sterk concept van een ionverbinding aan te leren op submicroscopisch niveau (zie 3.1). Het visualiseren (molview.org) van de dissociatie van NaCl in water op submicroscopisch niveau, gevolgd door het uitschrijven van de dissociatiereactie, kan dit misconcept wegwerken. Als deze oefening wordt gevolgd door een analoge uitwerking voor een magnesiumzout, krijgen de leerlingen ervaring met meerwaardige ionen. De leerkracht dient hierbij zeker het ionrooster van het magnesiumzout te visualiseren. Een voorbeeld van een symbolische visualisatie is weergegeven in figuur 11. [2]
Figuur 11: Symbolische visualisatie zouten en zoutoplossingen [2]
Uit een studie van Izzati et. al., waarbij vragen gesteld werden aan 10 leerlingen van 16-17 jaar uit het secundair onderwijs in Bogor, bleek dat 40% van deze leerlingen dacht dat NaCl reageerde tot NaOH en HCl. 20% wist dat er Na+ en Cl- ionen aanwezig waren in de oplossing, maar konden de dissociatievergelijking niet noteren, omdat ze in de war waren waar ze H2O moesten plaatsen. [14]
Een soortgelijk misconcept werd teruggevonden in een studie van Naah et. al. die 105 eerste jaarstudenten, die een inleidingscursus chemie volgden, vroeg om dissociatievergelijkingen van welbepaalde zouten uit te schrijven: [16]
“Wanneer een zout oplost in water, gaat het een chemische reactie aan met water. Het vormt een zuur en een metaaloxide of -hydroxide.”[16]
Andere fouten die tijdens deze studie werden opgemerkt zijn de volgende: ladingen van de ionen werden niet genoteerd (vergeten noteren of de leerlingen wisten dit niet), water dat reageert, massabalans klopt niet, ladingsbalans klopt niet, foutieve subscripten,… De fouten in verband met de subscripten kwamen bij 40% van de studenten voor wanneer een eenwaardig geladen ion (vb. Br-) gecombineerd was met
24 een meerwaardig geladen ion (vb. BaBr2). De studenten noteerden vooral Br2- of Br22- als anion in plaats van 2 Br-. [16]
3.3.2 Index en coëfficiënt
Uit een longitudinaal onderzoek bij leerlingen in het secundair onderwijs door Taber et al. bleek dat 74 % van deze leerlingen het verschil tussen de coëfficiënt 2 en het subscript 3 in 2SO3 niet kenden. Deze fout ontstaat uit een zwak concept omtrent chemische bindingen en moleculen op submicroscopisch niveau, met als gevolg een zwak begrip over chemische formules en vergelijkingen. Soortgelijke fouten werden hiervoor beschreven (voorbeeld BaBr2) [2, 17]
3.4 Polariteit
Om te bepalen of stoffen al dan niet oplossen in een welbepaald oplosmiddel, moet de polariteit van zowel de opgeloste stof als het oplosmiddel worden nagegaan. Om dit te doen hebben de leerlingen het begrip ENW, ruimtelijk inzicht en een sterk concept over ionverbindingen / moleculen nodig (zie 3.1). Hieronder zal een misconcept over het begrip ENW worden besproken, alsook een misconcept bij het bepalen van de polariteit van verbindingen.
3.4.1 Definitie ENW
Het belang van het definiëren van het begrip ENW is reeds in 3.1.1 aanbod gekomen. Uit een pilootstudie van 20 vrijwillige universiteitsstudenten met chemie in hun curriculum uitgevoerd door Gayle et. al., blijkt dat sommige studenten het begrip ENW verkeerd definiëren. Een deel van deze studenten stelt dat hoe hoger de ENW, hoe meer kans het atoom heeft om een elektron bij te krijgen. En een negatief ion te vormen. Dit is een verkeerde interpretatie van dit begrip, waar de grootte van de ENW de mogelijkheid weergeeft van een atoom om de elektronen in een binding naar zich toe te trekken. [12]
3.4.2 Polariteit bepalen verbindingen
Er worden (bijna) geen misconcepten gevonden over het bepalen van de soort binding in een molecule op basis van het verschil in ENW. Leerlingen ondervinden wel moeilijkheden bij de geometrie van een molecule. Onderstaande misconcept van 16-jarige leerlingen uit Yogyakarta (Indonesië) werd vastgesteld door Irwanto et. al. over polariteit.
“Het verschil in ENW tussen de atomen een molecule, toont altijd de polariteit van deze molecule” Dit misconcept volgt uit een onvolledig concept wat polariteit effectief betekent. Je moet de geometrie van de molecule ook in rekening brengen bij het bepalen van de polariteit. (Symmetrisch, planair, tetraëder,…) [9] Barke suggereert het gebruik van molecuulmodellen om moeilijkheden over de geometrie van verbindingen te beperken. [2]
25
Onderzoeksdesign
Zoals vermeld in de inleiding van deze masterproefbevat het tweede gedeelte van deze thesis een onderzoek naar bestaande misconcepten betreffende oplosbaarheid in water bij leerlingen in het 4e jaar secundair onderwijs in Vlaanderen. Het design van dit onderzoek bestaat uit een foutenanalyse. Deze werd op onderstaande manier uitgevoerd.
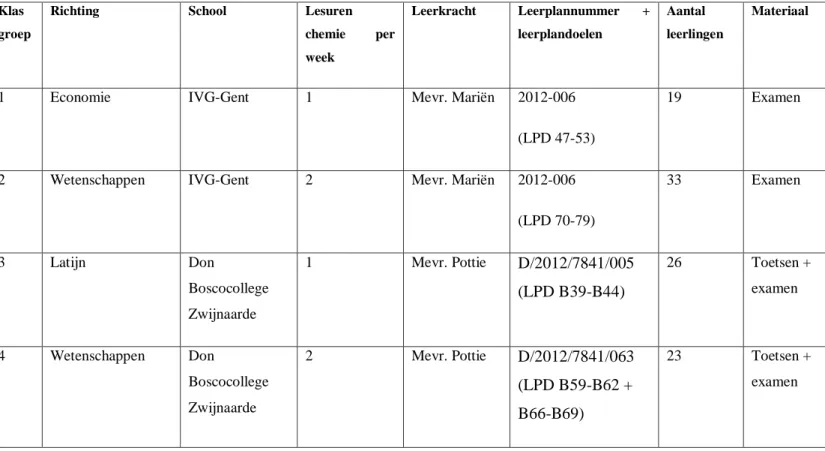
Om een beeld te krijgen van welke fouten worden gemaakt, wordt een kwalitatieve foutenanalyse uitgevoerd op toetsen en examens van klasgroepen uit het 4de jaar secundair onderwijs (schooljaar 2018-2019) uit het IVG-Gent (GO! Onderwijs Vlaanderen) en het Don Boscocollege Zwijnaarde (KOV) Informatie over de klasgroepen wordt weergegeven in tabel 1.
Tabel 1: Klasgroepen foutenanalyse
Klas groep
Richting School Lesuren
chemie per week Leerkracht Leerplannummer + leerplandoelen Aantal leerlingen Materiaal
1 Economie IVG-Gent 1 Mevr. Mariën 2012-006
(LPD 47-53)
19 Examen
2 Wetenschappen IVG-Gent 2 Mevr. Mariën 2012-006
(LPD 70-79) 33 Examen 3 Latijn Don Boscocollege Zwijnaarde 1 Mevr. Pottie D/2012/7841/005 (LPD B39-B44) 26 Toetsen + examen 4 Wetenschappen Don Boscocollege Zwijnaarde 2 Mevr. Pottie D/2012/7841/063 (LPD B59-B62 + B66-B69) 23 Toetsen + examen
De leerplannen kunnen worden geraadpleegd via onderstaande links:
GO! Onderwijs: https://proacc.g-o.be/pedagogische-begeleiding-leerplannen-nascholing/leerplannen/leerplannen-so
KOV: http://ond.vvkso-ict.com/lele/leerplannen.asp
Per klasgroep worden relevante vragen uit toetsen en examens geanalyseerd. Een relevante vraag is een vraag die betrekking heeft tot het gedeelte oplosbaarheid van stoffen in water. Deze vragen worden
26 aangeduid en er wordt op een systematische manier (turven) naar soortgelijke fouten gezocht. De fouten die het meest frequent voorkomen worden in het rood aangeduid en vervolgens fouten ingedeeld volgens één van de vier categorieën besproken in de literatuurstudie.
De ruwe data van de fouten worden bijgehouden in een excel bestand “foutenanalyse.xlsx”. De tabbladen van dit bestand worden teruggevonden in Bijlage A. Een voorbeeld van een uitgewerkt tabblad wordt weergegeven in tabel 2.
Tabel 2: Voorbeeld uitwerking foutenanalyse
In de eerste kolom wordt de vraag kort beschreven, de tweede kolom bevat een korte beschrijving van de soort fout en de derde kolom bevat de frequentie (hoeveel maal komt deze fout voor binnen deze klasgroep). Uit deze frequentie kan dan het percentage leerlingen worden berekend dat deze fout heeft gemaakt. De fouten die in het rood zijn gemarkeerd zijn deze die het meest voorkomen .
Na de foutenanalyse , worden de verschillen en de gelijkenissen van tussen de klasgroepen besproken. Vervolgens worden (o.m. op basis van de literatuurstudie) suggesties gegeven hoe deze misconcepten kunnen worden weggewerkt. Tot slot worden suggesties gedaan om deze fouten te minimaliseren door de introductie van nieuwe leermethoden.
27
Resultaten en discussie foutenanalyse
In dit deel worden de meest gemaakte fouten per categorie voorgesteld in een tabel, besproken en eventueel gelinkt aan de literatuur. Vervolgens worden de gelijkenissen en verschillen tussen de klasgroepen besproken. Tot slot wordt de opbouw van het gebruikte leermateriaal van de leerkrachten kort besproken.
1 Opbouw van de materie
In tabel 3 worden antwoorden van leerlingen getoond met betrekking tot de misconcepten over de opbouw van de materie. Deze verklaringen en/of tekeningen kunnen inzicht geven in de oorzaak van de fout.
Voorstelling ionverbinding
Bij klasgroepen 3 en 4 werden soortgelijke fouten opgemerkt over de voorstelling van een
ionverbinding. Bij klasgroep 4 werd volgende vraag gesteld: “Zijn volgende verbindingen polair of apolair? Teken de Lewisstructuur indien mogelijk.” 25% van deze leerlingen noteerde een
lewisstructuur van LiCl via een covalente binding. (zie tabel 3). Een soortgelijke fout werd waargenomen bij 16% van de leerlingen van klasgroep 3 wanneer ze de oplosbaarheid van KCl moesten verklaren. Dit misconcept houdt verband met een verkeerd inzicht in de opbouw van de materie, waarbij leerlingen ionverbindingen en moleculen door elkaar gebruiken. In dit geval uit dit misconcept zich via een foutieve structuur van een ionverbinding. (zie ook literatuurstudie § 3.1).
Aan klasgroep 4 werd de volgende vraag gesteld op het examen: “Verklaar wat er tijdens het
oplosproces gebeurt en illustreer het belang van het polair karakter van water”. Leerlingen illustreren hun antwoord met behulp van een figuur. Deze figuur bevat bij sommige leerlingen de foutieve structuur van een ionverbinding (geen exact percentage want niet elke leerling heeft een figuur getekend)
28
Verhoudingsformule:
De leerlingen van klasgroepen 3 en 4 moesten het begrip “verhoudingsformule” verklaren. 30 % van deze leerlingen antwoordde dat dit de verhouding is van het aantal elektronen dat werd opgenomen en afgegeven door de atomen en dat deze in balans moesten zijn. 25 % van de leerlingen gaf in hun antwoord aan dat het de verhouding van deeltjes of atomen was en dat deze in balans moesten zijn. 55% van de leerlingen vermeldde niet dat dit de symbolische voorstelling is van een ionverbinding. De meeste leerlingen maakten geen fouten bij het opstellen van een verhoudingsformule (formalistisch niveau), maar meer dan de helft van de leerlingen legt de link niet met het ionrooster/ionverbinding (submicroscopisch niveau). Leerlingen hebben moeilijkheden bij het heen-en-weer denken tussen verschillende verwerkingsniveaus en dit werd reeds besproken in de literatuurstudie (§ 2.2).
In de volgende categorieën worden ook fouten teruggevonden die te linken zijn aan misconcepten over de opbouw van de materie. In de bespreking van deze fouten zal naar deze categorie worden verwezen.
29
Tabel 3: Foutieve antwoorden: Opbouw van de materie
Categorie Vraag Voorbeeldantwoord leerlingen Klasgroep
Opbouw van de materie
Zijn volgende verbindingen polair of apolair? Teken de Lewisstructuur indien mogelijk.
4
Wat denk je van de oplosbaarheid van KCl in water? + Verklaar
3
Wat betekent deze verhoudingsformule? “De verhoudingsformule moet in balans zijn. Het geeft de verhouding weer van positieve en negatieve elektronen in een ionrooster.”
“ De verhoudingsformule geeft weer hoeveel deeltjes er werden opgenomen of afgegeven”
30
2 Rol van water bij het oplosproces
In tabel 4 worden foutieve antwoorden van leerlingen getoond met betrekking tot de misconcepten over de rol van water. Deze verklaringen en/of tekeningen kunnen inzicht geven in de oorzaak van de fout.
Het begrip dissociatie:
Bij het uitleggen van dit begrip verwarren leerlingen vaak de begrippen atomen, ionen, deeltjes en moleculen. “Een molecule wordt gesplitst” werd door 28% van de leerlingen uit klasgroep 2 geantwoord. 24% van diezelfde klasgroep schreef dat dissociatie een reactie met water is.
Klasgroep 3 moest het proces van het oplossen van een ionverbinding in water verwoorden. 25% van de leerlingen gebruikte de begrippen moleculen/atomen/deeltjes in hun uitleg in plaats van ionen. 25 % van de leerlingen schreef dat een ion een positieve en negatieve kant bezit. Daarnaast antwoordde 15% van de leerlingen dat water uit positieve en negatieve deeltjes bestaat.
Bij klasgroep 3 werd er gevraagd welke beker de juiste voorstelling is van NaCl opgelost in water. 20% van de leerlingen duidde beker B aan (zie figuur 13). Dit misconcept werd uitgebreid besproken in de literatuurstudie (§ 3.2.3), waarbij een soortgelijk misconcept is aangetoond door een studie van Izzati et. al. en duidt er op dat de leerlingen niet inzien dat een ionverbinding oplost onder de vorm van samenstellende ionen. [14]
Figuur 13: Misconcept oplossen ionverbinding water (antwoord toets)
Structuur watermolecule
Bij klasgroepen 3 en 4 werden vragen gesteld omtrent de beschrijving van het oplosproces van NaCl in water. Uit de antwoorden van leerlingen worden volgende misconcepten teruggevonden. 39 % van de leerlingen van klasgroep 4 zei dat een watermolecule uit ionen bestaat. Hetzelfde wordt gezegd door 30% van de leerlingen uit klasgroep 3 bij een soortgelijk vraag. Deze leerlingen verwarren deelladingen en ionen en maken in dit geval geen onderscheid tussen de structuur van een polaire molecule en een ionverbinding. Dit misconcept houdt verband met de opbouw van de materie.
31
Inter- en intramoleculaire krachten:
Bij klasgroep 4 werd op een toets tijdens het schooljaar volgende vraag gesteld “Wat kun je afleiden uit een hoge kooktemperatuur van water en verklaar.” 45 % van de leerlingen antwoordde dat dit komt door de sterke polaire covalente bindingen in het H2O- molecuul (intramoleculair). Tijdens het examen werd een soortgelijke vraag gesteld. Uit de antwoorden van de leerlingen uit zowel klasgroepen 3 en 4 blijkt dat niemand meer een antwoord geeft met de expliciete woorden “polaire covalente binding”. Er duikt wel een soortgelijk misconcept op bij 20% van de leerlingen, namelijk dat de bindingen tussen de atomen zouden breken tijdens het koken. Douglas et. al. stelde dezelfde misconcepten vast over inter- en intramoleculaire krachten. [8] Ook gaf 18% van de leerlingen aan dat water uit ionen zou bestaan en daarom niet makkelijk zou overgaan naar de gasfase. Dit misconcept houdt verband met een verkeerd inzicht in de opbouw van de materie, waarbij leerlingen vaak moleculen, atomen, deeltjes, ionen,… door elkaar gebruiken (zie ook literatuurstudie § 3.1).
De vaststelling dat geen enkele leerlingen de “polaire covalente binding” als antwoord gaf op het eindexamen bij de vraag over het kookpunt van water kan wellicht verklaart worden doordat de leerkracht het antwoord op de vraag tijdens het schooljaar heeft besproken. Uit de resultaten op het examen blijkt echter dat het misconcept bij een deel van de leerlingen niet weggewerkt is, want het uit zich onder een andere antwoordvorm. Een suggestie om te vermijden dat het misconcept blijft bestaan, is door bijvoorbeeld op elk tijdstip een visuele ondersteuning te bieden op submicroscopisch niveau.
32
Tabel 4: Foutieve antwoorden: Rol van water bij het oplosproces
Categorie Vraag Antwoorden leerlingen Klasgroep
Rol van water bij het oplosproces
Verklaar waarom water een hoge
kooktemperatuur heeft en illustreer a.d.h.v. een figuur.
4
Verklaar volgende termen: Dissociatie “Als men water bij een zuur of base toevoegt, dat noemt men dissociatie” “ Een reactie die alleen bij zouten kan plaatsvinden”
“Een vergelijking waarbij H2O vrijkomt en de stof gesplitst wordt in twee elementen”
“Een molecule splitsen in + geladen deeltjes en – geladen deeltjes”
2
Beschrijf, in stappen, het proces van oplossen van een ionverbinding in water onder invloed van het dipoolkarakter van water.
“Water wordt toegevoegd aan de stof en de deeltjes zullen zich vermengen. Dubbel effect: De roosterkracht daalt en H2O deeltjes zullen harder trekken aan de atomen (moleculen van de stof). Vervolgens zal de stof starten met oplossen in de stof. “
33 Als je een kristal in water brengt gaan de wateratomen rond de ionen gaan
en ze gaan zich richten met hun positieve kant naar de negatieve kant van de ionen en met hun negatieve kant naar de positieve kant van de ionen.
Wat kun je afleiden uit een hoge kooktemperatuur van water en verklaar.
“Dat de stof een sterke covalente binding is. Want dat betekent dat de atomen zich sterk naar elkaar toe trekken en dus moeilijker zijn om beweeglijk te maken.“
“Dit wilt zeggen dat de molecule een hoge ENW heeft en is dus zeker een sterk polaire covalente binding. (er zullen dus waarschijnlijk veel bruggen aanwezig zijn).“
“Dat de deeltjes sterk met elkaar verbonden zijn en een heel hoge
temperatuur nodig hebben om van elkaar los te komen. Dit komt doordat de stof apolair of sterk polair covalent verbonden is.“
4
Leg uit waarom die watermoleculen zo zijn georiënteerd (gehydrateerd ion)
“Aluminium wordt een positief ion en het negatieve ion van water richt zich naar het positief ion”
“Aluminium heeft een positieve lading en positieve ionen komen bij negatieve ionen”
3
Wat gebeurt er met de oplosbaarheid van O2 in water wanneer de T stijgt?
“Door de hardere trillingen komen de zuurstofatomen in de watermolecule los, de H-O binding wordt gebroken. Hierdoor daalt de oplosbaarheid van zuurstof in water.”
34 In welk van de onderstaande bekers werd
keukenzout (NaCl) opgelost? Verklaar je keuze.
Beker B (20%)
“Want NaCl is een ionenbinding en bij een ionenbinding breekt het rooster, maar de + en – blijven samen omdat het gehydrateerde ionen zijn.”
3
Onderstaande figuur illustreert het oplossen van natriumchloride in water. Verklaar wat er tijdens het oplosproces gebeurt en illustreer het belang van het polair karakter van water.
“De negatieve en positieve ionen trekken elkaar aan”
“De negatieve deeltjes van water (O) zullen rond de positieve deeltjes van natriumchloride zitten (Na) en de positieve deeltjes van water (H) zullen rond de negatieve deeltjes van natriumchloride (Cl) zitten.
35
3 Notatiefouten
In tabel 5 worden foutieve antwoorden van leerlingen getoond met betrekking tot de misconcepten over notatiefouten. Deze verklaringen en/of tekeningen kunnen inzicht geven in de oorzaak van de fout.
Dissociatie/ionisatievergelijking
Elke klasgroep heeft ergens een dissociatie en/of ionisatievergelijking moeten aanvullen. Klasgroep 3 en 4 vertoonden bij de toetsen weinig moeilijkheden bij het oplossen van deze oefeningen. Wel viel op dat bij het aanvullen van de dissociatievergelijking van CaO (klasgroep 3) en MgS (klasgroep 4) er toch respectievelijk 15% en 20% van de leerlingen de grootte van de lading verkeerd hadden. Tijdens het eindexamen vertoonde klasgroep 3 meer problemen dan op de toetsen tijdens het jaar. Zo schreef 20% van deze leerlingen bij geen enkele vergelijking ladingen op.
Bij klasgroep 2 werd een trapsgewijze ionisatie van fosforzuur gevraagd, alsook de globale
reactievergelijking. Deze vraag werd slechts door 30% van de leerlingen correct beantwoord. Bij deze vraag maakte 37% van alle leerlingen ladingsfouten (grootte van de lading verkeerd, geen lading genoteerd, ladingsbalans klopt niet,…). 15% van de leerlingen hadden verkeerde voorgetallen bij de globale reactievergelijking. Veel leerlingen lieten deze vraag ook blanco. Deze klasgroep had ook zeer veel moeite met noteren van de essentiële vergelijkingen bij het ontharden van water. Slechts 9% van de leerlingen hadden deze vraag correct. 53% van de leerlingen noteerden de Mg- en Ca-ionen als metalen. (zie tabel 5) Mogelijks hadden de leerlingen het moeilijk om dit macroscopisch verschijnsel zich voor te stellen op moleculair niveau. En vervolgens moesten ze dit formalistisch noteren via reactievergelijkingen. Deze verwerkingsniveaus worden voorgesteld op de scheikundige driehoek van Johnstone en de moeilijkheden die hiermee gepaard gaan werden reeds besproken in de
literatuurstudie (§ 2.2)
Klasgroep 1 vertoonde de meeste problemen bij het uitschrijven van deze vergelijkingen. Zo schreef 37% van de leerlingen bij geen enkele vergelijking ladingen op. 58% van de leerlingen hadden de lading van CO3-ion verkeerd bij het uitschrijven van de ionisatievergelijking van H2CO3. 21% van de leerlingen schreef 3Al+ i.p.v. Al3+ bij het uitschrijven van de dissociatievergelijking van AlBr
3. Bij klasgroep 4 antwoordde 35% van de leerlingen tijdens het examen dat bij de verbinding AlCl3 er evenveel Al-ionen als Cl-ionen aanwezig zijn. Naah et. Al. stelde een soortgelijk misconcept vast bij het uitschrijven van de dissociatievergelijking van BaBr2 (zie literatuurstudie § 3.3.1)
Gehydrateerd ion:
Klasgroep 3 moest een gehydrateerd Al-ion tekenen. 39% van de leerlingen maakte een fout wat betreft de lading van het Al-ion, de leerlingen schreven Al+, Alδ+. i.p.v. Al3+. De leerlingen moesten in deze vraag het formalistische niveau (de formule) koppelen aan het submicroscopische niveau (het deeltje).
36 In hun antwoord moesten ze de deelladingen van water aanduiden (met het symbool δ), waardoor sommige hetzelfde symbool gebruikten om de lading van Al-ion aan te duiden. Een soortgelijke vraag werd gesteld aan klasgroep 4. De leerlingen van deze klasgroep kregen een afbeelding van een gehydrateerd ion met de vraag: Is dit ion positief of negatief geladen? Teken een mogelijk ion op de figuur. 30% van de leerlingen gaf het ion geen lading en 15% duidde de lading van het ion aan als deellading (met het symbool δ). 25% van de leerlingen dacht dat het ion negatief geladen was.
Bovenstaand misconcept houdt verband met een verkeerd inzicht in de opbouw van de materie, waarbij de leerlingen een molecule (water) en een ion (afkomstig van een ionverbinding) niet van elkaar onderscheiden. Omdat ze in deze context mogelijks geen onderscheid maken tussen beide verbindingen, resulteert dit in bovenstaande verkeerde notatie.
37
Tabel 5: Foutieve antwoorden: Notatiefouten
Categorie Vraag Antwoorden leerlingen Klasgroep
Notatiefouten
Verklaar de verhoudingsformule aan de hand van de ionvorming van Cu2O.
4
Trapsgewijze ionisatie van fosforzuur. 2
In leidingwater zitten calcium- en
magnesiumionen. Waterontharders gebruiken natriumcarbonaat om deze ionen te verwijderen; Noteer de essentiële vergelijkingen van de reacties die optreden na toevoeging van het zout.
38
Notatiefouten
Dissociatievergelijkingen of
ionisatievergelijkingen uitschrijven.
1
Schrijf de dissociatievergelijking uit van MgS MgS –> Mg+ + S- 4
Schrijf de dissociatievergelijking uit van CaO CaO Ca+ + O- 3
Teken een aluminiumion omgeven door
watermoleculen.
3 + 4
Is hieronder een positief of negatief ion afgebeeld? Plaats een mogelijks ion op de figuur en schrijf de lading erbij.
39
4 Polariteit
In tabel 6 worden foutieve antwoorden van leerlingen getoond die betrekking hebben met de misconcepten over polariteit. Deze verklaringen en/of tekeningen kunnen inzicht geven in de oorzaak van de fout.
Definitie ENW: Bij klasgroepen 2 en 3 werd de vraag gesteld: “Definieer of verklaar de
elektronegatieve waarde (ENW).” Bij beide groepen valt op dat meer dan de helft van de klas deze vraag niet zonder fouten kon beantwoorden. Bij klasgroep 2 en klasgroep 3 gaven respectievelijk 30% en 20% van de leerlingen de uitleg over het verschil in negatieve waarde. Bij beide klasgroepen vergat 20% te vermelden dat het maat was voor het aantrekken van elektronen door een atoom. (ze vergaten het woord elektron te gebruiken in hun uitleg) De waarde voor het verschil in ENW wordt in oefeningen gebruikt om te bepalen of een binding polair of apolair is. Een groot deel van de leerlingen zijn er zich dus niet van bewust wat de ENW van een atoom effectief betekent. Dit wordt bevestigd door een pilootstudie van Gayle et. al. waarbij hetzelfde misconcept wordt vastgesteld bij universiteitsstudenten die chemie in hun curriculum opnemen. [12]
Dat de leerlingen moeite hebben met het begrip ENW blijkt ook uit een andere vraag bij klasgroep 2: Juist of fout en verklaar? ENW van een klein atoom is groter dan de ENW van een groot atoom, omdat de kern de elektronen minder hard aantrekt. 80 % van de leerlingen had deze vraag verkeerd. Van deze 80% antwoordde 36,4 % “juist” op bovenstaande vraag. 27 % van de leerlingen antwoordde “fout, het is andersom”. Dit laatste antwoord is ook incorrect, want de elektronen worden juist harder aangetrokken door de kern als het atoom kleiner is. Deze leerlingen waren dus niet in staat om zich deze situatie op een submicroscopisch niveau voor te stellen. Conclusie: de leerkracht moet naast het aanleren van het gebruik van de ENW ook voldoende aandacht besteden aan de betekenis van het begrip ENW.
Bepalen polariteit en oplosbaarheid
Klasgroep 1 vertoont de meeste moeilijkheden bij dit gedeelte. 68% van de leerlingen in deze groep antwoordde dat CO2 apolaire bindingen bevat en 53% antwoordde dat CO2 een polaire molecule is. 53% van de leerlingen gaf aan dat hexaan apolaire bindingen bevat. Klasgroep 2 moest met behulp van structuurformules bepalen of CO2 oplost in NH3. De meeste leerlingen konden de soort bindingen in CO2 wel bepalen (polair covalente bindingen), maar 27% van de leerlingen trok de verkeerde conclusie, namelijk dat CO2 een polaire molecule is. Slechts 6% van deze leerlingen dacht dat apolaire stoffen oplossen in polaire oplosmiddelen.
De hiervoor opgesomde fouten ontstaan doordat leerlingen verschillende fouten maken: ze maken gebruik van foutieve lewisstructuren, ze gebruiken een verkeerde formule, ze bepalen het verschil in ENW van de atomen in de binding niet, ze hebben problemen het geometrisch inzicht ( zie
40 literatuurstudie § 3.4),… Bij de opgave van klasgroep 1 konden de leerlingen ‘gokken’ omdat ze hun antwoord niet moesten verklaren. Deze klasgroep had duidelijk minder ervaring met het uitwerken van dit soort opgaven vergeleken met de andere klasgroepen. Een mogelijke verklaring is dat de leerlingen slechts 1u chemie/week hadden. Bij klasgroepen 3 en 4 werden (bijna) geen fouten gevonden bij soortgelijke opgaven.
Klasgroep 4 kreeg over hetzelfde onderdeel een meerkeuzevraag: “Welke stelling is correct?” 52% van de leerlingen van deze klasgroep antwoordde dat een apolaire stof nooit deelladingen bevat. Een verklaring voor deze fout ligt mogelijks bij de vraagstelling (meerkeuzevraag). De leerlingen zijn meer getraind in het oplossen van open vragen omtrent dit onderwerp dan het beantwoorden van
41
Tabel 6: Foutieve antwoorden: Polariteit
Categorie Vraag Antwoorden leerlingen Klasgroep
Polariteit
Verklaar volgende termen: Elektronegativiteit “Eigenschap hoe hard het atoom anderen aantrekt”
“Iets dat elke molecule heeft, hoe meer ΔE, hoe harder ze naar zich toe trekken”
“Gebruik je om te zien of het een polaire of apolaire stof is”
2
Welke bindingen hebben volgende stoffen? (CO2, HCl en hexaan) Zijn deze moleculen polair of apolair?
1
Zal CO2 oplossen in NH3? Verklaar met structuurformules. “ CO2 is polair” (27,3%)
“ Ja want apolaire stoffen lossen op in polaire oplosmiddelen.” (6%) 2
42
5 Vergelijken klasgroepen
De vier klasgroepen worden hieronder kort vergeleken met elkaar. Deze vergelijking is alleen gebaseerd op de foutenanalyse en het verkregen leermateriaal. Een lesobservatie was niet mogelijk wegens de Corona pandemie.
Bij klasgroep 1 en 2 werden alleen de vragen van de examens geanalyseerd, omdat de toetsen onvolledig of niet ter beschikking waren. Bij klasgroepen 3 en 4 werden zowel de toetsen als de examens geanalyseerd. Bij deze klasgroepen waren meer vragen beschikbaar om te analyseren. Dit resulteert in een vollediger beeld van de bestaande misconcepten bij deze leerlingen.
Klasgroepen 1 (economie) en 3 (latijn) volgden 1u chemie per week, maar tussen deze groepen is een groot verschil op te merken. De leerlingen van klasgroep 3 kregen meer uitbreidingsvragen, vooral op de toetsen, terwijl het examen van klasgroep 1 zich beperkt tot de minimale vereiste leerplandoelstellingen. Omwille van de uitbreidingsvragen, werden ook andere misconcepten vastgesteld bij klasgroep 3. Uit de foutenanalyse blijkt ook dat klasgroep 1 de meeste fouten maakt bij het bepalen van de polariteit van verbindingen en het oplossen van dissociatie/ionisatievergelijkingen. Een mogelijkse verklaring voor het niveauverschil tussen beide groepen, is de richting en de schoolcultuur.
Er was duidelijk een niveauverschil te bemerken tussen klasgroep 1 en klasgroep 2. Een mogelijke verklaring is dat de leerlingen van klasgroep 1 slechts 1u chemie/week hadden. Er wordt ook een verschillend leerplan gehanteerd.
Klasgroepen 3 en 4 kregen meer vragen waarbij de leerlingen een verklaring moesten geven. Deze klasgroepen kregen ook vragen waarbij de leerlingen een visualisatie op submicroscopisch niveau moesten maken/interpreteren of aanvullen. De leerlingen van klasgroep 3 kregen net zoals klasgroep 1 slechts 1u chemie/week, maar kregen soortgelijke vragen als klasgroep 4 (2u chemie/week) op de toetsen. De leerlingen van klasgroepen 3 en 4 vertoonden soortgelijke misconcepten en deze misconcepten kwamen even frequent voor bij beide klasgroepen.
De leerlingen van klasgroep 2 kregen 2u chemie/week (net zoals de leerlingen van klasgroep 4), maar de vraagstelling was anders. Er werden definities en juist/fout vragen gesteld. Uit de antwoorden van de leerlingen werden misconcepten over dissociatie en ENW opgemerkt. Er werd op hun examen niet gevraagd naar een getekende representatie van deze begrippen. Aan de leerlingen van klasgroepen 3 en 4 werd wel gevraagd om een tekening te maken of te verklaren over het oplosproces van een zout in water.
Besluit: Over de klasgroepen heen vertoonden leerlingen soortgelijke misconcepten over de
43 welbepaald misconcept, hangt af van vele variabelen. (schoolcultuur, leerkracht, leermateriaal, richting, vraagstelling, achtergrond leerlingen, aantal uur chemie/week, leerplan). Dit maakt het zeer moeilijk om conclusies te trekken.
6 Opbouw cursussen
De inhoudstabellen van de leerwerkboeken ION GO! 4.1 (klasgroep 1) en ION GO! 4.2 (klasgroep 2 en van de invulcursus van mevrouw Pottie (klasgroepen 3 en 4) zijn terug te vinden in bijlage B: Opbouw van het leermateriaal.
De vergelijking van het leermateriaal kan enkel worden gebaseerd op het verkregen cursusmateriaal. Er heeft geen lesobservatie plaatsgevonden wegens de Corona pandemie. Hierdoor worden de visualisaties (op bord of via een presentatie) niet mee in rekening genomen tijdens deze korte bespreking.
Bij het bekijken van de handboeken en cursussen ben ik tot de conclusie gekomen dat er zeer weinig visualisaties op submoleculair niveau in de leerwerkboeken ION GO! 4.1 en 4.2 staan. Er staan veel oefeningen in die zich situeren op het formalistisch niveau (noteren van de juiste formules, lewisstructuren), maar nauwelijks die pijlen naar inzicht van processen of verschijnselen op submoleculair niveau.
Een voorbeeld uit de cursus van mevr. Pottie wordt weergegeven op figuur 14. Hier wordt een duidelijke voorstelling gegeven van het oplosproces van een ionverbinding in water op submicroscopisch niveau. In de cursus wordt bij deze figuur (submicroscopisch niveau) een duidelijke uitleg gegeven en de dissociatievergelijking (formalistisch niveau) vermeld. In haar cursus is ook een practicum over polaire en apolaire stoffen uitgewerkt waarin de leerlingen 3D molecuulmodellen moeten maken. De vragen op toetsen en examens van mevr. Pottie peilden ook naar inzicht van dit proces op alle verwerkingsniveaus.
In figuur 15 worden waterstofbruggen voorgesteld met de structuurformule van water waarop de deelladingen staan aangeduid (ION GO! 4.2) en met watermoleculen (cursus mevr. Pottie). Een voorstel is om beide afbeeldingen op te nemen in het leermateriaal, om het submicroscopische niveau te linken aan het formalistische niveau.
44
Figuur 14: Visualisatie oplosproces NaCl in water cursus mevr. Pottie
45
7 Voorkomen en wegwerken van misconcepten in de chemie
Hieronder worden twee methoden kort besproken die helpen om misconcepten in de chemie te vermijden, namelijk “EXPlainistry” en “meerdere representaties”. Deze leermethodes focussen op het submicroscopische niveau uit de scheikundige driehoek van Johnstone.
7.1 EXPlainistry
EXPlainistry (“experiments explained in chemistry) is een leermethode die de drie verwerkingsniveaus uit de chemie samenbrengt met behulp van ICT en focust vooral op het submicroscopisch niveau. Uit de literatuurstudie bleek reeds dat leerlingen de meeste moeilijkheden hebben om het symbolische en het macroscopische verwerkingsniveau te linken aan dit submicroscopisch niveau (‘heen-en-weer denken’). De procedure die gebruikt wordt in EXPlainistry wordt voorgesteld in figuur 15. [3, 18] Er wordt veel aandacht besteed aan stap 3, namelijk het visualiseren van het experiment op submicroscopisch niveau. Het is cruciaal dat leerlingen zelf visualisaties maken va wat er gebeurt op moleculair niveau en dat het niet alleen de leerkracht is die demovoorbeelden toont.
Figuur 16: Procedure van de EXPlainistry methode [18]
Het tot leven brengen van processen op moleculair niveau is de grootste toegevoegde waarde van EXPlainistry, waarbij ICT kan helpen om nieuwe dimensies van animatie en visualisatie te openen. Elektronen/protonentransferreacties zijn moeilijk te visualiseren op een klasbord, terwijl dit wel op een dynamische manier gevisualiseerd kan worden met gratis apps zoals Keynote (IOS) of Powerpoint. Betalende apps zoals “Explain everything” kunnen worden gebruikt om animaties te maken via een interactief bord. Een voorbeeld van het gebruik van zo een app wordt afgebeeld op figuur 17.
![Figuur 1: Vakstructuur chemie [2]](https://thumb-eu.123doks.com/thumbv2/5doknet/3277966.21514/12.893.122.769.332.914/figuur-vakstructuur-chemie.webp)

![Figuur 5: Conceptenkaart soorten verbindingen [6]](https://thumb-eu.123doks.com/thumbv2/5doknet/3277966.21514/16.893.290.604.104.347/figuur-conceptenkaart-soorten-verbindingen.webp)
![Figuur 6: Samenvatting formule-eenheid en molecule ION 3 GO! [10]](https://thumb-eu.123doks.com/thumbv2/5doknet/3277966.21514/18.893.212.683.510.669/figuur-samenvatting-formule-eenheid-molecule-ion-go.webp)
![Figuur 8: Elektronendichtheidskaart NaCl (links) en H 2 (rechts) [7]](https://thumb-eu.123doks.com/thumbv2/5doknet/3277966.21514/19.893.138.756.600.856/figuur-elektronendichtheidskaart-nacl-links-h-rechts.webp)
![Figuur 9: Waterstofbruggen [2]](https://thumb-eu.123doks.com/thumbv2/5doknet/3277966.21514/21.893.288.602.175.416/figuur-waterstofbruggen.webp)
![Figuur 11: Symbolische visualisatie zouten en zoutoplossingen [2]](https://thumb-eu.123doks.com/thumbv2/5doknet/3277966.21514/23.893.201.697.453.637/figuur-symbolische-visualisatie-zouten-en-zoutoplossingen.webp)