-LACTAM ANTIBIOTICA BIJ
GERIATRISCHE PATIËNTEN:
IS ER NOOD AAN EEN GERIATRISCHE DOSERING?
Frederick Libeer
Studentennummer: 01308435
Helena Verhasselt
Studentennummer: 01503945Promotor: Prof. dr. Peter De Paepe en Prof. dr. Mirko Petrovic
Copromotor: Dr. Apr. Pieter De Cock en Dr. Tania Desmet
Masterproef voorgelegd in het kader tot het behalen van de graad Master of Medicine in de Geneeskunde
-LACTAM ANTIBIOTICA BIJ
GERIATRISCHE PATIËNTEN:
IS ER NOOD AAN EEN GERIATRISCHE DOSERING?
Frederick Libeer
Studentennummer: 01308435
Helena Verhasselt
Studentennummer: 01503945Promotor: Prof. dr. Peter De Paepe en Prof. dr. Mirko Petrovic
Copromotor: Dr. Apr. Pieter De Cock en Dr. Tania Desmet
Masterproef voorgelegd in het kader tot het behalen van de graad Master of Medicine in de Geneeskunde
Deze pagina is niet beschikbaar omdat ze persoonsgegevens bevat.
Universiteitsbibliotheek Gent, 2021.
This page is not available because it contains personal information.
Ghent University, Library, 2021.
1
1 VOORWOORD
Deze thesis werd geschreven door Helena Verhasselt en Frederick Libeer. De taken werden op een eerlijke manier verdeeld, wat nodig was om de thesis tot een goed einde te kunnen brengen. Zonder de hulp en raad van een aantal extra personen zou het niet gelukt om dit resultaat te kunnen voorleggen.
Vooreerst zouden we Dr. Tania Desmet uitgebreid willen bedanken voor alle hulp en goede raad die ze ons gegeven geeft. Bij vragen/problemen konden we dag en nacht bij haar terecht. Daarnaast willen we haar bedanken voor het grondig nalezen van onze thesis. Dankzij haar tips en opmerkingen hebben we deze thesis tot een hoger niveau kunnen tillen. Zonder Dr. Desmet gingen we deze thesis nooit tot een goed einde kunnen brengen.
Daarnaast dienen ook Prof. Dr. Peter De Paepe, Prof. Dr. Mirko Petrovic en Dr. Apr. Pieter De Cock bedankt te worden om ons kennis te laten maken met het uitvoeren van een
klinische studie. Dankzij hun uitgebreide expertise in deze wereld hebben wij ontzettend veel geleerd en inzicht gekregen in de wereld van wetenschappelijke studies en alles wat erbij komt kijken. Ook hun uitgebreide feedback over het schrijfproces was een absolute meerwaarde om deze thesis tot een goed einde te kunnen brengen.
Ook dienen de artsen/stagairs en verpleegkundigen op de spoedafdeling en de dienst geriatrie bedankt te worden. Dankzij hen was het mogelijk om patiënten op een adequate manier te kunnen rekruteren. De verpleegkundigen van de afdeling geriatrie verdienen een extra bedanking voor het nauwkeurig invullen en bijhouden van de studiegegevens.
Tot slot willen we iedereen van het secretariaat van de spoedgevallendienst bedanken om ons steeds te willen helpen bij de administratieve kant van het verhaal. Hiervoor konden we steeds bij hen terecht.
2
INHOUDSOPGAVE
1 Voorwoord... 2 Abstract ... 0 3 Inleiding ... 2 3.1 Vraagstelling ... 23.1.1 Belang van de studie ... 2
3.2 β-lactam antibiotica ... 4 3.2.1 Amoxicilline-clavulaanzuur ... 5 3.2.2 Piperacilline-tazobactam ... 7 3.3 Farmacokinetiek ... 8 3.3.1 Absorptie ... 9 3.3.2 Distributie... 9 3.3.3 Metabolisatie ... 12 3.3.4 Excretie... 13 3.4 Farmacodynamiek ... 17 3.4.1 Amoxicilline-clavulaanzuur ... 18 3.4.2 Piperacilline-tazobactam ... 19 3.5 Dosering... 19 3.5.1 Amoxicilline-clavulaanzuur ... 22 3.5.2 Piperacilline-tazobactam ... 23 4 Doelstellingen ... 24 5 Methodologie ... 25 5.1 Literatuurstudie ... 25 5.2 Onderzoeksmethodologie... 25 5.2.1 Studieopzet ... 25 5.2.2 Antibioticatoediening ... 26 5.2.3 Data collectie ... 26 5.2.4 Farmacokinetische analyse ... 27 5.2.5 Statistische analyse ... 29 6 Resultaten ... 30 6.1 Studiepopulatie ... 30 6.2 Target attainment ... 32 6.2.1 Algemeen overzicht ... 32 6.2.2 Amoxicilline ... 33 6.2.3 Clavulaanzuur ... 35 6.2.4 Piperacilline ... 37
3 6.2.5 Tazobactam ... 37 6.3 Klaring amoxicilline-clavulaanzuur... 38 6.3.1 Amoxicillineklaring: correlaties ... 43 6.4 Outcome studiepopulatie ... 43 6.5 Bijwerkingen ... 44 7 Discussie ... 45 7.1 Amoxicilline-clavulaanzuur ... 45 7.2 Piperacilline-tazobactam ... 49
7.3 Aanbevelingen voor vervolgstudies ... 50
7.4 Moeilijkheden en tekortkomingen van de studie ... 51
7.4.1 Studiepopulatie en bloedafnames ... 51
7.4.2 Statistische datacollectie en analyse ... 52
8 Conclusie ... 52
Referenties ... 54 9 Bijlagen ... I
9.1 Bijlage 1: PK eigenschappen voor amoxicillinen, clavulaanzuur, piperacilline en tazobactam ... I 9.2 Bijlage 2: Afnameschema amoxicillin-clavulaanzuur ... II 9.3 Bijlage 3: Afnameschema piperacilline-tazobactam ... III 9.4 Bijlage 4: Vergelijking resultaten met gezonde jongere populatie ... IV 9.5 Bijlage 5: Overzicht middose concentraties en dalconcentraties alle patiënten ... V 9.6 Bijlage 6: Overzicht klaring van alle patiënten ... VI 9.7 Bijlage 7: Informed consent wilsbekwame patiënt ... VII 9.8 Bijlage 8: Informed consent wilsonbekwame patiënt ... XI 9.9 Bijlage 9: CIRS vragenlijst ... XV 9.10 Bijlage 10: Katz vragenlijst ... XVI 9.11 Bijlage 11: G8 vragenlijst ... XVII
4
LIJST MET
AFKORTINGEN
AC
BBB
BMI
CAP
CIRS
CKD-EPI
C
TCSV
CYS C
eGFR
EMA
EUCAST
INR
Katz
LBM
MBC
MIC
PAE
PBP
PD
PK
PT
R
SIRS
TA
TDM
UWI
WZC
Amoxicilline-clavulaanzuur
Blood Brain Barrier
Body Mass Index
Community acquired pneumonia
Cumulative Illness Rating Scale
Chronic Kidney Disease Epidemiology Collaboration
Concentration threshold
Cerebrospinaal vocht
Cystatine C
estimated Glomerular filtration rate
European Medicine Agency
European Committee on Antimicrobial Susceptibility
International Normalized Ratio
Independence in Activities of daily living
Lean Body Mass
Minimaal bactericide concentratie
Minimale inhiberende concentratie
Post-antibiotisch effect
Penicilline-bindende proteïnen
Pharmacodynamics
Pharmacokinetics
Piperacilline-tazobactam
Correlatiecoëfficiënt
Systemic Inflammatory Response Syndrome
Target attainment
Therapeutische drug monitoring
Urineweg infectie
0
2 ABSTRACT
Inleiding: Geriatrische patiënten hebben vaak een gewijzigd farmacokinetisch (PK) profiel. De objectieven van deze studie zijn (i) het achterhalen van de target attainment (TA) van therapie met amoxicilline-clavulaanzuur (AC) en piperacilline-tazobactam (PT) bij
gehospitaliseerde geriatrische patiënten, (ii) het bepalen van de correlatie tussen de klaring van AC en de geschatte nierfunctie (eGFR) op basis van veelgebruikte formules, alsook het vergelijken van de bekomen PK parameters met de literatuur, (iii) het bepalen van
determinanten voor de klaring van amoxicilline bij steady state condities, alsook het
beschrijven van de outcome en bijwerkingen bij amoxicilline-clavulaanzuur en de mate van concentratieafhankelijkheid van die bijwerkingen.
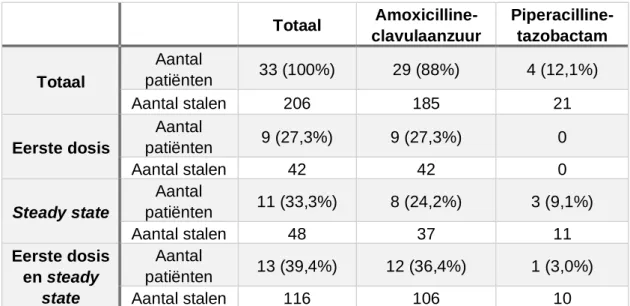
Methode: Dit is een single-centered, prospectieve, observationele farmacokinetische studie bij 33 geriatrische patiënten ( > 75 jaar) die werden opgenomen op de acute dienst geriatrie van het UZ Gent. Meerdere bloedstalen werden afgenomen tijdens het eerste dosisinterval en tijdens een dosisinterval bij steady state condities ter bepaling van TA (> 50 % T>MIC) bij
intraveneuze therapie van AC (1000/200 mg om de 4-6 u) of PT (4000/500 mg om de 6 u met verlengde infusie van 3 u). Middose concentraties werden afgemeten t.o.v een vaste target, nl. 8 mg/L voor amoxicilline, 2 mg/L voor clavulaanzuur, 16 mg/L voor piperacilline en 4 mg/L voor tazobactam. Niet-compartimentele analyse werd gehanteerd ter bepaling van de PK parameters met PKsolver®. Correlaties tussen de klaring van AC en eGFR werden beoordeeld a.d.h.v grafische voorstellingen en de Spearman correlatiecoëfficiënt (R). Resultaten: TA bij het eerste dosisinterval was 71 % voor amoxicilline, 67 % voor clavulaanzuur en 100 % voor zowel piperacilline als tazobactam. TA bij steady state condities was 87 % voor amoxicilline, 73 % voor clavulaanzuur en 100 % voor piperacilline en tazobactam. Correlaties tussen amoxicillineklaring in het eerste dosisinterval en eGFR waren R = 0,73 a.d.h.v. de Cockcroft-Gault formule, R = 0,48 a.d.h.v. CKD-EPI-creatinine en R = 0,68 a.d.h.v. de simpele cystatine C vergelijking. Correlaties tussen amoxicillineklaring bij steady state condities waren R=0,45 a.d.h.v. de Cockcroft-Gault formule en R=0,63 a.d.h.v. de simpele cystatine C vergelijking. Correlaties tussen clavulaanzuurklaring bij steady state condities waren R = 0,41 a.d.h.v. de Cockcroft-Gault formule, R=0,17 a.d.h.v. CKD-EPI-creatinine en R = 0,57 a.d.h.v. de simpele cystatine C vergelijking. Leeftijd, eGFR
1 en koorts bij opname waren determinanten voor amoxicillineklaring bij steady state
condities. Bij 86 % werd de therapie met amoxicilline-clavulaanzuur als succesvol
beschouwd. Bij therapie onder AC had 24 % diarree en 17 % gestoorde levertesten. Bij deze laatste werden hogere amoxicillineconcentraties gevonden dan bij de andere patiënten in deze studie.
Conclusie: Uit deze studie blijkt dat TA van AC voornamelijk tijdens het eerste dosisinterval moet verbeteren, TA tijdens het vervolg van de therapie met AC was adequaat. TA van PT was tijdens het volledige verloopt van de therapie adequaat. Huidige formules om nierfunctie te schatten o.b.v serumbepalingen zijn niet in staat nauwkeurig de klaring van AC weer te geven waardoor zij niet gebruikt kunnen worden om dosisaanpassingen uit te voeren. Bij therapie onder AC werd een goede outcome gezien samen met een verhoogde incidentie van bijwerkingen, waarvan gestoorde levertesten volgens onze resultaten
concentratieafhankelijk zijn.
2
3 INLEIDING
3.1
Vraagstelling
3.1.1
Belang van de studie
Ouderen maken een belangrijk deel uit van de bevolking. In Vlaanderen is 9,7 % ouder dan 75 jaar (1). Verwacht wordt dat deze cijfers in de toekomst nog meer zullen stijgen. De vooruitzichten opgesteld door het Federaal Planbureau voorspellen een stijging in het
aandeel 67-plussers van 16 % (2018) naar 23 % (2070) (2). Door de toenemende vergrijzing zal simultaan het aandeel in zorgbehoevende ouderen stijgen (cfr. infra) waardoor de
gezondheidszorg zich meer en meer zal moeten focussen op de noden en verzorging van de oudere patiënt.
Immunosenescence, of de achteruitgang van het immuunsysteem door het fysiologisch verouderingsproces, maakt ouderen meer vatbaar voor infecties. Infecties zijn een
belangrijke doodsoorzaak bij ouderen en resulteren in hoge morbiditeitscijfers. Wegens de verhoogde vatbaarheid zijn ouderen een courante gebruiker van antibiotica (3). In
eerstelijnszorg worden -lactam antibiotica vaak voorgeschreven als eerste keuze wegens hun gunstig spectrum en hoge therapeutische index. Community acquired pneumonia (CAP) is de meest voorkomende levensbedreigende infectie bij ouderen (4) en wordt conform met de wetenschappelijke evidentie behandeld met -lactam antibiotica.
De grootste bedreiging voor de huidige antibioticatherapie is de blijvende stijging in
resistentie van verschillende pathogenen. De toenemende resistentie en bijgevolg beperkte mogelijkheden tot nieuwe behandelingsopties maakt optimale dosering, naast oordeelkundig gebruik van antibiotica, cruciaal (5). Ouderen komen vaker dan de algemene populatie in contact met het ziekenhuismilieu en zijn vaker opgenomen in instellingen, zoals
woonzorgcentra (WZC). Bijgevolg heeft de oudere populatie een hoger statistisch risico te worden geïnfecteerd met laag gevoelige - tot multiresistente pathogenen (4). Voldoende hoge dosering van antibiotica is belangrijk om zowel de effectiviteit te verzekeren als resistentievorming tegen te gaan. Bij ouderen moet echter voorzichtig worden
omgesprongen met hoge dosissen wegens een verhoogde vatbaarheid voor bijwerkingen en het profiel van co-morbiditeiten en polyfarmacie, met bijkomend risico op interacties (6). De verhoogde vatbaarheid voor bijwerkingen bij ouderen is toe te schrijven aan wijzigingen in lichaamscompositie en orgaanfuncties (3) die leiden tot farmacokinetische (Engels: PK, voor pharmacokinetics) en -dynamische (Engels: PD, voor pharmacodynamics) veranderingen
3 (4). Bijwerkingen van geneesmiddelen zijn verantwoordelijk voor 10% van de hospitalisaties
bij ouderen (6).
De farmacokinetiek van antibiotica bij gehospitaliseerde patiënten is zeer complex en tot op heden niet te verklaren a.d.h.v. standaard patiënt-gerelateerde eigenschappen zoals geslacht, ernst van de ziekte of leeftijd (5). Hoewel patiënten vaak worden opgedeeld op basis van hun (kalender)leeftijd, loopt deze in de meeste gevallen niet gelijk met hun fysiologische leeftijd. PK/PD-veranderingen als gevolg van veroudering, treden niet bij iedereen op dezelfde leeftijd op of evolueren niet aan een gelijk tempo. Hierdoor is de oudere populatie heel divers, wat geneesmiddelengebruik bij ouderen nog uitdagender maakt. Een subpopulatie met een complexe problematiek en verhoogde zorgnood zijn ouderen met ‘kwetsbaarheid’ of ‘frailty’. Frailty kunnen we definiëren als ‘een klinisch syndroom bij ouderen die een verhoogde kwetsbaarheid tonen door leeftijdsgeassocieerde daling in de fysiologische reserves en de algemene functie van de organen, waardoor de mogelijkheid om met dagelijkse of acute stressoren om te gaan wordt gecompromitteerd’ (7). Deze definitie laat toe een beter beeld te krijgen over de gelaagdheid van het syndroom. De daling van de fysiologische reserves zorgt voor problemen in de homeostase (3) en is op die manier geassocieerd met chronische ziekten, co-medicatie (7) en een disproportionele achteruitgang van de toestand na blootstelling zijn aan, vaak milde, stress (3).
Binnen de oudere populatie wordt verwacht dat het aandeel van de groep ouder dan 85 jaar zal blijven stijgen de komende decennia (1). Frailty is niet direct gecorreleerd met de leeftijd, maar de incidentie stijgt wel in functie ervan (8). Waardoor de prevalentie van frailty bij ouderen enkel maar zal toenemen in de toekomst. Door hun verhoogde zorgnood en gecompliceerd profiel hebben dergelijke patiënten bij opname in het ziekenhuis nood aan gespecialiseerde zorg die aan hun noden kan voldoen, wat het belang van een geriatrische afdeling beklemtoont.
Ondanks het veelvuldig gebruik van medicatie door de oudere populatie, is
wetenschappelijke onderbouwing rond het voorschrijven van medicatie bij (kwetsbare) ouderen afwezig. Met hun gevarieerde waaier aan co-morbiditeiten en co-medicatie wordt de oudere patiënt vaak ten onrechte niet opgenomen in wetenschappelijke studies, aangezien deze veel verstorende variabelen met zich meebrengen. Daarom stelde de European Medicine Agency (EMA) in 2011 een EMA Geriatric Medicine Strategy op punt, waarin onder andere de noodzaak naar meer informatie rond het gebruik van medicatie bij ouderen naar voor komt (9). Alhoewel dit belang door EMA geconceptualiseerd werd,
4 bestaat er tot nu toe nog geen wettelijk kader over het includeren van geriatrische patiënten
in klinische studies.
De laatste jaren zien we een langzame stijging in inclusies van ouderen boven de 65 jaar in studies en wordt het belang hiervan meer erkend. Jammer genoeg blijven ouderen boven 75 jaar, in het bijzonder zij met een kwetsbaar profiel en/of co-morbiditeiten, vaak geëxcludeerd (3). Daarnaast zijn de weinige studies waar ouderen wel in worden geïncludeerd vaak cross-sectionele studies in plaats van de meer controleerbare longitudinale studies (10). Hierdoor blijft de wetenschappelijke evidentie in de behandeling van oudere patiënten beperkt en van een lagere methodologische kwaliteit dan bij de jongere populatie.
Op de acute afdeling geriatrie van het UZ Gent maakten β-lactam antibiotica in de periode van 1/10/2013 tot 1/06/2014, 65,4 % uit van de antibiotische monotherapieën. Daarvan stond 56% van de patiënten onder amoxicilline-clavulaanzuur en 30% onder piperacilline-tazobactam (11). Onderzoek naar deze twee vaak gebruikte antibiotica bij ouderen is bijgevolg van klinisch belang.
3.2
β-lactam antibiotica
De groep -lactamantibiotica omvat de verschillende antibioticaklassen die allen een lactamring bezitten (penicillines, cefalosporines, carbapenems en monobactams). Deze β-lactamring is noodzakelijk voor de bactericide activiteit.
Zowel amoxicilline als piperacilline behoren tot de groep van de semisynthetische
penicillines. Penicillines binden irreversibel aan het enzym DD-transpeptidase, dat hierdoor behoort tot de groep penicilline-bindende proteïnen (PBP). In de laatste stap van de
synthese van peptidoglycaan crosslinkt DD-transpeptidase de peptidoglycaan polymeren (12). Peptidoglycaan is een onmisbaar element van de bacteriële celwand. De celwand beschermt de bacterie tegen osmotische ruptuur, houdt de vorm van de cel in stand en is essentieel voor celdifferentiatie en –proliferatie. Inhibitie van PBP’s zal hierdoor bacteriolyse induceren (13). Aangezien de penicillines interfereren met de opbouw van de celwand, zullen voornamelijk (snel) delende bacteriën gehinderd worden. In traag groeiende
populaties (zoals in een abces) zijn zij dus minder werkzaam (14). Het spreekt voor zich dat bacteriën zonder celwand resistent zijn aan penicillines.
Het brede spectrum van de semisynthetische penicillines (amino-, carboxy-, amidino- en acylureïdopenicillines) omvat de meeste Gram-positieve en Gram-negatieve bacteriën
5 (eventueel in combinatie met β-lactamase remmers bij β-lactamase producerende bacteriën)
(15). De resistentie van de bacteriën neemt evenwel meer en meer toe.
Verworven resistentie tegen penicillines gebeurt op twee manieren. Enerzijds zijn bepaalde organismen in staat gebruik te maken van een PBP, dat niet wordt geïnhibeerd door
penicillines. Anderzijds produceren bepaalde organismen lactamasen die de essentiële lactamring van penicillines afbreken. Om op dit laatste een antwoord te bieden werden β-lactamaseremmers toegevoegd aan de behandeling van geselecteerde penicillineresistente bacteriën. De β-lactamaseremmers onderzocht in deze studie zijn clavulaanzuur (in
combinatie met amoxicilline) en tazobactam (in combinatie met piperacilline).
Om bijwerkingen en onvoorspelbare reacties op medicatie bij ouderen te vermijden, wordt vaak het principe ‘start low, go slow’ gehanteerd bij dosering van geneesmiddelen (6). Wegens het belang van (onmiddellijk) voldoende hoog te doseren bij antibiotica, is deze strategie hier uiteraard niet van toepassing. Penicillines hebben een wijd therapeutisch-toxisch venster. Hoewel bijwerkingen geregeld voorkomen, zijn ze meestal mild van aard. Concentratieafhankelijke bijwerkingen en toxiciteit moeten in acht genomen worden bij de therapiekeuze.
3.2.1
Amoxicilline-clavulaanzuur
Amoxicilline behoort tot de aminopenicillines. Volgens in vitro data is amoxicilline actief tegen Haemophilus influenzae, Helicobacter pylori, Escherichia coli, Proteus mirabilis, en salmonella-, shigella- en listeria-stammen (15-19). Gram-positieve bacteriën hebben een beperkte gevoeligheid voor amoxicilline, waardoor de dosis verhoogd dient te worden bij een ernstige infectie of wanneer gedeeltelijke resistentie wordt vermoed. Resistentie veroorzaakt door de productie van β-lactamasen kan worden opgevangen door toevoeging van
clavulaanzuur, waardoor het spectrum wordt uitgebreid tot soorten die bijna steeds β-lactamasen producerend zijn (zoals oa. meticilline gevoelige S. aureus, Klebsiella spp, Moraxella catarrhalis, Bacteroides fragilis) en degene die meer variabel zijn in hun β-lactamase productie (zoals oa. Haemophilus influenzae, Escherichia coli) (15). Er bestaan, soms op lokale epidemiologie gebaseerde, richtlijnen die aangeven wanneer het toevoegen van clavulaanzuur bij amoxicilline is gewettigd. Dat clavulaanzuur vaak onnodig wordt toegevoegd aan amoxicilline werd onder andere gezien in Italië waar de combinatie amoxicilline-clavulaanzuur in 2007 het meest voorgeschreven antibioticum was van alle β-lactam antibiotica (20). Enkel indien er een aanneembaar risico is op de aanwezigheid van β-lactamase producerende organismen kan het toevoegen van clavulaanzuur worden
6 verdedigd. Zoals eerder aangehaald wordt het risico op infectie met resistente pathogenen
hoger ingeschat bij ouderen. Om deze reden wordt amoxicilline vaak gecombineerd met clavulaanzuur bij deze studiepopulatie. Doordat bij ouderen vaker een breder spectrum wordt gehanteerd dan bij de jongere populatie heeft foutief gebruik van antibiotica bij hen nog een grotere impact naar resistentievorming toe.
Wegens zijn voordelig spectrum heeft amoxicilline(-clavulaanzuur) uiteenlopende indicaties, waarvan de belangrijkste: CAP, intra-abdominale infecties en infecties ter hoogte van de huid en weke delen (15, 18, 21). Amoxicilline-clavulaanzuur wordt gebruikt in zowel eerste- als tweedelijns zorg, al blijkt in het ziekenhuismilieu een toegenomen resistentie voor amoxicilline-clavulaanzuur op te treden (15). Contra-indicaties voor het gebruik van amoxicilline-clavulaanzuur zijn IgE-gemedieerde penicilline-allergie en een
voorgeschiedenis van amoxicilline-clavulaanzuur geassocieerde icterus of –leverstoornissen (15).
3.2.1.1 Wijze van toediening
Amoxicilline-clavulaanzuur kan zowel per os als parenteraal worden toegediend, waardoor het zowel ambulant als in ziekenhuisomgeving wordt ingezet (21, 22).
3.2.1.2 Bijwerkingen
Amoxicilline-clavulaanzuur wordt in principe goed getolereerd en heeft een brede
therapeutisch-toxische index, hierdoor wordt het als een veilig antibioticum beschouwd (16, 20). De meest frequente bijwerkingen zijn van gastro-intestinale aard, nl. misselijkheid, braken en diarree. Daarnaast wordt candidiasis van de huid en slijmvliezen frequent gerapporteerd (21). Bij te hoge dosissen kunnen ook convulsies optreden. Hier moet aandacht aan worden besteed, vooral bij een gedaalde nierfunctie (21).
Amoxicilline-clavulaanzuur kan via hemodialyse uit de circulatie verwijderd worden (21, 22). Alhoewel de combinatie amoxicilline-clavulaanzuur als veilig wordt beschouwd, is het belangrijk op te merken dat volgens de literatuur clavulaanzuur verantwoordelijk is voor een groot deel van de bijwerkingen die optreden bij gebruik van amoxicilline-clavulaanzuur (19, 20). Salvo et al. observeerden in een vergelijkende studie van amoxicilline per os in monotherapie en in combinatie met clavulaanzuur dat bij de combinatie een hoger aantal gastro-intestinale klachten werden gemeld (19, 20). Voornamelijk het optreden van diarree wordt
toegeschreven aan clavulaanzuur (23). Daarnaast stijgt de ernst van de bijwerkingen wanneer clavulaanzuur wordt toegevoegd. Dit wordt voornamelijk gezien ter hoogte van het hematologisch– en hepatobiliaire systeem (19, 20). Amoxicilline-clavulaanzuur,
7 verantwoordelijk voor 13-23% van alle geneesmiddel-gerelateerde hepatotoxische gevallen
(24), is gekend om zijn verhoogd risico op hepatotoxiciteit. Echter zagen Salvo et al. dat het aantal gevallen van geneesmiddel-geïnduceerde hepatotoxiciteit opnieuw beduidend lager was bij amoxicilline in monotherapie dan bij de combinatie met clavulaanzuur (20).
Hepatologische bijwerkingen komen meer voor bij mannen en ook een hogere leeftijd blijkt een risicofactor (20, 21).
3.2.1.3 Interacties
Er zijn verschillende interacties bekend tussen amoxicilline-clavulaanzuur en andere medicatie. Kwetsbare ouderen zijn belangrijke gebruikers van anticoagulantia. Orale vitamine K antagonisten, met name warfarine, kunnen in combinatie met amoxicilline-clavulaanzuur aanleiding geven tot ernstige bloedingen. Hierdoor is nauwkeurige opvolging van de INR of de protrombinetijd aangewezen wanneer beide geneesmiddelen simultaan worden toegediend (21, 22). Daarnaast zijn interacties beschreven die met de renale klaring van amoxicilline interfereren, zoals probenecide (cfr. infra). Verder kan
amoxicilline(-clavulaanzuur) interfereren met de klaring van andere geneesmiddelen en zo intoxicaties kunnen teweegbrengen, zoals bij methotrexaat (15, 21).
3.2.2
Piperacilline-tazobactam
Piperacilline is een ureïdopenicilline. In vergelijking met de andere penicillines bezitten ureïdopenicillines een grotere affiniteit voor PBP-3. Dit PBP is essentieel voor de groei van bepaalde Gram-negatieve bacteriën, zoals Pseudomonas aeruginosa. Hierdoor hebben ureïdopenicillines in regel een betere activiteit tegen Gram-negatieve bacteriën dan andere penicillines (13). Het brede spectrum van piperacilline omvat verschillende Gram-positieve - en Gram-negatieve aeroben (met inbegrip van, maar niet beperkt tot Pseudomonas-, Enterobacter-, Klebsiella- en Serratia-stammen), alsook de meeste anaeroben,
Streptokokken en Enterococcus faecalis (13, 15, 25). De activiteit tegen Pseudomonas aeruginosa is een kenmerkende eigenschap van de ureidopenicillines (13). Wegens de irreversibele inhibitie van verschillende types β-lactamasen wordt het spectrum door toevoeging van tazobactam verder uitgebreid (13, 25). Piperacilline is een
tweedelijnsantibioticum met als voornaamste indicaties ernstige pneumonieën, intra-abdominale-, huid en weke delen-, wond- en nosocomiale infecties. Uiteraard zal ook hier IgE gemedieerde penicilline allergie een contra-indicatie zijn (15, 26).
8
3.2.2.1 Wijze van toediening
Toediening van piperacilline-tazobactam verloopt parenteraal, aangezien beide stoffen niet gastro-intestinaal worden opgenomen (13). Wegens hun breed spectrum (met name de werking tegen P. aeruginosa) en nood aan intraveneuze toediening is piperacilline-tazobactam een ziekenhuisantibioticum (15).
3.2.2.2 Bijwerkingen
Piperacilline-tazobactam wordt goed getolereerd. De bijwerkingen die worden beschreven, zijn meestal vrij mild van aard (13). Ook hier zijn de voornaamste klachten gastro-intestinaal. Daarnaast komen rash, hoofdpijn en insomnia niet zelden voor (26). Ook
piperacilline-tazobactam heeft een wijde therapeutisch-toxische index waardoor overdosering zelden gevaarlijke situaties met zich meebrengt. Sinds het gebruik van piperacilline-tazobactam zijn enkele gevallen bekend van overdosering waarbij voornamelijk symptomen werden
gerapporteerd die reeds gekend waren als bijwerking na inname van de standaarddosis, zoals: misselijkheid, braken en diarree. Verder kunnen patiënten bij overdosering
symptomen hebben gaande van neuromusculaire prikkelbaarheid tot convulsies, opnieuw moeten voornamelijk patiënten met nierfalen hiervoor behoed worden (26).
3.2.2.3 Interacties
Net zoals bij amoxicilline-clavulaanzuur moeten de coagulatie parameters frequenter en intensiever worden opgevolgd wanneer piperacilline-tazobactam wordt gecombineerd met hoge dosissen heparine of orale anticoagulantia om manifeste bloedingen te vermijden (26). Hogere concentraties piperacilline-tazobactam kunnen worden bekomen doordat probenecid interfereert met hun klaring. Verder kan piperacilline-tazobactam inerfereren met de klaring van andere medicatie zoals opnieuw methotrexaat (26).
3.3
Farmacokinetiek
Farmacokinetiek (PK) beschrijft de weg die het geneesmiddel aflegt in het lichaam en de bijhorende metabolisatie, om het verloop van de concentratie in verschillende
lichaamscompartimenten te trachten voorspellen. Deze wordt beïnvloed door de eigenschappen van de patiënt en die van het geneesmiddel. De functionele en
morfologische veranderingen die optreden bij veroudering, en verder bij frailty, zullen invloed hebben op de absorptie, distributie, metabolisatie en eliminatie van geneesmiddelen (3). Bij het interpreteren van het tijdverloop van de plasmaconcentratie amoxicilline-clavulaanzuur
9 en piperacilline-tazobactam bij kwetsbare ouderen is kennis van deze veranderingen
essentieel. Hoewel de farmacokinetiek een uitgebreid bestudeerd onderwerp is (en blijft), zijn farmacokinetische parameters moeilijk te voorspellen op basis van de huidige kennis. In het bijzonder binnen de populatie van kwetsbare ouderen kan een grote inter-patiënt
variabiliteit verwacht worden in de parameters, waardoor elke uitspraak over de farmacokinetiek van de populatie in het algemeen met voorzichtigheid moet worden geïnterpreteerd.
3.3.1
Absorptie
Aangezien in deze studie zowel amoxicilline-clavulaanzuur als piperacilline-tazobactam intraveneus werden toegediend, wordt absorptie niet verder besproken.
3.3.2
Distributie
Distributie van een geneesmiddel is de transfer ervan vanuit de bloedbaan naar de weefsels. De mate van verspreiding van medicatie over de weefsels kan worden weergegeven a.d.h.v. het verdelingsvolume. Het verdelingsvolume is een fictief volume lichaamswater dat nodig zou zijn om de geobserveerde plasmaconcentratie te bereiken bij toediening van een bepaalde hoeveelheid medicatie, mocht deze gelijkmatig verspreid worden over alle compartimenten. In deze masterthesis wordt verder de genormeerde waarde gebruikt voor het verdelingsvolume, namelijk volume per kilogram lichaamsgewicht (l/kg).
Enkel medicatie die niet gebonden is aan eiwitten (= vrije concentratie) is biologisch actief en kan naar de perifere weefsels migreren. De graad van eiwitbinding bepaalt mede de nodige dosis om een therapeutische concentratie te bereiken in het doelorgaan en zal ook invloed hebben op het verdelingsvolume. Zowel amoxicilline-clavulaanzuur als piperacilline-tazobactam hebben een lage plasma eiwit-binding (Bijlage 1), maar toch een relatief laag verdelingsvolume (Bijlage 1) doordat ze hydrofiel zijn en niet intracellulair penetreren (10). Verspreiding naar de weefsels gebeurt langs de capillairen, waar meestal fenestraties aanwezig zijn. Het laag moleculair gewicht van beide penicillines (Bijlage 1) in ongebonden vorm, zorgt dat de antibiotica kunnen migreren doorheen deze fenestraties. Op plaatsen waar geen fenestraties in de wand van de capillairen aanwezig zijn, zoals in de hersenen en prostaat, moeten de moleculen doorheen de endotheliale cellen migreren. Het zure karakter van zowel amoxicilline-clavulaanzuur (10) als piperacilline-tazobactam (13) maakt dat een
10 groot deel van de moleculen zich in een geïoniseerde toestand bevindt bij fysiologische pH,
waardoor de passage door de lipide membranen wordt verhinderd (14). Dit maakt hen doorgaans geen eerste keuze antibiotica voor infecties ter hoogte van de prostaat of hersenen. De hersenen worden daarbijkomend afgesloten door de bloed hersenbarrière (BBB), waardoor penetratie verder wordt verhinderd.
De BBB krijgt een grotere permeabiliteit op oudere leeftijd (3, 10), waardoor medicatie vlotter de hersenen bereikt. Dit kan de kwetsbare oudere patiënt mogelijks gevoeliger maken voor neurologische bijwerkingen van zowel amoxicilline-clavulaanzuur als piperacilline-
tazobactam.
Beide antibiotica binden, zoals andere zure geneesmiddelen, voornamelijk aan albumine (14). Bij ouderen zien we vaak een daling van de albumineconcentratie. Deze daling is meestal niet rechtstreeks het gevolg van het verouderingsproces op zich, maar eerder van pathofysiologische veranderingen of ziekten die geassocieerd zijn aan ouderdom of frailty (zoals malnutritie) (29, 30). Bij een daling van het serumalbumine verwachten we een stijging in de vrije concentratie van zowel amoxicilline-clavulaanzuur als
piperacilline-tazobactam, met aansluitend een hogere biologisch actieve fractie van het geneesmiddel op plaatsen met goede penetratie. Chronisch nierfalen leidt tot een daling in
albumine-bindingsaffiniteit (31).
Hydrofiele medicatie wordt vlotter opgenomen door spierweefsel dan door vetweefsel (14, 32). Veroudering gaat gepaard met een toename van vetweefsel (14-35% (33)) en afname van spierweefsel (3, 34), resulterend in een daling van de Lean Body Mass Index (vetvrije massa) (29, 32). Hierdoor zullen zowel amoxicilline-clavulaanzuur als
piperacilline-tazobactam minder worden opgenomen in het perifere weefsel, waardoor bij ouderen een lager verdelingsvolume wordt verwacht. Vetweefsel bevat procentueel minder water dan spierweefsel (14) zodat het totale lichaamswater (10-15% (32)) en het plasmavolume daalt (3). Dit zal eveneens bijdragen tot een daling in het verdelingsvolume (34). Bepaalde chronische aandoeningen (zoals levercirrose en congestief hartfalen) doen dan weer het lichaamswater stijgen (14). Doordat het verdelingsvolume afhankelijk is van verschillende, uiteenlopende factoren verwachten we grote variatie binnen de kwetsbare oudere populatie. Als laatste wordt de distributie beïnvloed door de doorbloeding van de organen en perifere weefsels (32, 34). Een goed doorbloed orgaan zal sneller hoge concentraties antibiotica bereiken, terwijl een gebied met slechte doorbloeding mogelijks moeite zal hebben om de therapeutische concentratie te halen. De mate van doorbloeding hangt af van zowel de kwaliteit van het vaatsysteem en de cardiale output als de functie van de organen (14, 30,
11 33), wat beide bij ouderen kan zijn aangetast. Zo is er vaak een vermindering van de
cardiale output (3, 31, 33) en een verhoging van perifere weerstand (33). Daarnaast moet rekening gehouden worden met mogelijke diffuse vaataantasting.
De mate van penetratie van een antibioticum is afhankelijk van het type weefsel. Hierin schuilt het risico dat behandelingen falen bij infecties ter hoogte van weefsels waar een bepaald antibioticum niet goed penetreert (13).
3.3.2.1 Amoxicilline-clavulaanzuur
Amoxicilline heeft, door een hogere vetoplosbaarheid, een groter verdelingsvolume dan clavulaanzuur (Bijlage 1) (35), al blijft bij beide de vetoplosbaarheid door hun zuur karakter beperkt. De verwachte daling in verdelingsvolume bij ouderen werd niet bevestigd door Sjövall et al. in hun studie rond amoxicilline bij gezonde, fitte ouderen (gemiddeld 74 jaar). Zij zagen zelfs een lichte stijging in het in de verdelingsvolume bij ouderen vergeleken met, de door hen beschreven, verdelingsvolumes van jongere patiënten (36). Conclusies trekken uit dergelijk vergelijkend onderzoek is echter moeilijk aangezien voor het verdelingsvolume van amoxicilline zeer uiteenlopende waarden (tussen de 0,26 l/kg en 0,41 l/kg) (35) worden beschreven in de literatuur voor de gezonde jonge populatie. Daarenboven kan de lage gemiddelde leeftijd (74 jaar) in de studiepopulatie van Sjövall et al. een vertekend beeld geven van het profiel van de oudere patiënt. Het is dus niet mogelijk om de theoretische daling in verdelingsvolume bij ouderen te bevestigen noch te weerleggen a.d.h.v. deze studie. Janknegt et al. voerden een gelijkaardig onderzoek uit bij kwetsbare ouderen (gem. 82 jaar) onder amoxicilline en vergeleken hun resultaten met die van Sjövall et al.. Bij het vergelijken baseerden Janknegt et al. zich op foutieve waarden, waardoor zij verkeerdelijk concludeerden dat het verdelingsvolume in hun studiepopulatie lager lag dan in die van Sjövall et al.. In werkelijkheid vonden beide studies gelijkaardige waarden (+/- 0,3 l/kg) terug. Opmerkelijker was de veel grotere intervariabiliteit tussen de farmacokinetische parameters bij de studie van Janknegt et al. (37).
Neurologische bijwerkingen worden gerapporteerd bij hoge concentraties amoxicilline-clavulaanzuur (21). Amoxicilline penetreert, onafhankelijk van de aanwezigheid van inflammatie ter hoogte van de meningen (35), niet goed doorheen de BBB (21).
Clavulaanzuur heeft vermoedelijk een hogere BBB-permeabiliteit (38). De laatste jaren is in die veronderstelling veel geschreven over de neurologische en psychotrope effecten van clavulaanzuur met invloed op dopamine loslating (38). Deze effecten mogen we niet onderschatten bij (kwetsbare) ouderen, waar de BBB-permeabiliteit op zich al hoger ligt.
12
3.3.2.2 Piperacilline-tazobactam
In monotherapie hebben piperacilline en tazobactam een gelijkaardig verdelingsvolume (Bijlage 1). Wanneer tazobactam echter in combinatie met piperacilline wordt gegeven, vermindert het verdelingsvolume van tazobactam met 16 % (26). Volgens Kim et al. zorgt de combinatie van piperacilline en tazobactam voor een betere weefsel penetratie van
tazobactam (39). We zouden hierbij echter verwachten dat het verdelingsvolume van tazobactam stijgt, waardoor deze twee bevindingen elkaar lijken tegen te spreken.
In de beschikbare literatuur kon geen onderzoek rond het verdelingsvolume van piperacilline of tazobactam bij (kwetsbare) ouderen worden teruggevonden.
Piperacilline-tazobactam is uitsluitend een ziekenhuisantibioticum (cfr. supra). Patiënten onder deze behandeling zullen dus gemiddeld genomen een relatief hogere morbiditeit hebben dan de doorsnee antibiotica gebruiker, zodat extra aandacht voor gewijzigde farmacokinetiek hier aan de orde is. Zo kan het verdelingsvolume onder invloed van koorts (14) of sepsis (13, 14) verhogen.
Zowel piperacilline als tazobactam penetreren goed in de weefsels. Voornamelijk in de huid en longen worden hoge concentraties bereikt van ongeveer 90 % van de serumconcentratie. Piperacilline en tazobactam passeren niet goed door de BBB (13, 26), al zal een beperkte fractie van de concentratie in het CSV geraken (13) waardoor de neurologische effecten niet mogen worden onderschat bij kwetsbare ouderen.
3.3.3
Metabolisatie
De metabolisatie speelt een beperkte rol in de klaring van amoxicilline-clavulaanzuur en piperacilline-tazobactam. Verminderde doorbloeding van de lever kan een weerslag hebben op de metabolisatie. Zoals uit de eerder geschreven definitie blijkt, is frailty een belangrijke determinant in de functionaliteitsdaling van de organen bij ouderen. Hierdoor neemt de metabolisatie- en excretiecapaciteit bij kwetsbare ouderen nog meer af dan bij fitte ouderen.
3.3.3.1 Amoxicilline-clavulaanzuur
De fractie amoxicilline en clavulaanzuur dewelke gemetaboliseerd wordt is verschillend. Van de initiële dosis amoxicilline wordt na 6 uur 50-90 % onveranderd teruggevonden in de urine (16, 35, 40), ongeveer 10-25 % wordt gemetaboliseerd tot het inactieve penicilloïdezuur en renaal geëxcreteerd (21). Metabolisatie speelt een grotere rol bij clavulaanzuur, waar na 6
13 uur slechts 20-60 % van de initiële dosis onveranderd wordt teruggevonden in de urine (16,
35, 40). Na metabolisatie van clavulaanzuur in de lever, worden metabolieten teruggevonden in de urine, stoelgang en longen (als CO2) (16, 21, 35, 40).
3.3.3.2 Piperacilline-tazobactam
Zowel piperacilline als tazobactam ondergaan een splitsing van hun β-lactamring (13). Tot 26 % van de dosis van tazobactam wordt omgezet tot een inactieve metaboliet (M1) (13, 26, 41). Een kleine fractie van de dosis van piperacilline wordt zonder splitsen van zijn
β-lactamring (42) omgezet tot desethylpiperacilline (13, 26, 41, 42). Volgens sommige auteurs zou deze metaboliet nog enige antibacteriële activiteit bezitten (26, 42), terwijl andere auteurs deze als inactief beschouwen (13).
3.3.4
Excretie
Excretie van zowel amoxicilline-clavulaanzuur als piperacilline-tazobactam gebeurt
voornamelijk via de nieren. In de nieren kunnen antibiotica 3 wegen afleggen: glomerulaire filtratie, actieve tubulaire secretie en/of passieve tubulaire reabsorptie. Bij ouderen wordt een daling gezien in renale plasma flow en tubulaire secretie, met hierdoor een gedaalde
creatinine klaring (33). Gemiddeld daalt de creatinineklaring 40-50 % tussen de leeftijd van 25 en 85 jaar (33) ten gevolge van een daling in het aantal glomeruli (20-30 %) en de niermassa, die reeds begint vanaf 30 jaar (29). Een schatting van de nierfunctie (eGFR) wordt meestal gemaakt a.d.h.v. de Cockcroft-Gault formule. Deze tracht de creatinineklaring af te leiden uit de serumcreatinine rekening houdend met leeftijd, gewicht en geslacht. Het voordeel van deze formule is dat het rekening houdt met de leeftijd aangezien bij ouderen door de daling in spiermassa minder creatinine wordt geproduceerd waardoor de
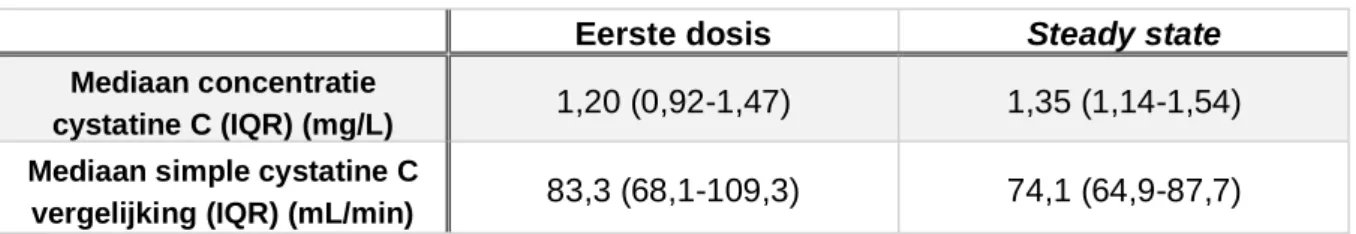
serumcreatinineconcentratie lager ligt en een vertekend beeld kan geven (29). Men stelt echter vast dat ook de Cockcroft-Gault formule vaak onvoldoende nauwkeurig blijkt (43, 44). De laatste jaren krijgt cystatine C (cys C) meer aandacht als biomarker voor de glomerulaire filtratie en eventuele vervanger van creatinine. Cys C wordt geproduceerd door alle cellen (met kern) (44, 45) aan een constante snelheid waardoor het minder afhankelijk is van de leeftijd, BMI, spiermassa of dieet (45) dan creatinine (43). Daarnaast wordt het glomerulair gefiltreerd om vervolgens te worden gereabsorbeerd en afgebroken door de proximale tubulaire cellen. De interpersoonlijke variabiliteit is lager bij Cys C dan creatinine.
14 het bepalen van de eGFR bij ouderen, patiënten met malnutritie en nierpatiënten (43, 45) en
bijgevolg kwetsbare patiënten.
Onderzoek toont aan dat een derde van de oudere patiënten geen daling in creatinineklaring vertoont en dat bij een beperkt deel zelfs een stijging in klaring optreedt (29). Daling in de nierfunctie wordt bijgevolg eerder toegeschreven aan ziekte en andere cofactoren (zoals hypertensie, vaatlijden, hartziekten en andere chronische aandoeningen) dan aan het verouderingsproces zelf. (3, 10, 14, 29, 33, 34). Daling in de nierfunctie treedt bij kwetsbare ouderen vaker op dan bij de algemene oudere populatie (8). Dit zal verder bijdragen tot een stijging in de (vrije) concentratie van geneesmiddelen (8). Daarnaast reduceert chronisch nierfalen de compensatoire renale excretie die zou moeten optreden bij een verhoogde vrije concentratie (46). De klinische relevantie van de stijging in vrije concentratie bij ouderen wordt betwist (34), tot op heden zijn er geen studies die de klaring en vrije concentratie van amoxicilline-clavulaanzuur of piperacilline-tazobactam bij (kwetsbare) ouderen met nierfalen bestuderen.Biliaire excretie, na metabolisatie in de lever, draagt in beperkte mate bij tot de eliminatie van zowel amoxicilline-clavulaanzuur (21) als piperacilline-tazobactam (26, 47).
3.3.4.1 Amoxicilline-clavulaanzuur
Ondanks de uiteenlopende metabolisatieroutes van amoxicilline en clavulaanzuur hebben ze een gelijkaardige halfwaardetijd (16). De belangrijkste excretieroute van amoxicilline loopt via de nieren, waar zoals eerder gezegd na 6 uur 50-90% onveranderd wordt geklaard (16, 35, 36, 40, 48). Amoxicilline wordt voornamelijk actief tubulair gesecreteerd (17, 48). De snelheid van urinaire excretie is het hoogst tot drie kwartier na dosistoediening (49). Non-renale routes maken 20% uit van de totale excretie (36, 48).
Clavulaanzuur heeft een minder prominente renale uitscheiding, al worden opnieuw uiteenlopende fracties beschreven. Verschillende auteurs beschrijven een renale excretie van 20-30% voor clavulaanzuur (36, 48), maar ook waarden tot 50-65% (16, 17, 21) worden beschreven. Binnen de eerste 2 uur na toediening wordt de grootste fractie clavulaanzuur uitgescheiden (21). Actieve tubulaire secretie wordt bij clavulaanzuur niet vermeld.
Aangezien amoxicilline en clavulaanzuur verschillende eliminatieroutes afleggen, zullen ze elkaar niet beïnvloeden in combinatietherapie.
Probenecid is een competitieve inhibitor van de transporter die betrokken is bij tubulaire secretie van zure moleculen in het lichaam. Het verschil in de renale routes tussen
15 vertragen, maar geen invloed heeft op clavulaanzuur (17, 21, 35).
In een studie van Horber et al. werd aangetoond dat de totale klaring van amoxicilline met 90 % afnam bij patiënten met creatinineklaring (CLCR)< 10 ml/min, de klaring van
clavulaanzuur nam met 70% af (48). Het spreekt voor zich dat hierdoor de ratio van
amoxicilline over clavulaanzuur in het lichaam bij patiënten met een verminderde nierfunctie zal veranderen. Bij CLCR> 75 ml/min is de verhouding in het bloed gelijk aan de verhouding
in toedieningsvorm, namelijk een 5-voudige concentratie van amoxicilline over clavulaanzuur bij een toediening van 1000/200 mg (48). Bij CLCR< 10 ml/min kan de concentratie van
amoxicilline echter oplopen tot 12 maal de concentratie van clavulaanzuur (48). Door de irreversibele binding van clavulaanzuur aan β-lactamasen zal de werking van clavulaanzuur bepaald worden door de concentratie ter hoogte van de infectieplaats en niet door de verhouding ten opzichte van amoxicilline (17), waardoor deze verhoudingsshift in concentratie geen invloed heeft op de werkzaamheid van clavulaanzuur.
Bij patiënten met chronisch nierfalen wordt daarnaast gezien dat de non-renale excretie daalt. Deze daling is meer uitgesproken voor amoxicilline dan voor clavulaanzuur, waardoor voornamelijk amoxicilline kan opstapelen tot hoge concentraties in het bloed. De oorzaak van de daling is niet goed gekend, al bemerkten Horber et al. dat deze patiënten vaak eveneens een gedaalde leverfunctie hebben zonder dat daar een anamnestisch of klinisch vermoeden voor bestond (48). Deze bevindingen zijn belangrijk om mee te nemen in de behandeling van kwetsbare ouderen, die met hun hoog aantal in co-morbiditeiten een groter risico hebben op de aanwezigheid van nier- én leverfalen met klinische relevantie.
3.3.4.2 Piperacilline-tazobactam
In tegenstelling tot amoxicilline-clavulaanzuur hebben piperacilline en tazobactam geen gelijkaardige halfwaardetijd. Volgens de studie van Kim et al. daalt de serumconcentratie van piperacilline tot onder die van tazobactam vanaf 7 uur na toediening. Daarenboven vertraagt de eliminatie en stijgt zo de halfwaardetijd van beide producten wanneer hoge dosissen piperacilline-tazobactam worden toegevoegd (39). Piperacilline en tazobactam worden voor het grootste deel renaal uitgescheiden (13, 25, 26, 50), het overige deel biliair (13, 26, 50).
De renale excretie van piperacilline en tazobactam gebeurt via glomerulaire filtratie en tubulaire secretie (26), waarbij het glomerulair filtraat het belangrijkste is (50). Actieve tubulaire secretie gebeurt met behulp van een tubulaire transporter. Volgens sommige auteurs is de excretie van piperacilline verzadigbaar (27), al wordt dit door anderen betwist
16 of niet klinisch relevant bevonden (27, 51).
Piperacilline en tazobactam gebruiken dezelfde transporter voor de actieve tubulaire secretie en treden hierdoor in competitie (26). Hierdoor zal de renale excretie van tazobactam verminderen (10%; (13)) in het bijzijn van piperacilline (13, 25) en stijgt de halfwaardetijd met 18% (26). Johnson et al. beschreven zelfs dat de onveranderde
hoeveelheid tazobactam uitgescheiden in de urine daalt van 76 % in monotherapie naar 56 % in combinatie met piperacilline. Het is evident dat hierdoor de maximale
serumconcentratie van tazobactam hoger is wanneer het in combinatie wordt gegeven met piperacilline. Kim et al. rapporteerden zelfs een verdubbeling van de maximale
serumconcentratie (39).
Biliaire excretie telt mee voor minder dan 1% bij zowel piperacilline als tazobactam (26, 47). De fractie uitgescheiden in de gal is hoger bij piperacilline dan bij tazobactam, door het hoger moleculaire gewicht van piperacilline (Bijlage 1). De fractie tazobactam uitgescheiden via non-renale routes blijft gelijk wanneer het in combinatie wordt gegeven met piperacilline (25). Doordat de renale route een groter aandeel heeft in de totale excretie van tazobactam dan in die van piperacilline, zal tazobactam een grotere impact ondervinden van
nierfunctiestoornissen. Verder ziet men bij patiënten met CLCR< 20 ml/min een daling van
63% en 77% in de totale klaring van resp. piperacilline en tazobactam (25). Hoewel tazobactam meer lijdt onder een nierfunctiedaling, is het verschil in totale klaring
onvoldoende om de vaste verhouding, waarin piperacilline-tazobactam standaard wordt toegediend (8:1), aan te passen bij patiënten met nierfunctiestoornissen (25).
De metaboliet van tazobactam, M1, wordt volledig renaal uitgescheiden (26) als gevolg van zijn laag moleculair gewicht (nl. 248,26 g/mol (41)). Bij patiënten met een gedaalde
nierfunctie (CLCR < 40 ml/min) zal opstapeling van tazobactam resulteren in een hogere
aanmaak van M1. Hoewel maximale serumconcentraties van M1 vanaf CLCR< 20 ml/min
verviervoudigen (26), tonen dierenstudies aan dat zelfs bij extreem hoge M1 concentraties geen toxisch effect optreedt (41).
Bij levercirrose stijgt de halfwaardetijd van piperacilline met 25% en die van tazobactam met 18%. Dosisaanpassingen zijn volgens de huidige richtlijnen echter niet nodig (26).
Opmerkelijk is dat de fractie piperacilline die biliair wordt geëxcreteerd, verhoogt bij het optreden van nierfalen (13). Dit in tegenstelling tot wat wordt beschreven bij amoxicilline-clavulaanzuur.
17
3.4
Farmacodynamiek
Terwijl farmacokinetiek de concentratie van de medicatie in het lichaam beschrijft in functie van de tijd, beschrijft de farmacodynamiek voornamelijk het effect van een bepaalde concentratie ter hoogte van het aangrijpingspunt, in dit geval de infectieplaats. Antibioticadosering wordt door, zowel farmacodynamische eigenschappen van het
antibioticum, als de MIC (minimale inhiberende concentratie) en MBC (minimaal bactericide concentratie) aangestuurd. De MIC is de minimale (serum-)concentratie aan antibiotica die nodig is om de groei van de bacteriën volledig te inhiberen. De MBC is de minimale
concentratie aan antibioticum die nodig is om een bacterie te doden en zal dus bij bactericide antibiotica, zoals de β-lactam antibiotica, een waarde hebben die (maximaal) gelijk zijn aan 4 maal de MIC (14). Aangezien penicillines tijdsafhankelijke antibiotica zijn, wordt de mate van werkzaamheid bepaald door de tijd dat de concentratie ongebonden antibioticum hoger is dan de MIC van een bepaald organisme (13), uitgedrukt in percentage van het dosisinterval (% T>MIC) (tijd boven de MIC). Bij tijdsafhankelijke antibiotica is een
concentratie-afhankelijk effect te zien tot een concentratie van 4 tot 5 maal de MIC wordt bereikt, daarboven kan geen concentratie-afhankelijke verbetering in effect meer worden vastgesteld (13, 26, 52). Aan de hand van de haalbare serumconcentratie van een antibioticum en de beoogde PK/PD target, worden de breekpunten bepaald. In Europa worden breekpunten vastgelegd door het European Committee on Antimicrobial Susceptibility (EUCAST) (53), die zo therapeutische richtlijnen bepalen.
Verder is het post-antibiotisch effect (PAE) belangrijk in het begrijpen en voorspellen van de bactericide activiteit. Over het algemeen wordt bij β-lactam antibiotica slechts een kort PAE gezien (16), waardoor het belangrijk is de concentratie op pijl te houden.
De farmacodynamiek van de β-lactamase inhibitoren is minder goed gekend, de mate van werkzaamheid wordt vaak omschreven als het percentage van de tijd waarin de
ongebonden concentratie van de β-lactamase inhibitoren zich boven een bepaalde
targetconcentratie bevindt (Engels: CT, voor concentration threshold) (27). Voor de meeste
β-lactamase inhibitoren is de CT niet goed gekend.
De nagestreefde werking van antibiotica is ter hoogte van bacteriën, elke interactie met het lichaam is bijgevolg niet nagestreefd en hierdoor vaak ongewenst effect. Enkele interacties hebben echter een bevorderlijk effect, zoals het immuunmodulerende – of neuroprotectieve
18 De farmacodynamische veranderingen bij ouderen zijn voornamelijk belangrijk in het
begrijpen en anticiperen op ongewenste effecten. Dergelijke veranderingen zijn minder goed gekend en onderzocht dan de farmacokinetische (6). Een deel van de
overgevoeligheidsreacties die optreden bij ouderen kunnen niet (volledig) worden verklaard a.d.h.v. de gewijzigde farmacokinetiek. Het onderliggend mechanisme hiervoor is nog niet helemaal duidelijk, al worden veranderingen in de neurotransmitters, hormonen en een verstoord glucosemetabolisme naar voor geschoven als mogelijke verklaring (3, 6). Verder ontstaan er farmacodynamische veranderingen door een daling in de cerebrale
doorbloeding, waardoor de controle over autonome functies (oa. temperatuurregulatie, hartritmeregulatie, vasoconstrictie en -dilatatie) daalt en een verstoorde homeostase optreedt (33). Dit zou één van de oorzaken kunnen zijn voor het frequenter optreden van ongewenste effecten bij ouderen (6).
3.4.1
Amoxicilline-clavulaanzuur
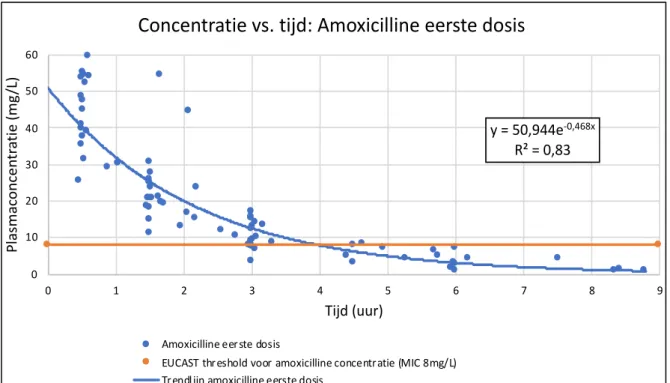
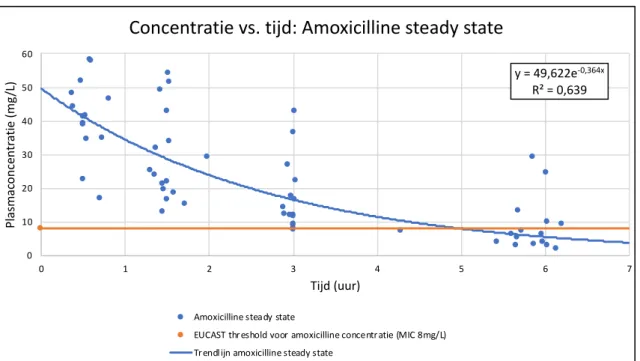
Volgens verschillende auteurs worden met amoxicilline goede klinische effecten gezien bij 40-50% T>MIC (18, 19, 23, 54, 55), met maximaal effect bij 60-70% T>MIC (19).
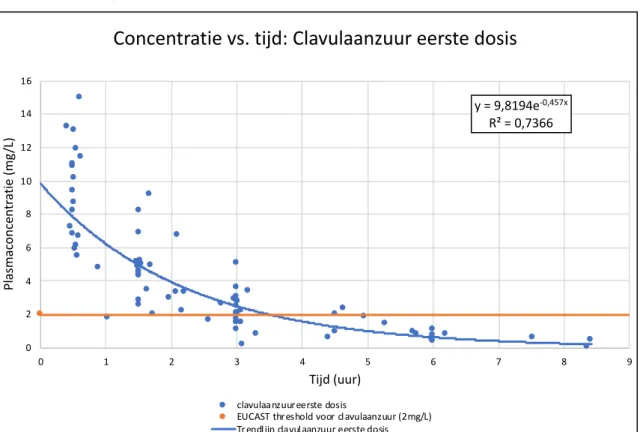
Er bestaat nog veel discussie over welke concentratie als CT (T>CT) moet worden
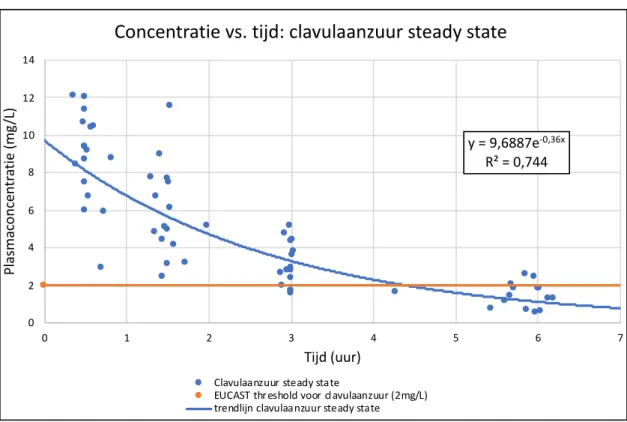
gehanteerd om de werkzaamheid van clavulaanzuur te waarborgen, vaak wordt gebruik gemaakt van de concentratie clavulaanzuur waarbij amoxicilline zijn antibacteriële werking blijft uitvoeren in in vitro testen. EUCAST stelt deze concentratie gelijk aan 2 mg/L (53). In in vitro studies werd echter verder aangetoond dat clavulaanzuur zijn effect behoudt bij heel beperkte concentraties (16, 19), waardoor clavulaanzuur nu in te hoge dosissen zou worden gegeven.
De laatste decennia werd veel onderzoek verricht naar de combinatie van amoxicilline en clavulaanzuur en naar de effecten ervan op de mens en pathogenen. Aanvankelijk werd aangenomen dat clavulaanzuur uitsluitend als inhibitor van β-lactamasen werkt. Uit
onderzoek blijkt echter dat lagere MIC waarden voor S. pneumoniae worden bekomen door toevoeging van clavulaanzuur aan amoxicilline, desondanks dat S. pneumoniae zijn
resistentie tegen penicillines niet verwerft door β-lactamasen te produceren (35). Dit doet vermoeden dat clavulaanzuur meer doet dan enkel β-lactamasen inhiberen. In de werking tegen S. pneumoniae wordt verondersteld dat clavulaanzuur complementair met amoxicilline bindt aan PBP’s, waardoor een synergistisch effect optreedt. Naast een daling van de MIC werd na toevoeging van clavulaanzuur aan amoxicilline beschreven dat de cellen van S.
19 pneumoniae onregelmatig werden, veranderden van vorm en een groter volume kregen.
Deze veranderingen werden niet gezien bij een behandeling met amoxicilline in
monotherapie. Bij verder in vitro onderzoek werd beschreven dat selectieve binding van clavulaanzuur met PBP-3 resulteert in vroegere cellyse, verhoogde gevoeligheid aan lysozyme-geïnduceerde autolyse en veranderingen in de peptidoglycaan-structuur (35). Verschillende auteurs beschrijven bijkomend een immuunmodulerende functie van
clavulaanzuur, waarbij clavulaanzuur de mate van fagocytose en intracellulaire doding door polymorfonucleaire neutrofielen (PNM) verhoogt (16, 35, 40). Amoxicilline heeft net zoals andere β- lactam antibiotica een kort PAE. Dit geldt niet voor clavulaanzuur, door zijn irreversibele binding aan β-lactamasen wordt een post β-lactamase inhiberend effect (PLIE) beschreven van 8-12 uur (16, 19). Uit sommige onderzoeken bleek dat het PAE van
amoxicilline verdubbelt (tot 1,8 uur) wanneer het in combinatie wordt gegeven met
clavulaanzuur, al blijft dit nog steeds eerder pover ten opzichte van dat van clavulaanzuur (16).
3.4.2
Piperacilline-tazobactam
Vaak wordt voor piperacilline een target van >50% T>MIC gehanteerd (28, 39), al wordt soms
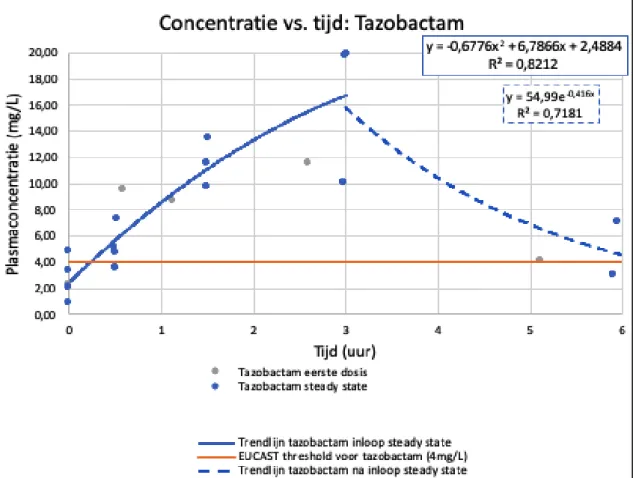
>90 % en 100% targets voorop gesteld (13, 27, 51). Opnieuw is beperkte evidentie voorhanden rond de CT van het toegevoegde β-lactamase, tazobactam, door EUCAST
wordt 4 mg/L tazobactam gehanteerd in vitro om de antibacteriële werking van piperacilline te testen.
Tot op heden werd weinig onderzoek verricht naar de combinatie van piperacilline en tazobactam. De gelimiteerde data beschrijft voorlopig geen interacties tussen beide (51). In tegenstelling tot clavulaanzuur zag men bij in vitro studies dat tazobactam in monotherapie geen intrinsieke activiteit heeft tegen bacteriën (onvoldoende binding aan PBP’s) (26).
3.5
Dosering
Tot voor kort werd bij een antibioticabehandeling in eerste instantie gefocust op de juiste keuze van het type antibioticum en was het vinden van de meest geschikte dosis of toedieningswijze minder prioritair. β-lactam antibiotica werden hierdoor een lange tijd gegeven onder de vorm van één standaarddosering in een vast doseringsinterval.
Dosisaanpassingen werden uitsluitend uitgevoerd in het kader van nierfunctiedaling, zonder verder het profiel van de patiënt in acht te nemen. Deze aanpak zorgt voor een grote
20 interpersoonlijke variabiliteit in antibiotica blootstelling (5), waarin het risico schuilt dat
bepaalde patiëntengroepen slechts sub-therapeutische weefselconcentraties bereiken, met daarbij het risico op therapiefalen en resistentievorming. Optimale dosering is uitermate belangrijk bij kritisch zieke patiënten (5). Daarnaast is een hogere dosering soms wenselijk bij patiënten die geïnfecteerd zijn door stammen met intermediaire gevoeligheid en
laaggradige resistentie (5, 10). De terechte vrees voor de toenemende resistentie heeft er de laatste jaren voor gezorgd dat meer aandacht wordt geschonken aan het optimaliseren van, onder meer, β-lactam antibioticatherapie.
Het vinden van de meest optimale behandelingsstrategie houdt in dat
behandelingsschema’s individueel moeten worden bekeken en moeten worden gebaseerd op de farmacodynamische eigenschappen van het antibioticum, de gevoeligheid van de bacteriën en de PK/PD wijzigingen van de patiënt. Een combinatie van factoren kan leiden tot het vinden van individuele toedieningsschema’s (bolus, verlengde- en continue
toediening; cfr. infra) en dosissen (5).
Het bepalen van de meest geschikte dosis van het β-lactam antibioticum blijft, ondanks toenemende kennis, moeilijk. In de praktijk worden β-lactam antibiotica vaak empirisch opgestart wanneer de oorzakelijke pathogenen en hun MIC waarden niet gekend zijn. Daarenboven zijn de eigenschappen van de organismen ter hoogte van de infectieplaats moeilijk te achterhalen en blijken laboratoriumwaarden soms niet representatief.
Laboratoriumwaarden zoals de MIC kunnen immers afwijken van het farmacodynamisch profiel in vivo ter hoogte van de infectieplaats (14), doordat onder andere de gevoeligheid van de traag groeiende kolonies niet in kaart worden gebracht (14). Door het statisch karakter van routine laboratorium analyses is het verloop van de antibacteriële werking tijdens het dosisinterval(14) moeilijk in te schatten. De dosis moet voldoende lang een therapeutische concentratie waarborgen op de infectieplaats, die niet steeds kan worden afgeleid uit de serumconcentratie (bv. in het CSV) en hierdoor vaak overschat wordt (50). Aangezien kennis ontbreekt om de optimale dosis te voorspellen op basis van patiënt-gerelateerde eigenschappen, worden meer en meer dosisaanpassingen uitgevoerd op basis van therapeutische drug monitoring (TDM) (bij voorkeur binnen de eerste 24 uur (5)). Bij zowel amoxicilline-clavulaanzuur als piperacilline-tazobactam wordt, in het bijzonder bij kritisch zieke patiënten, de targetconcentratie vaak niet gehaald. TDM kan bij kritisch zieke patiënten een nuttige tool zijn in het kader van antibioticadosering (13, 50, 56). Echter kunnen ook andere patiëntengroepen wiens PK/PD eigenschappen moeilijk te voorspellen zijn hierbij baat hebben. Patiëntengroepen waarbij dit reeds werd onderzocht, zijn patiënten
21 met brandwonden en mucoviscidose (13). Hierdoor rijst de vraag of TDM ook bij (kwetsbare)
ouderen een rol zou kunnen spelen.
Het is evident dat intraveneuze toediening de beste biodisponibiliteit garandeert.
Intraveneuze toediening kan via 3 schema’s: intermittente toediening in bolus, intermittente toediening met een verlengde infusie en via een continu infuus. Aangezien β-lactam
antibiotica tijdsgebonden antibiotica zijn, wordt geopteerd voor een doseringsschema dat de tijd boven de MIC zo lang mogelijk op pijl houdt.
Intermittente toediening met een verlengde infusie houdt in dat de inloopduur van de medicatie verlengd wordt (gedurende 40-50% van het dosisinterval (5)). Naargelang de eigenschappen van het antibioticum en de patiënt kunnen interval, inloopduur en dosis worden aangepast om een optimale behandeling te bekomen.
Indien de inloopduur gelijk wordt gesteld aan het dosisinterval spreken we van een continu infuus. Continue infusie bij β-lactam antibiotica wordt meer en meer naar voor geschoven in het zoeken naar een oplossing voor de stijgende resistentie (5). Continue infusie lijkt de meest voor de hand liggende toedieningsvorm om de tijd boven de MIC te garanderen, al moeten daarbij enkele zaken in rekening worden gebracht. De grootste hinderpaal voor een continu infuus is de mogelijke instabiliteit van het antibioticum in de infuuszak, en bijkomend de nood aan permanente intraveneuze toegangsweg (5). Bij onvoldoende stabiele
antibiotica zal de residuele activiteit mogelijks onvoldoende zijn op het einde van de infusietijd en kunnen degradatie producten hypersensitiviteit uitlokken.
De inloopduur verlengen heeft invloed op de piekconcentratie, die meer geleidelijk verloopt en zo een positieve invloed heeft op de T>MIC (10). Doordat de serumconcentratie trager
oploopt bij een continue - of verlengde infusie, wordt bij dergelijke infusies β-lactam antibiotica gebruik gemaakt van een ladingsdosis om snel therapeutische concentraties te behalen (5).
Bij hydrofiele medicatie heeft het verdelingsvolume een grote invloed op de distributie van de ladingsdosis (46). Bij ouderen worden bepaalde hydrofiele medicatie in een lagere ladingsdosis toegediend wegens hun lager verdelingsvolume (46). Dit werd tot op heden nog niet beschreven voor β-lactam antibiotica.
Studies die de drie intraveneuze toedieningswijzen vergelijken tonen aan dat de PK/PD targets bij verlengde toediening of continu infuus frequenter worden gehaald dan bij bolus toediening. Voornamelijk in situaties met risico op onderdosering (zoals bij multiresistente pathogenen of verhoogde renale klaring) verzekert het continu infuus de beste tijd boven de
22 MIC van de drie (5). Wijzigingen in de farmacokinetiek en -dynamiek, zoals die bij kwetsbare
ouderen optreden, kunnen beter opgevangen worden via een continue infuus (57).
Zoals hierboven aangehaald, is het wenselijk de richtlijnen omtrent toedieningswijzen ook te baseren op klinische outcomes en niet enkel te steunen op routine bacteriologisch
laboratorium onderzoek (zoals T>MIC ). Tot op heden konden de weinige grote studies (5)
die werden uitgevoerd geen evidentie voor een verschil in klinische outcomes aantonen. Retrospectieve en observationele studies rapporteren een daling in de mortaliteit bij het gebruik van continue dosering, maar dit kon nog niet worden bevestigd door middel van gerandomiseerd onderzoek met controlegroep (Engels: RCT, voor Randomized Controlled Trial). Één meta-analyse merkte een daling op in de ziekenhuismortaliteit bij continue toediening, maar zag geen significante verbetering op lange termijn (oa. Heropname en mortaliteit op intensieve zorgen) (5). Daarboven werden deze studies uitgevoerd bij patiënten opgenomen op de Intensieve Zorgen, waardoor deze resultaten niet naar onze studiepopulatie kunnen worden doorgetrokken. Verdere kwaliteitsvolle RCT’s zijn nodig om onderbouwde keuzes te kunnen maken in de wijze van β-lactam antibiotica toediening.
3.5.1
Amoxicilline-clavulaanzuur
De standaarddosering van amoxicilline-clavulaanzuur is 1000/200 mg, 4 maal per dag. Uit onderzoek van Haeseker et al. blijkt echter dat de tijd boven de MIC met dit schema niet voldoende wordt gewaarborgd. Zo haalde slechts 65% van de patiënten een concentratie van > 40% T>MIC wanneer pathogenen met een MIC van 8 mg/L werden behandeld (19). Zij,
en vele andere auteurs, stellen voor het dosisschema aan te passen naar 1000/200 mg 6 maal per dag (19). Belangrijk voor onze studiepopulatie is dat wanneer de patiënten werden opgedeeld volgens leeftijd alle patiënten boven de 70 jaar de target (PK/PD target van >40% T>MIC) haalden bij MIC waarden van 4 mg/L met dosering van 4 maal per dag, in
vergelijking met 87 % van de jongere patiënten. Bij een MIC van 8 mg/L haalde 81% van de ouderen de target tegenover 52% van de jongeren (19). Omdat zij een target van >40% T>MIC hanteerden, in plaats van de meer optimale 60-70% T>MIC, is het niet mogelijk op
basis van deze resultaten uitspraken te doen rond de dosering bij ouderen.
De interne doseerrichtlijnen van het UZ Gent, opgehaald in maart 2019, legt richtlijnen op onafhankelijk van de leeftijd van de patiënt. Het advies bestaat uit een intraveneuze toediening van 1000/200 mg amoxicilline-clavulaanzuur 6 maal per dag aan bij intra-abdominale infecties, vroege nosocomiale respiratoire infecties, pyelonefritis,
23 bloedstroominfecties, orthopedische infecties, prothese infecties of necrotische infecties. Bij
andere infecties wordt het schema van 4 maal per dag aanbevolen.
Dergelijke hoge doseringen stroken echter niet met het advies dat we terugvinden in de bijsluiter van Augmentin® 1000/200 mg, waar maximale dagdosissen van 3000 mg
amoxicilline en 600 mg clavulaanzuur worden aanbevolen met als doel de totale dagdosis clavulaanzuur te beperken. Zoals eerder besproken, kon worden aangetoond dat
clavulaanzuur het grootste aandeel heeft in de (concentratieafhankelijke)bijwerkingen die optreden bij een behandeling met amoxicilline-clavulaanzuur (20). Daarenboven heeft clavulaanzuur een lange PLIE en is beschreven dat lage concentraties voldoende zijn om de effectiviteit van clavulaanzuur te waarborgen (16, 19, 23). In studies bij kinderen zag men dat een dosisreductie van clavulaanzuur met 55% leidde tot een reductie van 33% in de piekconcentratie. Ondanks deze reductie bleef de concentratie voldoende hoog om de β-lactamasen effectief te inhiberen (23). Ook volgens Charoo et al. wordt clavulaanzuur momenteel te hoog gedoseerd en zou de maximale dagdosis 375 mg moeten bedragen (16). Wanneer een hoge dosis amoxicilline (3 g) 3 maal daags werd toegediend samen met 125 mg clavulaanzuur, rapporteerde slechts 5% van de patiënten ongewenste effecten (voornamelijk nausea en diarree). Wanneer de dosis clavulaanzuur werd verhoogd naar 250 mg werd dit 24% van de patiënten (16).
Dosisaanpassingen worden volgens de bijsluiter enkel aanbevolen bij nierfunctiestoornissen (CLCR< 30 ml/min). Voorzichtigheid bij dosering en nauwgezette opvolging wordt gevraagd
bij mensen met een verstoorde leverfunctie (21).
Zoals eerder besproken geniet een continu infuus bij tijdsafhankelijke β-lactam antibiotica de voorkeur. Dit geldt echter niet voor amoxicilline-clavulaanzuur omdat wordt aangenomen dat clavulaanzuur instabiel is bij kamertemperatuur (18). Over de stabiliteit van amoxicilline bij kamertemperatuur bestaat discussie (19), al tonen recente bevindingen van Arensdroff et al. een goede TA en klinische outcome bij amoxicilline in een continue infusie (58). Zij pleiten hierdoor voor verder onderzoek naar de veiligheid van amoxicilline in een continue infusie, al wordt het risico door hen laag ingeschat (58).
3.5.2
Piperacilline-tazobactam
Naar de huidige aanbevelingen wordt piperacilline-tazobactam voorgeschreven als een standaarddosis van 4 g piperacilline en 0.5 g tazobactam om de 6-8 h (26, 50, 59). Deze verhouding van 8:1 staat vast en is onafhankelijk van de dosis (27). In deze studie wordt piperacilline-tazobactam 4000/500mg toegediend in een verlengde infusie gedurende 3 u
24 met een interval van 6 of 8 u. Bij de eerste dosis wordt gestart met een ladingsdosis.
EUCAST (53) legt het breekpunt voor volledige resistentie op 16 mg/L. De meeste studies halen bij MIC waarden van 16 mg/L nipt de target van >50% T>MIC. In een onderzoek van
Kim et al. werd de target van >50% T>MIC bij MIC = 16 mg/L enkel behaald met
dagdosissen van 18 g piperacilline-tazobactam (39). De beste resultaten worden gehaald wanneer het dosisinterval wordt verlengd, zonder aanpassing in dagdosis. Doordat de dagdosis gelijk blijft, zullen de dosissen per toediening hoger zijn bij het verlengen van het dosisinterval. De betere resultaten die hierdoor worden geboekt, zijn te verklaren doordat de eliminatiesnelheid van piperacilline-tazobactam vertraagt bij hogere dosissen (cfr. supra). In het onderzoek van Alobaid et al. werden zoals verwacht betere PK/PD resultaten geboekt wanneer piperacilline-tazobactam werd toegediend via een continue toediening of via verlengde infusie in vergelijking met toediening in bolus (59).
Zoals bij amoxicilline-clavulaanzuur worden uitsluitend bij patiënten met een verminderde nierfunctie een aangepaste dosis aanbevolen (25, 26). De interne doseerrichtlijnen van het UZ Gent, opgehaald in augustus 2019, adviseren de toedieningsdosis gelijk te houden bij patiënten met een gedaalde nierfunctie (ClCR < 30 ml/min), maar het dosisinterval te
verlengen waardoor een lagere dagdosis wordt bereikt.
4 DOELSTELLINGEN
Doseringsschema’s die worden gehanteerd bij geriatrische patiënten zijn tot op heden onvoldoende wetenschappelijk onderbouwd. Evidentie ontbreekt om doseringsschema’s af te stemmen op de gewijzigde farmacokinetiek bij ouderen ten gevolge van verouderings- en ziekte gerelateerde veranderingen. Het primaire objectief van deze studie is het achterhalen van de mate van target attainment (TA) bij de huidige standaardtherapie
amoxicilline-clavulaanzuur en piperacilline-tazobactam bij gehospitaliseerde ouderen (> 75 jaar) op de dienst geriatrie. Secundair wordt de correlatie tussen de klaring van
amoxicilline-clavulaanzuur en de geschatte nierfunctie bekeken, om na te gaan of deze geschikt zijn om dosisaanpassingen op te baseren. Daarnaast worden farmacokinetische parameters van de geriatrische patiënten gekwantificeerd en vergeleken met de literatuur. Als tertiair objectief wordt gezocht naar determinanten voor de klaring van amoxicilline in steady state condities, om een eerste stap te zetten naar het selecteren van groepen met nood aan individuele dosisaanpassingen. Verder wordt in deze studie de outcome en bijwerkingen van de huidige