HEMATOGENE INFECTIES IN HET
BEWEGINGSSTELSEL BIJ VEULENS
IS SERUM AMYLOID A EEN BETROUWBARE PARAMETER
OM HET EFFECT VAN BEHANDELING NA TE GAAN?
Aantal woorden: 15.935
Eva Buschmann
Studentennummer: 01402310Promotor: Dr. Daphné Van Hende
Promotor: Prof. dr. Frederik Pille
Onderdeel van de Masterproef voorgelegd voor het behalen van de graad master in de diergeneeskunde
Academiejaar: 2019 – 2020
Universiteit Gent, haar werknemers of studenten bieden geen enkele garantie met betrekking tot de juistheid of volledigheid van de gegevens vervat in deze masterproef, noch dat de inhoud van deze masterproef geen inbreuk uitmaakt op of aanleiding kan geven tot inbreuken op de rechten van derden. Universiteit Gent, haar werknemers of studenten aanvaarden geen aansprakelijkheid of verantwoordelijkheid voor enig gebruik dat door iemand anders wordt gemaakt van de inhoud van de masterproef, noch voor enig vertrouwen dat wordt gesteld in een advies of informatie vervat in de masterproef.
Preambule
Deze masterproef werd geschreven tijdens COVID-19. Aangezien de data reeds verzameld werden tussen maart en september 2019 had dit geen invloed op het schrijven van de masterproef.
Voorwoord
Vooreerst zou ik in dit voorwoord mijn beide promotors willen bedanken voor het begeleiden van deze masterproef. Daphné Van Hende wil ik bedanken voor de hulp bij het verzamelen van de data en om me wegwijs te maken in het kliniekprogramma. Professor Pille zou ik willen bedanken voor zijn hulp en ideeën bij het sturen van dit onderzoek.
Ook wil ik mijn ouders en grootvader bedanken voor het nalezen van dit werk. Daarnaast wil ik ze ook bedanken voor alle mogelijkheden die ze me gegeven hebben om deze studie tot een goed eind te brengen. Tenslotte wil ik mijn beste vriendinnen Babette, Emma en Ester bedanken voor al hun steun tijdens mijn studie en om altijd voor de nodige ontspanning te zorgen.
Inhoud
Samenvatting ...6
1 Literatuurstudie ...7
1.1 De acute fase respons ...7
1.2 Serum Amyloid A (SAA) ...7
1.2.1 Functie ...8
1.2.2 Fysiologische condities ...8
1.2.3 Toepassingen ...8
1.2.4 Meting van Serum Amyloid A ... 12
1.3 Hematogene infecties van het bewegingsstelsel ... 13
1.3.1 Voorkomen/epidemiologie ... 13 1.3.2 Diagnose ... 14 1.3.3 Behandeling ... 17 1.3.4 Prognose ... 19 2 Eigen onderzoek ... 20 2.1 Probleemstelling ... 20 2.2 Doelstelling ... 21 2.3 Materiaal en methoden ... 22 2.3.1 Inclusiecriteria ... 22
2.3.2 Serum Amyloid A staalname en analyse ... 22
2.3.3 Verwerking data ... 22
2.4 Resultaten ... 22
2.4.1 Diagnose en klinisch verloop ... 22
2.4.2 SAA-gehaltes ... 27
2.5 Discussie ... 28
2.6 Conclusie ... 32
6
Samenvatting
Hematogene infecties van het bewegingsstelsel zijn een belangrijk en veel voorkomend probleem bij veulens. Een snelle diagnose en agressieve aanpak van septische artritis en osteomyelitis zijn cruciaal om het veulen de beste kansen op overleving en op een toekomstige succesvolle sportcarrière te geven. Dankzij zijn gunstige karakteristieken is het acute fase proteïne Serum Amyloid A (SAA) een beloftevolle parameter om het succes van behandeling na te gaan. SAA heeft bij gezonde paarden lage tot niet detecteerbare waardes, stijgt zeer snel en exponentieel na weefseltrauma, infectie en inflammatie. Door de korte halfwaardetijd daalt SAA heel snel na eliminatie van de infectieuze stimulus. Het doel van deze studie is om de betrouwbaarheid van SAA na te gaan in de opvolging van de behandeling van septische artritis en botinfecties bij veulens. Serum SAA-concentraties werden op vaste tijdstippen gemeten tijdens de behandeling en het verloop van deze concentraties werd vergeleken met het verloop van de therapie. We kunnen uit deze studie concluderen dat een sterke daling in SAA-concentratie op dag 6 overeenkomt met een succesvolle behandeling. Verhoogde concentraties op dag 6 werden gelinkt met het niet reageren op de behandeling en werd gezien bij patiënten waar de behandeling aangepast moest worden. Op basis van deze gegevens zou SAA een nuttige parameter zijn om therapiefalen sneller te onderkennen en de behandeling aan te passen. Ook zou bij dalende concentraties de duur van de antibioticabehandeling ingekort kunnen worden. Via sequentiële SAA-bepalingen zou dus op een snelle, relatief goedkope en niet-invasieve manier de respons op behandeling gemonitord kunnen worden. Verder onderzoek is echter nodig om deze bevindingen te bevestigen.
7
1 Literatuurstudie
1.1 De acute fase respons
Deze masterproef handelt over Serum Amyloid A (SAA). SAA is een acute fase proteïne. Acute fase eiwitten zijn eiwitten die snel vrijgesteld worden in de bloedbaan na infectie of weefselschade, deze reactie wordt de acute fase respons (APR) genoemd. Deze respons is een non-specifieke, complexe aangeboren immuunreactie, met als doel pathogenen te neutraliseren en isoleren, de weefselschade te minimaliseren, het herstelproces te stimuleren en homeostase terug te herstellen na infectie, trauma of stress. Met deze respons wordt een inflammatoire cascade geïnduceerd die zowel lokale vasculaire effecten als systemische effecten inhoudt. De APR wordt op gang gezet door de vrijstelling van arachidonzuur door de beschadigde cellen. Deze stimuleren dan op hun beurt de macrofagen en monocyten om cytokines zoals interleukine (IL)-1β, IL-6 en tumor necrosis factor-α (TNFα) vrij te stellen. Deze cytokines zijn verantwoordelijk voor de typische kenmerken van inflammatie, zoals pyrexie en leukocytose. De toename van deze pro-inflammatoire mediatoren in de bloedbaan stimuleert de lever tot de aanmaak van de acute fase proteïnen (Uhlar en Whitehead, 1999; Murata et al., 2004; Crisman et al., 2008). Voornamelijk speelt IL-6 hierin een belangrijke rol en zorgt voor de grootste stimulatie van de hepatische APR (Gabay en Kushner, 1999).
Acute fase proteïnen (APP) worden gedefinieerd als proteïnen waarvan de plasmaconcentratie minstens 25% verandert na een inflammatoire stimulus. Dit kan zowel een stijging als een daling van de concentratie betekenen. Is er een stijging van de plasmaconcentratie, dan wordt dit een positieve acute fase proteïne genoemd. Deze groep wordt nog eens onderverdeeld in de major en moderate APP. De major APP zijn de eiwitten die een heel lage of niet-detecteerbare plasmaconcentratie hebben bij gezonde individuen. Tijdens de acute fase respons stijgt de concentratie van deze APP snel tot meer dan 10, of vaak zelfs 100 of 1000 maal. Ook daalt de concentratie snel weer na resolutie van de ziekte. Bij het paard is er nog maar één major APP beschreven, namelijk Serum Amyloïd A. De moderate APP hebben andere karakteristieken. Zij zijn namelijk ook aanwezig bij gezonde individuen, de concentratie stijgt slechts 1 tot 10 keer tijdens inflammatie en de respons is veel trager. Voorbeelden hiervan zijn bij het paard fibrinogeen, haptoglobine, C-reactive proteïn en α1-acid glycoproteïn. Naast de positieve APP, zijn er ook negatieve APP. Dit zijn eiwitten waarvan de concentratie daalt na inflammatie. Zowel bij paarden als bij veel andere diersoorten is dit albumine. De synthese van albumine wordt onderdrukt in het voordeel van de aanmaak van de positieve acute fase proteïnen (Crisman et al., 2008).
1.2 Serum Amyloid A (SAA)
Serum Amyloid A is dankzij zijn gunstige kenmerken een veel gebruikt acute fase proteïne in de paardengeneeskunde. SAA is een 9-11 kilodalton apoproteïne, dat circuleert op een complex met high-density lipoproteïnes (Jacobsen en Andersen, 2007). De belangrijkste bron van SAA synthese is de lever, maar hiernaast is er ook een deel extrahepatische productie in verschillende weefsels. De extrahepatische synthese vindt voornamelijk plaats in de endotheliale cellen en de epitheliale cellen van organen die in contact staan met de buitenwereld. Dit gaat dan om een andere isovorm, namelijk SAA3. Zo is er uit onderzoek gebleken dat er bij gewrichtsinflammatie, naast een systemische, ook een lokale intra-articulaire SAA respons optreedt. (Jacobsen et al., 2006a). Ook wordt SAA3 lokaal aangemaakt in de melkklier, waarbij het vrijgesteld wordt in het colostrum (McDonald et al., 2001). De afbraak van Serum Amyloid A vindt plaats in de lever en heeft een zeer korte plasma halfwaardetijd. Bij knaagdieren rapporteerde men waardes van 30 minuten tot 2 uur, wat er op wijst dat de plasma levels snel dalen nadat de productie van dit eiwit afneemt (Bausserman et al., 1987; Uhlar en Whitehead, 1999; Jacobsen en Andersen, 2007).
8
1.2.1 Functie
De sterke stijging van SAA tijdens inflammatie en de bewaring van de proteïnes tijdens de evolutie, wijst erop dat SAA een kritische protectieve rol speelt in de acute fase respons (Uhlar en Whitehead, 1999). De functie van SAA is nog niet helemaal duidelijk en verschillende effecten zijn SAA toegewezen (Crisman et al., 2008). Zo versterkt SAA onder andere de leukocyt-endotheel interacties en heeft het een belangrijk chemotactisch effect op de monocyten, T-lymfocyten en neutrofielen naar de plaats van inflammatie (Xu et al., 1995). De extrahepatische productie van SAA3 oefent een ‘housekeeping’ rol uit, waarbij het zorgt voor een directe verdediging tegen binnenkomende pathogenen. De melkklier-geassocieerde SAA3 zou een voordelig effect hebben voor de neonaat en zorgt voor het in stand houden van de melkklier (McDonald et al., 2001; Jacobsen en Andersen, 2007; Crisman et al., 2008).
1.2.2 Fysiologische condities
Onder normale fysiologische condities ligt de plasma SAA-concentratie binnen een range van <0.5-20 mg/l (Jacobsen en Andersen, 2007). Deze brede range kan verklaard worden door individuele variaties van de immuunrespons en waarschijnlijk ook door de methode van meten. Deze individuele variatie zorgt ervoor dat de SAA-concentratie het best te interpreteren is aan de hand van de normaalwaarde van het individu, die in ideale omstandigheden reeds gemeten werd bij het gezonde dier (Witkowska-Piłaszewicz et al., 2019).SAA-levels zijn niet geslachtsafhankelijk, wel wordt er een leeftijdsafhankelijk verschil opgemerkt. Uit een studie blijkt dat de SAA-levels in neonatale veulens en paarden ouder dan 8 jaar iets hoger zijn dan de levels in andere leeftijdscategorieën (Nunokawa et al., 1993). Uit andere studies blijkt echter dat de SAA-concentratie bij zowel neonatale als oudere veulens zeer laag tot niet detecteerbaar is. In ieder geval zijn deze verschillen in concentratie te klein om van klinisch belang te zijn (Nunokawa et al., 1993).
Fysiologische veranderingen in de concentratie worden gezien tijdens de dracht. In de periode van 4 tot 1 maand voor de partus blijft de SAA-concentratie stabiel binnen de fysiologische range, maar net na het veulenen stijgt de concentratie snel, met een maximumwaarde op 3 dagen na de partus. Op 1 week na de partus daalt de concentratie tot de helft van zijn maximumwaarde, met daarna een continue daling tot het terug zijn normale waarde bereikt op 1 maand postpartum (Nunokawa et al., 1993; Witkowska-Piłaszewicz et al., 2019). Dit kan verklaard worden door de weefselschade die veroorzaakt wordt tijdens het uitdrijven van de foetus (Witkowska-Piłaszewicz et al., 2019).
1.2.3 Toepassingen
Kent (1992) beschreef de karakteristieken van een APP met diagnostisch potentieel. Zo moet een goed major APP een verwaarloosbare of lage basaalwaarde hebben met een nauwe referentie die onveranderd blijft met leeftijd of geslacht. De concentratie stijgt snel tot zeer hoge waardes (>100x) bij infectie of inflammatie. De mate van stijging komt overeen met de mate van weefselschade. Ook dalen de waardes terug snel na resolutie van de ziekte, maar blijven ze onveranderd indien er nog geen herstel plaats vindt. Niet-inflammatoire condities, nutritionele status, arbeid of minimale stress zouden de concentratie niet mogen beïnvloeden. De SAA respons heeft een groot aantal van deze gunstige eigenschappen, wat het een interessante tool maakt in de diergeneeskunde. Dankzij deze karakteristieken is de interpretatie van SAA-levels duidelijker dan de interpretatie van moderate of minor APP’s zoals fibrinogeen. Bij gezonde paarden is de SAA-concentratie zeer laag tot niet detecteerbaar, dit maakt de interpretatie van licht gestegen waardes meer straight forward. Na een inflammatoire stimulus stijgt de plasmaconcentratie ook zeer snel en exponentieel. Een stijging kan al gedetecteerd worden op 6 uur na de stimulus en bereikt zijn piekwaarde op 48 uur (Nunokawa et al., 1993). Hierdoor kan een ziekteproces al vroeg gedetecteerd worden en het verloop ervan goed opgevolgd. De korte halfwaardetijd van SAA zorgt ervoor dat de plasma levels snel dalen in correlatie
9 met resolutie van de ziekte. De SAA-concentratie daalt namelijk binnen de 12 uur na het oplossen van de inflammatie (Witkowska-Piłaszewicz et al., 2019). Om deze redenen zouden sequentiële bepalingen van SAA een hulp kunnen bieden in de opvolging van een patiënt en het bepalen van de behandelingsstrategie (Jacobsen en Andersen, 2007).
1.2.3.1 Bacteriële en virale infecties
Verschillende studies hebben reeds aangetoond dat bacteriële infecties een sterke stijging geven van de plasma SAA-concentratie, in tegenstelling tot virale infecties die aanleiding geven tot een kleine tot matige stijging van SAA (Pepys et al., 1989; Jacobsen en Andersen, 2007). Op basis hiervan zou er gedacht kunnen worden dat de mate van SAA stijging een indicatie kan geven van het type infectieuze agens dat verantwoordelijk kan zijn voor de ziekte. De acute fase respons is echter een niet-specifieke reactie op inflammatie, deze respons wordt in gang gezet door diverse infectieuze, inflammatoire en traumatische stimuli. Dit zorgt ervoor dat de concentratie van SAA niet gebruikt kan worden om een etiologische diagnose te stellen. Wel kan het een sterke indicatie geven of infectie al dan niet aanwezig is(Jacobsen en Andersen, 2007). Uit ervaring van verschillende onderzoekers blijkt echter wel dat een enorm hoge stijging van SAA meest waarschijnlijk veroorzaakt wordt door een bacteriële infectie (Pepys et al., 1989). Hultén et al. (1999a) concludeerde dat een mogelijke verklaring hiervoor is dat de stijging van SAA meer afhankelijk is van de graad van weefselschade dan van het type inflammatie. Bacteriële infecties zouden ernstigere weefselschade geven en daardoor ook een sterkere stijging van SAA.
1.2.3.2 Neonatale ziekte
Sepsis is een van de belangrijkste problemen bij neonatale veulens en is verantwoordelijk voor een groot aandeel van de sterftegevallen bij jonge veulens (Stoneham et al., 2001). De klinische tekens van septicemie zijn subtiel en niet specifiek en daarnaast zijn er ook geen specifieke hematologische of biochemische parameters die met zekerheid het septicemische veulen kunnen onderscheiden van een zwak veulen. Om een definitieve diagnose te kunnen stellen is het hierdoor nodig de resultaten van een bloedcultuur af te wachten (Hultén en Demmers, 2002). Vaak laten deze resultaten op zich wachten en daarnaast komen vals negatieve resultaten niet zelden voor. Dit maakt het stellen van een snelle diagnose en vroege instelling van de juiste therapie moeilijk, wat juist van cruciaal belang is voor een goede afloop (Stoneham et al., 2001). Uit onderzoek is gebleken dat Serum Amyloid A een nuttige parameter is om onderscheid te maken tussen ziektes die zwakte veroorzaken bij het neonatale veulen. Hoge SAA-concentraties zijn indicatief voor een infectieuze aandoening, zoals sepsis (Chavatte et al, 1992; Stoneham et al., 2001; Hultén en Demmers, 2002). Echter, bij navelinfecties vindt men niet altijd een stijging in de SAA-levels terug. Dit kan verklaard worden doordat dit een chronische aandoening is die vaak omkapseld wordt en daardoor de SAA productie niet continu stimuleert. Bij veulens met niet-infectieuze oorzaken van zwakte (bv. prematuriteit, failure of passive transfer, isoerythrolosyis en meconiumobstipatie) worden plasma levels binnen de normale range gemeten (Stoneham et al., 2001; Hultén en Demmers, 2002). In een ander onderzoek wordt net waargenomen dat deze niet-infectieuze aandoeningen eveneens gestegen SAA-waardes kunnen geven, wel niet in dezelfde mate als bij een infectieuze aandoening (Chavatte et al, 1992). Stoneham et al. (2001) stelde een cut-off waarde voor van 100 mg/l om infectieuze van niet-infectieuze cases te onderscheiden. Brewer en Koterba (1988) ontwikkelde een ‘sepsis scoring system’, dit systeem biedt een hulp in de snelle diagnose van septicemie bij veulens. De meting van SAA includeren in dit scoring system zou de diagnose van neonatale sepsis en hierbij de kans op een vlugge therapie verbeteren.
1.2.3.3 Respiratoire infecties
De concentratie van Serum Amyloid A is reeds onderzocht bij respiratoire aandoeningen bij paarden, voornamelijk bij equine influenza en Rhodococcus equi pneumonie. Hultén et al. (1999b) toonde aan
10 dat de SAA-concentratie stijgt bij paarden geïnfecteerd met influenza. De levels van SAA kwamen duidelijk overeen met de ernst van de ziekte. De concentratie steeg gedurende de eerste 48 uur van de klinische tekens en daalde terug naar de normaalwaarde binnen de 11 tot 22 dagen bij ongecompliceerde cases. SAA bleek eveneens een meer gevoelige merker te zijn van acute infectie dan de detectie van het virus via nasale swabs (Jacobsen en Andersen, 2007; Crisman et al., 2008). Vergelijkend met influenza, werd bij Rhodococcus equi eveneens aangetoond dat veulens hogere plasma SAA-levels vertoonden bij aankomst in de kliniek en dat deze waardes weer daalden bij een succesvolle behandeling en klinische verbetering. Fibrinogeen, die standaard gebruikt wordt in de opvolging van de behandeling, bleef echter hoog. Hieruit kan geconcludeerd worden dat SAA een betere parameter zou zijn om de respons op behandeling te monitoren, aangezien deze sneller daalt dan fibrinogeen (Hultén en Demmers, 2007). Uit een recente studie over Rhodococcus equi pneumonie bij veulens jonger dan 1 maand blijkt echter dat twee-maandelijkse SAA metingen niet bruikbaar zijn als een screeningstest voor een vroege detectie van R. equi. Mogelijke verklaringen hiervoor zijn het lange interval tussen de twee staalnames, een misclassificatie van de infectiestatus of dat geïnfecteerde veulens toch geen of slechts een kleine SAA respons vertonen. Meer onderzoek is nodig om het nut van SAA metingen in de diagnose en monitoring van R. equi pneumonie na te gaan (Cohen et al., 2005; Jacobsen en Andersen, 2007). Na een experimentele infectie met Streptococcus equi subsp. zooepidemicus werden zeer hoge plasma SAA-concentraties bereikt, met een piek op 3 dagen post-infectie. Hierna daalde de concentratie terug, samen met resolutie van de klinische symptomen. Hieruit kan geconcludeerd worden dat metingen van SAA gebruikt kan worden om paarden met een bacteriële pneumonie te monitoren (Hobo et al., 2007).
Levels van dit acute fase proteïne zouden ook kunnen mee bepalen wanneer een paard terug in het werk kan na het doormaken van een respiratoire infectie. SAA-levels blijven namelijk gedurende een langere periode verhoogd indien het gaat om een ernstige influenza infectie of indien het paard een secundaire bacteriële infectie doormaakt, vergeleken met een milde influenza infectie (Hultén et al., 1999b).
Bij paarden met inflammatory airway disease (IAD) ziet men geen verschil in SAA-concentraties vergeleken met gezonde paarden (Leclere et al., 2015). Een andere studie van dezelfde groep toonde echter aan dat bij IAD SAA toch 3.5 keer hoger was dan bij de controle groep (Bullone et al., 2015). Bij recurrent airway obstruction (RAO) stijgt SAA wel licht bij antigen challenge (Lavoie-Lamoureux et al., 2012). Uit deze bevindingen blijkt dat SAA bij respiratoire aandoeningen vooral nuttig kan zijn in het onderscheiden van bacteriële aandoeningen, die doorgaans zeer hoge SAA-concentraties bereiken en inflammatoire aandoeningen veroorzaakt door virale infecties of niet-infectieuze oorzaken zoals allergische aandoeningen, die een meer variabele en gewoonlijk mildere stijging geven (Witkowska-Piłaszewicz et al., 2019). Het is wel belangrijk te onthouden dat SAA bepalingen niet diagnostisch zijn op zich, maar wel een aanwijzing geven van verdere diagnostische testen. Een antibioticatherapie kan niet worden ingesteld enkel op basis van een verhoogde SAA-concentratie, maar moet gecombineerd worden met andere testen om verantwoordelijk antibioticagebruik te kunnen garanderen (Witkowska-Piłaszewicz et al., 2019).
1.2.3.4 Gastro-intestinale aandoeningen
Verschillende studies zijn reeds uitgevoerd die de respons van SAA op koliek bij paarden onderzoeken. Koliek met een inflammatoire oorzaak, zoals colitis, enteritis, peritonitis en abdominale abcessen, induceert duidelijk hogere SAA-concentraties. Zo zouden SAA-concentraties hoger dan 50 µg/ml karakteristiek zijn voor een onderliggende inflammatoire aandoening. SAA kan hier eveneens gebruikt worden als prognostische parameter. Paarden met koliek omwille van een inflammatoire oorzaak en een SAA-concentratie boven 50 µg/ml hebben een slechtere overlevingskans dan paarden met een
11 andere aandoening (Vandenplas et al., 2005). Bij paarden met koliek zijn zowel de serum SAA als SAA in het buikvocht significant gestegen ten opzichte van gezonde paarden (Pihl et al., 2013).
Bij equine grass sickness, een neurodegeneratieve aandoening met een moeilijke ante-mortem diagnose, zou het bepalen van SAA ook meer duidelijkheid kunnen geven. Bij deze aandoening is de SAA-concentratie sterk gestegen en kan op deze manier een onderscheid gemaakt worden tussen andere oorzaken van abdominale pijn, zoals een obstipatie. Een limitatie is echter wel dat er geen verschil is in SAA-waarde met inflammatoire oorzaken van abdominale pijn (Copas et al., 2013).
1.2.3.5 Chirurgie
Chirurgie triggert de acute fase respons en zorgt hierbij voor verandering van de SAA-concentratie in het bloed (Nunokawa et al., 1993; Pollock et al., 2005; Jacobsen en Andersen, 2007; Witkowska-Piłaszewicz et al., 2019). De normale postoperatieve SAA respons vertoont een stijging en daling van de concentratie. Een aanhoudende stijging zou wijzen op postoperatieve complicaties (Jacobsen, 2007). Blijvende hoge SAA-waardes op dag 8 in de postoperatieve periode na castratie wordt gelinkt met complicaties zoals erge inflammatie of infectie (Jacobsen et al., 2005). Sequentiële SAA metingen zouden dus een hulp kunnen bieden in het vroeg herkennen van postoperatieve complicaties, zoals infecties na castratie of andere chirurgische procedures. Op deze manier kan er tijdig een aangepaste therapie ingesteld worden. Dit zorgt voor een comfortabelere herstelperiode en voorkomt ergere complicaties (Jacobsen et al., 2005).
1.2.3.6 Gewrichtsaandoeningen
Meerdere studies tonen aan dat het bepalen van serum SAA of SAA uit synoviaalvocht een nuttige aanvulling kan zijn bij de diagnose van septische artritis (Jacobsen et al., 2006b; Graham et al., 2016; Robinson et al., 2017). Bij gezonde paarden vindt men serum en synoviale concentraties van SAA die over het algemeen lager zijn dan 1 µg/ml. Net zoals bij andere ziektes, blijkt een bacteriële infectie van gewrichten en andere synoviale structuren de meest potente stimulans te zijn voor de SAA productie (Long en Nolen-Walston, 2020). Dit wordt onder andere duidelijk aangetoond in een onderzoek van Ludwig et al. (2016). Hier ziet men dat na experimentele inductie van septische artritis zowel de serum SAA-concentraties als SAA in het gewrichtsvocht significant toenemen. Dit in tegenstelling tot de inductie van aseptische artritis, waarbij SAA binnen de normale range bleef. Het bepalen van SAA zou dus een hulp kunnen bieden in het onderscheiden van septische met aseptische artritis. Serum SAA stijgt sneller dan het synoviale SAA en zou gebruikt kunnen worden als vroege merker voor synoviale sepsis. De uitgestelde stijging van het synoviale SAA ten opzichte van serum SAA, zorgt ervoor dat synoviaal SAA niet ideaal is voor het stellen van een vroege diagnose. Daarnaast is het voor de clinici eenvoudiger om in het veld via een bloedname SAA te bepalen en zo een snelle diagnose te stellen, zonder de nood aan een arthrocentese. Op deze manier kan de eerstelijns dierenarts de patiënt tijdig doorsturen naar een kliniek voor de verdere behandeling (Ludwig et al., 2016). Robinson et al. (2017) stelde als cut-off waarde voor de detectie van synoviale sepsis 61 µg/ml voor serum SAA en 1.14 µg/ml voor synoviaalvocht voor. Een vroege detectie van septische artritis laat toe snel een correcte therapie in te stellen, wat een grote invloed heeft op de prognose voor overleving en sportcarrière van het paard.
Voorheen werd voor de opvolging van de behandeling het synoviaal totaal proteïne (TP) en het aantal witte bloedcellen (TNCC) bepaald en op basis van deze resultaten maakte men aanpassingen aan de therapie en de prognose (Walmsley et al., 2011). Helaas is uit onderzoek gebleken dat zowel herhaalde arthrocentese als eenmalige intra-articulaire toediening van antibiotica resulteert in een stijging van het TP en TNCC ( Jacobsen et al., 2006b; Dykgraaf et al., 2007; Sanchez Teran et al., 2012). Dit maakt dat de interpretatie van deze parameters onbetrouwbaar is en er dus nood is aan meer betrouwbare parameters om de behandeling op te volgen. Serum Amyloid A blijkt hier een nuttige aanvulling te zijn.
12 Uit verschillende onderzoeken blijkt dat SAA, zowel serum als synoviaal, niet stijgt bij herhaalde arthrocentese, herhaalde intra-articulaire toediening van amikacine en een gewrichtsspoeling door middel van naalden (Jacobsen et al., 2006b; Sanchez Teran et al., 2012; Sanchez-Teran et al., 2016). Uit deze gegevens kan geconcludeerd worden dat SAA-bepalingen een betere merker zijn voor de opvolging van de klinische progressie van synoviale sepsis.
Een klinische studie duidde ook al het nut van de monitoring van SAA in de opvolging van de behandeling van synoviale infecties. Een daling van de plasma SAA-concentratie komt overeen met een positieve respons op de behandeling. Verdere studies zijn echter nodig om het nut in de praktijk aan te tonen (Haltmayer et al., 2017). Deze bevinding werd onlangs nog bevestigd in een andere studie (Sinovich et al., 2020). Wel moeten bij paarden die ondertussen aan een andere inflammatoire aandoening lijden, zoals grote wondes of uitgebreid weke delen trauma, de waardes telkens met de nodige voorzichtigheid geïnterpreteerd worden aangezien dit ook kan zorgen voor een stijging van serum SAA (Robinson et al., 2017; Sinovich et al., 2020).
1.2.4 Meting van Serum Amyloid A
Verschillende methodes zijn reeds geëvalueerd om SAA bij het paard te bepalen, voorbeelden hiervan zijn enzyme-linked immunosorbent assay (ELISA) (Satoh, 1994; Hultén et al., 1999a), slide-reversed passive latex agglutinatie (Wakimoto, 1996), single radial immunodiffusion (SRID) (Nunokawa et al., 1993), electroimmunoassay (Pepys et al., 1989; Chavatte et al., 1992) en latex agglutination immunoturbidimetric assay (Stoneham et al., 2001). De meeste van deze methodes worden echter enkel gebruikt voor onderzoeksdoeleinden. Het gaat om arbeidsintensieve methodes waarvan het tot meer dan 24 uur kan duren vooraleer een resultaat verkregen wordt. Hierdoor zijn ze niet geschikt voor een routine analyse waar een snelle diagnose noodzakelijk is (Hultén et al., 1999a). Om SAA in een klinisch laboratorium te kunnen bepalen, is er nood aan een geautomatiseerde methode, die eveneens snel genoeg is (Yamada, 1999).
Hiervoor evalueerde Jacobsen et al. (2006c) een turbidometric immunoassay (TIA) ontwikkeld voor humaan serum, voor het gebruik bij paarden. Het principe van deze test is de binding van SAA-antigen aan humane SAA-antistoffen geconjugeerd op latex microbeads. Indien SAA-antigenen aanwezig zijn in het staal, treedt er agglutinatie op door de antigen-antistof binding. De mate van agglutinatie komt overeen met de SAA-concentratie. De agglutinatie wordt vervolgens turbidometrisch gemeten. Uit dit onderzoek bleek dat deze methode SAA bij paarden op een accurate manier kan bepalen, met een goede intra- en interassay precisie (Jacobsen et al., 2006c; Jacobsen en Andersen, 2007). Dit is een snelle, geautomatiseerde en commercieel beschikbare test, waardoor het nu algemeen gebruikt wordt in diagnostische laboratoria en zo de routine SAA bepalingen bij paarden verzorgt (Stoneham et al., 2001).
Ook is er een commercieel beschikbare point-of-care (POC) lateral flow immunoassay ontwikkeld om de SAA-concentratie te bepalen bij het paard, namelijk StableLab (Epona Biotech Limited, Sligo, Ireland). Deze test kan onmiddellijk na de staalname uitgevoerd worden en geeft reeds na 10 minuten de aan- of afwezigheid van SAA weer. Schwartz et al. (2018) valideerde deze POC test. Met deze test kan zowel semi-kwantitatief (met een kleurindicator) als kwantitatief (met een draagbare reader) SAA bepaald worden op serum, plasma en vol bloed. De POC test vertoont een acceptabele accuraatheid en precisie voor SAA-concentraties tot 1000 µg/ml. Met deze test kan op een betrouwbare manier onderscheid gemaakt worden tussen gezonde paarden met lage SAA-concentraties en paarden met een acute fase respons. Bij hogere SAA-concentraties, zoals het geval kan zijn bij paarden met een ernstige systemische inflammatie, zijn de resultaten echter minder precies, wat de accurate
13 interpretatie van opeenvolgende metingen kan hinderen (Schwartz et al., 2018). Aangezien deze test een snel, ‘stall-side’ resultaat geeft, is de test zeer nuttig wanneer een resultaat snel bekomen moet worden of voor een eerstelijns dierenarts in het veld, indien laboratoria niet ter beschikking zijn (Ludwig et al., 2016; Schwartz et al., 2018). Ludwig et al. (2016) vergeleek TIA met de POC test. Uit dit onderzoek bleek dat er een goede overeenkomst was bij lage SAA-concentraties (<50µg/ml), bij hogere concentraties (100 µg/ml) liepen de waardes meer uiteen. Wel kon geconcludeerd worden dat de draagbare SAA test een makkelijke en snelle manier was om SAA ter plaatse te meten.
Men moet voornamelijk in gedachte houden dat de SAA-concentraties gemeten door verschillende analysemethodes niet vergelijkbaar zijn en de absolute concentraties en cut-off waardes kunnen verschillen. Bij het opvolgen van de SAA-concentratie moet dus steeds dezelfde analysemethode gebruikt worden om hier betrouwbare conclusies uit te kunnen trekken (Jacobsen en Andersen, 2007).
1.3 Hematogene infecties van het bewegingsstelsel
1.3.1 Voorkomen/epidemiologie
Net zoals bij elk species, is ook bij veulens de eerste levensmaand een zeer gevoelige periode. Dit komt doordat veulens geboren worden met een immatuur immuunsysteem. De epitheliochoriale placenta van de merrie laat de transfer van antistoffen tijdens de dracht niet toe en de neonaat is dus volledig afhankelijk van de opname en absorptie van maternale antistoffen via het colostrum. Het belangrijkste immunoglobine in het colostrum is IgG. IgG zorgt voor bescherming tegen infectie gedurende de eerste twee levensmaanden. Hierdoor wordt het veulen beschermd terwijl het zijn eigen antistoffen kan ontwikkelen (Centre et al., 1997). Echter, de trage stijging in endogene antistoffen en de snelle daling van de maternale antistoffen zorgt ervoor dat veulens gevoeliger zijn voor infecties en hier opvolgende bacteriëmie tot zelfs septicemie (Trumble, 2005). Het risico hierop verhoogt nog meer indien het veulen er niet in slaagt voldoende antistoffen uit het colostrum te absorberen. Dit wordt failure of passive transfer (FPT) genoemd. Er wordt gesproken van een partiële FPT bij een antistoffengehalte in het bloed tussen 400-800 mg/dL en van een complete FPT wanneer de concentratie onder de 400 mg/dL ligt. Door een tekort aan passieve immuniteit kunnen bacteriën makkelijker binnendringen in het bloed, met als belangrijkste intredepoorten het gastro-intestinaal en respiratoir stelsel, de navel en de placenta (Annear et al., 2011). FPT kan optreden door zowel maternale als veulen factoren. Voorbeelden van maternale factoren zijn premature lactatie of onvoldoende colostrumproductie door de merrie. Langs de andere kant kan er een vertraagde opname zijn door het veulen of is het veulen niet in staat het colostrum te absorberen (Centre et al., 1997).
Eens de bacteriën het bloed zijn binnengedrongen, kunnen ze de verschillende gewrichten en beenderen bereiken. De bacteriële kolonisatie van de immature gewrichten en beenderen wordt vergemakkelijkt door de specifieke organisatie van de vascularisatie. Tijdens deze immature periode is er een snelle groeifase die nood heeft aan een verhoogde bloedvloei wat de verspreiding van bacteriën toelaat. De epifyseale bloedvaten vertakken ter hoogte van het articulaire oppervlak in kleine capillairen die haarspeldbochten vormen en uiteindelijk eindigen in wijde veneuze sinusoïden. Ter hoogte van deze sinusoïden is er een lage bloedflow, een lage druk en lage zuurstofspanning waardoor circulerende kiemen makkelijker kunnen migreren en het bot koloniseren, vooral in de epifyse en de metafyse. Daarnaast zijn er in de eerste levensdagen transfyseale bloedvaten aanwezig die zorgen voor de communicatie tussen de epifyseale en metafyseale vascularisatie. Prematuriteit en dysmaturiteit kunnen ervoor zorgen dat dit vasculair patroon langer aangehouden wordt dan normaal, wat deze veulens gevoeliger maakt voor gewrichts- en botinfecties (Trumble, 2005; Annear et al., 2011; Rinnovati et al., 2018).
14 Septische artritis/osteomyelitis wordt opgedeeld in verschillende types naargelang de bevindingen op klinisch, radiologisch en pathologisch onderzoek. Deze classificatie gaat als volgt:
- S-type: Gewrichtsinfectie zonder osteomyelitis, vaak meer dan 1 gewricht betrokken. Voornamelijk veulens in de eerste twee levensweken. Meestal carpaalgewrichten, knie en tarsus.
- E-type: Infectie van het gewricht met aanpalende epifyse en kan een of meerdere gewrichten betrekken. Voornamelijk gezien bij veulens van 3-4 weken oud. Meest aangetaste plaatsen zijn de mediale en laterale femurcondyl, de tibiale condylen, de laterale processus stylohyoideus van de distale radius en de distale tibia en patella.
- P-type: Osteomyelitis van de fyse. Voornamelijk bij veulens van 1-12 weken oud. Meest aangetaste plaatsen zijn de distale radius, distale tibiale, metacarpale en metatarsale fyses. - T-type: Infectie van de kleine botjes in de carpus en de tarsus.
Deze types zijn niet absoluut en meer dan 1 type kan in dezelfde patiënt voorkomen. Type E en type S zijn het meest voorkomende type bij veulens jonger dan twee maanden. Bij type E begint de infectie op de verbinding tussen het epifyseale subchondrale been en het kraakbeen en spreidt zich verder uit tot in het gewricht. Dit type kan je enkel zien bij deze leeftijdscategorie door de specifieke vascularisatie in het articulair kraakbeen. Bij oudere individuen regresseren deze bloedvaten namelijk samen met de maturatie van de epifyse (Annear et al., 2011).
Septische artritis is een belangrijk probleem bij veulens: 0.5-1% van de veulens geraakt aangetast en is verantwoordelijk voor sterfte bij 5.2% van de veulens tussen 8 en 31 dagen oud. De meest kritische periode voor het ontwikkelen van deze aandoening is de eerste 30 dagen post partum (Stoneham, 1997; Rinnovati et al., 2018). De tarsus wordt het vaakst aangetast, maar in principe kan elk gewricht hierin betrokken worden. Zo zijn de knie, de carpus en de kogel ook vaak betrokken. In tegenstelling tot volwassen paarden, is er bij veulens een hoog risico op infectie van multipele gewrichten of gaat het vaker gepaard met botaantasting ter hoogte van de epifyse of de fyse. Om deze reden wordt deze aandoening ook wel het ‘artritis-osteomyelitis’ syndroom genoemd (Smith et al., 2004; Rinnovati et al., 2018). In veulens zijn de meest geïsoleerde organismen Gram-negatieve bacteriën en vaak gaat het om multipele bacteriële species. De isolaten zijn vooral typische Gram-negatieve kiemen zoals Escheria coli, Actinobacillus spp., Salmonella spp. en Klebsiella spp. Daarnaast zijn Gram-positieve isolaten ook mogelijk, hierbij gaat het dan vooral om Streptococcus spp., Staphylococcus spp. en Clostridium spp. In zeldzame gevallen kan de infectie veroorzaakt worden door strikt anaeroben, mycoplasma of chlamydia (Annear et al., 2011).
1.3.2 Diagnose
Aangezien een gewrichtsinfectie snel evolueert en kan leiden tot irreversibele veranderingen van het articulair kraakbeen, is een vroege diagnose en behandeling essentieel voor een goede uitkomst en voor een optimale kans op een succesvolle sportcarrière (Stoneham, 1997). Een diagnose kan gesteld worden op basis van de anamnese en klinische tekens, een analyse van het gewrichtsvocht en medische beeldvorming. Septische artritis, fysitis en osteomyelitis moet bij elk mank veulen uitgesloten of bevestigd worden. Veulens met septicemie hebben een hoog risico op het ontwikkelen van septische artritis. Dit uit zich klinisch uren tot dagen na de initiële symptomen van de septicemie (Hardy, 2006).
Anamnese en klinisch onderzoek
Ten eerste kan de anamnese al een indicatie geven van septische artritis. Het zijn voornamelijk veulens tussen de 12 uur en 30 dagen oud, met een geschiedenis van failure of passive transfer, prematuriteit/dysmaturiteit of perinatale abnormaliteit (Stoneham, 1997). Vervolgens is het van
15 belang een volledig klinisch onderzoek uit te voeren. Klinische symptomen kunnen duidelijk zijn. Effusie van het gewricht is hier het meest consistent klinisch teken en kan variëren van mild tot ernstig. Dit gaat vaak gepaard met peri-articulaire zwelling, warmte ter hoogte van het gewricht en pijn bij palpatie (Stoneham, 1997; Morton, 2005; Annear et al., 2011; Glass en Watts, 2017). Een acute mankheid is meestal ook aanwezig, variërend van een milde mankheid tot geen steunname. Dit kan gemaskeerd worden bij zwakke of lusteloze veulens. De kreupelheid ontwikkelt zich 8-24 uur na de initiële infectie van het gewricht. Indien het klinisch onderzoek uitgevoerd wordt kort na het begin van infectie, kan mankheid nog minder ernstig zijn (Stoneham, 1997; Morton, 2005; Annear et al., 2011). De vitale parameters kunnen zich binnen de normale limieten situeren, een gestegen hart- en ademhalingsfrequentie kan eveneens aanwezig zijn als gevolg van erge pijn (Morton, 2005). In tegenstelling tot volwassen paarden, gaat deze aandoening bij veulens wel vaak gepaard met een gestegen lichaamstemperatuur (Glass en Watts, 2017).
De identificatie van septische artritis of osteomyelitis is echter niet altijd zo duidelijk. Bij het S-type, waar enkel het gewricht betrokken is, kan de diagnose vaak wel makkelijk gesteld worden op basis van de klinische symptomen. Het gaat hier om een veulen met koorts en een duidelijke effusie van het aangetaste gewricht. Bij type E kunnen deze symptomen echter minder duidelijk zijn. De infectie begint hier ter hoogte van het subchondraal bot van de epifyse zonder dat er meteen een verbinding met het gewricht aanwezig is. Dit kan resulteren in een erg mank veulen zonder een duidelijke gewrichtsopzetting, wat de lokalisatie van de mankheid kan bemoeilijken. Pas bij doorbreken van de infectie vanuit de epifyse naar het gewricht treedt er een gewrichtseffusie op, waarbij de diagnose dan voor de hand ligt. Sommige veulens leiden aan septicemie waardoor ze zwak en lusteloos zijn. Echter, dit is moeilijk te onderscheiden van andere niet-infectieuze oorzaken van zwakte (Hultén en Demmers, 2002).
Aangezien vaak multipele gewrichten aangetast zijn, moet een grondige palpatie van elk gewricht een onderdeel uitmaken van het klinisch onderzoek. Het veulen moet continu gemonitord worden op de ontwikkeling van nieuwe infecties. Ook is het van belang de algemene toestand van het veulen na te gaan en op zoek te gaan naar een onderliggende bron van infectie. Dit kan onder andere gaan om diarree, pneumonie, een navelinfectie,… (Morton, 2005; Annear et al., 2011). Hiervoor kunnen bijkomende diagnostische testen uitgevoerd worden, zoals een echografie van de thorax, abdomen en umbilicale structuren, een radiografie van de thorax en een mestonderzoek. Het niet identificeren en behandelen van de onderliggende oorzaak heeft een negatieve invloed op de prognose (Glass en Watts, 2017).
Een algemeen bloedonderzoek kan ook uitgevoerd worden bij deze veulens. De Complete Blood Count (CBC) komt overeen met het beeld van een inflammatoire respons, dit houdt een neutrofiele leukocytose en hyperfibrinogenemie in (Hardy, 2006).
Medische beeldvorming
Indien de klinische tekens wijzen in de richting van een orthopedische infectie is het belangrijk om een radiografie te nemen van de aangetaste regio(‘s). Dit om vroegtijdig aantasting van het subchondrale bot en/of de (epi-)fyse te diagnosticeren, wat een invloed heeft op de prognose en therapeutische planning. Doordat het 10 tot 14 dagen kan duren vooraleer er radiografische veranderingen te zien zijn, moet dit wekelijks worden opgevolgd (Trumble, 2005).
In het beginstadium van septische artritis kunnen de radiografieën normaal zijn of er kan een verbreding van de gewrichtsinterlinie en weke delen zwelling rond het gewricht te zien zijn. Deze bevindingen zijn niet specifiek, maar kunnen wel nuttig zijn in combinatie met de klinische bevindingen en resultaten van de analyse van het gewrichtsvocht. In een verder gevorderd stadium van de infectie
16 kan er een vernauwing van de gewrichtsinterlinie te zien zijn door destructie van het articulair kraakbeen, periostale reactie en subchondrale botlyse (Annear et al., 2011).
Echografie kan een meerwaarde leveren in de diagnose van infectieuze artritis, voornamelijk voor gewrichten die anatomisch moeilijk te bereiken zijn via het klinisch onderzoek of radiografie, zoals de schouder of de heup. Via echografie kan de mate van gewrichtsopzetting, de aard van het synoviaal vocht, de integriteit van het kraakbeen en de mate van inflammatie van het synovium bepaald worden (Morton, 2005). Bevindingen op echografisch onderzoek die wijzen op een infectieuze artritis zijn: een toegenomen synoviale effusie, een verdikking van het synovium, echogeen synoviaal vocht, focale hyperechogene spots en intrasynoviaal fibrine (Beccati et al., 2015). Een beperking is echter dat het geen complete anatomische studie weergeeft en daardoor minder betrouwbaar is voor de karakterisatie van de opzetting of de oorzaak ervan (Beccati et al., 2015). De bevindingen op echografisch onderzoek zijn enkel suggestief, maar geen betrouwbare indicator van infectie (Annear et al., 2011). Ook kan het een hulp bieden bij de arthrocentese. Op deze manier kan er echogeleid synoviaal vocht gecollecteerd worden voor analyse (Morton, 2005).
Als laatste kunnen CT en MRI ook zinvol zijn aangezien deze technieken zeer gedetailleerd het bot en weke delen in beeld brengen. Computer Tomografie (CT) is een uitstekende techniek om osteomyelitis te detecteren met botdestructie en sequestratie, maar geeft minder gedetailleerd de weke delen weer. Magnetic resonance imaging (MRI) is in de humane geneeskunde de gouden standaard voor de diagnose van septische artritis, acute osteomyelitis en weke delen infecties. MRI kan weke delen letsels, vochtproliferatie, botoedeem en osteochondrale botbeschadiging weergeven. Op deze manier kan MRI een hulp bieden in de vroege diagnose van septische artritis, voornamelijk wanneer de klinische diagnose moeilijk is, bijvoorbeeld indien er geen synoviaalvocht kan verzameld worden of indien de analyse niet conclusief is (Easley et al., 2011). Deze technieken worden echter niet routinematig gebruikt. De prijs en duur van dit onderzoek en de nood aan zware sedatie of algemene anesthesie zijn limiterende factoren (Annear et al., 2011)
Arthrocentese
Een vermoedelijke diagnose van gewrichtsinfectie kan op een meer objectieve manier gesteld worden na analyse van het gewrichtsvocht. Collectie van synoviaalvocht is het hoekpunt van de diagnose van septische artritis. Het gewrichtsvocht moet op een strikt aseptische manier verzameld worden om te voorkomen dat een niet-infectieus gewricht geïnoculeerd wordt met een infectieus agens. Na punctie van het gewricht wordt het vocht gecollecteerd in een serumbuisje en een EDTA-bloedbuisje voor analyse.
Er wordt gestart met een visuele inspectie van het synoviaal vocht. Gezond synoviaal vocht is doorzichtig, helder tot lichtgeel en heeft een hoog dradentrekkend vermogen. Septisch gewrichtsvocht is daarentegen troebel en nonvisceus. Er wordt gezegd dat indien de troebelheid zo hoog is dat er geen krant meer gelezen kan worden door het staal, dit sterk wijst op infectie. Normaal gezien kunnen met het gewrichtsvocht draden getrokken worden van 2.5-5cm. Door een verlies aan viscositeit, neemt de lengte van deze draden af. De kleur van infectieus gewrichtsvocht wordt geel tot oranje of rood (Morton, 2005; Steel, 2008).
Belangrijke parameters bij de analyse van het gewrichtsvocht zijn het total protein (TP), total nucleated cell count (TNCC) en het percentage van neutrofielen (Trumble, 2005). De inflammatie in het gewricht leidt tot een toename van de permeabiliteit van de vascularisatie van het synovium. Dit zorgt voor een toename van het totaal proteïne en het aantal witte bloedcellen (Trumble, 2005). Bij gezonde paarden ligt het TP onder 20 g/l. Een waarde boven 40 g/l is indicatief voor een infectie (Steel, 2008). Deze concentratie varieert echter in functie van de duur van infectie en kan in het beginstadium lager zijn
17 (Morton, 2005). De TNCC van gezond synoviaal vocht is minder dan 200 cellen/µl en bestaat voornamelijk uit neutrofielen, lymfocyten en monocyten. Het percentage neutrofielen is minder dan 10% van de totale witte bloedcellen (Morton, 2005). Een stijging van het witte bloedcel gehalte wordt 12 tot 24 uur na infectie waargenomen (Steel, 2008). Een WBC gehalte boven 30.000/µl is sterk indicatief voor septische artritis (Morton, 2005). Dit gehalte kan zelfs tot boven 100.000/µl gaan wat pathognomisch is voor infectie (Trumble, 2005). De leukocyten bestaan uit 80 tot 90% uit neutrofielen (Stoneham, 1997; Morton, 2005; Trumble, 2005; Steel, 2008; Glass en Watts, 2017). De neutrofielen vertonen zelden degeneratieve veranderingen op cytologie (Steel, 2008).
De diagnose kan bevestigd worden met een positieve bacteriële cultuur. Indien de bacteriële isolatie uit het gewrichtsvocht gebeurt met een routinecultuur op een agarplaat zijn de resultaten teleurstellend door een groot aantal vals negatieve resultaten: slechts in 37.5% van de gevallen kan er een oorzakelijke kiem geïdentificeerd worden, zelfs na aanrijking in klassieke bouillons. Dit komt door het lage aantal levende micro-organismen in het synoviaal vocht, gefagocyteerde kiemen die niet meer kunnen groeien in het isolatie medium, door intrinsieke inhibitoren aanwezig in het synoviaal vocht en voorafgaande antibiotica behandeling (Dumoulin et al., 2010a). Deze resultaten kunnen echter sterk verbeterd worden als men aanrijkt via een bloedcultuur medium (BCM) in de plaats van een agarplaat. Deze techniek is superieur ten opzichte van andere technieken onder andere doordat er een groter volume kan geïnoculeerd worden wat detectie van lage concentraties micro-organismen toelaat en de groei-inhibitoren en antibiotica verdunt. Verder bevatten deze media resine en lytische agentia die respectievelijk de groei-inhibitoren en antibiotica inactiveren en gefagocyteerde kiemen vrijstellen (Dumoulin et al., 2010b). Daarnaast is een BCM makkelijk in gebruik, minder arbeidsintensief en relatief goedkoop. In plaats van een detectieratio van 37.5% bij klassieke methodes, bereiken we na aanrijking in bloedcultuur medium 77.6%, wat al een enorme verbetering is (Michèle Dumoulin et al., 2010a). De diagnose stellen aan de hand van een positieve bacteriële cultuur heeft als grootste voordeel dat door identificatie van de oorzakelijke kiem en de mogelijkheid tot het aanleggen van een antibiogram de antibioticatherapie veel doelgerichter ingezet kan worden.
1.3.3 Behandeling
Eens de diagnose van septische artritis/osteomyelitis gesteld is, moet zo snel mogelijk een correcte behandeling ingesteld worden om de kans op succes te vergroten. Synoviale infecties bij veulens moeten dan ook steeds als een spoed behandeld worden (Glass en Watts, 2017). Het doel van de behandeling is een eliminatie van het oorzakelijke agens, resolutie van de inflammatie, verwijderen van inflammatieproducten die schadelijk zijn voor het articulair kraakbeen, reductie van gewrichtseffusie en het herstel van de normale synoviocyt en kraakbeen functie. Indien bij veulens meer dan één gewricht betrokken is, moet elke geïnfecteerde locatie individueel behandeld worden, in relatie met de ernst. Ook kan het nodig zijn een behandeling in te stellen voor andere aandoeningen zoals failure of passive transfer, sepsis of andere foci van infectie (Annear et al., 2011).
De behandeling is gebaseerd op een combinatie van systemische breed-spectrum antibiotica, gewrichtslavage en debridement en lokale antibiotica (Hardy, 2006).
1.3.3.1 Systemische antibiotica
Idealiter wordt het antibioticum gekozen op basis van de resultaten van de cultuur en het bijhorende antibiogram. Het kan echter tot 48 uur duren vooraleer deze resultaten gekend zijn. Aangezien het snel instellen van een antibioticatherapie erg belangrijk is, wordt een initiële antibioticabehandeling al ingesteld. De keuze van antibiotica wordt dan gebaseerd op de kennis van meest voorkomende kiemen bij infecties van het bewegingsstelsel (Trumble, 2005). Aangezien de meeste veulens aangetast worden door Gram-negatieve kiemen (Hepworth-Warren et al., 2015), wordt er aangeraden te starten met
18 een breed-spectrum antibiotica. Daarnaast moet er ook met andere factoren rekening gehouden worden bij de keuze. Zo moet het antibioticum bactericide zijn, aangezien het immuunsysteem van deze veulens al onderdrukt is. Indien het veulen renaal gecompromitteerd is, moet er voorzichtig omgesprongen worden met bijvoorbeeld aminoglycosiden, deze zijn namelijk nefrotoxisch. Veulens hebben slechts een beperkte spiermassa, dit zorgt ervoor dat de administratieroute bij voorkeur intraveneus of per oraal is. Het gekozen antibioticum moet ook een goede penetratie hebben in bot en synovia (Stoneham, 1997; Trumble, 2005). De meest gebruikte en meest efficiënte antibiotica voor orthopedische infecties zijn cephalosporines, β-lactam en aminoglycosiden (Trumble, 2005). Een combinatie van een β-lactam (bijvoorbeeld penicilline) en een aminoglycoside (bijvoorbeeld amikacine) is een goede keuze voor een initiële opstart tot de resultaten van cultuur verkregen zijn (Annear et al., 2011).
Naast de juiste keuze van antibioticum, is het even belangrijk om de therapie lang genoeg verder te zetten. Een behandeling van 2 tot 4 weken na resolutie van de klinische tekens wordt hierbij aangeraden. Na 7 – 10 dagen intraveneuze toediening, kan er over gegaan worden naar een orale behandeling (Carstanjen et al., 2010; Annear et al., 2011).
1.3.3.2 Gewrichtsspoeling
De fysieke verwijdering van bacteriën, inflammatoire producten, niet-vitaal weefsel en debris is minstens even belangrijk als de antibacteriële therapie (Morton, 2005). De verschillende methodes om een goede spoeling van het gewricht te verkrijgen zijn lavage met naalden, arthroscopie of arthrotomie. De keuze van de behandeling wordt bepaald op basis van het aangetaste gewricht, de ernst van de gewrichtsaantasting en de beschikbaarheid van materiaal en anesthesie (Annear et al., 2011).
Bij een acute septische artritis zonder betrokkenheid van bot of fyse kan een spoeling met naalden voldoende zijn. Indien er echter botabnormaliteiten aanwezig zijn of de eerdere behandeling geen effect had, moet een arthroscopische spoeling aangeraden worden. Hierbij kan een debridement van intra-articulaire botlesies uitgevoerd worden of kunnen grote hoeveelheden van debris en fibrine beter verwijderd worden (Glass en Watts, 2017). De frequentie en aantal van de gewrichtsspoelingen wordt beslist op basis van de klinische en cytologische verbeteringen en het oordeel en ervaring van de clinici. Vaak wordt de lavage om de 24 tot 48 uur herhaald voor 1 tot 3 behandelingen (Annear et al., 2011).
1.3.3.3 Lokale antibiotica
Toediening van intra-articulaire antibiotica heeft als voordeel dat er lokaal in het aangetaste gewricht veel hogere concentraties bereikt kunnen worden dan via een systemische therapie mogelijk is (Morton, 2005). Deze behandelingen moeten beschouwd worden als een aanvulling aan de systemische antibioticatherapie en mogen deze niet vervangen (Morton, 2005). Antibiotica toedienen in het aangetaste gewricht kan via directe intra-articulaire injectie, regionale intraveneuze of intraosseuse perfusie of implantatie van antibioticageïmpregneerde materialen (Hardy, 2006). Vaak gebruikte antibiotica voor lokale toediening zijn aminoglycosiden zoals amikacine en gentamycine of ceftiofur (Hardy, 2006).
1.3.3.4 Aanvullende therapie
Om de pijn en inflammatie te controleren is het eveneens noodzakelijk om systemisch niet-steroïdale anti-inflammatoire geneesmiddelen (NSAID) toe te dienen (Stoneham, 1997). Ook is het aangewezen een antiulcer therapie op te starten, zeker indien het veulen erg pijnlijk, gestresseerd is of een hoge dosis NSAID’s ontvangt. Hiervoor is omeprazole geïndiceerd, aangezien dit het enige geneesmiddel is dat een goede preventie biedt in de ontwikkeling van maagulcers (Hardy, 2006).
19
1.3.4 Prognose
De prognose voor septische artritis/osteomyelitis moet altijd als gereserveerd beschouwd worden (Smith et al., 2004; Hardy, 2006). Een overlevingspercentage tussen 45 en 78% voor veulens werd vermeld in verschillende studies (Smith et al., 2004; Annear et al., 2011). Naast de kans op overleving moet er echter ook rekening gehouden worden met de toekomstige sportcarrière van het paard. Zo zou 78% overleven, maar slechts 30% van deze veulens kon later deelnemen aan races (Annear et al., 2011). Dit kan verklaard worden doordat septische artritis het potentieel heeft om permanente schade aan te brengen aan het kraakbeen en om degenerative joint disease, fibrose en blijvende mankheid te veroorzaken indien de infectie niet snel genoeg uit de synoviale ruimte geëlimineerd wordt (Smith et al., 2004)
Smith et al. (2004) toonde de verschillende factoren aan die de prognose negatief kunnen beïnvloeden. Veulens jonger dan 30 dagen op het tijdstip van diagnose, kritisch zieke veulens, polyarticulaire infectie of een combinatie met osteomyelitis zijn hier voorbeelden van.
20
2 Eigen onderzoek
2.1 Probleemstelling
De prognose van hematogene infecties van het bewegingsstelsel zijn voor zowel overleving als voor een toekomstige sportcarrière gereserveerd (Trumble, 2005). Dit zorgt ervoor dat de preventie van deze aandoening zeer belangrijk is. Veulens worden immuno-incompetent geboren en zijn afhankelijk van de transfer van immunoglobulines vanuit het colostrum van de merrie. Hierdoor moet er in de preventie van hematogene infecties vooral aandacht besteed worden aan de toediening van voldoende colostrum van een goede kwaliteit. Ook moet failure of passive transfer tijdig onderkend worden zodat de passieve immuniteit van het veulen snel gecorrigeerd kan worden om zo het risico op septische artritis te voorkomen (Elsohaby et al., 2018). Een snelle diagnose en agressieve aanpak van septische artritis is noodzakelijk zodat permanente schade aan het gewricht kan voorkomen worden en de veulens de beste kans op een succesvolle sportcarrière hebben. Dit is helaas niet altijd eenvoudig. Men kan zich baseren op de klinische tekens. Deze diagnose kan evident zijn indien de veulens symptomen vertonen zoals koorts, een opgezet gewricht dat pijnlijk is en warm aanvoelt, aanwezigheid van pericapsulaire zwelling en kreupelheid. In dit geval worden veulens verdacht van infectie tot het tegendeel bewezen is. Sommige veulens vertonen echter heel weinig tot geen symptomen (Rinnovati et al., 2018). Sommige veulens lijden aan septicemie waardoor ze algemene symptomen hebben en heel zwak zijn. Echter, dit is moeilijk te onderscheiden van andere niet-infectieuze oorzaken van zwakte (Hultén en Demmers, 2002). Indien de klinische tekens wijzen in de richting van een orthopedische infectie is het belangrijk om een radiografie te nemen van de aangetaste regio. Dit om vroegtijdig aantasting van het subchondrale bot en/of de (epi-)fyse te diagnosticeren. Doordat het 10 tot 14 dagen kan duren vooraleer er radiografische veranderingen te zien zijn, moet dit wekelijks worden opgevolgd. Een vermoedelijke diagnose van gewrichtsinfectie kan meer objectief gesteld worden na analyse van het gewrichtsvocht. Abnormaliteiten zoals witte bloedcellen (WBC) >30.000/μL waarvan 90% neutrofielen en een totaal eiwit van 40 g/L zijn indicatief voor infectie (Rinnovati et al., 2018).
De diagnose kan bevestigd worden met een positieve bacteriële cultuur. De bacteriële isolatie uit het gewrichtsvocht werd standaard uitgevoerd door middel van een routinecultuur op een agarplaat. Met deze techniek zijn er echter een groot aantal vals negatieve resultaten en slechts in 37,5% van de gevallen kan er een oorzakelijke kiem geïdentificeerd worden. Dumoulin et al. (2010b) toonde aan dat deze resultaten sterk verbeterd kunnen worden als men aanrijkt via een bloedcultuur medium (BMC) in plaats van een agarplaat. In plaats van een detectieratio van 37.5% bij klassieke methodes, bereiken we na aanrijking in bloedcultuur medium 77,6%, wat al een enorme verbetering is. Ondanks deze betere cultuurmethodes zijn er nog altijd cases waar het onmogelijk is onderscheid te maken tussen infectieus en niet-infectieus. Technieken zoals de geautomatiseerde bloedcultuur vereisen specifieke laboratoriumtoestellen, wat het praktisch niet altijd haalbaar maakt voor de clinicus. Ook is het voor de clinicus van belang dat een accurate diagnose zo snel mogelijk beschikbaar is, omdat een snelle behandeling tot een betere prognose zal leiden. Om deze redenen is er nog altijd nood aan nieuwe technieken (Wauters et al., 2013).
Terzake werd heel wat onderzoek uitgevoerd naar het gebruik van biomarkers. Bij het paard hebben we het onder andere over Serum Amyloid A (SAA), lactaat, haptoglobine en myeloperoxidase (Wauters et al., 2013; Barrachina et al., 2016; Robinson et al., 2017). SAA wordt als meest betrouwbare parameter beschouwd voor de diagnose van orthopedische infecties en is het belangrijkste acute fase proteïne bij het paard. Serum SAA heeft het grootste diagnostisch potentieel, doordat het in gezonde paarden heel lage tot niet detecteerbare waardes heeft. Na weefseltrauma, inflammatie of infectie
21 stijgt SAA zeer snel en exponentieel: binnen de 6-12 uur en bereikt maximale waardes na 48 uur (Crisman et al., 2008; Jacobsen and Andersen, 2007). Verschillende studies hebben al aangetoond dat SAA een goede merker is voor infectieuze aandoeningen. Zo is SAA significant gestegen bij infectieuze artritis en niet tot minimaal bij niet-septische inflammatoire aandoeningen (Jacobsen et al., 2006b; Ludwig et al., 2016). Ook is aangetoond dat SAA een belangrijke hulp kan zijn in de differentiaal diagnostische procedure van systemisch zwakke veulens, waar SAA duidelijk gestegen is bij bacteriële aandoeningen (Hultén en Demmers, 2002).
Naast de diagnose van een gewrichtsinfectie of botinfectie bij een veulen, is ook een accurate opvolging van de behandeling een belangrijk gegeven. Zo valt het bij een botinfectie moeilijk uit te maken wanneer de infectie geëradiceerd is en de antibioticatherapie mag stopgezet worden. Te vroeg stoppen met toediening van antibiotica kan nefaste gevolgen hebben door heropflakkeren van de infectie. Anderzijds is het belangrijk niet langer dan noodzakelijk antibiotica toe te dienen in het kader van het rationeel omspringen met antibiotica. Waar er vroeger standaard bij bot- en gewrichtsinfecties 6 weken antibioticumtherapie werd voorgeschreven, werd dit door een goede opvolging ondertussen sterk ingekort. Opvolging van de behandeling van een gewrichtsinfectie gebeurt voornamelijk door herhaald analyseren van het gewrichtsvocht. Hierbij worden er regelmatig puncties van het gewrichtsvocht genomen om parameters zoals totaal eiwit en witte bloedcellen te bepalen. Bij een succesvolle therapie kan men een daling van deze parameters verwachten (Trumble, 2005). Ook kan er opnieuw een bacteriële isolatie uitgevoerd worden op het gewrichtsvocht. In een bloedcultuur medium zijn resine en/of SPS (sodium polyanethole sulphonate) toegevoegd om antibiotica te absorberen en groei inhibitoren te inactiveren. Dit zorgt ervoor dat ondanks de patiënt al onder antibioticatherapie staat, de eventueel nog aanwezige kiemen toch geïsoleerd kunnen worden (Dumoulin et al., 2010b). Voor botinfecties ligt het echter moeilijker om het succes van behandeling te evalueren en is men aangewezen op het klinisch en radiografisch beeld dewelke niet noodzakelijk met elkaar in overeenstemming zijn. Het systemisch bepalen van SAA lijkt dan ook een beloftevolle parameter om het succes van behandeling bij orthopedische infecties op te volgen, mede naar analogie met het gebruik van de biomarker C-reactive protein (CRP) bij de mens. SAA heeft net als CRP een korte halfwaardetijd, waardoor SAA snel daalt bij genezing (Jacobsen en Andersen, 2007).
2.2 Doelstelling
Door de korte halfwaardetijd daalt SAA heel snel na eliminatie van de infectieuze stimuli, hierdoor is SAA een beloftevolle parameter om het succes van behandeling na te gaan. Hier is echter nog heel weinig onderzoek over. Eén studie toont wel al veelbelovende resultaten na de behandeling van penetrerende wondes van synoviale structuren, waaruit bleek dat een continue daling van de SAA-concentraties wees op een goede respons op therapie (Haltmayer et al., 2017).
De doelstelling van dit onderzoek is dan ook om de betrouwbaarheid van SAA na te gaan in de opvolging van de behandeling van septische artritis en botinfecties bij veulens. Door op regelmatige tijdstippen bloed te nemen kan zo een daling in de SAA-waarde waargenomen worden. Doordat de halfwaardetijd heel kort is (24 uur), wordt verwacht dat SAA na een succesvolle therapie snel daalt. Op basis hiervan kan de duur van de antibioticabehandeling bepaald worden. Indien de patiënt niet reageert op de behandeling zou dit leiden tot verhoogde SAA-concentraties, waarop de behandeling aangepast kan worden. Ook zouden langdurige verhoogde SAA-concentraties een slechtere prognose voorspellen. Via deze procedure zou op een snelle, relatief goedkope en niet-invasieve manier de respons op behandeling gemonitord kunnen worden.
22
2.3 Materiaal en methoden
2.3.1 Inclusiecriteria
Veulens die aangeboden werden in de dierenkliniek van de faculteit diergeneeskunde, UGent met hematogene infecties van het bewegingsstelsel in de periode tussen maart en september 2019 werden opgenomen in het onderzoek. Enkel deze veulens waar SAA consequent bepaald werd, konden uiteindelijk een deel uitmaken van de studie. Deze hematogene infecties van het bewegingsstelsel waren infectieuze artritis, osteomyelitis en fysitis. Meer gedetailleerde informatie per patiënt kan teruggevonden worden in tabel 1.
2.3.2 Serum Amyloid A staalname en analyse
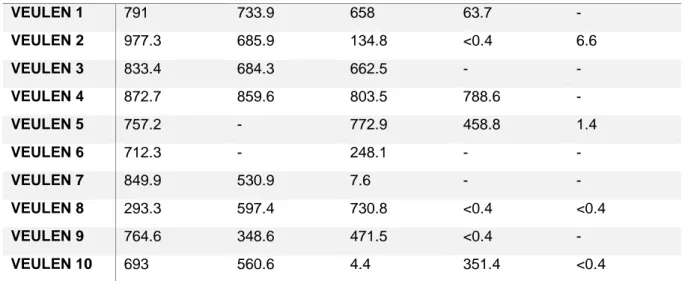
Op regelmatige tijdstippen werd bloed genomen van de veulens om SAA te bepalen. Bloedstalen werden genomen op de dag van aankomst in de kliniek (dag 0), dag 3, dag 6, dag 13 en vervolgens om de 7 dagen tot de infectie opgelost was. Het veulen werd als genezen beschouwd bij een verbetering van de klinische symptomen en indien de synoviale parameters zich terug binnen de normale limieten situeerden. Bloed werd genomen vanuit de vena jugularis of vanuit de vena saphena of vena cephalica en werd verzameld in een serum bloedbuisje. De stalen werden gekoeld bewaard en zo snel mogelijk opgehaald door een veterinair labo. SAA werd in het labo gemeten via een humane SAA turbidometrische immunoassay, die gevalideerd is voor het gebruik bij stalen van paarden (Jacobsen et al., 2006c). Als cut-off waarde voor een verhoogde SAA wordt 4 µg/ml genomen.
2.3.3 Verwerking data
De SAA-concentraties werden bijgehouden per veulen en samen in een tabel geordend (tabel 2). Voor elk veulen werd het verloop van de behandeling in het kliniekprogramma opgezocht. Aandacht werd besteed aan de lokalisatie van de infectie, welke behandeling er werd in gesteld en of er complicaties optraden gedurende de hospitalisatieperiode. Wat de behandeling betreft, werd bijgehouden wanneer en of een chirurgische behandeling werd uitgevoerd, welk type antibiotica gebruikt werd en of een antibiotica switch noodzakelijk was gedurende het verloop van de behandeling. Overschakelen van antibiotica wijst er namelijk op dat het veulen niet reageerde op de primair ingestelde behandeling. Het behandelingsverloop werd beschreven en samengevat in tabel 1. Hierna werd een link gelegd tussen het verloop van SAA-concentraties en het verloop van de behandeling per veulen.
2.4 Resultaten
2.4.1 Diagnose en klinisch verloop
Een overzicht van de diagnose en behandeling van de patiënten kan terug gevonden worden in tabel 1.
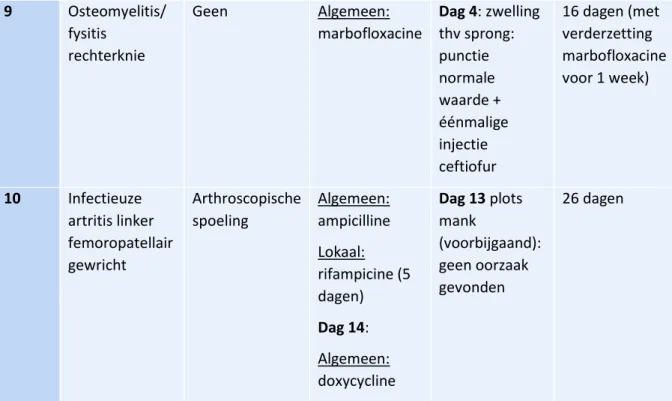
Veulen 1 is een veulen van 2 dagen oud en werd aangeboden op de dienst inwendige ziekten omwille van een tekort aan antistoffen. Wegens opzetting van beide sprongen werd het veulen gecontroleerd door de dienst heelkunde. De diagnose van infectieuze artritis van beide sprongen werd gesteld, waarop beide gewrichten onder algemene anesthesie gespoeld werden. Het tekort aan antistoffen werd hersteld door pre-operatief plasma toe te dienen. De antistoffen werden opgevolgd en een tweede toediening van plasma bleek de dag nadien noodzakelijk. Gedurende de volledige hospitalisatieperiode stond het veulen onder algemene antibiotica (ceftiofur) en ontstekingsremmers en tijdens de eerste 3 dagen eveneens een dagelijkse intra-articulaire injectie met amikacine in beide sprongen. Het veulen evolueerde goed en mocht zonder verdere nabehandeling de kliniek verlaten na 14 dagen.
Veulen 2 kon reeds 4 dagen niet meer recht en had koorts. Infectieuze artritis van de rechterknie (femoropatellair gewricht), linkersprong en beide carpi werd vastgesteld. Het veulen werd hiervoor
23 gedurende 13 dagen behandeld met systemische antibioticatoediening (ceftiofur) en ontstekingsremmers en lokale injecties met amikacine gedurende 3 dagen. Het veulen evolueerde goed en kon na 20 dagen de kliniek verlaten.
Veulen 3 werd na onderzoek bij aanbieding op kliniek gediagnosticeerd met artritis ter hoogte van het rechter tibiotarsaal gewricht, de kogel van het linkervoorbeen en de kogel van het linkerachterbeen. Na een arthroscopische spoeling van de aangetaste gewrichten, werd de behandeling verder gezet met een systemische toediening van antibiotica (een combinatie van ampicilline en amikacine) en niet-steroïdale ontstekingsremmers (NSAID’s). De aangetaste gewrichten werden dagelijks gepuncteerd ter controle en een lokale injectie met amikacine werd toegediend. Bacteriologisch onderzoek wees uit dat de kiem uit de sprong Klebsiella pneumonia was en op basis van het antibiogram werd overgeschakeld op systemische toediening van marbofloxacine en intra-articulaire toediening van ceftiofur. 3 dagen na de chirurgische behandeling werd echter terug een stijging in het aantal witte bloedcellen van het rechter tibiotarsaal gewricht vastgesteld en men merkte eveneens een opzetting van de linkerknie op. Voor beide gewrichten werd opnieuw een arthroscopische spoeling onder algemene anesthesie uitgevoerd. In de nabehandeling werden de linkerknie en rechtersprong dagelijks gepuncteerd en lokaal met antibioticum (ceftiofur) behandeld. Systemische toediening van marbofloxacine werd eveneens verder gezet. Hierna was er verder een goede evolutie zichtbaar en na 15 dagen mocht het veulen de kliniek verlaten. Algemene antibiotica werd nog gedurende 10 dagen thuis verder gezet.
Veulen 4 werd na onderzoek gediagnosticeerd met infectieuze artritis van het linker tibiotarsaal gewricht en failure of passive transfer. Het veulen werd hiervoor behandeld door middel van arthroscopische spoeling en het tekort aan antistoffen werd hersteld door middel van plasma toediening. Nadien werd het veulen verder behandeld met breedspectrum antibiotica (ampicilline + amikacine), NSAID’s en lokale injecties met ceftiofur. Uit het bacteriologisch onderzoek kon Streptococcus bovis geïsoleerd worden, gevoelig aan ampicilline, ceftiofur en doxycycline, maar resistent aan amikacine. Op basis van dit antibiogram werd de toediening van amikacine stopgezet op dag 6. Het gehalte aan WBC daalt geleidelijk, maar op dag 9 wordt er echter terug een stijging opgemerkt en is het veulen plots opnieuw kreupel. Op basis hiervan werd een tweede spoeling van de sprong uitgevoerd. Op dag 11 werd op basis van het antibiogram de antibioticabehandeling opnieuw aangepast: systemisch werd doxycycline toegediend en intra-articulair rifampicine. Hierna merkt men een daling van het aantal WBC in het synoviaalvocht en een klinische verbetering op. Op dag 21 kon het veulen de kliniek verlaten met een verderzetting van doxycycline gedurende 3 weken.
Veulen 5 was reeds gedurende 2 dagen suf en had op moment van aanbieding koorts en leek mank aan de achterhand. Na verder onderzoek werd een opzetting van het linker femoropatellair gewricht vastgesteld. Echografisch en radiografisch onderzoek van de linker knie waren normaal. Het veulen kreeg algemeen ontstekingsremmers en antibiotica (doxycycline) toegediend en het gewricht werd lokaal behandeld met intra-articulaire injecties met ceftiofur. Er was geen klinisch verbetering zichtbaar, waarop de radiografieën van de knie herhaald werden op dag 7. Ditmaal kon de diagnose van osteomyelitis van de patella gesteld worden. Het systemisch antibioticum werd overgeschakeld op marbofloxacine en het lokale antibioticum op rifampicine. Hierna verbeterde het veulen geleidelijk aan klinisch en op dag 22 werd op de radiografische controle eveneens een verbetering van de osteomyelitis vastgesteld. Op dag 24 kon het veulen de kliniek verlaten, mits verderzetting van marbofloxacine gedurende 10 dagen.
Bij Veulen 6 werd een infectieuze artritis van het linker en rechter tibiotarsaal gewricht en van de kogel rechtsvoor gediagnosticeerd. Het veulen werd systemisch behandeld met ceftiofur en