DE INVLOED VAN BACTERIËN UIT HET LONGMICROBIOOM
OP DE VIRULENTIE VAN
Pseudomonas aeruginosa
Fien Meersschaert
Masterproef in de opleiding Master in de Farmaceutische Zorg
Masterproef voorgelegd aan de faculteit Farmaceutische Wetenschappen, uitgevoerd i.s.m. het Laboratorium voor Farmaceutische Microbiologie.
Promotor: Prof. Dr. Aurélie Crabbé
Commissarissen: Prof. Dr. Tom Coenye en Dr. Charlotte Peeters
De informatie, conclusies en standpunten opgenomen in deze masterthesis zijn op rekening van de auteur en vertegenwoordigen niet noodzakelijk de mening van de promotor of zijn/haar onderzoeksgroep.
DE INVLOED VAN BACTERIËN UIT HET LONGMICROBIOOM
OP DE VIRULENTIE VAN
Pseudomonas aeruginosa
Fien Meersschaert
Masterproef in de opleiding Master in de Farmaceutische Zorg
AUTEURSRECHT
“De auteur en de promotor geven de toelating deze masterproef voor consultatie beschikbaar te stellen en delen ervan te kopiëren voor persoonlijk gebruik. Elk ander gebruik valt onder de beperkingen van het auteursrecht, in het bijzonder met betrekking tot de verplichting uitdrukkelijk de bron te vermelden bij het aanhalen van de resultaten uit deze masterproef.”
10 februari 2020
Promotor Auteur
CORONACRISIS
Op 13-03-2020 besliste het bestuur van de UGent om over te stappen naar onderwijs op afstand om de verdere verspreiding van het coronavirus COVID-19 zoveel mogelijk te vertragen. Het aantal besmette patiënten met het coronavirus steeg exponentieel zonder extra maatregelen. In deze situatie zou het Belgische gezondheidssysteem de COVID-19 pandemie niet aankunnen. Maatregelen, zoals het sluiten van scholen, waren nodig om deze piek te doen spreiden over de tijd.
Mijn initiële doelstellingen waren: (1) de bepaling van de invloed van drie microbioomleden, Delftia lacustris, Rothia mucilaginosa en Streptococcus salivarius, op de biofilmontwikkeling en het cytotoxisch effect van Pseudomonas aeruginosa; (2) de bepaling van de invloed van deze drie microbioomleden op de productie van pyocyanine, rhamnolipiden en proteasen door P. aeruginosa; (3) de bepaling van de mogelijkheid van deze drie microbioomleden om quorum sensing binnen P. aeruginosa te inhiberen en (4) de bepaling van de invloed van deze drie microbioomleden op de geïnduceerde inflammatoire respons door P. aeruginosa. Een gedetailleerde beschrijving van het geplande onderzoek staat in het hoofdstuk ‘Objectieven’.
Als gevolg van de coronacrisis was er geen mogelijkheid meer om verder experimenteel werk te verzetten en kon ik enkel stap 1 voltooien. Ik werkte de hoofdstukken ‘Materiaal en Methoden’ en ‘Resultaten en Discussie’ af op basis van het beschikbare materiaal. Verder vulde ik de inleiding aan met een uitgebreide literatuurstudie over antivirulentie strategieën tegen P. aeruginosa en interacties tussen P. aeruginosa en leden uit het longmicrobioom.
SAMENVATTING
Pseudomonas aeruginosa is een bacterie die kan overleven in diverse omgevingen zoals water, de wortelzone van planten en de mens. Zowel acute longinfecties bv. ventilator-associated pneumonia, als chronische longinfecties bv. mucoviscidose worden veroorzaakt door dit opportunistisch pathogeen. Intrinsieke en verworven resistentie, evenals tolerantie, zorgen ervoor dat de behandeling een heuse uitdaging vormt. Daarnaast produceert dit pathogeen een waaier aan virulentiefactoren zoals een flagel en pili om te binden met de gastheercellen, toxines van het type III secretie systeem, proteasen, pyocyanine, lipases, sideroforen en rhamnolipiden die schade aanbrengen aan de gastheer. Tijdens chronische infecties ontwikkelt P. aeruginosa zich als een biofilm door de productie van een extracellulaire matrix die een verzameling aan microkolonies omhult. De aanmaak van vele van deze virulentiefactoren wordt gereguleerd door quorum sensing.
Het wereldwijde probleem van antibioticaresistentie zorgt ervoor dat nieuwe behandelingsstrategieën zijn vereist. Het targetten van virulentiefactoren is een veelbelovend alternatief omdat deze aanpak de leefbaarheid van P. aeruginosa niet aantast, maar wel de bacterie ontwapent. Verschillende onderzoeksgroepen hebben gepeild naar potentiële quorum quenching bacteriën daar deze in dezelfde niche overleven als P. aeruginosa en ermee in competitie treden. De componenten die worden aangemaakt door deze bacteriën kunnen worden ingezet als behandeling tegen P. aeruginosa. Echter, een nieuwe invalshoek die reeds in beperkte mate werd bestudeerd, is de zoektocht naar bacteriën uit het longmicrobioom die als probiotica zouden kunnen dienen, specifiek voor de longen. Deze thesis spitst zich dan ook toe op dit onderzoeksgebied en meer specifiek op de invloed van Delftia lacustris, Rothia mucilaginosa en Streptococcus salivarius, 3 longmicrobioomleden, op de virulentie van P. aeruginosa.
3-D longepitheelcellen werden onderworpen aan een infectie met P. aeruginosa in de aan- en afwezigheid van 1 bacterie uit het longmicrobioom voor een periode van 4 uur of 16 uur. Hieruit bleek dat D. lacustris en R. mucilaginosa de associatie en het cytotoxisch effect van P. aeruginosa op de 3-D cellen niet doen afnemen. Het effect van S. salivarius leverde geen sluitende conclusie op. Het verder nagaan van de invloed van meerdere bacteriële soorten uit het longmicrobioom op P. aeruginosa, de invloed op de productie van verschillende virulentiefactoren door P. aeruginosa en het mechanisme achter deze interacties zijn vereist.
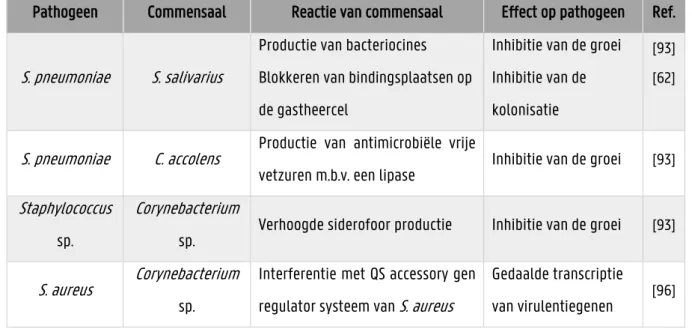
In de literatuur worden voornamelijk interacties tussen P. aeruginosa en andere pathogenen uit de longen beschreven. Er is zeer weinig geweten over hoe commensalen in het longmicrobioom interageren met P. aeruginosa en de virulentie van dit pathogeen beïnvloeden. Er dient meer inzicht te worden verkregen in de rol van commensale bacteriën in de bescherming tegen het belangrijke respiratoire pathogeen P. aeruginosa om zo commensalen met inhiberende eigenschappen in te zetten als een behandeling tegen pathogenen.
DANKWOORD Tijdens het schrijven van mijn thesis heb ik hulp gekregen van een aantal personen, deze wil ik graag bedanken. Bedankt aan Prof. Aurélie Crabbé voor de mogelijkheid om mijn thesis te schrijven in het Laboratorium voor Farmaceutische Microbiologie. Ook bedankt om de tijd te nemen om mijn tekst grondig en kritisch na te lezen. A huge thank you to Lucia, for all your explanations, really funny moments in the lab, Dutch translations, patience and encouragement. I could always count on you. Thanks to your quick responses to any of my questions, your amazing knowledge and the Skype calls for hours, I could accomplish this thesis. I have learned so much from you as a researcher, but also as a person. Bedankt aan Ellen voor de handige tips en tricks en het beantwoorden van mijn vragen. Bedankt aan Emma, Amber, Romi en Tom voor de toffe en gezellige middagpauzes en de onvergetelijke momenten in het labo tijdens die eerste vijf weken. Ook bedankt aan alle andere medewerkers van het team voor de vrolijke sfeer die aanwezig was in het labo. Bedankt aan mijn ouders en zussen om me tijdens deze bizarre periode onvoorwaardelijk te steunen en te zorgen voor de nodige afleiding. Bedankt aan mijn vriend om altijd voor me klaar te staan, me te motiveren en voor de ontspannende fietstochten tijdens het samen thesissen.
INHOUDSOPGAVE
1. INLEIDING ... 1
1.1. PSEUDOMONAS AERUGINOSA ... 1
1.1.1. P. aeruginosa, een opportunistisch pathogeen ... 1
1.1.2. Antibioticaresistentie en tolerantie ... 3
1.1.3. Virulentie ... 5
1.2. ANTIVIRULENTIE STRATEGIEËN TEGEN PSEUDOMONAS AERUGINOSA ... 11
1.2.1. Directe inhibitie van virulentiefactoren ... 12
1.2.2. Verstoren van de regulatie ... 14
1.2.3. Virulence attenuating combination therapy (VACT) ... 16
1.2.4. Antivirulentie strategieën gebaseerd op het gebruik van bacteriën ... 17
1.3. LONGMICROBIOOM ... 19
1.3.1. Het longmicrobioom in gezondheid en in ziekte ... 19
1.3.2. Invloed van leden van het longmicrobioom op de groei en virulentie van P. aeruginosa... 20
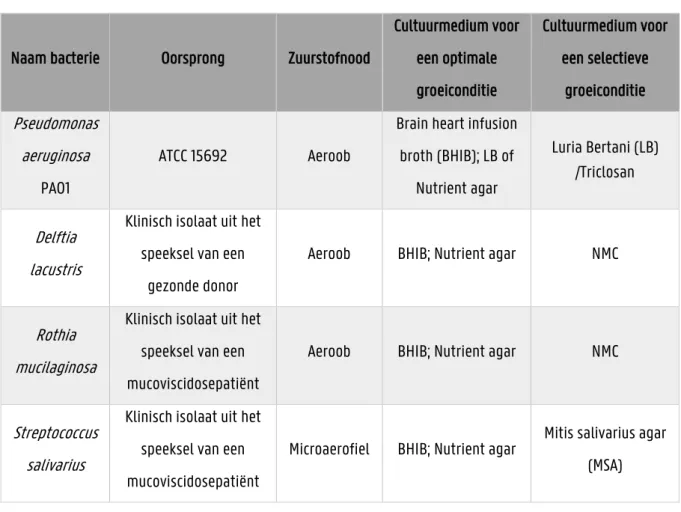
1.3.3. Invloed van leden van het longmicrobioom op de groei en virulentie van andere respiratoire pathogenen ... 24 2. OBJECTIEVEN ... 26 3. MATERIAAL EN METHODEN ... 27 3.1. BACTERIËN EN GROEIMEDIA ... 27 3.2. REINCULTUUR ... 29 3.3. OVERNACHTCULTUUR ... 29
3.4. BEPALEN VAN DE CORRELATIE TUSSEN DE OD EN CFU VOOR ALLE BACTERIËN ...30
3.5. CYTOTOXICITEIT VAN LONGMICROBIOOM BACTERIËN IN HET 3-D A549 LONGMODEL ... 32
3.5.1. Infecteren van 3-D A549 cellen met enkelvoudige culturen van P. aeruginosa PAO1, D. lacustris, R. mucilaginosa en S. salivarius ... 32
3.5.2. Bepalen van de leefbaarheid van de 3-D A549 cellen ... 33
3.6. MICROSCOPISCHE ANALYSE VAN DE BIOFILMVORMING DOOR P. AERUGINOSA PAO1 BIJ EEN MOI VAN 10 OP 3-D A549 LONGEPITHEELCELLEN NA 4 UUR ... 35
3.7. EVALUEREN VAN DE ANTIVIRULENTIE ACTIVITEIT M.B.V. EEN IN VIVO-LIKE INFECTIEMODEL ... 35
3.7.1. Inhibitie van P. aeruginosa PAO1 adhesie aan 3-D longepitheelcellen na 4 uur door D. lacustris en R. mucilaginosa ... 35
3.7.2. Invloed van longmicrobioom bacteriën op het cytotoxisch effect van P. aeruginosa PAO1 op 3-D longepitheelcellen na 16 uur ... 36
3.8. STATISTISCHE ANALYSE M.B.V. SPSS 25... 36
4.1. BEPALEN VAN DE CORRELATIE TUSSEN DE OD EN CFU VOOR ALLE BACTERIËN ... 37 4.2. MICROSCOPISCHE ANALYSE VAN DE BIOFILMVORMING DOOR P. AERUGINOSA PAO1 BIJ EEN MOI VAN 10 OP 3-D A549 LONGEPITHEELCELLEN NA 4 UUR ... 38 4.3. CYTOTOXICITEIT VAN LONGMICROBIOOM BACTERIËN IN HET 3-D A549 LONGMODEL ... 38 4.4. EVALUEREN VAN DE ANTIVIRULENTIE ACTIVITEIT M.B.V. EEN IN VIVO-LIKE INFECTIEMODEL ... 43 4.4.1. Inhibitie van P. aeruginosa PAO1 adhesie aan 3-D longepitheelcellen na 4 uur door D. lacustris en R. mucilaginosa ... 43 4.4.2. Invloed van longmicrobioom bacteriën op het cytotoxisch effect van P. aeruginosa PAO1 op 3-D longepitheelcellen na 16 uur ... 45 5. CONCLUSIES ... 48 6. LITERATUURLIJST... 49
LIJST MET AFKORTINGEN 3-D: driedimensionaal
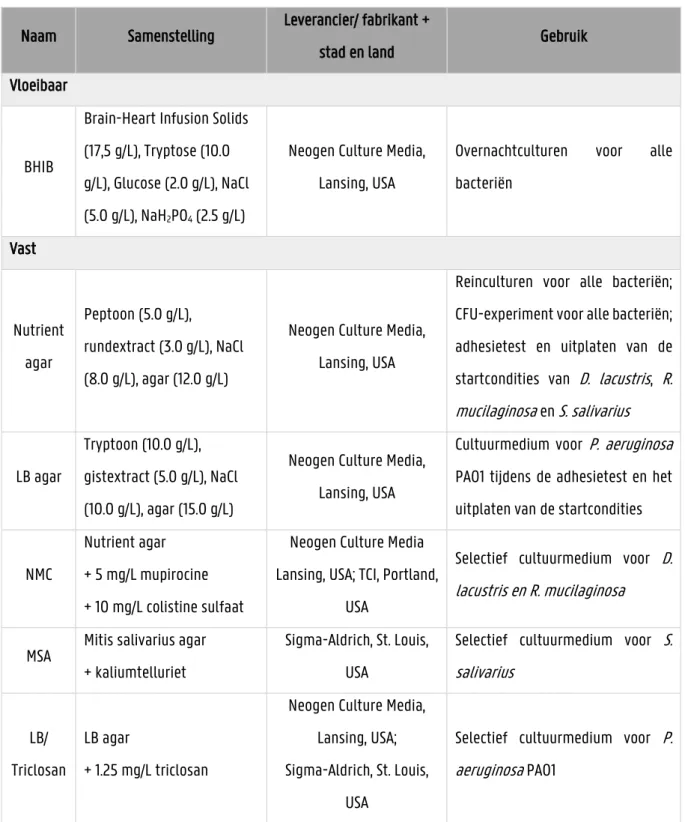
AHL: N-acyl-homoserinelactone ATCC: American Type Culture Collection BF: brightfield
BHIB: Brain heart infusion broth BHL: N-butyrylhomoserinelactone CAP: community-acquired pneumonia c-di-GMP: cyclisch diguanylaat monofosfaat CF: cystic fibrosis, mucoviscidose
CFU: colony-forming unit
COPD: chronisch obstructief longlijden fT3SS: flagelT3SS
G2-FBS: GTSF-2 medium zonder Fetal Bovine Serum GFP: Green Fluorescent Protein
IQS: integrated quorum sensing signal, 2-(2-hydroxyfenyl)-thiazole-4-carbaldehyde iT3SS: injectosoomT3SS
LAF-kast: laminaire airflow kast LB: Luria Bertani
LDH: lactaat dehydrogenase LPS: lipopolysacharide
MALDI-TOF MS: matrix assisted laser desorption ionization-time of flight mass spectrometry MOI : multiplicity of infection
MomL: Muricauda olearia marine AHL-lactonase MSA: Mitis salivarius agar
OD450: optical density bij 450 nm
OD590: optical density bij 590 nm
OdDHL: N-(3-oxododecanoyl)-L-homoserinelactone PAI: Pseudomonas autoinducer
PQS: Pseudomonas quinolone signaal, 2-heptyl-3-hydroxy-4-quinolone QS: Quorum sensing
QSI: QS-inhibitoren
rHPLOE: recombinant hemolymfe plasmalectine
RNI: reactieve stikstofhoudende intermediairen
ROS: reactive oxygen species, reactieve zuurstof componenten T3SS: type III secretie systeem
VACT: Virulence attenuating combination therapy VAP: ventilator-associated pneumonia
1
1. INLEIDING
1.1. Pseudomonas aeruginosa
1.1.1. P. aeruginosa, een opportunistisch pathogeen
De aerobe, Gram-negatieve bacterie Pseudomonas aeruginosa is een opportunistisch pathogeen en behoort tot de Pseudomonadaceae familie. [1] Deze bacterie leeft op oppervlakken in een waterige omgeving, maar kan ook in andere omstandigheden overleven door zijn groot aanpassingsvermogen en intrinsieke antibioticaresistentie. [2] P. aeruginosa tast zelden gezonde individuen aan, daarentegen heeft dit pathogeen een grote invloed op personen met een verminderd verdedigingssysteem, zoals bij neutropenie, ernstige brandwonden of bij cystic fibrosis (CF)-patiënten. Zoals weergegeven in Tabel 1.1 kan deze staafvormige bacterie bijna elk deel van het menselijk lichaam koloniseren. [2,3] Tot op heden zijn er weinig strategieën voor de behandeling van P. aeruginosa chronische infecties. Dit heeft een hoge morbiditeit en mortaliteit tot gevolg. [1,2]
Tabel 1.1: De meest voorkomende P. aeruginosa infecties met bijhorende risicofactoren [2,3]
Infectieplaats Aandoening Belangrijkste risicofactoren
Huid en weke delen
Wondinfectie Diabetische voet
Brandwonden, open wonden, postoperatieve wonden Diabetes, bemoeilijkte microvasculaire circulatie Urinewegen Acute en chronische infecties Urinaire katheter of urinaire chirurgie
Bloed Bacteriëmie en sepsis Immuundeficiëntie, aids, diabetes, brandwonden, neutropenie gerelateerd aan kanker
Luchtwegen Acute pneumonie Chronische longinfectie
Mechanische ventilatie, hospitalisatie Chronisch obstructief longlijden (COPD), CF Oor Otitis externa (zwemmersoor)
Otitis media folliculitis Maligne otitis externa
Chronische middenoorontsteking
Weefselschade, verstopping oorkanaal door water Slecht gereinigde bubbelbaden
Diabetes
Oog Keratitis (hoornvliesontsteking) Langdurig dragen van contactlenzen, gecontamineerde contactlensvloeistof Hersenen Meningitis, hersenabces Neurochirurgie, trauma, invasieve procedures
Hart Endocarditis Intraveneuze druggebruikers
Bot en gewricht Osteochondritis t.h.v. de voeten Trauma t.g.v. punctie Maag en
darmen
Perirectale infecties
Necrotiserende enterocolitis
2
Er kan een onderscheid worden gemaakt tussen community- en hospital-acquired o.b.v. een verschil in overdracht. Daarnaast maakt men ook een verschil tussen acute en chronische infecties. [2] Aangezien de focus in deze thesis ligt op acute en chronische infecties van de longen, worden deze hieronder toegelicht.
Acute longinfecties
Vaak is een verwonding, bv. intubatie bij ventilator-associated pneumonia (VAP), de oorzaak van een acute infectie. Door het plaatsen van een endotracheale buis wordt er schade aan het epitheel van de luchtwegen gebracht. Op deze plastic buis kan een biofilm ontstaan die moeilijk te verwijderen en te behandelen is. [2] Daarnaast zorgt intubatie niet alleen voor schade aan de natuurlijke barrière tussen de orofarynx en de trachea, maar ook voor een eenvoudige toegang van verschillende pathogenen tot het lichaam. [4] Risicofactoren zijn een langdurige mechanische ventilatie, een hoge leeftijd, een voorafgaande P. aeruginosa infectie of antibioticakuur en kanker. [5]
Vervolgens kan P. aeruginosa ook een community-acquired pneumonia (CAP) veroorzaken. Er is een hoger risico op een CAP wanneer patiënten verblijven in verzorgingstehuizen en bij patiënten met COPD [4], bronchiëctasie of CF. [5] Ook onderliggende immuundeficiënties t.g.v. neutropenie door chemotherapie bij kanker, een hogere leeftijd of immunosuppressie bij een orgaantransplantatie verhogen het risico op een CAP. [2,5] Een pneumonie kan leiden tot een bacteriëmie door schade aan het longepitheel en toegang van P. aeruginosa tot het pulmonaire vaatbed. [6–8] Daarnaast hebben kankerpatiënten met neutropenie en patiënten met een immunodeficiëntie gerelateerd aan aids, diabetes mellitus of ernstige brandwonden ook een groot risico op een bacteriëmie. [3]
Chronische longinfecties
Mucoviscidose is het best gekende voorbeeld van een chronische P. aeruginosa infectie. 80% van alle patiënten is gekoloniseerd met P. aeruginosa tegen een leeftijd van 18 jaar. [9] Deze bacterie zal zich na een acute fase aanpassen aan zijn omgeving en zo overgaan tot een chronische fase met biofilmvorming. Aan de basis van CF ligt een mutatie in het DNA die ervoor zorgt dat er problemen ontstaan in de vorming en functionaliteit van het Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) eiwit. Dit eiwit is een cAMP-afhankelijk chloridekanaal dat chloride en water verplaatst naar de luchtwegen en zo het slijm voldoende vloeibaar houdt. Een fout in dit kanaal zorgt voor een gedehydrateerde, dikke, taaie slijmlaag die de mucociliaire klaring belemmert. Ingeademde bacteriën vertoeven graag in het dikke slijm en zorgen zo voor een aanhoudende immunologische stimulatie. [2,8]. Neutrofielen worden t.g.v. stimulatie door inflammatoire cytokines of bacterieel lipopolysacharide (LPS) uiterst inflammatoir, waarbij degranulatie resulteert in destructie van het
3
longweefsel. Deze granulocyten richten schade aan door de productie van reactieve zuurstof componenten (ROS) en reactieve stikstof componenten, en het vrijstellen van elastase, myeloperoxidase, lysozymen en defensinen uit hun granulen. [2]
P. aeruginosa chronische infecties komen ook voor bij patiënten met chronische bronchiëctasie en COPD, en zijn geassocieerd met een ernstiger ziekteverloop en luchtwegenobstructie. Bronchiëctasie is de irreversibele verwijding van bronchi door een aantasting van de spieren en het elastisch weefsel. [2] Dit leidt tot een gedaalde mucusklaring en gunstige omstandigheden voor een chronische P. aeruginosa infectie. [10] Bij COPD zorgt een abnormale inflammatoire respons op componenten die worden ingeademd voor een versmalling van de luchtwegen en een belemmering van de luchtstroom. [2,11] Vermits een chronische infectie met P. aeruginosa een chronische inflammatie induceert, draagt deze bacterie bij tot de pathogenese van COPD. [11] Alhoewel veel patiënten genezen van de infectie, ontwikkelen anderen een persistente infectie die wordt getypeerd door regelmatige exacerbaties. [2] 5% van deze infectieuze exacerbaties zijn toe te schrijven aan P. aeruginosa. [12] 1.1.2. Antibioticaresistentie en tolerantie
P. aeruginosa bezit één van de grootste genomen van alle prokaryoten. Dit genoom codeert voor een opmerkelijk grote hoeveelheid eiwitten die betrokken zijn in regulatie, transport en virulentie. [3] Ook heeft P. aeruginosa verschillende mechanismen die tot resistentie aan verschillende antibiotica leiden [5], waardoor de behandeling van P. aeruginosa infecties een grote uitdaging vormt. Resistentie kunnen we opsplitsen in intrinsieke en verworven resistentie. [12]
P. aeruginosa bezit het vermogen om zijn eigen structurele en functionele eigenschappen in te zetten tegen specifieke antibiotica, wat leidt tot intrinsieke resistentie, zoals weergegeven in Figuur 1.1. Ten eerste moeten antibiotica in staat zijn om de bacterie binnen te dringen om hun werking te kunnen uitoefenen. β-lactams en quinolones passeren het celmembraan m.b.v. porines, terwijl
aminoglycosiden en polymyxines worden opgenomen door interactie met LPS van het buitenste membraan. [12] Het aminozuurspecifiek porine OprD bezit bindingsplaatsen voor carbapenems en is belangrijk in de opname van
Figuur 1.1: Intrinsieke antibioticaresistentie in P. aeruginosa wordt veroorzaakt door een beperkte permeabiliteit van het buitenste
4
deze β-lactam antibiotica, maar afwezigheid zorgt voor een verhoogde resistentie. [12] Het OprH-kanaal induceert de modificatie van LPS door het bezetten van de Mg2+-bindingsplaatsen wanneer deze kationen slechts
beperkt aanwezig zijn. [13] Hierdoor stabiliseert dit porine het buitenste membraan en zorgt het op deze manier voor resistentie tegen polymyxines en aminoglycosiden. [12] Het tweede intrinsiek resistentiemechanisme bestaat uit effluxpompen die toxische componenten exporteren. [12] Het laatste en belangrijkste intrinsiek resistentiemechanisme is de productie van antibiotica-inactiverende enzymen. Zo produceert P. aeruginosa bv. β-lactamasen die de amidebinding in de β-lactamring verbreken. Deze Gram-negatieve bacterie bezit nl. een induceerbaar ampC gen dat hiervoor codeert. [12]
Multidrugresistentie wordt voor het grootste deel bekomen door verworven resistentie. Dit type resistentie kan onderverdeeld worden in twee groepen. [12] Ten eerste kunnen er mutaties optreden die leiden tot een verminderde opname van antibiotica, een modificatie van de target of een overexpressie van effluxpompen en inactiverende enzymen. Spontane mutaties in porines leiden tot een verminderde permeabiliteit van het celmembraan en zo tot een verhoogde antibioticaresistentie. Een voorbeeld van targetmodificaties zijn mutaties in de genen die coderen voor DNA-gyrase en -topoisomerase IV en leiden tot een verminderde bindingsaffiniteit van quinolones. [12] Een tweede mechanisme is het verwerven van resistentiegenen via horizontale gentransfer. Deze resistentiegenen bevinden zich op plasmiden, transposons, integrons en profagen en verspreiden op deze manier antibioticaresistentie tussen verschillende P. aeruginosa stammen en andere bacteriële species. [12]
Resistentie doet zich voor in zowel de planktonische als de biofilm groeimodus. Daarentegen komt tolerantie aan antibiotica enkel voor in P. aeruginosa biofilms. [14] Een biofilm bestaat uit aggregaten van bacteriën die omgeven zijn door een zelfgeproduceerde matrix en bevindt zich op levende en niet-levende oppervlakken (zie deel 1.1.3.2.). De tolerantie van biofilms kan opgesplitst worden in een fysieke, fysiologische en genetische factor. Fysieke tolerantie treedt op omdat antibiotica gebonden worden aan componenten van de extracellulaire matrix en bacteriële membranen, met een beperkte penetratie tot gevolg. [15] Een tweede determinant is de fysiologische tolerantie die wordt veroorzaakt door een verschil in metabole activiteit en de aanwezigheid van persisters in biofilms. In de biofilm ontstaat een heterogeniteit aan subpopulaties door een verschil in metabole activiteit. Subpopulaties aan de buitenzijde van de biofilm bezitten een hoge fysiologische activiteit daar ze bijna alle zuurstof en nutriënten verbruiken. Hierdoor vertonen de subpopulaties in het midden van de biofilm een lage metabole activiteit en inactiveren ze belangrijke antibioticatargets wat tolerantie met zich meebrengt. [15] Persisters delen traag of niet en kunnen overgaan tot een rusttoestand die de synthese van antibioticatargets stillegt. Persisters kunnen een antibioticabehandeling overleven en zorgen voor een heropflakkering van de infectie door na afloop van de behandeling hun groei te hervatten. [12] Als laatste kan er ook tolerantie ontstaan door de expressie van genen specifiek in biofilms. [15]
5
1.1.3. Virulentie
1.1.3.1. Virulentiefactoren
Zoals geïllustreerd in Figuur 1.2 heeft P. aeruginosa naast celgeassocieerde virulentiefactoren (bv. flagel, pili) ook gesecreteerde virulentiefactoren (bv. proteasen, toxines) nodig voor infectie.
Flagel en pili
Oppervlaktevirulentiefactoren zijn nodig voor bacteriële aanhechting, kolonisatie en invasie, en kunnen zo een inflammatoire respons initiëren. Eén pool van de bacterie beschikt over één flagel die zorgt voor beweging en ook een rol heeft in initiële oppervlakte-interacties. [1] Eén van de targets in de luchtwegen waarop de bacterie zal binden met zijn flagel is het glycolipide asialo-ganglioside M1 [1,2,4,8] dat maximaal tot expressie komt tijdens epitheliaal celherstel. Dit is een verklaring waarom we P. aeruginosa vaak gebonden zien aan een aangetast luchtwegepitheel. [1] De binding van P. aeruginosa op zijn target brengt een sterke NF-κB-gemedieerde inflammatoire respons teweeg. [2,4,8] De kortere type IV pili zijn verantwoordelijk voor hechting aan celmembranen en andere oppervlakken. [1] Pili kunnen de cel over een vast oppervlak trekken door zich te verlengen en te verkorten. Daarnaast zijn ze ook belangrijk voor de biofilmontwikkeling door de vorming van microkolonies (zie deel 1.1.3.2.). [2]
Lipopolysacharide
Het lipopolysacharide is een complex glycolipide dat zich bevindt op het buitenste membraan van Gram-negatieve bacteriën. Dit complex bestaat uit drie delen waaronder lipide A, de polysacharide kernregio en een sterk variabel O-specifiek polysacharide (O-antigen). Samen spelen deze een belangrijke rol in de binding met elementen van het adaptieve immuunsysteem, de inflammatoire respons, het verhinderen van de invasie van vreemde moleculen en interacties met antibiotica. Lipide A zorgt voor de verankering van het LPS in het buitenste membraan. Het is een atypisch glycolipide dat de buitenzijde van het LPS vormt en gemakkelijk kan binden met receptoren op targetcellen. Door binding met coreceptoren MD2 en CD14 wordt TLR4 geactiveerd, de NF-κB pathway geactiveerd, alsook de productie van pro-inflammatoire cytokines en chemokines, inflammatie en een endotoxische shock gestimuleerd. [2] Gedurende de overgang van de acute naar de chronische fase tijdens CF ondergaat P. aeruginosa veranderingen in LPS. [2] Zo wordt het antigenspecifiek O-polysacharide minder tot expressie gebracht tijdens chronische infecties om het adaptief immuunsysteem te vermijden. [2]
Exotoxine A, lipases en fosfolipases
Exotoxine A draagt bij tot de onderbreking van de proteïnesynthese en celdood door een ADP-ribosylering van de elongatiefactor 2 in eukaryoten. [1] Het gevolg van de interruptie van de proteïnesynthese is een gedaalde
6
hoeveelheid tight junction eiwitten en zo een verhoogde permeabiliteit van het luchtwegepitheel. Uiteindelijk leidt dit tot een inductie van apoptose. [8] Ook worden celmembranen aangetast door de destructie van surfactantlipiden en fosfolipiden wegens de inwerking van lipases en fosfolipases. [2]
Type III secretie systeem
Het type III secretie systeem (T3SS) is een contactafhankelijk systeem dat bestaat uit 1 kanaal dat het hele bacteriële membraan overspant en wordt geactiveerd door binding met een epitheelcel. [1,4] FlagelT3SS (fT3SS) en injectosoomT3SS (iT3SS) komen beiden tot expressie bij P. aeruginosa. fT3SS maakt chemotaxis mogelijk door de productie van proteïnen voor de flagel. Daarnaast produceert het ook effector toxines. [16] P. aeruginosa injecteert d.m.v. iT3SS, een naaldachtig aanhangsel, vier exo-enzymen doorheen de opening in het membraan van de epitheelcel. ExoS, ExoT, ExoU en ExoY geven aanleiding tot een verandering in de immuunrespons, celschade en celdood. [1,4]
ExoS is een ADP-riboxyltransferase en heeft vooral een effect op de organisatie van het actinecytoskelet. Ook blokkeert ExoS de aanmaak van ROS door neutrofielen. Als tweede is er ExoY, een adenylaatcyclase dat apoptose veroorzaakt. ExoT is een bifunctioneel proteïne dat een GTP-ase activerend en ADP-riboxyltransferase domein bezit. Dit toxine veroorzaakt een vertraagde wondheling door een inhibitie van de cytokinese. De grootste rol in virulentie is toe te schrijven aan ExoU, een fosfolipase dat schade berokkent aan de plasmamembraanintegriteit en zo snel kan leiden tot dood van zijn target. Het T3SS injectiesysteem geeft P. aeruginosa de mogelijkheid om tijdens de kolonisatie wondheling tegen te werken en celschade direct via ExoU te bevorderen. [2,4,16] Een verhoogde mortaliteit in patiënten met respiratoir falen, pneumonie en sepsis, en een ernstiger ziektebeeld bij VAP zijn mede te wijten aan de expressie van het T3SS. [1]
7
Pyoverdine, pyocheline en pyocyanine
Om groei en kolonisatie mogelijk te maken heeft P. aeruginosa ijzer nodig. Daarom produceert de bacterie pyoverdine en pyocheline, twee sideroforen die de capaciteit hebben om ijzer te binden. Tijdens acute infecties is het hoge affiniteitssiderofoor pyoverdine nodig. Deze molecule functioneert ook als een signaalmolecule aangezien het de productie van virulentiefactoren stimuleert. Bij CF-patiënten speelt voornamelijk pyocheline een belangrijke rol, aangezien het de inflammatie en oxidatieve schade aan het longweefsel veroorzaakt. [17]
De gastheercel kan tevens worden beschadigd t.g.v. de pro-inflammatoire en oxidatieve effecten van pyocyanine, een fenazine. Deze blauwe redox-actieve secundaire metaboliet is een zwitterion, dat gemakkelijk kan penetreren in biologische membranen en zo eukaryote cellulaire pathways verstoort. [18] Pyocyanine zorgt voor de verstoring van cilia [1], katalase en het mitochondriaal elektronentransport. [2] Daarnaast produceert het tijdens een redoxreactie in eukaryotische cellen ROS wat leidt tot een cytotoxisch effect. [19] Ook is dit fenazine verantwoordelijk voor ijzeropname in biofilms door de reductie van Fe3+ gebonden aan eiwitten naar
Fe2+. [17] In een muismodel met acute pneumonie werd aangetoond dat muizen van een P. aeruginosa
pyocyanine-deficiënte infectie wel konden genezen, maar niet van een wild-type P. aeruginosa infectie. Ook werd pyocyanine aangetroffen in grote hoeveelheden in sputum van CF-patiënten. [18]
Proteasen
Daarnaast worden ook proteasen en elastasen gesecreteerd door P. aeruginosa. Deze enzymen zijn verantwoordelijk voor de afbraak van immunoregulatoire proteïnen, oppervlakte-actieve eiwitten A en D, immunoglobuline, antibacteriële peptiden en complementeiwitten. [1,8] Proteasen zorgen naast de degradatie van fibrine en tight junctions ook voor weefselschade tijdens respiratoire infecties. Alkaline protease is een metalloprotease dat zorgt voor de afbraak van vrije flagelline monomeren om zo immuundetectie door TLR5 te vermijden. Verder staat P. aeruginosa in voor de productie van elastasen LasA en LasB [2], 2 metalloproteasen die voornamelijk elastine afbreken. [20] Ook zorgen deze exoproducten voor een verhoogde permeabiliteit van het respiratoir epitheel [8] door de afbraak van zonula occludens tight junction proteïnen. [21] Protease IV is een serineprotease dat zorgt voor de destructie van surfactantproteïnen A en D. Dit belet de binding van P. aeruginosa met de alveolaire macrofagen en is hierdoor belangrijk voor de overleving van de bacterie. [2] Rhamnolipiden
Rhamnolipiden zijn rhamnosebevattende glycolipide biosurfactanten en veroorzaken een inductie van de productie van mucus glycoconjugaten in de bronchi en een verlies van de beweging van cilia. [8] Ook zijn deze bij een hoge concentratie verantwoordelijk voor de vernietiging van intercellulaire juncties. [8] Verder zijn hun
8
amfipatische eigenschappen belangrijk voor het gebruik van hydrofobe koolwaterstoffen als koolstofbron. [22] Rhamnolipiden hebben ook een belangrijke rol in verschillende stadia van biofilmontwikkeling (zie deel 1.1.3.2.). Dit biosurfactant zorgt voor een vlottere initiële binding door een hydrofober celoppervlak te creëren, onderhoudt de biofilm door kolonisatie van de waterkanalen te vermijden en helpt bij het verspreiden van bacteriën uit de biofilm. [23]
1.1.3.2. Biofilm
De term biofilm duidt op de groei van bacteriën als een verzameling microkolonies die gebonden zitten op een oppervlak, in mucus of op andere gastheerfactoren, en omhuld zijn door een extracellulaire matrix. [1,2]. Deze sterk gehydrateerde matrix bestaat uit exopolysachariden, proteïnes, nucleïnezuren en mineralen. Deze complexe samenstelling zorgt voor een stevige architectuur en de nodige flexibiliteit van de biofilm. Ook heeft deze een beschermende taak door het genereren van een fysische barrière die de diffusie van omgevingsfactoren verhindert. Zo wordt er een verhoogde tolerantie van de bacteriën ontwikkeld tegen antibiotica (zie deel 1.1.2.). [2,24] Er zijn twee modellen die de biofilmontwikkeling onder verschillende omstandigheden beschrijven, zoals weergegeven in Figuur 1.3.
In het eerste model, zoals weergegeven in Figuur 1.3a, bestaat de biofilmontwikkeling uit 5 belangrijke stappen. Het proces start met de herkenning van een beschikbaar oppervlak door mobiele bacteriën. De initiële reversibele adhesie van de vrije bacteriën wordt bewerkstelligd door fysicochemische en elektrostatische interacties. [24] Door het gebruik van type IV pili op het oppervlak van de bacterie wordt de adhesie irreversibel. De gehechte bacteriën vermenigvuldigen zich en er worden microkolonies gevormd. [2] Bacteriële oppervlaktestructuren zijn niet meer vereist na aanvang van de biofilmontwikkeling waardoor hun corresponderende genen worden onderdrukt. Vervolgens wordt de extracellulaire matrix geproduceerd die zorgt voor een mechanische samenhang tussen bacteriën. [24] Tijdens de maturatiestap ontwikkelt de biofilm zich als een paddenstoelachtige structuur in vitro. Deze complexe 3-D-structuur bestaat uit waterige kanalen die zorgen voor de uitwisseling van enerzijds zuurstof en voedingsstoffen, en anderzijds afvalstoffen. De laatste stap in dit proces is de afbraak van de biofilm t.g.v. mechanische krachten, enzymen, het gebrek aan voedingsstoffen of een overpopulatie. Dit leidt tot verspreiding van vrije bacteriën in de omgeving die vervolgens nieuwe oppervlakken kunnen koloniseren. [2,24] Het eerste model verklaart niet hoe biofilms worden gevormd onder specifieke omstandigheden zoals de longen van CF-patiënten.
In het tweede model zitten de bacteriën ingesloten in een dikke mucuslaag. Dit model wordt voornamelijk geassocieerd met chronische P. aeruginosa infecties bv. CF. In Figuur 1.3b (i) wordt geïllustreerd dat P. aeruginosa niet in contact kan komen met het epitheel door de dikke mucuslaag. In (ii) verliest P. aeruginosa zijn adhesines
9
en muteert de bacterie naar een mucoïd fenotype waarin hij omgeven is door alginaat omwille van een alginaat overproductie. In de laatste stap wordt weergegeven dat de mucuslaag en biofilm zorgen voor de bescherming van P. aeruginosa tegen neutrofielen en macrofagen zodat er een chronische infectie ontstaat. [8]
1.1.3.3. Quorum sensing
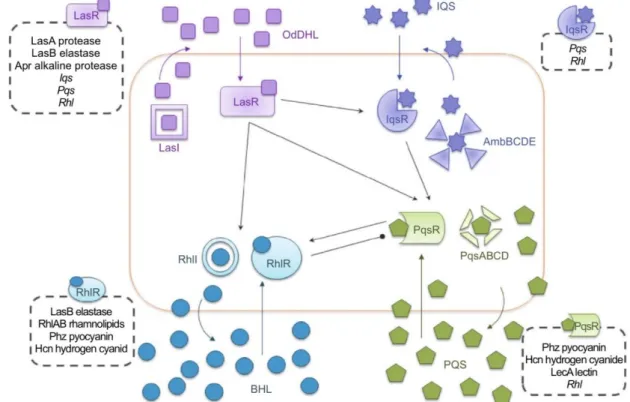
Quorum sensing (QS) biedt de mogelijkheid aan een bacteriële populatie om zich aan te passen aan veranderingen in hun omgeving. Elke bacterie produceert constitutief kleine moleculen, autoinducers, die doorheen het celmembraan kunnen diffunderen. De concentratie van deze moleculen is evenredig met de hoeveelheid bacteriën. Wanneer de concentratie aan autoinducers een bepaalde drempel bereikt, gedragen ze zich als cofactoren van hun transcriptie-eenheden. Dit leidt tot de inductie van specifieke targetgenen en een georganiseerde respons over de hele P. aeruginosa populatie. [2,8,9,18] Deze bacteriële cel-cel communicatie controleert de overleving van de bacterie, de biofilmontwikkeling en de productie van virulentiefactoren. [2,8]
QS binnen P. aeruginosa bestaat uit een aantal geconnecteerde systemen nl. LasI/LasR, RhlI/RhlR, Pqs en Iqs, zoals weergegeven in Figuur 1.4. [25,26] Elk systeem bestaat uit een specifieke autoinducer die wordt aangemaakt door een synthase en een receptor/transcriptionele regulator die de autoinducer bindt. De vorming van het autoinducer-receptor complex activeert de transcriptie van bepaalde genen. [9] De Pseudomonas autoinducers (PAI) zijn respectievelijk (3-oxododecanoyl)-L-homoserinelactone (OdDHL), N-Figuur 1.3: Model a illustreert de biofilmontwikkeling op (a)biotische oppervlakken (bv. medische hulpmiddelen en mucosa). Model b illustreert de biofilmontwikkeling gesuspendeerd in mucus van CF-patiënten. [8]
10
butyrylhomoserinelactone (BHL), heptyl-3-hydroxy-4-quinolone (Pseudomonas quinolone signaal, PQS) en 2-(2-hydroxyfenyl)-thiazole-4-carbaldehyde (integrated quorum sensing signal, IQS). Het Las-systeem heeft voornamelijk een belangrijke rol in acute infecties. Figuur 1.4 geeft ook de interconnectie weer tussen de vier QS-systemen met bovenaan de hiërarchie het las signalisatiesysteem. Binnen één systeem vindt een positieve feedback lus plaats t.g.v. de stimulatie van hun eigen gen door het autoinducer-receptor complex. [25,26]
Belangrijk is dat de productie van virulentiefactoren onder controle staat van QS. Zo worden protease LasA en alkaline protease gecontroleerd door OdDHL, en rhamnolipiden gecontroleerd door BHL. OdDHL, BHL en PQS controleren de pyocyanineproductie. Als laatste staat LasB elastase onder controle van OdDHL en BHL. [26]
1.1.3.4. Verschil in virulentie-expressie tussen acute en chronische infecties
P. aeruginosa stammen afkomstig uit acute infecties brengen een wijd gamma aan virulentiefactoren tot expressie. [2,4] Tijdens het verloop van CF ondergaat P. aeruginosa verschillende fenotypische en genotypische veranderingen. [8] Er treedt een downregulatie op van de flagel en pili aangezien deze binden met fagocyten en de aantrekking van neutrofielen stimuleren. [2,4] T3SS kan zijn functie niet meer uitoefenen daar deze een direct contact met de epitheelcellen nodig heeft om te kunnen werken. [8] Ook ontwikkelen zich veranderingen in LPS. In chronische infecties werd opgemerkt dat er meer BHL-productie is t.o.v. OdDHL dan in planktonische bacteriën door een mutatie in het lasR gen. [8,26] Vervolgens ontstaan er mutaties in mucA die leiden tot de overexpressie van alginaat. Dit zorgt voor de vorming van mucoïde kolonies en biofilmopbouw. [2,4,8]
Figuur 1.4: Het QS-netwerk van P. aeruginosa dat bestaat uit de vier autoinducers OdDHL, BHL, PQS en IQS. Lijnen met een bol uiteinde duiden op een inhiberend effect. Pijlen duiden op een stimulerend effect. [25]
11
1.2. ANTIVIRULENTIE STRATEGIEËN TEGEN Pseudomonas aeruginosa
Zoals reeds beschreven is de behandeling van P. aeruginosa problematisch door zijn intrinsieke resistentie en het verwerven van additionele resistentiemechanismen. Verder vormt dit pathogeen biofilms die bijdragen aan de tolerantie van antibiotica. Voor de behandeling van pathogenen in biofilms is er een verlengde therapieduur vereist, wat op zijn beurt ook bijdraagt aan antibioticaresistentie door de hoge selectiedruk. [27– 30] In 2017 plaatste de World Health Organisation carbapenem-resistente P. aeruginosa op de lijst van kritische pathogenen waarvoor er een hoge nood is aan nieuwe behandelingen. Verder leiden carbapenem-resistente P. aeruginosa tot een zeer hoge mortaliteit van meer dan 40%. [31] 80% van de overlijdens bij CF-patiënten zijn te wijten aan P. aeruginosa. [30] Tot 87% van patiënten met een VAP veroorzaakt door P. aeruginosa overlijdt eraan. [30] De productie van een breed scala aan virulentiefactoren heeft namelijk een belangrijke bijdrage aan de pathogeniciteit. [30] Samengevat is er een grote nood aan nieuwe therapeutische opties voor de behandeling van P. aeruginosa infecties.
Aangezien antibiotica enkel gevoelige bacteriën doden, leidt deze therapie tot de ontwikkeling van een resistente populatie door hun enorm groeivoordeel. Indien we een behandeling specifiek zouden richten tegen virulentiefactoren, blokkeren we de pathogeniciteit zonder een invloed te hebben op de groei van P. aeruginosa. [9,26,27,32–36] Hierdoor vermijden we de twee belangrijkste nadelen van antibiotica: resistentie en het doden van commensalen. [37,38]
Door het verzwakken van P. aeruginosa zouden het immuunsysteem en de normale microbiota in staat moeten zijn om kolonisatie van pathogenen te vermijden of om de nog aanwezige pathogenen te verwijderen. [36,37] Daarnaast biedt antivirulentie een brede waaier aan potentiële targets waardoor het mogelijk is om geneesmiddelen te produceren met een uniek aangepast activiteitenspectrum. [37,38] Een geneesmiddel met een breder spectrum kan gebruikt worden om meerdere bacteriën tegelijkertijd te bestrijden. [36] Afhankelijk van de target kan een middel soort- of stamspecifiek en in specifieke niches van het lichaam werken. Zo wordt een ongewenste off-site activiteit en schade aan commensalen vermeden. [38]
Virulentiemechanismen zijn cruciaal voor infectie en een blijvende aanwezigheid in de gastheer. Antivirulentie strategieën worden daarom beschouwd als een veelbelovend alternatief voor antibioticatherapie. Er wordt een onderscheid gemaakt tussen twee behandelingsdoelen. In een eerste behandelingsstrategie worden virulentiefactoren en hun biosynthese direct tegenwerkt. Daarnaast kan men de behandeling ook richten op de regulatie van virulentiefactoren. [9]
12
1.2.1. Directe inhibitie van virulentiefactoren
Zoals eerder vermeld maakt P. aeruginosa gebruik van het T3SS om toxines in de targetcellen over te brengen. Een veelbelovende techniek is de verstoring van hun samenstelling en functie om zo dit opportunistisch pathogeen deels te ontwapenen. Een onderzoeksgroep voerde een high-throughput screening uit van 80.000 chemische componenten om inhibitoren van het T3SS te identificeren. Hieruit bleek dat de secretie van de T3SS effector ExoS werd geïnhibeerd door het racemische fenoxyacetamide. [9] Het proteïne PscF dat aanwezig is in de extracellulaire naald werd later geïdentificeerd als potentiële target van fenoxyacetamide. [9] Naast nog vele andere chemische componenten werden er ook monoclonale antilichamen ontwikkeld tegen bv. PcrV, een proteïne in T3SS. [9] Aangezien het T3SS specifiek door Gram-negatieve pathogenen tot expressie wordt gebracht, beperkt dit het off-target effect. T3SS is niet van vitaal belang voor P. aeruginosa waardoor verstoren van het T3SS niet leidt tot de ontwikkeling van nieuwe resistentiemechanismen. [16]
Een volgend mogelijk doelwit is het LasB protease. Vermits dit een zink-afhankelijk elastase is, vormen metaalchelerende componenten potentiële inhibitoren. Er werd aangetoond dat dit metalloprotease wordt geïnhibeerd door peptiden met een thiolgroep. [9] Een voorbeeld van een LasB elastase inhibitor is weergegeven in Tabel 1.2. [9]
Mutaties in P. aeruginosa die leiden tot een pyoverdinetekort zorgen voor een minder efficiënte kolonisatie. [9] P. aeruginosa gebruikt pyoverdine om ijzer, nodig voor de overleving en groei van dit pathogeen, uit de omgeving op te nemen. [39] Daarnaast heeft pyoverdine ook een rol in de regulatie van andere virulentiefactoren en de biofilmontwikkeling. [9] Bijgevolg is pyoverdine een mogelijke antivirulentie target. In de pyoverdinebiosynthese vormt het verwijderen van een myristoylgroep van een precursor een cruciale stap. Deze eliminatie wordt gekatalyseerd door PvdQ, een nucleofiel hydrolase dat wordt geïnhibeerd door NS2028 en SMER28, twee arylbromide componenten. [9]
Daarnaast kan men met de biofilmontwikkeling en celadhesie interfereren omdat adhesines essentieel zijn voor de biofilmontwikkeling, maar niet cruciaal zijn voor de leefbaarheid van P. aeruginosa. Dit pathogeen brengt verschillende adhesines, bv. lectines, type IV pili en een flagel, tot expressie. Aangezien adhesines zich extracellulair bevinden, worden mogelijke resistentiemechanismen zoals effluxpompen en beperkt transport in de bacterie vermeden. [9] Lectines zijn proteïnen van het buitenste membraan en essentieel voor adhesie en biofilmontwikkeling. Door het herkennen en binden van suikerresidu’s, fucose en galactose in glycolipiden, glycoproteïnen en polysachariden uit de biofilm matrix, op specifieke bindingsplaatsen zorgen lectinen voor adhesie aan het epitheel en de opbouw van een biofilm. [40] Deze specifieke bindingsplaatsen worden
13
competitief geblokkeerd door de inhalatie van een aerosol die L-fucose en D-galactose componenten bevat. [9,39]
Een andere aanpak is de inhibitie van Pel en Psl, 2 componenten van de extracellulaire polymeer matrix die worden geproduceerd tijdens de beginfase van de biofilmontwikkeling. [16] Deze techniek is behoorlijk aantrekkelijk aangezien dit leidt tot de eliminatie van de gevormde biofilm, wat P. aeruginosa meer gevoelig maakt voor antibiotica. I7 is een Pel repressor en een potentieel middel in de behandeling van P. aeruginosa in CF-patiënten. [16]
Er zijn reeds veel beschreven acyl-homoserinelactones (AHL)-inhibitoren (zie deel 1.2.2.1.), maar geen enkele kan volledig de biofilmvorming tegengaan. Recent legde een studie de focus op factoren die een directe invloed hebben op de ontwikkeling van een biofilm. Zo speelt di-rhamnolipide een belangrijke rol in elke fase van de biofilmontwikkeling. Rhamnose dat aanwezig is in LPS, di-rhamnolipiden en PsI in biofilms wordt herkend door een recombinant hemolymfe plasmalectine (rHPLOE). rHPLOE bindt aan rhamnose wat aanleiding geeft tot
een daling van extracellulaire di-rhamnolipiden. Verder veroorzaakt rHPLOE een gedaalde autoinducer productie,
biofilmvorming en cytotoxiciteit. Dit rhamnose bindingsproteïne kan de architectuur van een mature biofilm verstoren en het pathogeen zo meer gevoelig maken aan een antibioticakuur. [41]
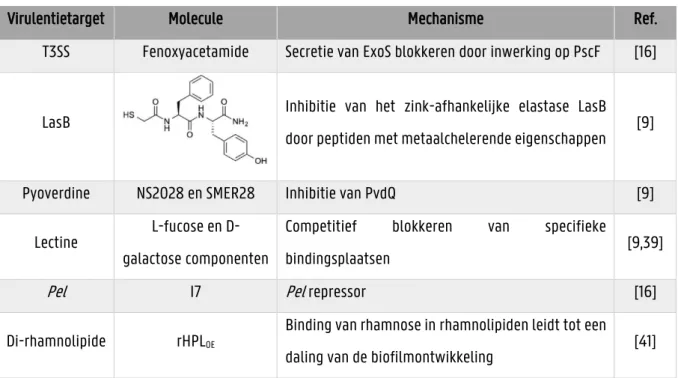
In Tabel 1.2 wordt er een overzicht weergegeven van de mogelijke inhibitoren van verscheidene virulentie targets met vermelding van hun mechanisme.
Tabel 1.2: Enkele voorbeelden van moleculen die virulentiefactoren van P. aeruginosa direct hinderen
Virulentietarget Molecule Mechanisme Ref.
T3SS Fenoxyacetamide Secretie van ExoS blokkeren door inwerking op PscF [16]
LasB Inhibitie van het zink-afhankelijke elastase LasB door peptiden met metaalchelerende eigenschappen [9]
Pyoverdine NS2028 en SMER28 Inhibitie van PvdQ [9]
Lectine L-fucose en D-galactose componenten
Competitief blokkeren van specifieke
bindingsplaatsen [9,39]
Pel I7 Pel repressor [16]
Di-rhamnolipide rHPLOE
Binding van rhamnose in rhamnolipiden leidt tot een
14
1.2.2. Verstoren van de regulatie 1.2.2.1. QS-inhibitoren (QSI)
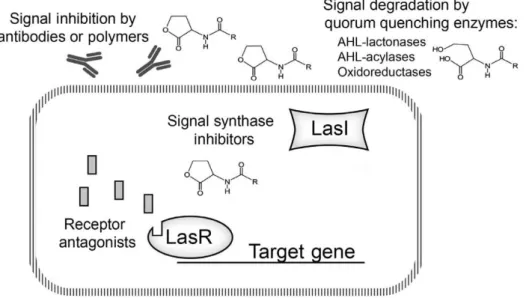
QS is belangrijk voor de pathogeniciteit van P. aeruginosa en vormt een cruciale schakel in de productie van virulentiefactoren, biofilmontwikkeling, swarming, swimming en twitching. QS is daarentegen niet betrokken in de groei van P. aeruginosa. [9] Voordelen bij het gebruik van QSI zijn een verbeterde bacteriële klaring, een gestimuleerde immunogeniciteit en een gedaalde longschade. [16]
Daarnaast gaan er ook enkele uitdagingen gepaard met deze antivirulentie strategie. Zo worden bepaalde virulentiefactoren gereguleerd via andere mechanismen dan QS, zoals het cyclisch diguanylaat monofosfaat (c-di-GMP) (zie deel 1.2.2.2.). [42] Aangezien verschillende QS-systemen in een complex netwerk met elkaar verbonden zijn, kan interferentie in één van de QS-systemen leiden tot een ongewenste stijging van de virulentie. [42] Bijvoorbeeld, in een lasR deficiënte P. aeruginosa stam is het rhl systeem niet geblokkeerd, waardoor er toch een pyocyanine- en rhamnolipidenproductie kan optreden, wat bijdraagt aan de virulentie. [43] Vele in vitro experimenten toonden aan dat interferentie in QS geen invloed heeft op de groei, daartegenover werd er door in vivo experimenten aangetoond dat de groei wel kan worden beïnvloed met resistentie tot gevolg. [42,43] Vermits de interactie tussen pathogenen in een polymicrobiële infectie mogelijks QS-gemedieerd is, kan interferentie in het QS-systeem van 1 pathogeen ook een invloed hebben op andere pathogenen. [42] Over het algemeen zijn er drie methoden om QS te onderbreken (zie Figuur 1.5). [44]
Synthese van het QS-signaal
Een eerste methode is de verstoring van de biosynthese van PAI-moleculen. De synthases, LasI, RhlI en PqsABCDE, staan in voor de ontwikkeling van deze signaalmoleculen. [9] Inhibitie van de signaalproductie gebeurt via substraatanalogen of transitie toestand analogen. Deze tactiek biedt enkele voordelen zoals de inhibitie van specifieke enzymen die uitsluitend in het pathogeen en niet in de mens voorkomen, en de mogelijkheid om de productie van meer dan één PAI te beïnvloeden. [42] Daar de synthases zich intracellulair bevinden, zijn er ook enkele uitdagingen. Eerst moet de inhibitor het dubbele membraan overwinnen en eens in de bacterie kan het door effluxpompen naar buiten worden gewerkt. Het is belangrijk dat de inhibitor geen enzymen blokkeert die betrokken zijn in cruciale metabolische processen omdat dit leidt tot een daling van de leefbaarheid van P. aeruginosa. [42]
Een voorbeeld zijn de sulfonyladenosineverbindingen MAS en AMSN die anthranilyl-CoA ligase inhiberen. Deze moleculen inhiberen het enzym dat instaat voor de productie van PQS en zijn precursor HHQ door het anthranilyl-AMP intermediair na te bootsen. Dit leidt tot een daling van de PQS-productie en elastase-activiteit. [42]
15
Transmissie van het QS-signaal
Een tweede aanpak is de onderbreking van de signaaltransmissie. Quenching van QS treedt op door enzymen die PAI degraderen. [9] Aangezien de autoinducers worden aangevallen na secretie, worden problemen i.v.m. bereikbaarheid vermeden. De AHL-moleculen worden afgebroken door AHL-lactonase en AHL-acylase. Deze enzymen vernietigen respectievelijk de esterbinding via hydrolyse en de amidebinding tussen de staart en ring via hydrolyse. Het AHL-oxidoreductase modificeert de acylstaart. Een voorbeeld is het lactonase SsoPox-W263I dat in een acuut P. aeruginosa pneumonie ratmodel een verlaagde mortaliteit en longschade teweegbracht. [42] Ook vormen anti-QS-signaal antilichamen een mogelijke strategie. Antilichamen vertonen een laag off-target effect, maar de kleine autoinducers zijn slechte antigenen waardoor de ontwikkeling van antilichamen een uitdaging vormt. [42] Als laatste zijn synthetische polymeren in staat de QS-signaalmoleculen te binden. Er werd aangetoond dat 2-hydroxyethylmethacrylaat gebaseerde molecular imprinted polymer de biofilmontwikkeling van P. aeruginosa onderdrukt. [42]
Detectie van het QS-signaal
De derde strategie is het beïnvloeden van de signaalreceptoren, LasR, RhlR en PqsR. Inhibitoren van deze receptoren werden ontwikkeld door de natuurlijke agonist te modificeren of door bibliotheken met verschillende componenten te screenen. Er werd reeds veel onderzoek verricht naar inhibitoren die LasR en RhlR blokkeren aangezien deze een cruciale rol hebben in de biofilmontwikkeling en de regulatie van virulentiefactoren. [9]
Antagonisten van de AHL-receptoren bestaan dikwijls uit een homoserinelactone-hoofd en een lineaire N-acyl-staart die worden gederivatiseerd. Vaak leidt het vervangen van het homoserinelactone-hoofd door een
Figuur 1.5: QS-inhibitie bestaat uit de inhibitie van de biosynthese van autoinducers, de inhibitie of afbraak van autoinducers en de inhibitie van signaaldetectie. [44]
16
aromatische ring tot een antagonist. [9] Antagonisten beïnvloeden op verschillende manieren het signaal bv. door het blokkeren van de bindingsplaats, door het destabiliseren van de receptor en door het verhinderen van dimerisatie van de receptor, DNA-binding of interactie met RNA-polymerase. Productie van deze inhibitoren gaat gepaard met enkele uitdagingen waaronder de stabiliteit van de molecule en effluxpompen. [42]
Er zijn zowel natuurlijke als synthetische moleculen die de QS-signaaltransmissie blokkeren. Knoflook is een natuurlijke component die de eigenschap heeft om QS-gereguleerde genexpressie in P. aeruginosa te inhiberen. Deze natuurlijke QSI blokkeert de QS-receptoren direct en verzwakt zo de bacteriële virulentie. [45] Daarnaast werd in een chronisch longinfectie muismodel vastgesteld dat knoflook de mortaliteit doet dalen [46] en de bacteriële klaring doet stijgen. [39] Furanones lijken structureel goed op AHL aangezien ze beiden een ring en C-keten bevatten. [47] Hierdoor treden de furanones in competitie met de binding van de autoinducers aan de AHL-receptor. Furanones zijn in staat de productie van virulentiefactoren en biofilms te verminderen. [48] 1.2.2.2. C-di-GMP als doelwit
C-di-GMP is verantwoordelijk voor de overgang tussen de planktonische en biofilm levensstijl, daar een hoge concentratie voortbeweging van het pathogeen inhibeert. [9] In de ontwikkeling van een biofilm heeft QS een rol in de vorming van een mature biofilm, terwijl c-di-GMP belangrijk is voor de initiële aanhechting en de overgang naar een sessiele, vastzittende levensstijl. [9] Daarnaast is c-di-GMP ook essentieel voor virulentie en andere functies van pathogenen. [9] Het c-di-GMP level in P. aeruginosa wordt geregeld door fosfodiësterase en diguanylaatcyclase, 2 enzymen die instaan voor resp. de afbraak en synthese van c-di-GMP. Overexpressie van het fosfodiësterase leidt tot een daling van de hoeveelheid c-di-GMP en een dispersie van de biofilm, en vormt zo een ideale target. Een andere target is het diguanylaatcyclase dat kan worden geblokkeerd t.h.v. zijn I-site door de covalente binding van ebselen en ebselenoxide, waardoor de biofilmontwikkeling vermindert. [9] 1.2.3. Virulence attenuating combination therapy (VACT)
Naast de mogelijkheid om bovenstaande componenten te gebruiken als een enkelvoudige therapie, bieden deze ook potentieel om gecombineerd te worden met reeds bestaande geneesmiddelen. Deze strategie, VACT, streeft naar een verbeterde bacteriële klaring, het gebruik van achterhaalde antibiotica, die niet meer klinisch worden gebruikt, bij een lage dosis en het vermijden van resistentie. Er werd aangetoond dat de synergistische combinatie van virulentie-inhibitoren (die P. aeruginosa ontwapenen) met antibiotica (die P. aeruginosa afdoden) de antipseudomonas activiteit verbetert. [16]
Een monotherapie van antibiotica bij CF-patiënten faalt vaak in het bereiken van een volledige bacteriële klaring [16], omwille van de eerder aangehaalde resistentie- en tolerantiemechanismen. VACT vormt een veelbelovende behandeling tegen P. aeruginosa. [16] Bijvoorbeeld, de combinatie van linoleenzuur en
17
tobramycine resulteert in de synergistische vermindering van de biofilmontwikkeling en de productie van virulentiefactoren. [16] Samen interfereren ze met de drie QS-systemen en wordt de alginaatproductie onderbroken, wat een belangrijke eigenschap tijdens de behandeling van chronische infecties. Ook vermindert deze combinatie de toxiciteit van tobramycine omdat er slechts een lage concentratie van dit antibioticum nodig is. [16]
1.2.4. Antivirulentie strategieën gebaseerd op het gebruik van bacteriën
Veel onderzoeksgroepen hebben bacteriën bestudeerd naar hun capaciteit om antivirulentie eigenschappen uit te oefenen. Er werden reeds talrijke studies verricht naar omgevingsbacteriën als potentiële quorum quenching bacteriën aangezien deze bacteriën in dezelfde niche als P. aeruginosa overleven en ermee in competitie treden. [49] Een voorbeeld is de Staphylococcus intermedius groep die yayurea A en B, 2 componenten die QS-expressie onderdrukken, produceert. Deze componenten voorkomen de productie van toxines door P. aeruginosa waardoor deze bacteriën met elkaar kunnen samenleven zonder dat S. intermedius leden worden gedood. [50,51]
Muricauda olearia bezit een extracellulaire AHL-lactonase activiteit die zorgt voor de hydrolyse van de esterbinding in de HSL-ring. Dit enzym, Muricauda olearia marine AHL-lactonase (MomL), behoort tot de metallo-β-lactamase superfamilie en breekt korte en lange keten AHL-moleculen af. [52,53] Door de afgenomen AHL hoeveelheid treedt er een daling op van het aantal virulentiefactoren dat wordt geproduceerd. Zo zal het de protease- en pyocyanineproductie door P. aeruginosa inhiberen. Ook beschermt MomL Caenorhabditis elegans tegen het doden door P. aeruginosa. [52,53] Als laatste inhibeert MomL de biofilmvorming van P. aeruginosa. [52] Verder produceren Pectobacterium atrosepticum en Agrobacterium tumefaciens, twee Gram-negatieve pathogene plantbacteriën, penicilline V acylases. Dit enzym breekt N-acyl-homoserinelactones geproduceerd door P. aeruginosa af en verlaagt hierdoor de productie van elastase, pyocyanine en biofilms. [54] Aangezien dit enzym de virulentie van P. aeruginosa vermindert, kan het worden ingezet als potentiële behandeling bij infecties van CF-patiënten. [54]
Een veelbelovende aanpak voor de behandeling van longinfecties is het gebruik van leden uit het longmicrobioom als antivirulentie strategie. De laatste jaren is er steeds meer interesse in de ontwikkeling van microbioomleden als probiotica specifiek voor de longen. Echter werd slechts in beperkte mate bestudeerd of bacteriën uit het longmicrobioom antivirulentie eigenschappen bevatten. Voor een aantal bacteriën werd reeds aangetoond dat ze beschikken over de capaciteit om te interfereren met de virulentie van pathogenen of inflammatie geïnduceerd door de pathogenen (zie deel 1.3.).
18
Het antivirulentie potentieel van probiotica
Probiotica zijn gezondheidsbevorderende, levende bacteriën die voornamelijk worden geïsoleerd uit de stoelgang, maar ook worden getest om te kunnen gebruiken in andere delen van het lichaam bv. de longen. [55] Aangezien probiotica zorgen voor het herstel van de diversiteit in het darmmicrobioom, wat bijdraagt tot de kolonisatieresistentie tegen verschillende pathogenen [56], wordt bestudeerd of gelijkaardige bevindingen mogelijk zijn voor het longmicrobioom. [57] Op basis van het principe van kolonisatieresistentie zouden beschikbare nutriënten worden geconsumeerd door het diverse microbioom en hierbij zorgen dat P. aeruginosa niet de nodige energiebron ter beschikking heeft om de longen te koloniseren. [58,59] Via antibacteriële, antiadhesie en anti-QS componenten kunnen probiotica op een directe wijze pathogenen tegenwerken. Ook helpen probiotica op een indirecte wijze in de verdediging tegen pathogenen via een verbetering van de barrièrefunctie van het epitheel. Oraal ingenomen probiotica kunnen pneumonie op intensieve zorgen en exacerbaties bij CF-patiënten voorkomen door hun immunomodulatoire activiteit in de darm-long as. [60]
Dikwijls beschreven probiotica zijn Lactobacillus sp. uit de darm die verschillende antagonistische componenten secreteren, zoals exopolysachariden, bacteriocines, ROS en biosurfactanten. [57] Lactobacillus fermentum is in staat P. aeruginosa te doden of te inhiberen en de biofilmontwikkeling tegen te werken door de productie van drie belangrijke organische zuren nl. lactaatzuur, azijnzuur en mierenzuur. [30,61] Daarnaast verminderen Lactobacillus isolaten de productie van pyocyanine en rhamnolipiden, en de elastase-activiteit van P. aeruginosa. [60] Lactobacillus sp. vertonen een protectief effect op de A549 cellen wanneer ze voor een P. aeruginosa PAO1 infectie worden toegediend. [60–62] Ook wordt de AHL-productie geïnhibeerd door Lactobacillus plantarum, waardoor er een daling in virulentie optreedt. [61] Bovendien werd in een studie van CF-patiënten opgemerkt dat er bij 61% van alle patiënten minstens 1 Lactobacillus stam in het sputum aanwezig was. [63] Als gevolg van deze bevindingen kunnen Lactobacillus sp. mogelijks worden ingezet als een veilig en natuurlijk alternatief voor antibiotica, als een probioticum, in de behandeling van respiratoire infecties.
Daarnaast gaan er ook enkele moeilijkheden gepaard met de productie van probiotica voor de longen. Zo moet de leefbaarheid en de stabiliteit tijdens het productieproces en de opslag gegarandeerd kunnen blijven. Daarnaast is het risico groot dat resistentiegenen worden overgedragen van probiotica naar andere bacteriën. Het is belangrijk om het genoom te beoordelen op overdraagbare en niet-overdraagbare resistentiegenen. [57] Vaak worden bacteriële soorten geïsoleerd uit de stoelgang met als doel een potentieel probioticum te vormen dat werkt in de longen. [55] Eenzelfde stam kan in een andere omgeving verschillend reageren, waardoor het belangrijk is om potentiële probiotica stammen te screenen op de specifieke infectieplaats. [57] Ook produceren Lactobacillus sp. lactaatzuur dat de pH sterk doet dalen en nadelige effecten kan uitoefenen op de longen. Het
19
lijkt plausibel dat leden van het longmicrobioom die geassocieerd zijn met positieve gezondheidseffecten effectiever zijn als potentieel probioticum omwille van de bovenstaande argumenten. Ook kunnen ze in theorie de longen efficiënter koloniseren. [55]
1.3. LONGMICROBIOOM
1.3.1. Het longmicrobioom in gezondheid en in ziekte
Het microbioom bevat al het genetisch materiaal van micro-organismen, nl. pathogenen en commensalen, in een bepaalde omgeving. [58] Het microbioom beschermt ons tegen infecties door het uitoefenen van kolonisatieresistentie op een directe manier, bv. nutriënt depletie, en een indirecte manier, bv. instandhouding van het epitheel. [56] Een ontregeling van deze georganiseerde structuur leidt tot kolonisatie en infectie van mucosa door opportunistische pathogenen, auto-immuniteit, obesitas, cardiovasculaire ziekten en tumoren. [64] Vroeger werden de lage luchtwegen als steriel beschouwd. Deze veronderstelling werd recent verworpen door nieuwe cultuur-onafhankelijke technieken die aantoonden dat er een diversiteit aan micro-organismen aanwezig is in zowel zieke als gezonde longen. [58,64]
De longen van een foetus worden beschouwd als steriel. Vanaf de geboorte worden de longen gekoloniseerd door een waaier aan bacteriën en evolueert het longmicrobioom naar een evenwicht. [58,64] De ontwikkeling van het longmicrobioom wordt beïnvloed door omgevingsfactoren, de geboorteroute en borstvoeding. [65] In de longen kunnen slechts een beperkte hoeveelheid bacteriën worden teruggevonden, nl. 102 bacteriën per mL bronchoalveolaire lavage. [58] Het respiratoir microbioom is een heterogeen ecosysteem
met een continue variatie aan micro-organismen. Microaspiratie en directe mucosale verspreiding zorgen voor de aanvoer van bacteriën uit de bovenste luchtwegen naar de lage luchtwegen. Daarentegen zorgen ciliair transport en hoest voor de overdracht van bacteriën uit de lage luchtwegen naar de bovenste luchtwegen. [58,59,64,66] De invloed van de directe inademing van omgevingslucht op het longmicrobioom is onbekend. Gastro-oesofagale reflux kan zorgen voor de overdracht van gastro-intestinale microbiota naar de longen, maar deze bijdrage is verwaarloosbaar. [58]
Een gezonde homeostase is geassocieerd met een grote bacteriële diversiteit. [59] In het algemeen kunnen we stellen dat een gezonde long bestaat uit bacteriën die afkomstig zijn uit de bovenste luchtwegen en slechts tijdelijk aanwezig blijven. Daarentegen vertonen de longen tijdens chronische respiratoire ziekten een permanent gevestigd microbioom. [58] In de longen van een gezonde volwassene worden de fyla Bacteroides, Firmicutes en Proteobacteria waargenomen. Prevotella, Veillonella, Streptococcus en Pseudomonas zijn de voornaamste geslachten. [58,64] Opvallend is de bacterie Tropheryma whipplei die zich enkel bevindt in de lage luchtwegen en dus niet wordt verkregen door verspreiding uit de bovenste luchtwegen. [58]
20
Bij een acute infectie wordt een opportunistisch pathogeen vaak vanuit de bovenste luchtwegen gerekruteerd naar de lage luchtwegen. Wanneer de onderdrukking door commensalen wegvalt, heeft het pathogeen de kans om de bovenste luchtwegen te koloniseren. Dit pathogeen kan zich snel verspreiden en uitbreiden naar een systemische infectie indien het niet verwijderd wordt door het lichaam. [67] Patiënten die een longtransplantatie hebben ondergaan, vertonen een gedaalde diversiteit in het longmicrobioom en vaak 1 bacterie die abundant aanwezig is bv. P. aeruginosa of Staphylococcus aureus. Ook bij patiënten die mechanisch worden geventileerd, treft men na de behandeling met breedspectrum antibiotica vaak een dominante P. aeruginosa aan. [64]
Bij chronische infecties ontstaat een polymicrobiële longinfectie door een onderliggend probleem in het immuunsysteem. [67] Een progressieve luchtwegobstructie en periodieke luchtweginfecties zijn belangrijke doodsoorzaken voor CF-patiënten. De luchtwegen van een CF-patiënt zijn voornamelijk gekoloniseerd door S. aureus, Haemophilus influenzae en P. aeruginosa. Daarnaast zijn ze gevoelig aan Stenotrophomonas maltophilia en Burkholderia cenocepacia, 2 zeldzame luchtwegpathogenen. [64,66,68] Ook worden Prevotella, Streptococcus, Rothia, Actinomyces en Veillonella waargenomen in CF-patiënten. Tijdens de eerste 10 levensjaren worden vooral S. aureus en H. influenza geïsoleerd uit het sputum, daarna domineert voornamelijk P. aeruginosa de longen. [68] De diversiteit van het longmicrobioom daalt met de leeftijd en ernst van de luchtwegobstructie. [64,66]
Er werden reeds verschillende studies uitgevoerd naar het longmicrobioom bij COPD-patiënten, een ziekte die deels wordt veroorzaakt door inflammatie secundair aan een chronische luchtweginfectie. Een onderzoek bemerkte een gestegen hoeveelheid Proteobacteria en een gedaalde hoeveelheid Bacteroides. Daarnaast werden vooral Pseudomonas, Streptococcus, Prevotella en Haemophilus stammen aangetroffen in COPD-patiënten. [64] Opmerkelijk, bij ernstige luchtwegobstructies, een zware vorm van COPD, vond men een gedaalde microbiële diversiteit. [59,64]
1.3.2. Invloed van leden van het longmicrobioom op de groei en virulentie van P. aeruginosa
De meeste infecties zijn polymicrobieel, slechts zeer uitzonderlijk leven bacteriën alleen. Bacteriën communiceren met elkaar via kleine moleculen bv. autoinducers van een QS-systeem, en direct cel-cel contact bv. het type VI secretie systeem. [69] Hierdoor kunnen ze elkaars aanwezigheid registreren en erop reageren. Enerzijds kunnen interacties leiden tot een stijging van de virulentie en een blijvende aanwezigheid van het pathogeen. [70] Daarnaast kunnen commensalen helpen in de verdediging tegen pathogenen. Deze bacteriën voorkomen kolonisatie van P. aeruginosa door de protectieve respons van het immuunsysteem te stimuleren. [61] Vaak ontstaat er ook competitie omwille van een beperkte hoeveelheid nutriënten. [70]
21
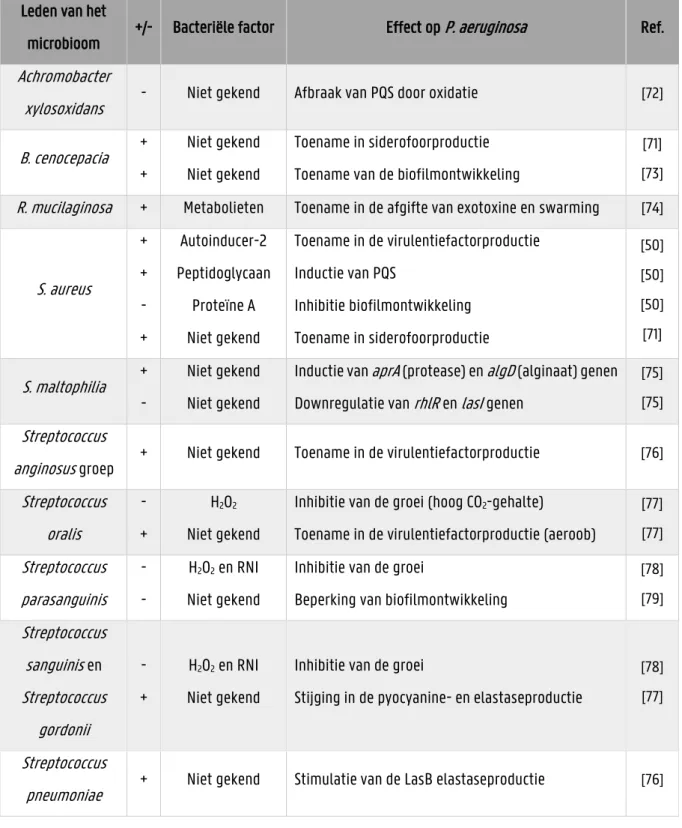
Er zijn reeds veel interacties beschreven tussen P. aeruginosa en andere pathogenen van het longmicrobioom waarbij er een toename is van de virulentie van P. aeruginosa. [71] Echter willen we interacties tussen het longmicrobioom en P. aeruginosa vinden die leiden tot een daling in virulentie. In Tabel 1.3 wordt een overzicht gegeven van de interacties tussen P. aeruginosa en het longmicrobioom.
Tabel 1.3: Interacties tussen P. aeruginosa en andere leden van het longmicrobioom die leiden tot een stijging (+) of daling (-) van de virulentie, met vermelding van de bacteriële factor oorzakelijk voor het effect. Leden van het
microbioom +/- Bacteriële factor Effect op P. aeruginosa Ref. Achromobacter
xylosoxidans - Niet gekend Afbraak van PQS door oxidatie [72] B. cenocepacia +
+
Niet gekend Niet gekend
Toename in siderofoorproductie Toename van de biofilmontwikkeling
[71] [73] R. mucilaginosa + Metabolieten Toename in de afgifte van exotoxine en swarming [74]
S. aureus + + - + Autoinducer-2 Peptidoglycaan Proteïne A Niet gekend Toename in de virulentiefactorproductie Inductie van PQS Inhibitie biofilmontwikkeling Toename in siderofoorproductie [50] [50] [50] [71] S. maltophilia + - Niet gekend Niet gekend
Inductie van aprA (protease) en algD (alginaat) genen Downregulatie van rhlR en lasI genen
[75] [75] Streptococcus
anginosus groep + Niet gekend Toename in de virulentiefactorproductie [76] Streptococcus oralis - + H2O2 Niet gekend
Inhibitie van de groei (hoog CO2-gehalte)
Toename in de virulentiefactorproductie (aeroob)
[77] [77] Streptococcus parasanguinis - - H2O2 en RNI Niet gekend
Inhibitie van de groei
Beperking van biofilmontwikkeling
[78] [79] Streptococcus sanguinis en Streptococcus gordonii - + H2O2 en RNI Niet gekend
Inhibitie van de groei
Stijging in de pyocyanine- en elastaseproductie
[78] [77]
Streptococcus
22
Interactie met andere pathogenen uit het longmicrobioom
Sommige pathogenen zorgen voor een stijging van de virulentie, andere voor een daling van de virulentie. De competitie tussen P. aeruginosa en S. aureus leidt in het algemeen tot een ernstiger ziekteverloop van CF. [50] Het gesecreteerde autoinducer-2 door S. aureus verhoogt de productie van LasB, elastase, rhamnolipiden, exotoxines, fenazines, biofilms en pyocyanine door P. aeruginosa. [27,50] Daarnaast zorgt de aanwezigheid van N-acetylglucosamine, een onderdeel van het Gram-positieve celwandpolymeer peptidoglycaan, voor een sterkere productie van het PQS signaal. Aangezien PQS de pyocyanine-, elastase- en rhamnolipidenproductie controleert, leidt dit tot een hogere virulentie. [27,50,69–71,79] P. aeruginosa reageert op autoinducer-2 en N-acetylglucosamine van S. aureus door de inductie van virulentiefactoren met als doel zijn concurrent uit de weg te ruimen, maar dit heeft ook een negatief effect op de gastheer. [27,50] Daarentegen kan S. aureus de biofilmontwikkeling van P. aeruginosa inhiberen door binding van het gesecreteerde proteïne A aan Psl en type IV pili. [50]
Een limiet aan nutriënten, bv. ijzer, leidt tot de competitie tussen pathogenen omdat ijzer essentieel is voor de overleving en groei. Zo zal P. aeruginosa de productie van specifieke sideroforen verhogen in aanwezigheid van andere opportunistische pathogenen, S. aureus en B. cenocepacia. [27,71] Daarnaast werd aangetoond dat een interactie met B. cenocepacia de biofilmontwikkeling van P. aeruginosa promoot en leidt tot een sterkere inflammatoire respons in CF-muismodellen. [73,79]
A. xylosoxidans en S. maltophilia zijn 2 opkomende, opportunistische pathogenen die worden aangetroffen in CF-longen. [80] A. xylosoxidans inactiveert het PQS-signaal door oxidatie van verschillende PQS-moleculen. [72] De groei van P. aeruginosa en S. maltophilia in een gemengde biofilm leidt tot een inductie van aprA en algD, genen die coderen voor resp. protease en alginaat, terwijl de QS-genen rhlR en lasI van P. aeruginosa minder tot expressie komen. [75]
Streptococcus sp.
Orale commensale Streptococcus stammen koloniseren samen met P. aeruginosa de longen van CF-patiënten. Er werd aangetoond dat S. parasanguinis, S. sanguinis en S. gordonii de groei van P. aeruginosa inhiberen door de productie van H2O2 in de aanwezigheid van nitriet. Reactieve stikstofhoudende intermediairen
(RNI), bv. peroxynitriet, worden gevormd door de combinatie van nitriet en H2O2. RNI oefenen negatieve effecten
uit op naburige bacteriën door oxidatie of door het plaatsen van NO2 op DNA, lipiden en eiwitten. Ook veroorzaken
deze componenten schade aan celmembranen. [78] Daar deze Streptococcus stammen P. aeruginosa inhiberen, maken ze plaats voor de kolonisatie van andere bacteriën. Hierdoor stijgt de microbiële diversiteit in de longen,
![Tabel 1.1: De meest voorkomende P. aeruginosa infecties met bijhorende risicofactoren [2,3]](https://thumb-eu.123doks.com/thumbv2/5doknet/3284483.21753/12.892.108.791.518.1150/tabel-meest-voorkomende-p-aeruginosa-infecties-bijhorende-risicofactoren.webp)
![Figuur 1.2: Virulentiefactoren van P. aeruginosa [2]](https://thumb-eu.123doks.com/thumbv2/5doknet/3284483.21753/17.892.221.689.791.1148/figuur-virulentiefactoren-van-p-aeruginosa.webp)