Richtlijn Antitrombotisch
beleid
INITIATIEF
Nederlandse Internisten Vereniging
IN SAMENWERKING MET
Nederlands Huisartsen Genootschap Nederlandse Orthopaedische Vereniging
Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose Nederlandse Vereniging van Klinisch Chemici
Nederlandse Vereniging voor Anesthesiologie Nederlandse Vereniging voor Cardiologie Nederlandse Vereniging voor Heelkunde
Nederlandse Vereniging voor Kindergeneeskunde Nederlandse Vereniging voor Klinische Geriatrie Nederlandse Vereniging voor Neurologie
Nederlandse Vereniging voor Obstetrie & Gynaecologie Nederlandse Vereniging voor Radiologie
Vereniging Artsen Laboratoriumdiagnostiek
MET ONDERSTEUNING VAN
Kennisinstituut van Medisch Specialisten
FINANCIERING
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Colofon
RICHTLIJN ANTITROMBOTISCH BELEID ©2015
Nederlandse Internisten Vereniging Mercatorlaan 1200, 3528 BL UTRECHT 030 28 23 229
secr@niv.knmg.nl www.internisten.nl
Alle rechten voorbehouden.
De tekst uit deze publicatie mag worden verveelvoudigd, opgeslagen in een geautomatiseerd gegevensbestand, of openbaar gemaakt in enige vorm of op enige wijze, hetzij elektronisch, mechanisch door fotokopieën of enige andere manier, echter uitsluitend na voorafgaande toestemming van de uitgever. Toestemming voor gebruik van tekst(gedeelten) kunt u schriftelijk of per e-mail en uitsluitend bij de uitgever aanvragen. Adres en e-mailadres: zie boven.
Inhoudsopgave
Samenstelling van de werkgroep ... 6
Hoofdstuk 1 Inleiding ... 7
Hoofdstuk 2 Verantwoording ... 10
Hoofdstuk 3 Preventie VTE ... 17
3.3.1 Tromboseprofylaxe bij grote orthopedische en traumatologische ingrepen 17 3.1.1 Start tromboseprofylaxe bij grote orthopedische en traumatologische ingrepen 18 3.1.2 Keuze en duur van tromboseprofylaxe bij grote orthopedische en traumatologische ingrepen... 21
3.2 Preventie bij trauma ... 59
3.3 Preventie bij electieve rugchirurgie ... 63
3.4 Tromboseprofylaxe bij arthroscopische ingrepen rondom het kniegewricht ... 67
3.5 Preventie bij gipsen en onderste extremiteit letsel ... 71
3.6 Hormonale anticonceptie en veneuze trombo-embolie ... 74
3.6.1 Risico op veneuze trombo-embolie bij pilgebruik in de algemene bevolking 74 3.6.2 Risico op veneuze tromboembolie bij pilgebruik door vrouwen met een verhoogd risico op VTE (trombofilie en/of positieve familieanamnese)... 78
3.6.3 Vrouwen met voorgeschiedenis met VTE ... 83
3.7 Hormonale suppletie therapie en veneuze tromboembolie... 84
3.8 Veneuze tromboseprofylaxe bij niet-chirurgische patiënten ... 88
3.9 Preventie VTE bij chirurgische patiënten (inclusief gynaecologische chirurgie, exclusief orthopaedische chirurgie en neurochirurgie) ... 106
3.10 Tromboseprofylaxe bij patiënten met een acute beroerte (herseninfarct/ hersenbloeding) ... 115
Hoofdstuk 4 Preventie van veneuze trombo-embolie (VTE) in de verloskunde ... 118
4.1 Veneuze trombo-embolie in de zwangerschap en postpartum periode ... 118
4.2 Vrouwen na een sectio caesarea ... 127
4.3 Keuze anticoagulantia tijdens zwangerschap... 130
4.4 Wat is het beste beleid bij zwangere vrouwen die buiten de zwangerschap antistolling gebruiken? ... 133
4.5 Welke specifieke maatregelen zijn nodig bij de bevalling bij gebruik van anticoagulantia? ... 135
4.6 Welke anticoagulantia zijn geschikt voor vrouwen die borstvoeding geven? . 137 4.7 Trombofilie en zwangerschapscomplicaties ... 139
4.8 Preventie veneuze trombo-embolie bij fertiliteitsbevorderende behandelingen (IVF) 142 Hoofdstuk 5 Preventie van trombose bij neonaten en kinderen tot 18 jaar ... 143
5.1 Neonaten met een centraal veneuze catheter ... 145
5.2 Kinderen > 1 maand met een centraal veneuze katheter ... 147
5.3 Specifieke risicogroepen... 148
5.3.1 Kinderen met een centraal veneuze katheter en langdurige parenterale voeding (TPV) ... 148
5.3.2 Kinderen met een maligniteit ... 150
5.3.5 Kinderen met een nefrologische aandoening... 155
5.3.6 Overige kinderen met een verhoogd risico op trombose ... 156
Bijlage 5.1 Stroomdiagram ... 159
Hoofdstuk 6 Therapie VTE ... 171
6.1 Initiële behandeling Veneuze Trombo-Embolie (VTE) ... 171
Aanbevelingen ... 182
6.2 Trombolyse bij behandeling DVT been en arm ... 189
6.2.1 Katheter geleide trombolyse bij de behandeling DVT van het been ... 189
6.2.2 Trombolyse bij de behandeling DVT van de arm ... 195
6.3 Thuisbehandeling longembolie ... 208
6.4 Thuisbehandeling bij DVT ... 214
6.5 Continueren antistolling ... 217
6.6 Behandeling oppervlakkige tromboflebitis (SVT) ... 232
6.7 Behandeling diepe kuit(spier)venetrombose ... 244
6.8 Behandeling katheter gerelateerde trombose ... 247
6.9 Behandeling van bij toeval gevonden diepe veneuze trombose of longembolie 249 Hoofdstuk 7 Kleppen en antistolling... 254
7.1 Mechanische hartklepprothesen ... 254
7.2 Nieuwe orale antistollingsmiddelen en kunstkleppen ... 257
7.3 Biologische hartklepprothesen ... 258
7.3.1 Antistolling tijdens de eerste drie maanden na biologische mitralisklepimplantatie en mitralisklepreconstructie ... 258
7.3.2 Antistolling de eerste drie maanden na biologische aortaklep implantatie 259 7.3.3 Lange termijn (vanaf drie maanden na implantatie bioprothese) antitrombotische behandeling bij biologische hartklepprothese ... 259
7.4 Antitrombotische therapie bij overige hartklepafwijkingen ... 260
7.4.1 Reumatisch mitraalklepstenose ... 260
7.4.2 Antitrombotisch beleid bij mitraalklepprolaps ... 261
7.4.3 Antitrombotisch beleid bij aortaklep- en boogafwijkingen ... 262
7.4.4 Antitrombotisch beleid bij endocarditis ... 263
7.4.5 Antitrombotisch beleid bij percutane aortaklepvervanging of percutane sluiting mitraalklep (mitraclip) ... 264
7.4.6 Antistolling bij kunstkleppen tijdens de zwangerschap... 265
Hoofdstuk 8 Perioperatief beleid ... 272
8.1 Perioperatief beleid bij patiënten die worden behandeld met vitamine K antagonisten ... 276
8.2 Perioperatief beleid bij patiënten die worden behandeld met DOACs ... 285
8.3 Perioperatief beleid bij patiënten die trombocytenaggregatieremmers gebruiken ... 292
8.3.1 Wel of niet stoppen? ... 293
8.3.2 Wanneer staken “dual antiplatelet therapy” (DAPT)? ... 294
8.3.3 Wanneer herstarten van trombocytenaggregatieremmers? ... 296
Hoofdstuk 9 Strategie in geval van bloeding of ingrepen ... 299
9.1 Farmacologische strategie voor couperen in geval van bloeding/ingreep bij VKA 299 9.2 Farmacologische strategie voor couperen in geval van bloeding/ingreep bij LMWH/ongefractioneerde heparine ... 309
9.3 Farmacologische strategie voor couperen in geval van bloeding/ingreep bij DOACs 311
9.4 Farmacologische strategie voor couperen in geval van bloeding bij
trombocytenaggregatieremmers ... 314
9.5 Herstarten antistollingstherapie ... 318
Hoofdstuk 10 Laboratoriumtesten bij antistollingsmiddelen ... 347
10.1 Meten effecten acenocoumarol en fenprocoumon ... 349
10.2 Meten effect van LMWH , pentasaccharide of heparinoïde ... 350
10.3 Meten van het effect van ongefractioneerde heparine ... 352
10.4 Meten fondaparinux ... 353
10.5 Meten effect bivalirudine ... 354
10.8 Meten effect rivaroxaban ... 360
10.9 Meten effect apixaban ... 363
10.10 Meten effect edoxaban ... 365
10.11 Meten effect COX-1-remmers (COX-1) ... 367
Aanbeveling ... 368
10.12 Meten effect P2Y12-remmers (clopidogrel, prasugrel en ticagrelor) ... 369
Bijlage 1 Tabel profylactische en therapeutische doseringen anticoagulantia. ... 347
Bijlage 2 Verslag invitational conference ... 372
Bijlage 3 Afkortingen en begrippenlijst ... 376
Bijlage 4 Belangenverklaringen ... 378
Samenstelling van de werkgroep
prof. dr. M.V. Huisman, internist-vasculaire geneeskunde, LUMC (voorzitter), NIV dr. R. Bakx, kinderchirurg, Emma Kinderziekenhuis AMC & VU, NVK
dr. M. Coppens, internist-vasculaire geneeskunde, AMC, NIV dr. E.J. van Dijk, neuroloog, Radboudumc, NVN
dr. E.A. Dubois, cardioloog, Erasmus MC, NVVC dr. L. van Erven, cardioloog, LUMC, NVVC dr. H. Ettema, orthopedisch chirurg, Isala, NOV
dr. R. A. Faaij, klinisch geriater, Diakonessenhuis, NVKG dr. J.P. Frölke, traumachirurg, Radboudumc, NVVH dr. ir. Y.M.C. Henskens, klinisch chemicus, MUMC, NVKC
prof. dr. P.W. Kamphuisen, internist-vasculaire geneeskunde, UMCG, NIV prof. dr. F.W.G. Leebeek, internist-hematoloog, Erasmus MC, NIV
dr. J.J.C.M. van de Leur, arts klinische chemie, Isala Klinieken, VAL dr. W. A. M. Lucassen, huisarts, NHG
dr. M. Kruip, internist-hematoloog, Erasmus MC, NIV dr. K. Meijer, internist-hematoloog, UMCG, NIV
prof. dr. S. Middeldorp, internist-vasculaire geneeskunde, AMC, NIV dr. C.H. van Ommen, kinderarts, Erasmus MC, NVK
dr. M. van Pampus, gynaecoloog, OLVG, NVOG
prof. dr. J.A. Reekers, interventie radioloog, AMC/UVA, NVvR dr. S. Renes, anesthesioloog, Radboudumc, NVA
drs. R.J. Snijder, longarts, St. Antoniusziekenhuis, NVALT dr. A.K. Stroobants, klinisch chemicus, AMC/UVA, NVKC drs. M.C. Struijk-Mulder, orthopeed, tot 1 februari 2014, NOV dr. R. Vink, internist-intensivist, Tergooiziekenhuis, NIV dr. A. Wiersema, vaatchirurg, Westfriesgasthuis, NVVH dr. E. Wildschut, kinderintensivist, Erasmus MC, NVK Met ondersteuning van:
Drs. E. E. Volmeijer, junior adviseur, Kennisinstituut van Medisch Specialisten Ir. T. A. van Barneveld, directeur, Kennisinstituut van Medisch Specialisten dr. B.H. Stegeman, adviseur, Kennisinstituut van Medische Specialisten
Hoofdstuk 1 Inleiding
Aanleiding voor het maken van de richtlijn
Meer dan 1 miljoen mensen in Nederland gebruiken enige vorm van antistolling ter preventie en/of behandeling van een trombotische aandoening. Operaties en andere ingrepen bij deze patiënten komen veel voor. Vele specialismen zijn hierbij betrokken. Momenteel is er geen uniformiteit in het gevoerde beleid en daarmee sprake van aanzienlijke praktijkvariatie.
Omdat vrijwel elke klinische werkende arts te maken krijgt met antitrombotische therapie is het van verstrekkend belang dat er een richtlijn Antitrombotische beleid is. Een multidisciplinaire richtlijn is onontbeerlijk voor de patiënt die met deze therapie soms meer specialismen bezoekt. De laatste herziening van de richtlijn heeft in 2008 plaatsgevonden, deze was gebaseerd op de 7e editie van de Noord-Amerikaanse richtlijn ‘Antithrombotic Therapy’ van de American College of Chest Physicians (ACCP). Intussen zijn van deze ACCP richtlijn twee herzieningen (juni 2008 en februari 2012) verschenen. Naast het herzien van de huidige richtlijn is gebleken dat bij interventieartsen (cardiologen, interventieradiologen, etc.) en snijdende specialisten behoefte is aan een duidelijke richtlijn ‘perioperatief gebruik van antistollingsmedicatie’. Dit ontbreekt ten dele in de richtlijn uit 2008. Bij herziening van de richtlijn wordt daarom aandacht besteed aan het antistollingsbeleid rondom operaties en ingrepen. Dit sluit goed aan bij de landelijke standaard ketenzorg antistolling (LSKA) die op gezag van het Ministerie van VWS is gemaakt.
Een tweede aandachtspunt heeft betrekking op de belangrijke ontwikkeling betreffende de introductie van de directe orale antistollingsmiddelen (DOACs) in Nederland. Deze introductie heeft impact op de antistollingsbehandeling van grote groepen patiënten (onder andere patiënten met atriumfibrilleren, patienten met acute veneuze tromboembolie en patiënten die grote orthopedische ingrepen ondergaan). Het is essentieel dat de praktische implicaties (onder andere veiligheidsaspecten); van de invoering van deze nieuwe middelen opgenomen zijn in de herziene richtlijn. Er wordt ook verwezen naar de richtlijn neuraxisblokkade en antistolling (NVA, 2014)
Aanvullend zijn een viertal knelpunten ter hand genomen: kindertrombose, preventie van veneuze tromboembolie, antistollingsbeleid rond hartkunstkleppen en laboratoriumtesten rond antistollingsbehandeling.
In deze richtlijn zijn de therapeutische ranges van de INR gelijkgesteld aan de ranges die in internationale richtlijnen (ACCP 2012, ACC 2014 en ESC 2014) worden gehanteerd. Voor de routine patiëntenzorg maar ook voor wetenschappelijk onderzoek is het van groot belang dat in Nederland hetzelfde beleid wordt gevoerd als in het buitenland. De therapeutische ranges van de INR zijn nu conform internationale richtlijnen voor de lage intensiteit 2,0 tot 3,0 en voor de hoge intensiteit 2,5 tot 3,5.
In de vorige CBO richtlijn 2008 werd naast de therapeutische ranges van de INR (2,5 tot 3,5 en 3,0 tot 4,0) ook een streefgebied aangegeven (2,0 tot 3,5 en 2,5 tot 4,0). Deze
ingevoerd om te vermijden dat de INR-waarde onder de therapeutische range zou komen te liggen. Zowel de therapeutische range als ook het gebruik van een streefgebied week daarmee af van internationale richtlijnen. Deze incongruentie is met de huidige richtlijn komen te vervallen.
Doel van de richtlijn
Het doel is de multidisciplinaire nationale richtlijn Antitrombotisch beleid te herzien, waarbij er een duidelijke invulling komt van de gesignaleerde klinische knelpunten. Als voorbeeld wordt de hiaat met betrekking tot het beleid van perioperatief gebruik van antistolling herzien en wordt aandacht gegeven aan de introductie van DOACs.
Afbakening van de richtlijn
Meer dan 1 miljoen mensen in Nederland gebruiken enige vorm van antistolling ter preventie en/of behandeling van een trombotische aandoening. Operatieve ingrepen komen bij deze patiëntengroep frequent voor. Daarnaast is er een grote groep patiënten de vanwege de aard van de ingreep, bijvoorbeeld grote orthopedische ingrepen, (enige tijd) antistolling moet gebruiken.
Met de huidige opzet is gekozen voor grondige revisie van de meest prangende klinische knelpunten. Deze punten zijn na discussie binnen de multidisciplinaire herzieningscommissie vastgesteld.
Andere onderdelen van de richtlijn uit 2008 worden wel in de nieuwe richtlijn benoemd maar zijn niet onderworpen aan revisie. Bij deze onderdelen wordt verwezen naar de meest recente – buitenlandse – richtlijnen zodat de Nederlandse arts de laatste informatie ter beschikking heeft.
De grootste groep patiënten gebruikt de bloedplaatjesremmer acetylsalicylzuur, soms in combinatie met andere bloedplaatjesremmers of antistolling. Naar schatting 400.000 patiënten gebruiken orale anticoagulantia die ingrijpen op de aanmaak van vitamine K afhankelijke stollingsfactoren, veelal acenocoumarol of fenprocoumon. De dosering van deze medicatie wordt door de Trombosediensten in Nederland gereguleerd aan de hand van de INR (International Normalized Ratio). Daarnaast zijn er de DOACs, waarvan een vaste dosering wordt genomen en waarvan het effect niet hoeft te worden gecontroleerd. Deze middelen worden voor de indicatie preventie trombose bij heup- en knievervanging, preventie herseninfarct bij niet valvulair atriumfibrilleren en behandeling van diepe veneuze trombose en longembolie gezien als goede vervangers van de nu gangbare orale anticoagulantia die ingrijpen op de aanmaak van vitamine K afhankelijke stollingsfactoren.
Beoogde gebruikers van de richtlijn
Deze richtlijn is geschreven voor patiënten, trombosediensten, en alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met antitrombotische therapie.
Literatuur
Antithrombotic Therapy and Prevention of Thrombosis, 9th Ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines.
Werkgroep LSKA. Landelijke Standaard Ketenzorg Antistolling voor de eerste- en tweedelijnszorg. 2014.
Werkgroep NOACs van de wetenschappelijke verenigingen en Orde van Medisch Specialisten. Leidraad begeleide introductie nieuwe orale antistollingsmiddelen. 2012.
ESC Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC), Konstantinides SV, Torbicki A, et al. ESC Guidelines on the diagnosis and management of acute pulmonary embolism: The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) Endorsed by the European Respiratory Society (ERS). Eur Heart J, 2014.
Hoofdstuk 2 Verantwoording
Geldigheid
Deze richtlijn is modulair herzien. Een aantal modules dienen binnen de tijdstermijn van 5 jaar herzien te worden. De NIV is daarom voornemens een deel van de werkgroep in stand te houden. Een nader uitgewerkt onderhoudsplan wordt tijdens de commentaarronde ter consultatie voorgelegd aan de NIV commissie richtlijnen en kwaliteitsmeting.
De NIV is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kims.orde.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2013 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met antitrombotisch beleid te maken hebben (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte van september 2013 tot december 2015 aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn aan het begin van het traject ingevuld en getekend, en besproken in de werkgroep en met de Nederlandse Internisten Vereniging.
Aan het einde van de ontwikkelfase zijn de belangenverklaringen herbevestigd of aangevuld en opnieuw besproken binnen de werkgroep. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (Kennisinstituut), een overzicht vindt u in de bijlage.
Er is besloten werkgroepleden met mogelijke belangenverstrengeling omtrent het onderwerp DOACs uit te sluiten voor besluitvorming aangaande de aanbevelingen in de richtlijn (modules 3.1 en 6.1). Hierbij werd mogelijke belangenverstrengeling conform de NIV leidraad interpretatie van de ‘Code ter voorkoming van onwenselijke beïnvloeding door belangenverstrengeling’ gedefinieerd als:
adviseur/advisory board bij instantie/bedrijf in de afgelopen twee jaar;
betrokkenheid bij onderzoek naar DOACs/fondaparinux de afgelopen twee jaar; persoonlijke financiering door instantie/bedrijf met belangen bij DOACs;
financiering door een instantie/bedrijf met belangen bij DOACs via een stichting/ziekenhuis/universiteit waarbij het werkgroeplid deel is van de stuurgroep of invloed heeft (gehad) op het studie design.
In het geval van financiering door een instantie/bedrijf met belangen bij DOACs via een stichting van het ziekenhuis/universiteit waarbij het werkgroeplid geen deel uitmaakte van de stuurgroep of invloed had op het studie design (maar bijvoorbeeld wel patiënten voor dit onderzoek heeft geïncludeerd) is beoordeeld dat de kans op oneigenlijke belangenverstrengeling dermate klein is dat uitsluiting van besluitvorming over DOACs niet gerechtvaardigd is. In de overzichtstabel is te zien welke werkgroepleden werden uitgesloten voor de besluitvorming.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een search naar het patiëntenperspectief. Daarnaast zal bij de richtlijn een zogenaamde ‘option grid’ worden ontwikkeld (keuzehulp voor patiënten en zorgverleners samen) voor het onderwerp continueren antistolling.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft tevens interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie indicatorenontwikkeling).
Werkwijze AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.kwaliteitskoepel.nl). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Doordat delen van de richtlijn niet herzien zijn, zijn door de evolutie van richtlijn ontwikkelmethodologie de gebruikte methodes verschillend voor verschillende delen. De delen over diagnostiek bij diepe veneuze trombose, diagnostiek longembolie, aparte categorieën in kader van diagnostiek, arteriële preventie en bijzondere situaties veneuze preventie veneuze trombo-embolie uit de CBO richtlijn van 2008 zijn zo veel mogelijk in originele structuur en stijl behouden (hoewel er aan de structuur wijzigingen zijn gemaakt zodat deze teksten conform het richtlijnendatabase format zijn). De additionele secties over medicamenteuze behandeling van veneuze trombo-embolie, niet-medicamenteuze behandeling van veneuze trombo-embolie, bijzondere situaties veneuze trombo-embolie en preventie veneuze trombo-embolie bevatten nieuwe literatuur en aanbevelingen die werden ontwikkeld volgens nieuwe methodologie. Dit heeft onvermijdelijk geleid tot inconsistenties in de stijl. Bijvoorbeeld is de GRADE methodologie gebruikt in de nieuwe teksten om de kwaliteit en sterkte van de bewijskracht en aanbevelingen te graderen in de nieuwe stukken, waar in de oude stukken gebruik is gemaakt van de oudere EBRO methodologie, of gradering van de oude ACCP richtlijn (2004) is overgenomen. Daarnaast wordt in de oude delen van de richtlijn asymptomatische DVT als uitkomstmaat gehanteerd, maar meer recentelijk wordt zowel nationaal als internationaal deze uitkomstmaat niet meer gebruikt. In de nieuwe delen worden daarom alleen de resultaten met betrekking tot symptomatische DVT gerapporteerd.
De beschrijving van de methodologie bij de verschillende teksten (tabblad achtergrond) bevatten een beschrijving van de details met betrekking tot de methodologie voor de betreffende module.
Het is van belang om te benadrukken dat hoewel de richtlijn methodologie is veranderd, ook de oudere aanbevelingen uit de CBO richtlijn 2008 onverminderd van kracht zijn.
Knelpuntenanalyse
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (CBO, 2008) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door NIV, NVvH, NVN, NVvC, Nefarma, Achmea, KNMP, NHG, De Hart&Vaatgroep, VAL, FNT, NVKC tijdens de invitational conference. Een verslag hiervan kunt u vinden in de bijlagen bij deze richtlijn. Genodigde partijen op de invitational conference waren: ZN, NPCD, De Hart&Vaatgroep, CVZ, IGZ, VWS, Trombosedienst, Nefarma, NFU, STZ, NVZ, NHG, NGIR, NIV, NVVC, NVN, NVvH, NVA, NVALT, VAL, NVKC, NVKG, VAGZ, KNMP. Een lijst van de aanwezigen is opgenomen in het verslag. De werkgroep stelde vervolgens een lijst met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Hierbij zijn de volgende onderwerpen geprioriteerd:
- couperen van bloedingen / bij spoedingrepen; - preventie VTE bij kinderen;
- het gebruik van antistolling bij kleppen; - laboratoriumdiagnostiek;
- het onderbreken en overbruggen van antistolling; - preventie VTE:
- risicostratificatie bij chirurgische patiënten; - risicostratificatie bij niet-chirurgische patiënten;
- preventie VTE bij orthopedische patiënten; - preventie VTE in de verloskunde en gynaecologie; - keuze hormonale anticonceptie.
- therapie VTE:
- behandeling CVC gerelateerde trombose; - behandeling kuitvene trombose;
- thuisbehandeling DVT en longembolie; - trombolyse bij de behandeling van DVT; - continueren antistollingsbehandeling; - behandeling oppervlakkige tromboflebitis; - behandeling toevallig gevonden trombose; - DOACS bij de behandeling van VTE.
Een overzicht van de alle paragraven uit de CBO richtlijn, inclusief vragen die geen prioriteit voor herziening kregen kunt u vinden in bijlage 5 bij deze richtlijn.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar systematische reviews [EMBASE, MEDLINE, Cochrane library]. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen schatten. Deze beoordelingen kunt u vinden in de Risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden
beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.]
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Schünemann H, 2013).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie.
GRADE Definitie
Hoog - er is veel vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie;
- het is zeer onwaarschijnlijk dat de literatuurconclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de conclusie worden toegevoegd.
Matig - er is matig vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie;
- het is mogelijk dat de conclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de conclusie worden toegevoegd.
Laag - er is beperkt vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie;
- het is waarschijnlijk dat de conclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de conclusie worden toegevoegd.
Zeer laag - er is weinig vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie;
- de conclusie is zeer onzeker.
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
De GRADE methodiek is door de Nederlandse werkgroep GRADE-NL (nog) niet vastgesteld voor dit type vraagstelling. De bewijskracht van de conclusie is bepaald volgens de EBRO-methode (Van Everdingen, 2004).
Belangrijkste verschillen tussen de GRADE- en ACCP-indeling
1. met de ACCP-indeling worden aanbevelingen gegradeerd, met de GRADE methodiek worden conclusies gegradeerd. In de ACCP-aanbevelingen wordt wel rekening gehouden met overige (meer subjectieve) overwegingen (bijwerkingen, kosten, gemak voor patiënt), maar dit is niet expliciet terug te vinden; dit komt terug in grootte van het effect (zie punt 2). In de GRADE methodiek worden de overige overwegingen (bijwerkingen, kosten, patiëntenperspectief, expert opinion) gewogen en transparant beschreven, deze overwegingen samen met de wetenschappelijke conclusies leiden tot de aanbevelingen;
2. in de ACCP-indeling wordt onderscheid gemaakt tussen een duidelijk klinisch effect (1) en een klein of onduidelijk effect (2), volgens de GRADE-methodiek wordt vooraf benoemde klinische relevantie meegewogen in de gradering van de conclusies.
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische testen, over schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in één of meerdere conclusie(s), waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals criteria die van invloed zijn op de aanbeveling, de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. De richtlijn bevat geen organisatie van zorg hoofdstuk, omdat er over organisatie van zorg en samenwerking binnen de keten reeds documenten bestaan (bijvoorbeeld LSKA 2.0).
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de richtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (de indicatoren zijn te vinden in de aanverwante producten). Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek worden toegevoegd na de commentaarfase.
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Hoofdstuk 3 Preventie VTE
Uitgangsvragen
3.1 Tromboseprofylaxe bij grote orthopedische en traumatologische ingrepen
3.2 Wat is beste vorm van tromboseprofylaxe bij grote traumatologie (inclusief neurotrauma, ‘spinal cord injury’ en traumatische wervelkolom chirurgie)?
3.3 Wat is beste vorm van tromboseprofylaxe bij electieve rugchirurgie?
3.4 Wat is de beste vorm van tromboseprofylaxe bij een arthroscopische ingreep van de knie?
3.5 Wat is de beste vorm van tromboseprofylaxe bij een geïsoleerd letsel van de onderste extremiteit die een gipsimmobilisatie ondergaan?
3.6 Welke vorm van hormonale anticonceptie is het veiligst wat betreft het risico op veneuze trombo-embolie?
3.7 Hormonale suppletie therapie en veneuze tromboembolie
3.8 Wat is de optimale preventieve behandeling voor symptomatische veneuze trombo-embolie voor opgenomen patiënten met een acute medische (hierna te noemen niet-chirurgische) aandoening?
3.9 Wat is de optimale profylaxe voor symptomatische veneuze trombo-embolie (VTE; voor chirurgische patiënten?
3.10 Wanneer is tromboseprofylaxe geïndiceerd bij patiënten met een acute beroerte (herseninfarct / hersenbloeding) en welke profylaxe heeft de voorkeur?
Subvragen
3.1.1 Wat is het optimale tijdstip om tromboseprofylaxe te starten rondom grote orthopedische/ traumatologische ingrepen?
3.1.2 Wat is de optimale vorm en duur van tromboseprofylaxe na grote orthopedische/ traumatologische ingrepen?
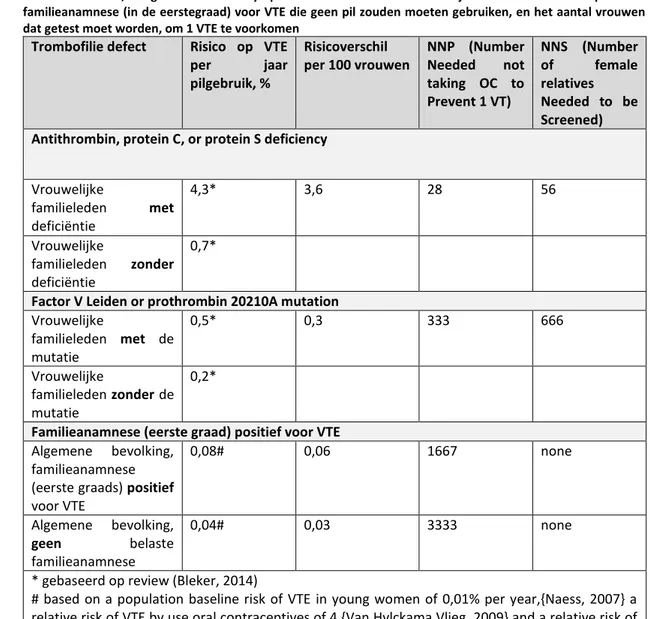
3.6.1 Risico op veneuze trombo-embolie bij pilgebruik in de algemene bevolking
3.6.2 Risico op veneuze tromboembolie bij pilgebruik door vrouwen met een verhoogd risico op VTE (trombofilie en/of positieve familieanamnese)
3.6.3 Vrouwen met voorgeschiedenis met VTE
3.3.1 Tromboseprofylaxe bij grote orthopedische en traumatologische ingrepen Algemene inleiding
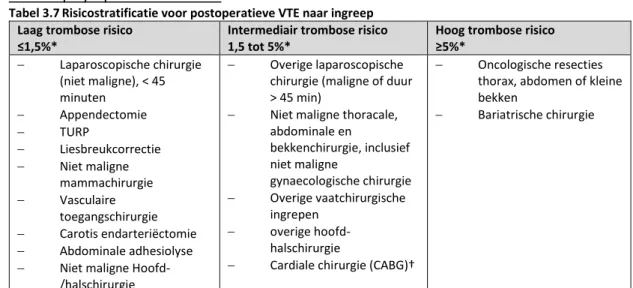
Totale heup arthroplastiek (THP) en totale knie arthroplastiek (TKP) behoren tot de meest succesvolle grote orthopedische operaties en worden in toenemende mate wereldwijd toegepast. Het risico op VTE na grote orthopedische operaties is het hoogst van alle chirurgische ingrepen. Het risico is het hoogst na THP en operatie voor heupfractuur (HF). Naar analogie van de ACCP richtlijn (2012) wordt in deze richtlijn op symptomatische trombose gefocust. Het risico op symptomatische DVT na THP,TKP en heupfractuur zonder profylaxe wordt geschat op 1,8% en het risico op een symptomatische longembolie op 1% in de eerste 7 tot 14 dagen postoperatief (ACCP 2012). Het cumulatieve postoperatieve risico op VTE zonder profylaxe na 35 dagen is 4,3% (DVT 2,8%, longembolie 1,5%).
Er is een grote overlap in het bewijs voor de meest onderzochte grote orthopedische/ traumatologische ingrepen (THP,TKP HF), derhalve is er grote overlap in de teksten voor de betreffende ingrepen in deze module. Deze adviezen kunnen mogelijk ook geëxtrapoleerd worden naar andere grote orthopedisch/ traumatologische ingrepen waarover minder bewijs bestaat. Te denken valt aan distale femur fractuur/ osteotomie en osteotomie/ fractuur van de proximale tibia.
3.1.1 Start tromboseprofylaxe bij grote orthopedische en traumatologische ingrepen
Inleiding
In Nederland wordt inmiddels de tromboseprofylaxe in de overgrote meerderheid van de ziekenhuizen postoperatief gestart, dit was niet altijd het geval, tien jaar geleden werd in Nederland vrijwel uitsluitend nog preoperatief gestart. Het bloedingsrisico is sterk verbonden met het tijdstip waarop de tromboseprofylaxe wordt geïnitieerd. Naar schatting 75% van het postoperatief bloedverlies vind plaats gedurende de eerste 6 uur na de ingreep.
Zoeken en selecteren
Deze module is overgenomen uit de ACCP richtlijn (2012). Op basis van expert opinion en de bij de werkgroep bekende literatuur zijn de overwegingen aangepast.
Samenvatting literatuur (uit ACCP)
In een systematische review werd er geen statistisch significant verschil in DVT-incidentie gevonden (bij preoperatieve start: 19,2% en bij postoperatieve start 14,4%), noch in de incidentie van ernstige bloedingen (bij preoperatieve start: 1,4% en bij postoperatieve start 2,5%) bij pre-(>12 uur) en postoperatieve (12 tot 48 uur) start van LMWH. Wel werden meer ernstige bloedingen (5 tot 7%) gezien bij een perioperatieve start (twee uur preoperatief tot <=4 uur postoperatief) dan bij een pre- (>12 uur) of postoperatieve (12 tot 24uur) start (1 tot 3%) (Strebel, 2002).
Het is voor deze paragraaf van de ACCP richtlijn niet duidelijk of er systematisch naar literatuur gezocht is, en er is geen systematische beschrijving (of tabellen) van de literatuur beschikbaar. De conclusies voor deze module kunnen daardoor niet worden gegradeerd aan de hand van de GRADE systematiek.
Conclusies
Het is mogelijk dat preoperatief (>12uur) starten en postoperatief starten (12 tot 24 uur) van LMWH niet leiden tot een verschillend risico op DVT en ernstige bloedingen.
Het is waarschijnlijk dat perioperatief (minder dan vier uur preoperatief of minder dan vier uur postoperatief) leidt tot hoger risico op het optreden van bloedingen dan postoperatief of preoperatief starten.
Bronnen (Strebel, 2002)
Overwegingen
De auteurs van de beschreven studie concluderen dat preoperatief starten niet effectiever is dan postoperatief starten en dat er wel een trend is te zien dat perioperatief starten wellicht iets effectiever is maar dat dit geheel teniet wordt gedaan door een sterk verhoogd bloedingsrisico. Deze aanbevelingen werden gedaan op basis van indirecte vergelijkingen van venografisch aangetoonde asymptomatische trombose. Het is onbekend of deze conclusies overeind blijven indien gekeken wordt naar een directe vergelijking op basis van symptomatische eindpunten. Een 12 tot 24 uur postoperatieve start komt overeen met in de meeste gevallen een eerste gift de ochtend na de operatie. In veel ziekenhuizen wordt traditioneel gekozen voor het geven van de profylaxe tussen grofweg 18.00 en 22.00. Indien het praktischer is om voor en dergelijke strategie te kiezen lijkt het in ieder geval wenselijk niet eerder dan zes uur na het einde van de operatie te starten met farmacologische profylaxe (NICE, 2010). Deze aanbeveling kan verschillen van wat de fabrikant in de geneesmiddelen tekst heeft geadviseerd.
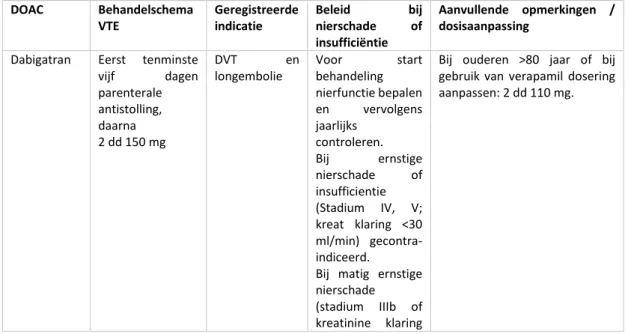
Bovengenoemde conclusies betreffen profylaxe met een LMWH. Voor DOACs geldt dat ze universeel postoperatief gestart worden. In het algemeen geldt dat hoe korter gestart na het sluiten van de wond, hoe effectiever (minder VTE) maar minder veilig (meer bloedingen). Fondaparinux word doorgaans zes tot acht uur postoperatief gestart, in een studie werd er overigens geen verschil gevonden in effectiviteit alsmede bloedingsrisico indien fondaparinux zes tot acht uur postoperatief werd gestart of indien 12 tot 24 uur postoperatief gestart werd (Colwell, 2006). Dabigatran wordt één tot vier uur postoperatief gestart in een gereduceerde dosis, rivaroxaban zes tot tien uur postoperatief (indien er geen actief bloedverlies meer is) en apixaban 12 tot 24 uur postoperatief. Bij het gebruik van DOACs wordt geadviseerd om deze door de fabrikant opgestelde en/of in trials geëvalueerde richtlijnen te gebruiken.
Bij patiënten die preoperatief geïmmobiliseerd zijn en uitgesteld worden geopereerd (heupfractuur) is het te adviseren om preoperatief al te starten met tromboseprofylaxe, de laatste gift LMWH dient dan >12 uur preoperatief gegeven te worden.
Aanbeveling
Kies bij grote orthopedische ingrepen (THP,TKP, HF) en het gebruik van LMWH voor een postoperatieve start (tenminste zes uur na de ingreep).
Geef patiënten die preoperatief geïmmobiliseerd zijn en uitgesteld worden geopereerd preoperatief tromboseprofylaxe (laatste gift LMWH>12 uur preoperatief)
Literatuur
Strebel N, Prins M, Agnelli G, et al. Preoperative or postoperative start of prophylaxis for venous thromboembolism with low-molecular-weight heparin in elective hip surgery? Arch Intern Med. 2002;162(13):1451-1456. Colwell CW Jr, Kwong LM, Turpie AG, et al. Flexibility in administration of fondaparinux for prevention of
symptomatic venous thromboembolism in orthopaedic surgery. J Arthroplasty. 2006;21(1):36-45. National Institute for Health and Clinical Excellence (NICE). National Collaborating Centre for Acute and Chronic
Conditions. Venous thromboembolism: reducing the risk. Reducing the risk of venous thromboembolism (deep vein thrombosis and pulmonary embolism) in patients admitted to hospital. 2010.
3.1.2 Keuze en duur van tromboseprofylaxe bij grote orthopedische en traumatologische ingrepen
Inleiding
Het risico op symptomatische VTE na grote orthopedische ingrepen wordt geschat op 2,8% na 14 dagen (ACCP, 2012). In de drie weken daarna treden zonder profylaxe nog in 1,5% van de patiënten een VTE op waarmee het cumulatieve risico na 35 dagen wordt geschat op 4,3% (ACCP, 2012). In de meeste ziekenhuizen in Nederland is het gebruikelijk om farmacologische tromboseprofylaxe te gebruiken na grote orthopedische/ traumatologische ingrepen hierbij wordt het meest gekozen voor een LMWH maar fondaparinux en DOACs worden ook regelmatig voorgeschreven. Er wordt nauwelijks gebruik gemaakt van vitamine K antagonisten. In Nederland wordt doorgaans acenocoumarol gebruikt terwijl internationaal in trials doorgaans warfarine het gebruikte middel is.
Mechanische methoden worden in Nederland nauwelijks (IPC en voetpomp) of weinig (compressiekousen) toegepast voor de preventie van trombose na grote orthopedische/ ingrepen en heupfractuur chirurgie. Deze methode heeft tot doel om de veneuze stasis in de benen te verminderen en daarmee het tromboserisico. Er zijn drie typen te onderscheiden: gegradueerde compressiekousen, intermitterende pneumatische compressie en de veneuze voetpomp. Het evidente voordeel is dat deze modaliteiten geen verhoging van het perioperatieve bloedingsrisico geven; voor intermitterende pneumatische compressie (IPC, kuitpomp) en de veneuze voetpomp zijn de lage compliantie en de slechte toepasbaarheid na ontslag uit het ziekenhuis duidelijke nadelen. Het voorkomen van huidcomplicaties is een ander nadeel hoewel onduidelijk is hoe vaak dit voorkomt. In Nederland is het gebruikelijk om tromboseprofylaxe na grote orthopedische/ traumatologische zoals THP, TKP en HF ingrepen te continueren voor een periode van vier tot zes weken.
Op dit moment zijn drie DOACs opgenomen in het Geneesmiddelen Vergoedingssysteem (GVS) voor de indicatie voorkoming van veneuze trombo-embolie na heup- of knie vervangende operaties: dabigatran (sinds 2008), rivaroxaban (sinds 2008) en apixaban (sinds 2011). Edoxaban is tijdens het schrijven van deze richtlijn nog niet op de Nederlandse markt voor deze indicatie, studies naar dit middel worden daarom niet toegevoegd aan de systematische literatuuranalyse. De DOACs zijn nieuw ten opzichte van de vorige CBO richtlijn. De plaats van DOACs als profylacticum na orthopedische ingrepen dient bepaald te worden ten opzichte van andere, gangbare farmacologische tromboseprofylaxe.
Daarnaast leeft bij orthopedisch chirurgen op dit moment de vraag of volstaan kan worden met het relatief goedkope middel acetylsalicylzuur als tromboseprofylacticum na heup- of knieprotheses. Een uitgebreide analyse van literatuur is daarom gerechtvaardigd. Interessant is dat de ACCP in 2012, op basis van hetzelfde bewijs (PEP trial), nu acetylsalicylzuur wel aanbeveelt als monotherapie, terwijl dit in het verleden niet werd aanbevolen (acetylsalicylzuur is een doorgaans minder effectief profylacticum dan LMWH en leidt mogelijk niet tot minder bloedingen).
Zoeken en selecteren
Voor de verschillende vergelijkingen van middelen is een andere methodiek gebruikt: voor de evaluatie van LMWH’s, fondaparinux, vitamine K antagonisten en
mechanische profylaxe is de literatuur deels overgenomen uit de ACCP richtlijn (2012). Op basis van expert opinion en de bij de werkgroep bekende literatuur zijn de overwegingen aangepast.
daarnaast werd ervoor gekozen om een nieuwe evaluatie te doen DOACs en acetylsalicylzuur. Deze uitgangsvraag is uitgewerkt in twee deelvragen:
hoe groot is het risico op symptomatische VTE (en hoe hoog is het risico op ernstige bloedingen) bij gebruik van DOACs ten opzichte van LMWH bij patiënten die een heup- of knie vervangende operatie of heupfractuur operatie ondergaan?
hoe groot is het risico op symptomatische VTE (en hoe hoog is het risico op ernstige bloedingen) bij gebruik van acetylsalicylzuur ten opzichte van LMWH bij patiënten die een heup- of knie vervangende (operatie of heupfractuur operatie ondergaan? De ACCP van 2012 is voor het beantwoorden van deze uitgangsvraag als uitgangspunt genomen. Tevens is na de zoekdatum van de ACCP (november 2009) systematisch gezocht naar meer recente literatuur aan de hand van de volgende wetenschappelijke vraagstelling:
P: patiënten die een heup- of knie vervangende operatie (hip and knee arthroplasty) ondergaan + heupfractuur;
I: DOACs (dabigatran, rivaroxaban, apixaban), acetylsalicylzuur; C: LMWH (of pentasacharide (fondaparinux);
O: symptomatische VTE, asymptomatische VTE, ernstige bloedingen, niet ernstig klinisch relevante bloeding (operatieplaats), mortaliteit, reoperatie nodig wegens bloeding.
Relevante uitkomstmaten
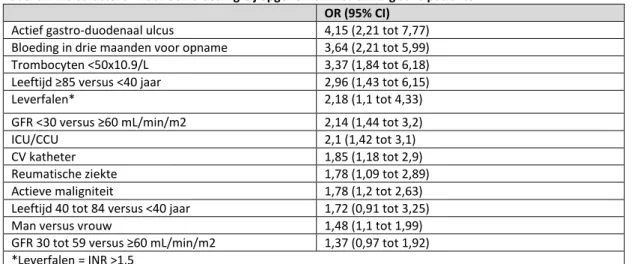
De aanbevelingen zijn gebaseerd op voor de patiënt relevante uitkomstmaten fatale en symptomatische longembolie, symptomatische DVT, ernstige bloedingen en mortaliteit. De werkgroep achtte non-ernstige klinisch relevante bloedingen, bloedingen op de operatieplaats en heroperaties vanwege bloedingen voor de besluitvorming belangrijke uitkomstmaten.
In de verschillende studies worden verschillende definities van deze uitkomstmaten gebruikt. De werkgroep hanteerde de volgende definities:
- ernstige bloedingen: fatale bloeding, bloeding in kritiek orgaan (onder andere retroperitoneaal, intracraniaal, intraoculair, intraspinaal), klinisch duidelijk (onder andere GI) bloeding geassocieerd met een daling van hemoglobine niveau van 2g/dl of waarvoor twee units bloed transfusie nodig is, en bloedingen waarvoor heroperatie nodig is;
- in de ACCP worden fatale bloedingen en bloedingen waarvoor heroperatie nodig is apart benoemd omdat deze uitkomstmaten het meest eenduidig zijn. Omdat patiënten die een operatie ondergaan bloed verliezen en chirurgen mogelijk een lage drempel hebben voor bloedtransfusie met autoloog bloed zijn een daling in hemoglobine en noodzaak voor bloedtransfusie moeilijk te interpreteren. Het effect van peroperatieve transfusies op de uitkomst ernstige bloedingen is niet bekend;
- ernstige bloedingen volgens de bovenstaande definitie lijken echter wel een klinische impact te hebbe: een regressie analyse van ernstige bloedingen met meer dan 13.000 patiënten in fondaparinux trials liet een hazard ratio voor overlijden zien van bijna 7 (8,6% vs. 1,7%): een sterke relatie tussen bloeden en slechte uitkomst onafhankelijk van de medicatie die werd gebruikt. Het is onduidelijk of deze bevinding generaliseerbaar is naar andere interventies of populaties.
Ook in de ACCP wordt voor sommige studies het risico op symptomatische DVT (wanneer niet gerapporteerd) gebaseerd op het risico op asymptomatische DVT.
Zowel symptomatische VTE en bloedingen zijn belangrijke, ongewilde uitkomsten vanuit het perspectief van een patiënt. Er is weinig informatie beschikbaar over de mening van patiënten ten aanzien van de relatieve disutiliteit van deze twee uitkomsten. Dit is echter een belangrijke overweging, omdat veel van de methoden om postoperatieve VTE te voorkomen anticoagulantia gebruiken en deze allen het risico op bloedingen verhogen. Het is daarom zeer belangrijk om de relatieve balans tussen een episode VTE en een bloeding te wegen. Om dit te doen werd in de ACCP gebruik gemaakt van de beschikbare literatuur over een waarderings- oefening door artsen betrokken bij het opstellen van de richtlijn. Per saldo werd ingeschat dat de nadelige effecten van een ernstige postoperatieve bloeding ongeveer gelijk waren aan die van een symptomatische VTE. In het opstellen van de aanbevelingen worden deze twee uitkomsten daarom als gelijkwaardig gezien.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase en de Cochrane Library is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd onderzoek die acetylsalicylzuur of een DOAC (dabigatran, rivaroxaban, apixaban) vergelijken met LMWH voor patiënten die een knie- of heup vervangende operatie of een heupfractuuringreep ondergaan. De zoekverantwoording is weergegeven onder het tabblad verantwoording. De literatuurzoekactie leverde 438 treffers op.
DOACs vs. LMWH
Studies werden geselecteerd op grond van de volgende selectiecriteria: voldoende data presentatie, systematische review of gerandomiseerde studie, directe vergelijking tussen DOAC en LMWH bij patiënten die knie- of heupvervangende operatie ondergaan, met als uitkomstmaat een van de door de werkgroep gedefinieerde uitkomstmaten. Opvallend was het grote aantal overlappende systematische reviews en meta-analyses (met dezelfde zoekdatum, onderzoeksvraag en in- en exclusiecriteria). Eerst werden alle geselecteerde reviews op fulltext beoordeeld op kwaliteit, relevantie en recentheid. Er werd een systematische review van systematische reviews gevonden (Adam, 2013), waarin verschillende systematische reviews met verschillende vergelijkingen (rivaroxaban, dabigatran, apixaban, edoxaban versus LMWH) worden samengevat. De reviews die in dit artikel worden geïncludeerd, includeren echter geen losse studies die niet reeds in de ACCP worden beschreven. In aanvulling op de ACCP werd één meer recente RCT gevonden die voldeed aan de inclusiecriteria (ref), 35 studies werden geëxcludeerd (zie exclusietabel).
De studies die zijn geïncludeerd in de ACCP richtlijn en een additionele studie (ref) zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De evidencetabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
In veel systematische reviews worden de resultaten van studies met verschillende orale factor Xa inhibitors (rivaroxaban, apixaban en edoxaban) samen gepoold en beschreven. In de ACCP worden rivaroxaban en apixaban echter apart beschreven. Ook in deze richtlijn worden de middelen apart beschreven.
Acetylsalicylzuur vs. LMWH
Studies werden geselecteerd op grond van de volgende selectiecriteria: voldoende data presentatie, systematische review of gerandomiseerde studie, directe vergelijking tussen acetylsalicylzuur en LMWH bij patiënten die knie- of heupvervangende operatie ondergaan, met als uitkomstmaat een van de door de werkgroep gedefinieerde uitkomstmaten. Op basis van titel en samenvatting werden in aanvulling op de ACCP werd drie meer recente reviews gevonden (waarvan de meest recente zocht tot juni 2013), en drie RCT’s die voldeden aan de inclusiecriteria. Op basis van de volledige tekst werden twee reviews en twee RCT’s geëxcludeerd (zie exclusietabel).
Twee studies (review en RCT) zijn opgenomen in de literatuuranalyse. De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in bijlage vinden.
Samenvatting literatuur
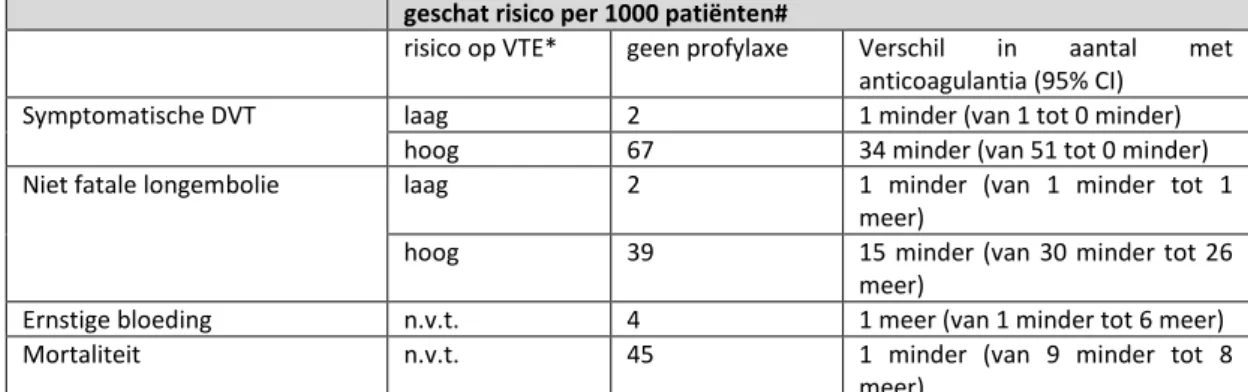
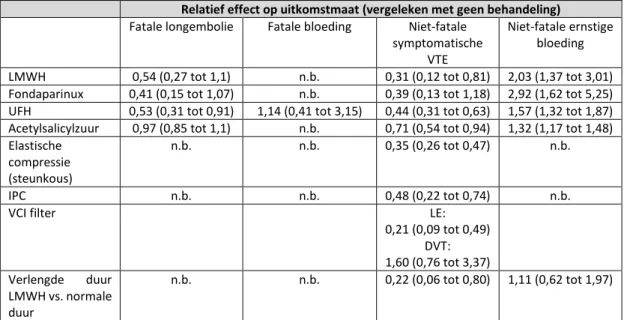
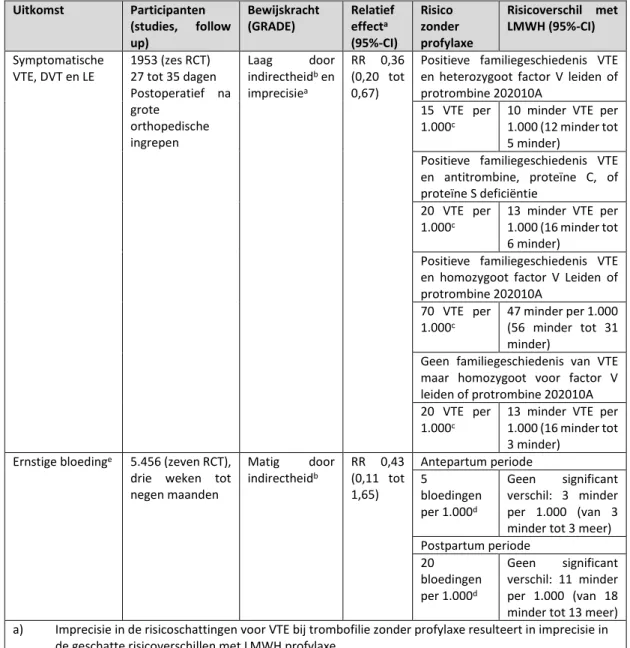
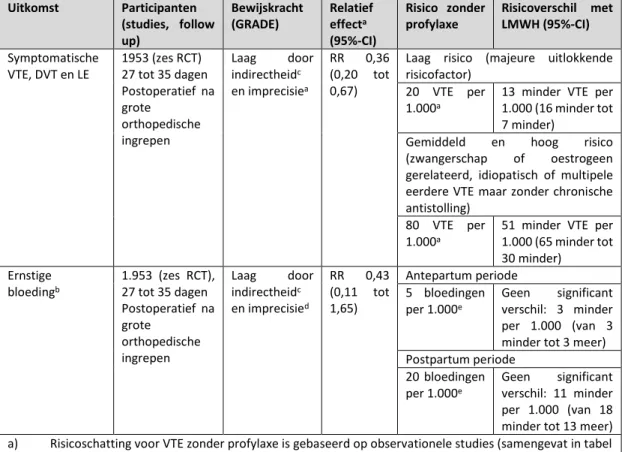
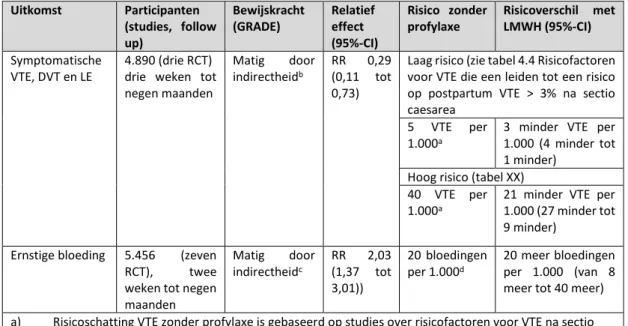
LMWH vs. geen profylaxe na heup of knie vervangende operatie of heupfractuur
LMWH (zes tot tien) dagen verlaagt de incidentie van symptomatische DVT (afgeleid van asymptomatische DVT) na heup- en kniearthroplastiek met ongeveer 50% (14 studies, 2,250 participanten, RR 0,50 95%-CI 0,43 tot 0,59) vergelijkbare reducties werden gevonden voor heupfracturen. Deze reductie wordt niet gevonden voor longembolie (11 studies, 2,025 participanten, RR 0,58, 95%-CI 0,22 tot 1,47). De ACCP verwacht dat het gebruik van LMWH voor een periode van tien tot 14 dagen 13 VTE per 1000 patiënten voorkómt bij een geschat risico van 1% voor longembolie en 1.8% voor symptomatische DVT. Er werd geen negatief effect op de incidentie van ernstige bloeding bij het gebruik van LMWH gezien (11 studies, 1,977 participanten, RR 0,81, 95%-CI 0,38 tot 1,71), hoewel er geen eenduidige rapportage van ernstige bloedingen was in diverse studies.
Verlengde profylaxe
Uit observationeel onderzoek wordt gesuggereerd dat het risico op VTE na grote orthopedische ingrepen na ongeveer drie maanden terugkeert op het preoperatieve niveau (Bjornara, 2006; White, 1998). In oudere studies was de duur van profylaxe doorgaans tien tot 14 dagen, dit komt overeen met de opnameduur destijds. Het is nu gebruikelijk om de duur te verlengen en in recente trials werd profylaxe met name na THP vaak gecontinueerd voor >30 dagen. Drie systematische reviews onderzochten het effect van verlengde profylaxe met LMWH vs. placebo. De gegevens waren afkomstig van zeven studies met >2600 patiënten. Het betrof meestal THP patiënten maar een studie includeerde ook TKP. Randomisatie vond doorgaans plaats bij ontslag (tien tot 14 dagen)
en vervolgens werd er gerandomiseerd tussen LMWH en placebo tot 27 tot 35 dagen postoperatief.
Er werd geen longembolie gevonden in de LMWH-groep versus 5 longembolie in 1104 patiënten in de placebogroep. Symptomatische DVT werd met ongeveer 50% verminderd (RR 0,46 95%-CI 0,26 tot 0,82) in de LMWH-groep. Er werd geen effect gevonden op de incidentie van ernstige bloedingen (RR 0,43 95%-BI 0,11 tot 1,65) en mortaliteit (RR 0,39 95%-CI 0,08 tot 1,98), twee doden ten gevolge van VTE werden gevonden in de placebogroep. De ACCP verwacht dat verlengde profylaxe tot 35 dagen postoperatief zal resulteren in 9 minder symptomatische VTE per 1000 patiënten ten opzichte van placebo zonder het risico op ernstige bloedingen te verhogen (tabel 5, ACCP).
De gradering van de conclusies is overgenomen uit de ACCP richtlijn.
Conclusies
Profylaxe tien tot 14 dagen Matig
GRADE
Het gebruik van LMWH voor tien tot 14 dagen verlaagt het risico op het optreden van VTE ten opzichte van placebo na grote orthopedische en traumatologische ingrepen.
Bronnen (ACCP, 2012)
Matig GRADE
Het effect op ernstige bloedingen van tien tot 14 dagen LMWH in vergelijking met placebo voor patiënten na grote orthopedische en traumatologische ingrepen op het risico kon niet worden aangetoond noch uitgesloten.
Bronnen (ACCP, 2012) Verlengde profylaxe
Hoog GRADE
Verlengde profylaxe tot 35 dagen postoperatief met LMWH verlaagt de incidentie van VTE na grote orthopedische en traumatologische ingrepen ten opzichte van placebo.
Bronnen (ACCP, 2012)
Hoog GRADE
Verlengde profylaxe tot 35 dagen postoperatief met LMWH verhoogt het risico op ernstige bloedingen na grote orthopedische en traumatologische ingrepen niet.
Bronnen (ACCP, 2012
Vitamine K antagonisten vs. geen profylaxe of LMWH na heup of knie vervangende operatie of heupfractuur
Vitamine K antagonisten vs. placebo
bijna 80% (RR 0,21 95%-BI 0,08 tot 0,53) hoewel dit was gebaseerd op maar 32 events. Het risico op grotendeels symptomatische DVT (afgeleid van asymptomatische DVT) werd gereduceerd met meer dan 50% (RR 0,45 95%-BI 0,32 tot 0,62). Het gebruik van VKA was geassocieerd met een trend naar meer bloedingen (RR 1,50 95%-BI 0,92 tot 2,43), al was er aanzienlijke variabiliteit in definitie van bloedingen.
De ACCP verwacht dat het gebruik van VKA (tien tot 14 dagen) resulteert in 18 (95%-BI: van 12 minder tot 21 minder) minder VTE per 1000 patiënten en 7 (95%-BI: van 1 minder tot 12 meer) meer ernstige bloedingen.
De bewijskracht voor de uitkomstmaat symptomatische DVT werd met een niveau verlaagd naar matig gezien indirectheid (afgeleid van asymptomatische DVT). De bewijskracht voor de uitkomstmaat bloedingen werd met een niveau verlaagd gezien imprecisie (confidence interval bevat zowel een mogelijk positief als negatief effect).
LMWH vs. VKA
Verschillende RCT’s hebben het gebruik van LWMH vergeleken met vitamine K antagonisten als initiële profylaxe bij THP en TKP (maar niet HF). Het betrof >9.000 patiënten. Er werd geen statistisch significant effect gevonden op de incidentie van longembolie (RR 0,68 95%-BI 0,22 tot 2,1). Bij het gebruik van LMWH werd wel een reductie in symptomatische DVT (afgeleid van asymptomatische DVT) gevonden (RR, 0,68; 95% BI, 0,6 tot 0,78)) ten koste van een toename in het aantal ernstige bloedingen (RR 1,56 95%-BI 1,23 tot 2,0). In deze trials werd LMWH doorgaans kort preoperatief gestart wat leidt tot een toename van het bloedingsrisico (zie ook module ‘start tromboseprofylaxe’). Wanneer deze trials werden geëxcludeerd was er alleen nog sprake van een trend richting meer bloedingen met LMWH (RR 1,36 95%-BI 0,95 tot 1,96). De ACCP verwacht bij het gebruik van een LMWH in de initiële profylaxe na een grote orthopedische ingreep drie minder VTE per 1000 patiënten dan bij VKA en vier meer ernstige bloedingen.
De gradering van de bewijskracht is overgenomen uit de ACCP richtlijn. De bewijskracht voor symptomatische DVT en ernstige bloedingen is met twee niveaus verlaagd gezien inconsistentie (I2=50%) en indirectheid (symptomatische DVT werd afgeleid van asymptomatische DVT, voor bloedingen werd in de studies enoxaparine kort na de ingreep (<12u) toegediend, dit wijkt af van de huidige praktijk).
Verlengde profylaxe
Er is een grote RCT (>1200 patiënten) die het gebruik van LMWH vergeleek met het gebruik van VKA (INR2 tot 3) na THP voor een duur van zes weken. Er werd geen longembolie gezien in de LMWH-groep vs. vier van 636 patiënten in de VKA-groep. Er werd geen voordeel gezien voor het gebruik van VKA ten opzichte van LMWH op het optreden van symptomatische DVT (RR 1,35 95%-BI 0,7 tot 2,6). Wel werden er vier keer meer ernstige niet fatale bloedingen gevonden bij het gebruik van VKA ten opzichte van LMWH (RR 3,9 95%-BI 1,9 tot 8,1) Er waren twee doden in de VKA-groep waarvan een door een gastro-intestinale bloeding.
De gradering van de conclusies is overgenomen uit de ACCP richtlijn. De bewijskracht voor de uitkomstmaten symptomatisch DVT is met een niveau verlaagd naar matig gezien imprecisie (betrouwbaarheidsinterval bevat zowel gunstig als ongunstig effect), de
bewijskracht voor de uitkomstmaat ernstige bloedingen is met een niveau verlaagd (rapportage van bloedingen was waarschijnlijk niet geblindeerd).
Conclusies VKA vs. placebo
Matig GRADE
Het gebruik van vitamine K antagonisten voor tien tot 14 dagen verlaagt het risico op het optreden van DVT ten opzichte van placebo.
Bronnen (ACCP, 2012)
Matig GRADE
Het gebruik van vitamine K antagonisten voor tien tot 14 dagen verlaagt het risico op het optreden van longembolie ten opzichte van placebo.
Bronnen (ACCP, 2012)
Laag GRADE
Het is mogelijk dat het gebruik van LMWH (tot 14 dagen) het risico op het optreden van DVT verlaagt ten opzichte van vitamine K antagonisten
Bronnen (ACCP, 2012)
Laag GRADE
Het is mogelijk dat het gebruik van LMWH (tot 14 dagen) het risico op het optreden van bloedingen verhoogt ten opzichte van VKA.
Bronnen (ACCP, 2012) Extended LMWH vs. VKA
Matig GRADE
Een voordeel van verlengde duur VKA ten opzichte van verlengde duur LMWH op symptomatische DVT kon worden aangetoond noch uitgesloten.
Bronnen (ACCP, 2012)
Matig GRADE
VKA verhoogt het risico op ernstige bloedingen ten opzichte van LMWH in de verlengde profylaxe.
Bronnen (ACCP, 2012)
Fondaparinux vs LMWH en placebo (verlengde profylaxe) na heup of knie vervangende operatie of heupfractuur
LMWH vs fondaparinux
Verschillende grote trials vergeleken fondaparinux (zes tot acht uur na sluiten van de wond) met LMWH (>12 uur voor of >12 uur na operatie) bij patiënten na een THP,TKP of HF. In de ACCP analyse werd ook een studie bij abdominale chirurgie geïncludeerd omdat de relatieve effecten vergelijkbaar waren. Op deze manier werden >1000 patiënten geïncludeerd.
reductie werd gevonden in het optreden van asymptomatische DVT bij het gebruik van fondaparinux. Er was een substantiële toename in het optreden van bloedingen bij het gebruik van fondaparinux (RR 1,85 95%-BI 1,1 tot 3,11). Al werd er geen verschil gevonden in het optreden van ernstige niet-fatale bloedingen (RR 1,35 95% BI 0,89 tot 2,05). Fatale VTE was zeldzaam in beide groepen (fondaparinux 5/5049 en LMWH 6/5046) net als fatale bloedingen (fondaparinux 2 en LMWH 3).
De ACCP verwacht dat het gebruik van fondaparinux niet meer VTE voorkomt dan LMWH terwijl er mogelijk 9 (95%-BI: van 2 minder tot 25 meer) meer ernstige bloedingen per 1000 patiënten optreden (tabel 16 ACCP).
Verlengde profylaxe fondaparinux vs. placebo
In een studie werden patiënten gerandomiseerd na een initiële periode van zes tot acht dagen fondaparinux. Het betrof 656 patiënten na een heupfractuur waarbij fondaparinux voor een additionele periode van 19 tot 23 dagen werd vergeleken met placebo. Er werd geen longembolie gezien in de fondaparinuxgroep vs 2 van 330 in de placebogroep. Er werd geen effect gevonden op de reductie in symptomatische DVT bij het gebruik van fondaparinux (RR 0,17 95%-BI 0,02 tot 1,39) alsmede op mortaliteit (RR 0,76 95%-BI 0,27 tot 2,16) . Er werden zes ernstige bloedingen gezien in de fondaparinuxgroep vs geen in de placebogroep (RR 13,12 95%-BI 0,74 tot 231). De ACCP verwacht 12 minder (95%-BI van 15 minder tot 20 meer) VTE per 1000 patiënten bij het gebruik van fondaparinux ten opzichte van geen verlengde profylaxe maar ook 12 meer (95%-BI: van 1 minder tot 17 meer) ernstige bloedingen.
De bewijskracht is overgenomen uit de ACCP richtlijn. De bewijskracht voor de uitkomstmaten symptomatische VTE en ernstige bloedingen werd met een niveau verlaagd naar matig, gezien imprecisie (de betrouwbaarheidsintervallen bevatten zowel een positief als negatief effect).
Conclusies
Fondaparinux vs. LMWH Matig
GRADE
Een verschil in het risico op VTE met fondaparinux in vergelijking met LMWH kon worden aangetoond noch uitgesloten.
Bronnen (ACCP, 2012)
Matig GRADE
Het is mogelijk dat het risico op bloedingscomplicaties hoger is met fondaparinux in vergelijking met LMWH.
Bronnen (ACCP, 2012)
Mechanische profylaxe na heup of knie vervangende operatie en heupfractuur
Gegradueerde compressie kousen (GCS) vs. geen profylaxe
Hoewel compressie kousen frequent gecombineerd worden met andere vormen van profylaxe zijn er weinig data betreffende het gebruik van gegradueerde compressie kousen (GCS) vs. geen profylaxe bij grote orthopedische chirurgie. In een systematische
(maar een trial met orthopedische patiënten). Er werd geen effect gevonden van GCS op het optreden van longembolie (RR 0,63 95%-BI 0,32 tot 1,125), hoewel er wel een effect werd gevonden van GCS op asymptomatische DVT ten opzichte van geen profylaxe (RR 0,51 95%-BI 0,36 tot 0,73) (Hill, 2010). In een studie van betere kwaliteit bij patiënten met een CVA werd er geen effect gevonden van GCP op symptomatische DVT (RR 0,92 95%-BI 0,77 tot 1,09) terwijl er vier keer meer huidcomplicaties werden gevonden (RR 4,02, 95%-BI 2,34 tot 6,91) tabel 10 ACCP (ACCP, 2012).
Intermitterende pneumatische compressie (kuitpomp, IPC) en voetpomp vs. geen
profylaxe
In zeven RCT met >900 patiënten na arthroplastiek of HF werd mechanische profylaxe met een IPC (zes trials) of een voetpomp (één trial) vergeleken met geen profylaxe. De kwaliteit van de trials was laag en er waren aanwijzingen voor publicatie bias. Er werden verschillend apparaten gebruikt en compliantie werd zelden gerapporteerd. Er werd een risico reductie van >50% gevonden na TKP,THP, HF in longembolie (RR 0,4 95%-BI 0,17 tot 0,92) en DVT (RR 0,46 95%-BI 0,35 tot 0,61). De ACCP schat op basis van deze RR per 1000 patiënten 16 minder symptomatische VTE. Er werden geen aanwijzingen gevonden voor een effect op mortaliteit. (tabel 11 ACCP)
Intermitterende pneumatische compressie (IPC) vs. VKA
IPC werden vergelijken met VKA in >500 patiënten uit vier trials (THP,TKP) Er werden geen longembolie gevonden. Er was geen verschil in asymptomatische DVT voor IPC vs. VKA (RR 0,79 95%BI 0,5 tot 1,25) Alle bloedingen werden gerapporteerd in een studie waarbij VKA al één week preoperatief werd gestart. De ACCP schat dat er per 100 patiënten 19 meer bloedingen zullen zijn met VKA en twee minder DVT dan bij het gebruik van IPC. Intermitterende pneumatische compressie /voetpomp vs. LMWH
Mechanische compressie werd vergeleken in vijf studies (twee IPC, drie voetpomp) met >100 patiënten na THP en TKP, soms in combinatie met gegradueerde compressie kousen. Er was een longembolie in de mechanische compressiegroep. Er was een trend naar meer asymptomatische DVT in de mechanische compressiegroep (RR 1,38 95%-BI 0,92 tot 2,06) en minder ernstige bloedingen (RR 0,32 95%-BI 0,12 tot 0,89) hoewel de obervers niet waren geblindeerd bij de beoordelingen van de bloedingen. Er waren drie VTE gerelateerde doden in de mechanische compressiegroep en geen in de LMWH-groep. De ACCP verwacht 10 meer (95%-BI van 4 minder tot 88 meer) VTE per 100 patiënten bij het gebruik van mechanische compressie vs. LMWH en 10 minder (95%-BI: van 2 minder tot 13 minder) ernstige bloedingen.
Draagbare Intermitterende pneumatische compressie in combinatie met acetylsalicylzuur vs. LMWH
In twee trials werden modernere draagbare IPC gecombineerd met acetylsalicylzuur (81 tot 100mg) vergeleken met LMWH bij THP en TKP bij >500 patiënten. Er werd geen effect gevonden van het gebruik van IPC op de incidentie van longembolie door het lage aantal longembolie maar werd een positief effect gevonden van IPC op asymptomatische DVT in een van de trials (gepoolde RR 0,47 95%-BI 0,24 tot 0,91)> Er werden minder ernstige bloedingen gezien bij het gebruik van IPC in een van de studies (RR 0,04 95%-BI 0 tot 0,7). Er was echter sprake van imprecisie door het lage aantal van 42 VTE en 11 bloedingen. Er