BEPALING VAN INTRAOCULAIRE
ANTI-HERPETISCHE ANTISTOFFEN
GOLDMANN-WITMER COËFFICIËNT
Maxim De Maere
Stamnummer: 01204424Promotor: Prof. dr. Elizaveta Padalko
Copromotor: Prof. dr. Ilse De Schryver
Masterproef voorgelegd in het kader tot het behalen van de graad Master of Medicine in de Geneeskunde Academiejaar: 2019 - 2020
Deze pagina is niet beschikbaar omdat ze persoonsgegevens bevat.
Universiteitsbibliotheek Gent, 2021.
This page is not available because it contains personal information.
Ghent University, Library, 2021.
Voorwoord
Het schrijven van deze masterproef is een leerrijke opdracht geweest. Omgaan met nieuwe uitdagingen en obstakels tijdens dit traject brachten me doorzettingsvermogen bij. Mezelf aanpassen aan nieuwe omstandigheden de afgelopen twee jaar was niet gemakkelijk, maar ik heb meer dan ooit gericht probleemoplossend en zelfstandig leren werken.
Het tot stand brengen en voltooien van de experimentele proeven in het klinisch laboratorium was een unieke ervaring.
Ik bedank graag mijn promotor, Prof. Dr. Elizaveta Padalko.
Haar onuitputbaar enthousiasme en behulpzaamheid de laatste maanden waren essentieel voor de realisatie van deze masterproef.
De medewerkers van het labo klinische biologie bedank ik voor de aangename ontvangst. Ook Mevr. Eveline Nys wil ik bedanken voor haar advies en hulp bij de voorbereidingen.
Ten slotte wil ik mijn ouders, mijn zus en vrienden bedanken voor hun steun, begrip en perspectief.
Bedankt,
1
1.
Abstract ... 3
2.
Inleiding ... 4
2.1.
Aandoeningen van het oog ... 5
2.2.
Biologie van de herpesvirussen ... 6
2.3.
Herpes simplex virus ... 7
2.3.1. Epidemiologie ... 7
2.3.2. Levenscyclus en pathogenese ... 8
2.3.3. Symptomatologie ... 10
2.3.4. Oculaire Herpes Simplex ... 11
2.3.5. Preventie ... 15 2.3.6. Behandeling ... 16
2.4.
Varicella-zoster virus ... 17
2.4.1. Epidemiologie ... 17 2.4.2. Levenscyclus en pathogenese ... 17 2.4.3. Symptomatologie ... 19 2.4.4. Oculaire Varicella-Zoster ... 19 2.4.5. Preventie ... 21 2.4.6. Behandeling ... 222.5.
Cytomegalovirus ... 23
2.5.1. Epidemiologie ... 23 2.5.2. Levenscyclus en pathogenese ... 23 2.5.3. Symptomatologie ... 25 2.5.4. Oculaire aandoeningen ... 25 2.5.5. Preventie ... 27 2.5.6. Behandeling ... 272.6.
Laboratorium diagnostiek van oculaire herpetische infecties ... 28
2.6.1. Polymerase chain reaction ... 28
2.6.2. Goldmann-Witmer coëfficiënt ... 28 2.6.3. Vergelijking van PCR en GWC ... 29
3.
Methodologie ... 31
3.1.
Literatuuronderzoek ... 31
3.2.
Procedure staalselectie ... 32
3.2.1. Immunoglobuline G bepaling ... 333.2.2. Bepaling van anti-herpetische antistoffen ... 33
2
3.2.4. Procedure en meting ... 34
4.
Resultaten ... 36
4.1.
Bepaling specifieke antilichamen op de eerste staalselectie ... 36
4.1.1. Anti-HSV-1/2 bepaling op CSF en serum ... 36
4.1.2. Anti-VZV IgG bepaling op CSF en serum ... 37
4.1.3. Anti-CMV IgG bepaling op CSF en serum ... 38
4.2.
Bepaling Goldmann-Witmer coëfficiënt op de tweede staalselectie ... 39
4.2.1. GWC berekening op gepaard CSF en serum ... 39
5.
Discussie ... 43
5.1.
Gebruik ELISA-kit voor GWC berekening ... 43
5.1.1. Vergelijking voorkamervocht, cerebrospinaal vocht en serum ... 43
5.1.2. Evaluatie ELISA-kit (EUROIMMUN) op CSF en serum ... 44
5.1.3. Gebruik ELISA-kit voor GWC-berekening ... 45
5.1.4. GWC-bepaling in de praktijk ... 46
5.2.
Beperkingen en sterktes van de studie ... 47
6.
Conclusie ... 47
7.
Referentielijst ... 48
8.
Bijlage ... 51
8.1.
Bijlage 1: Afkortingenlijst ... 51
8.2.
Bijlage 2: Inhoud Anti-VZV ELISA-kit (EUROIMMUN) ... 52
8.3.
Bijlage 3: Inhoud Anti-CMV ELISA-kit (EUROIMMUN) ... 53
8.4.
Bijlage 4: Kalibratiecurve Anti-HSV-1/2 IgG voor staalselectie 1... 53
8.5.
Bijlage 5: Kalibratiecurve Anti-VZV IgG voor staalselectie 1 ... 54
8.6.
Bijlage 6: Kalibratiecurve Anti-CMV IgG voor Staalselectie 1... 54
8.7.
Bijlage 7: Kalibratiecurve Anti-HSV-1/2 IgG voor staalselectie 2... 55
8.8.
Bijlage 8: Kalibratiecurve Anti-VZV IgG voor staalselectie 2 ... 55
3
1. Abstract
Objectief. De studie heeft als hoofddoelstelling het gebruik van de ELISA-kit (EUROIMMUN) te evalueren voor de bepaling van intra-oculaire anti-herpetische antistoffen voor het berekenen van de Goldmann-Witmer coëfficiënt (GWC). Bijkomend werd getracht de GWC te introduceren in het labo Klinische Biologie UZ Gent voor de detectie van oculaire herpetische infecties.
Methode. Uit het labo-informatiesysteem (LIS) van het UZ Gent werd er retrospectief gezocht naar stalen van cerebrospinaal vocht (CSF) die positief getest waren voor viraal DNA met de Polymerase Chain Reaction (PCR) en naar serumstalen met een positieve immunoglobuline G bepaling. Voor de tweede staalselectie om de GWC te berekenen werd gezocht naar gepaarde CSF en serumstalen, waarvan de afname op dezelfde dag plaats vond en resultaten van totale IgG bepalingen gekend waren.
Resultaten. De eerste staalselectie bestond uit 24 stalen. Voor HSV-1/2 en VZV konden er telkens 10 stalen weerhouden worden waarvan 5 per matrix (CSF, serum). In het geval van CMV konden er door schaarste van de aanvragen voor bepalingen voor CMV slechts 2 CSF stalen weerhouden worden, die negatief waren bevonden door PCR op CMV DNA.
Alle resultaten voor anti-HSV IgG en anti-VZV IgG waren positief wat resulteert in een sensitiviteit van 100% in vergelijking met PCR.
De tweede staalselectie bevatte 24 gepaarde stalen, met een vooraf bepaalde concentratie totale IgG. De specifieke antistoffen voor HSV-1/2, VZV en CMV werden bepaald waarna de Goldmann-Witmer coëfficiënt kon berekend worden.
Er kon slechts bij drie patiënten een GWC bekomen worden. De GWC bij deze patiënten konden niet vergeleken worden met de kliniek aangezien er gebruik werd gemaakt van CSF.
Conclusie. De ELISA-kit van EUROIMMUN werd voldoende sensitief bevonden voor het bepalen van herpes specifieke antilichamen op voorkamervocht en zou bijgevolg gebruikt kunnen worden om de GWC te berekenen. De procedure kan geïntroduceerd worden bij specifieke klinische indicaties op de afdeling klinische biologie van het laboratorium UZ Gent. Prospectieve dubbelblinde studies zijn nodig om de plaats en waarde van de GWC-bepaling in de praktijk te evalueren.
4
2. Inleiding
De Herpesviridae familie bestaat uit meer dan 80 geïdentificeerde pathogenen waarvan er 8 gekende humane virussen zijn. Alle humane Herpesvirussen zijn ongeveer een miljoen jaar geleden gedifferentieerd van een gemeenschappelijke voorouder.
Meestal verlopen herpetische infecties mild of asymptomatisch en vergen ze geen behandeling. Wanneer een van de virussen het oog binnendringt, kunnen er meerdere pathologieën ontstaan die vaak door het recidiverend karakter een belangrijke oorzaak van oculaire morbiditeit zijn. Het herpes simplex virus (HSV), het varicella-zoster virus (VZV) en het cytomegalovirus (CMV) zijn de belangrijkste virussen die oculaire infecties veroorzaken. Het herpes simplex virus infecteert in het oog vaak de cornea met inflammatie tot gevolg, vaak herpes keratitis genoemd. De latente natuur van het virus veroorzaakt episodes van reactivatie die kunnen leiden tot beschadiging van de cornea en neovascularisatie. De infectie van het oog met het HSV is de meest voorkomende oorzaak van infectieuze blindheid in de wereld.(1)
Het varicella-zoster virus is de oorzaak van de ‘waterpokken’ en ‘gordelroos’. Herpes Zoster Oftalmicus (HZO), de infectie van de oogzenuw met het VZV kan geassocieerd worden met ernstige oculaire aandoeningen die kunnen leiden tot chronische inflammatie van de aangetaste structuur. Dit kan leiden tot pijn in het oog, zichtverlies en uiteindelijk blindheid. Het cytomegalovirus tast het oog aan bij immuun gecompromitteerde patiënten, typisch resulterend in een ontsteking van de retina. CMV retinitis is de meest voorkomende oogziekte bij aidspatiënten, maar is in opmars bij mensen met een intact immuunsysteem.
Meestal is de diagnose van herpetische oogziekten een klinische vaststelling. Bij nood aan laboratorische bevestiging kan gebruik gemaakt worden van Polymerase Chain Reaction (PCR), immunofluorescentie of serologische bepalingen.
Er werd beslist om voor deze studie retrospectief te werken omdat het prospectief verzamelen van oculaire stalen voor de drie virussen te lang zou geduurd hebben. Retrospectief werd er gezocht naar stalen van intra-oculair vocht, maar deze waren slechts in kleine aantallen aanwezig en door de kleine afnamevolumes bleef er niet genoeg reststaal over na de initiële analyse voor het uitvoeren van aanvullende bepalingen. Cerebrospinaal vocht (CSF) daarentegen is in grote hoeveelheden aanwezig in het labo. De concentratie van de antilichamen in CSF is vergelijkbaar met die in voorkamervocht, waardoor er werd gekozen om cerebrospinaal vocht te gebruiken als surrogaat matrix. Vervolgens werd er gezocht naar een geschikte kit die zowel voor CSF als serum kon gebruikt worden.
5 Ik heb samen met de medewerkers van het labo klinische biologie mij de handmatige ELISA-techniek eigen gemaakt. Hierna heb ik zelfstandig de proeven uitgevoerd en in overleg met de medewerkers en mijn promotor de resultaten besproken.
Hieronder wordt er relevante informatie over de onderzochte virussen en gebruikte technieken gegeven alvorens over te gaan tot de beschrijving van de methodologie en de rapportering van de resultaten. Ten slotte worden de bevindingen besproken onder de rubriek discussie.
2.1. Aandoeningen van het oog
Inflammatie van het oog kan zowel van infectieuze als immunologische aard zijn en wordt steeds als uveïtis benoemd.
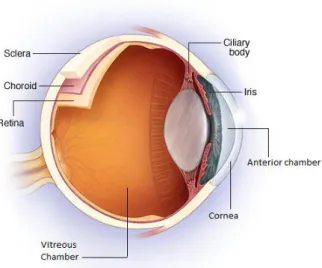
De term is afgeleid van de uvea die vaak getroffen wordt bij inflammatoire aandoeningen. De uvea bestaat uit de iris, het corpus ciliare en de choroïdea die ook wel het vaatvlies genoemd wordt, omdat deze de retina van bloed voorziet. De retina is het netvlies en is verantwoordelijk voor het opvangen en verwerken van binnenkomend licht. Uveïtis beperkt zich dus niet tot de uvea en de uvea moet ook niet aangetast zijn om over uveïtis te spreken.
Afhankelijk van de anatomische lokalisatie van de inflammatie kan deze aandoening gecategoriseerd worden in anterieure, intermediare en posterieure uveïtis. Er wordt gesproken van anterieure uveïtis bij inflammatie van het voorste deel van het oog namelijk de iris, de cornea en het corpus ciliare, waarbij vaak inflammatoire factoren of etiologische pathogenen in het voorkamervocht aanwezig zijn. Dit is de meest voorkomende vorm van uveïtis. (2) Posterieure uveitis wordt gedefinieerd als inflammatie van de retina, choroïdea en oogzenuw. Wanneer er inflammatie van het vitreum, dat ook wel glasvocht wordt genoemd, optreed spreekt men van intermediaire uveïtis.
6
2.2. Biologie van de herpesvirussen
De herpesvirussen VZV, HSV en CMV zijn sferische micro-organismen met respectievelijk een diameter van 80 tot 120 nm, 120 tot 150 nm en 150 nm tot 200 nm. Het cytomegalovirus is daardoor een van de grootste ziekteverwekkende virussen. (3)(4)(5)
De drie virussen hebben een gelijkaardige structuur. De virussen zijn opgebouwd uit 3 hoofdcomponenten. Centraal bevindt zich het nucleocapside, een kernmembraan dat opgebouwd is uit eiwitten en waarin het virale genoom zich bevindt. Het capside heeft een icosahedrale vorm. Hier rond bevindt zich het tegument, dat eiwitten met een regulatorische functie bevat. (3,4,5)
Het tegument is op zijn beurt omringd door de virale enveloppe. Het binnenste membraan van de enveloppe is opgebouwd uit ‘messenger’ RNA en eiwitten terwijl het buitenste een dubbel lipide membraan is bezet met glycoproteïnen. Deze helpen het virus bij het binnendringen van het membraan van de gastheercel. Afhankelijk van het type van gastheercel kan het virus fuseren met de cel of endocytose ondergaan. (6) Meerdere genen die instaan voor essentiële virale processen en de aanmaak van bepaalde glycoproteïnes zijn geconserveerd tijdens differentiatie en aanwezig bij alle herpesvirussen. (3)
7
2.3. Herpes simplex virus
Het herpes simplex virus (HSV) maakt deel uit van de Alfaherpesvirinae subfamilie. Aangezien de mens de enige natuurlijke gastheer is voor HSV, is er een nauwe associatie ontstaan tussen verschillende takken van de Herpesfamilie en de menselijke populatie doorheen de geschiedenis. HSV is endemisch in praktisch elke samenleving, van ontwikkelde maatschappijen tot afgelegen inheemse bevolkingen. (6)
De humane herpes simplex virussen zorgen voor een besmettelijke infectie en blijven latent aanwezig in hun gastheer gedurende diens hele leven. De twee serotypes, HSV-1 en HSV-2 delen een gelijkaardige opbouw in hun DNA-sequentie en zijn bijna 70% genetisch homoloog. Zij verschillen vooral door hun unieke envelop samenstelling. (6) Ook de klinische presentatie is variabel voor elk van beide types en worden beïnvloed door factoren zoals de weg van de besmetting, competentie van het immuunsysteem van de gastheer en de primaire of secundaire aard van de ziekte.
2.3.1. Epidemiologie
De globale incidentie van besmetting met het HSV1 wordt geschat op 80-90% van de bevolking. Er heerst een grote variabiliteit in prevalentie afhankelijk van land, socio-economische status (SES), geslacht, etniciteit en leeftijd. Er zijn intercontinentale verschillen met een seroprevalentie in de US van >50%, in Duitsland >75%, en in Tanzania >90%. (7, 8) HSV werd teruggevonden in de trigeminale ganglia van kadavers door PCR bij 20% dat ouder was dan 20jaar en bij ongeveer 100% van de mensen ouder dan 60 jaar. (1)
Het verschil in voorkomen tussen ontwikkelingslanden en de westerse landen kan een gevolg zijn van betere leefomstandigheden en meer hygiëne wat leidt tot minder blootstelling aan het virus. (8)
De jaarlijkse incidentie van oculaire HSV-infectie wordt geschat op 11,8 per 100.000 (Verenigde staten) en een incidentie van 18,3 recidieven per 100.000 individuen per jaar. (9) Er is geen eenduidig beeld van de prevalentie van HSV-2. Er wordt geschat dat minstens 20% van de wereldbevolking besmet is en het virus meer voorkomt bij vrouwen. (8) De prevalentie is zeer laag tijdens de kindertijd, stijgt met de jaren en behaalt zijn hoogtepunt rond 40 jaar. (10)
Een deel van de westerse bevolking komt later in contact met HSV-1 en is hiervoor dus seronegatief, wanneer ze geconfronteerd worden met genitale HSV-1 of HSV-2 infecties. Dit leidt tot een ernstigere symptomatologie en verhoogde kans op transmissie. (11)
8 Recent werd aangetoond dat een primaire infectie bij de moeder de meest belangrijke predictieve factor is voor overdracht naar de foetus. Het risico op transmissie is het grootst bij vrouwen die tijdens de tweede helft van de zwangerschap een primaire infectie doormaken. (10) Deze shift kan dus indirect de incidentie van neonatale HSV, samen met de oculaire complicaties, verhogen. (7)
Positief predictieve factoren voor besmetting met HSV-1 zijn het vrouwelijk geslacht, Afrikaanse etniciteit, eerste seksueel contact voor de leeftijd van 15 jaar, de totale duur van seksuele activiteit en de aanwezigheid van orale aantasting bij de partner. (6, 7, 11) Factoren die de kans op het verwerven van HSV-2 verhogen zijn het vrouwelijk geslacht, de Afrikaanse en Zuid-Amerikaanse etniciteit, hogere leeftijd, lager niveau van educatie, armoede, bacteriële vaginose, cocaïnegebruik en het hebben van meerdere seksuele partners. (7, 10)
2.3.2. Levenscyclus en pathogenese
Infectie met HSV begint bij direct contact met een laesie van een besmettelijk individu of geïnfecteerde lichaamsvocht. 1 is voornamelijk aanwezig in orale secreties, terwijl HSV-2 meestal verspreid wordt via genitale secreties. Besmetting kan ook optreden via contact met ademhalingsdruppels of mucocutane secreties van een persoon met asymptomatische loslating van HSV. De initiële infectie met HSV-1 is typisch het gevolg van het krijgen van een kus door de ouders en uit zich meestal als een acute oropharyngitis. (11)
Het herpes simplex virus type 1 infecteert de orale mucosa door te binden met specifieke receptoren op het celmembraan van de epitheliale cellen. Receptorbinding leidt tot fusie van de enveloppe met het plasmamembraan van de cel. Na het binnendringen van de cel annuleert het HSV de eiwitsynthese van de gastheercel door mRNA moleculen af te breken. Het viraal capside wordt, eens deze zich in het cytoplasma bevindt, getransporteerd naar de nucleaire porie waardoor het zijn viraal DNA loslaat in de nucleus. Hier wordt het viraal genoom gerepliceerd, worden structurele proteïnes gesynthetiseerd en het nucleocapside opnieuw aangemaakt. Replicatie van het virus resulteert na afloop in de productie van virale deeltjes die uiteindelijk celdood veroorzaken. De cytopathologische effecten van virale infectie zijn nucleolaire zwelling en fragmentatie, gevolgd door verplaatsing van chromatine naar de nucleaire periferie en uiteindelijk chromosomale alteraties. (3) Replicatie duurt vijf tot zes dagen, maar de incubatietijd kan variëren van 1 tot 28dagen. (6, 8)
9
Figuur 3. Transport van het virus naar de nucleus en injectie van het viraal DNA (3)
Ongeacht de klinische presentatie van de primaire infectie zal het virus zich retrograad verplaatsen door de peri-axonale schede van de sensorische takken naar neuronale cellichamen van de trigeminale, cervicale, lumbosacrale of autonome ganglia van het zenuwstelsel van de gastheer. De trigeminale en sacrale ganglia zijn de voorkeurslocatie voor respectievelijk HSV-1 en HSV-2. (3, 6, 7, 8)
Beide virussen hebben echter wel het vermogen om hetzelfde stelsel te gaan infecteren wat aantoont dat lokale factoren de voorkeurslocatie van beide virussen beïnvloeden. Het feit dat de twee serotypes van het virus kunnen gedifferentieerd worden op basis van hun besmettingsweg is een lang aanvaarde en verkeerde opvatting. (1, 3, 8)
Bovendien dient de aangetaste tak van het ganglion niet de initiële locatie van besmetting te innerveren. De snelheid waarmee het virus zich verspreidt is geassocieerd met de lengte van de axonen waarlangs het virus zich verplaatst. (11)
Eens toegekomen in het neuron zal het virus chronisch latent aanwezig blijven voor de rest van het leven van de gastheer. Tijdens latentie wordt de DNA replicatie gelimiteerd als een gevolg van aangepaste genexpressie door een unieke set 'Latency-associated transcripts' (LATs). De moleculaire basis is ongekend maar het mechanisme is suggestief voor epigenetische regulatie zoals DNA methylatie. (3)
10 De chronische immuunrespons die bij latentie voorkomt kan worden waargenomen als een stijging van de hoeveelheid cytokines in het geïnfecteerd ganglion en de aanwezigheid van CD8+ en CD68+ macrofagen errond. (11)
Wanneer HSV1 wordt gereactiveerd verspreiden de geproduceerde virale partikels van de geïnfecteerde neuronen via anterograad axonaal transport naar mucocutane locaties en kunnen ze ook losgelaten worden in het speeksel. Het virus kan afdalen langs elke zenuw dat geïnnerveerd wordt door dat ganglion. (8)
Herhaaldelijke episodes van virale reactivatie verhogen de besmettelijkheid. Virale reactivatie kan ook leiden tot het asymptomatisch loslaten van virale deeltjes in afwezigheid van een klinisch ziektebeeld. (1, 6) Asymptomatische loslating van HSV-1 partikels in mucosale secreties treedt afwisselend op in 80% van de geïnfecteerde personen. (7) Spontane opstoten van virale replicatie zijn mogelijk, maar de omzetting van het virus van een latente naar een proliferatieve staat is meestal het gevolg van interne en externe triggers: psychologische stress, vermoeidheid, koorts, immunosuppressie, enz.
Algemeen kan de levenscyclus van de HSV infectie beschreven worden als een chronische infectie van de sensorische ganglia met een variabel verloop van expressie.
2.3.3. Symptomatologie
De verschillende aandoeningen en symptomatologie zijn afhankelijk van de weg van besmetting, de immuniteit van de gastheer en de lokale afweermechanismen. (11)
Men spreekt van een primaire infectie wanneer er voor het eerst een infectie met HSV optreedt bij een persoon die seronegatief is voor HSV-1 en HSV-2. Meer dan 60% van de primaire infecties zowel door HSV-1 als door HSV-2 verlopen asymptomatisch of blijven onontdekt. Er is gerapporteerd dat primaire infecties zich klinisch manifesteren in slechts 1% tot 6% van de gevallen. (7)
Een HSV-1/2 infectie gaat hoofdzakelijk gepaard met een orale, pharyngeale, faciale, oculaire aantasting als gevolg van de verspreiding volgens het centraal zenuwstelsel. HSV-2 daarentegen uit zich meestal als een anogenitale infectie. (6,11) Klassiek zal het virus een gebied kiezen met een hoge densiteit aan sensorische receptoren zoals de cornea, orale en genitale mucosa, lippen en vingertoppen. (8)
De klinische presentatie van pasgeborenen met neonatale HSV is bijna steeds symptomatisch en vaak dodelijk. De infectie is getypeerd door huidwondjes of littekens, aantasting van het oog (chorioretinitis, microphthalmia, cataract), neurologische schade, groei retardatie en psychomotore ontwikkelingsachterstand ten gevolge van encefalitis. (10)
11
2.3.4. Oculaire Herpes Simplex
2.3.4.1. Incidentie
Herpetische oculaire aandoeningen ontwikkelen zich in minder dan 1% van de populatie die seropositief is voor Herpes Simplex. (12) De jaarlijkse incidentie wordt door Young et al. geschat op 11.8 per 100 000 inwoners in de Verenigde Staten. (4) In ontwikkelende landen ligt de prevalentie op 149 gevallen per 100 000. (12)
Oculaire aandoeningen ten gevolge van HSV type 1 komen voor het eerst voor op een gemiddelde leeftijd van 37 jaar in de Verenigde Staten en 25 jaar in Groot-Brittannië. (9) Oculaire HSV-2 infecties worden meer gevonden bij neonaten die het virus in utero, tijdens de bevalling of postnataal verworven hebben. HSV2 kan zich ook uitzonderlijk oculair manifesteren bij volwassenen. Epitheliale keratitis is de meest prevalente vorm van oculaire herpesinfecties verantwoordelijk voor 50-80%. (3,8)
2.3.4.2. Klinische presentatie
Reactivatie van latent HSV is meestal de eerste presentatie van een klinisch zichtbare oculaire aandoening en wordt vaak oculaire herpes genoemd. (1) Een infectie als gevolg van directe inoculatie van het virus op het oogoppervlak of door retrograad transport tijdens de primaire orolabiale infectie kan voorkomen bij kinderen, maar is uitzonderlijk bij de immuun competente volwassene.
Het manifesteert zich meestal als een folliculaire conjuctivitis met al dan niet inflammatie van het ooglid, blefaritis.(1, (13), 8)
Het virus kan zich verspreiden naar de rest van het oog of rechtstreeks andere oculaire structuren aantasten en aanleiding geven tot keratitis, anterieure uveïtis, iridocyclitis of retinitis. Bij de primaire episode was de conjuctiva in 54% van de gevallen betrokken, de oppervlakkige cornea in 63%, de diepe lagen van de cornea in 6% en de uvea in 4%. (7) Recidieven kunnen uitgelokt worden door koorts, hormonale veranderingen, ultraviolet blootstelling, psychologische stress, oogtrauma en aantasting van de trigeminus zenuw. Recidieven komen frequenter voor na elke opstoot waarbij het interval tussen twee opeenvolgende episodes ook steeds verkleint. Meestal is het type aandoening bij een recidief gelijk aan de in het verleden doorgemaakte variant. (7)
12
2.3.4.3. Herpes keratitis
De ontsteking en inflammatie van de cornea, wat herpes simplex keratitis wordt genoemd, is typisch voor HSV. De keratitis kan geïsoleerd voorkomen of in combinatie met andere vormen van anterieure uveïtis. HSV keratitis is de meest voorkomende vorm van keratitis en de belangrijkste oorzaak van blindheid in de wereld. (3)
Bij aantasting van de cornea kunnen de laesies zich bevinden op de epitheliale laag of dieper in de stromale laag, respectievelijk infectieuze epitheliale keratitis en stromale keratitis genoemd. Bij volwassenen komt de epitheliale keratitis meer voor als oculaire manifestatie van HSV infectie, terwijl kinderen vaker stromale keratitis ontwikkelen als gevolg van een sterker inflammatoir antwoord. Kinderen hebben ook een groter risico op herhaalde episodes
en op het ontwikkelen van complicaties zoals corneale littekens en verminderde visus. (1, 3, 8, 11)
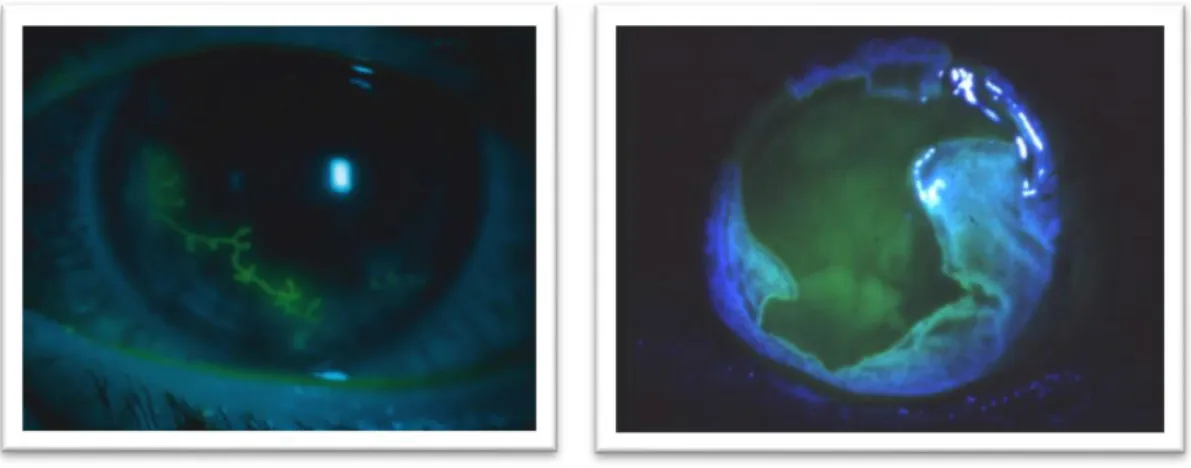
De infectie begint met de aanwezigheid van meerdere kleine zones van epitheliale letsels die gepuncteerde epitheliale keratitis genoemd worden. Door de snelle replicatie zwellen de cellen op en barsten open met de verspreiding van het virus naar de omgeving tot gevolg. (12)
De gestippelde letsels groeien in aantal en vloeien samen tot een dendritisch letsel. (9) Na aantasting van het basaalmembraan ontstaat er een centrale necrose afgelijnd door
verheven randen, als gevolg van de voorschrijnende epitheliolyse. De dentritische keratitis bij HSV vertoont lineaire vertakkingen die uitlopen op vergrote ronde uiteinden (bulbae). De basis van de corneale verzwering kan worden aangekleurd met fluoresceïne. De centrale ulceratie vergroot in 22% van de gevallen, wat aanleiding geeft tot een geografisch letsel dat gepaard gaat met ernstige corneale erosie. (12), 9)
13 Patiënten lijdend aan epitheliale keratitis rapporteren pijn, gevoeligheid aan het licht (fotofobie), verhoogde traanproductie, wazig zicht en roodheid van het aangetaste oog en conjuctiva. Na afloop kan er verminderde sensatie in de cornea optreden. De ernst van de corneale hypoesthesie is gecorreleerd met het aantal en de ernst van de keratitis episodes. (3, 8, 9, 12)
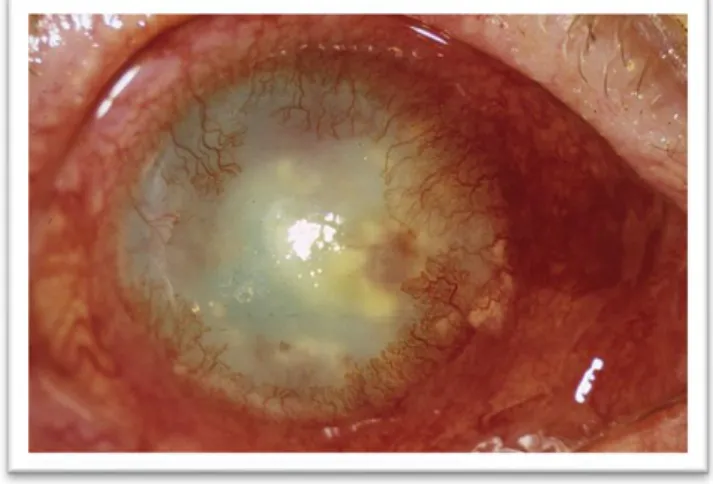
Herpetische Stromale Keratitis (HSK) wordt gezien in 2% van de primaire en 20-48% van de recidieve HSV-infecties. (12) HSK is additief aan de epitheliale vorm in 30% van de gevallen. (8) Stromale keratitis kan onderverdeeld worden in twee types, een necrotiserende vorm en een immunologische vorm. De meer voorkomende immunologische vorm heeft als oorzaak herhaalde infecties van het stroma van de cornea. Overblijvende virale deeltjes die na een infectie een sterke immuunreactie uitlokken liggen waarschijnlijk aan de oorzaak.(12)(8) Bij de necrotiserende stromale keratitis zorgt de virale infiltratie voor rechtstreekse cytotoxische effecten met ulceratie en een forse inflammatoire reactie. Aantasting van de epitheel laag kan voorkomen, maar is niet altijd aanwezig. Grijs-witte homogene abcessen worden gevormd en brengen oedeem in de intermediaire laag van de cornea met zich mee. Acuut treedt er vaak ook een ernstige iridocyclitis op met verhoogde intraoculaire druk. De destructieve inflammatie kan wanneer onbehandeld, leiden tot verdunning van de cornea of perforatie. (8,9) De gevolgen van de vaak herhaalde stromale aantasting zijn opaciteit, oedeem en neovascularisatie van het stroma. De neovascularisatie is de aanmaak en ingroei van nieuwe vaatnetwerken in het stroma en kan de passage van licht door het oog bemoeilijken alsook toegang geven voor de afzetting van lipiden, eiwitten en inflammatoire factoren in dit weefsel. Dit alles resulteert in structurele schade van de cornea met de aanmaak van littekenweefsel. Wanneer keratitis herhaaldelijk voorkomt kan dit leiden tot irreversibel littekenvorming en daling van de visuele capaciteit. (1,3,8,9,12)
Figuur 5. Close-up van herpes simplex stromale keratitis met duidelijke opacificatie en neovascularisatie van de cornea. (6)
14 Bij recurrente HSV-keratitis kan er ook endotheliitis, ook wel endotheliale keratitis genoemd, of neurotrofische keratopathie (NK) optreden. Men spreekt van endotheliitis wanneer het virus doordringt tot in de binnenste laag van de cornea, verantwoordelijk voor het behouden van de doorlaatbaarheid van de cornea. Inflammatie zorgt voor de disfunctie van deze endotheelcellen en beschadigt de vochtpomp. (8, 9)
Oedeem van de cornea zonder tekenen van inflammatie in het stroma is indicatief voor endotheliitis. Het kan echter ook herkend worden door de aanwezigheid van keratotische neerslag ook het gevolg van inflammatie. Neurotrofische keratopathie daarentegen is een degeneratieve corneale aandoening gekarakteriseerd door een verminderd of afwezig gevoel in de cornea. Het heeft een multifactoriële oorzaak, komt vaak voor na een lang traject van dentritische ulceraties, waarvoor antivirale behandeling wordt gegeven resulterend in aantasting van de nervus trigeminus, schade aan het basaalmembraan en inflammatie van de cornea. Afhankelijk van de duur en ernst geeft keratopathie aanleiding tot verminderde traansecretie, daling van de zichtkwaliteit, aanhoudende corneale epitheliale defecten en ulcers, stromale opaficatie en corneale neovascularisatie. (8,9)
2.3.4.4. Atypische presentatie
HSV kan ook nog iridocyclitis, panuveitis retinitis en acute retinale necrose veroorzaken hoewel deze pathologieën uitzonderlijk zijn bij de immuuncompetente individu.
Acute retinale necrose (ARN) is een complicatie en ernstige vorm van HSV retinitis. Aantasting van de retina begint bij de infectie van de retinale bloedvaten (vasculitis) vaak gecombineerd met een diffuse uveïtis. (3)
Oculaire herpes is hoofdzakelijk een unilaterale ziekte, maar in 1.3-12% van de gevallen komt het bilateraal voor. Bilaterale infecties hebben de neiging om een ernstigere kliniek te vertonen en komen meestal voor bij jongere individuen. (8)
Het herhalende karakter van de aantasting van het oculair weefsel zorgt voor een hoge morbiditeit door beschadiging van essentiële structuren en visusdaling of uiteindelijk blindheid tot gevolg.
15
Figuur 6. HSK met centrale opaciteit, leidend tot zicht verlies. (9)
Figuur 7. Dezelfde patiënt twee jaar later, na keratoplastie en discontinuatie van de postoperatieve medicatie wijzend op het recurrente karakter van herpes simplex keratitis. (9)
2.3.5. Preventie
De hoge prevalentie in de algemene bevolking in combinatie met het vaak asymptomatisch voorkomen van de primaire HSV infectie maakt de preventie van initiële infectie secundair ten opzichte van het reduceren van de besmettelijkheid, zowel symptomatische als asymptomatische ‘shedding’, en het beperken van de recurrente episodes. (11)
Een belangrijk hard eindpunt van de HSV infectie is de virale replicatie die in de eerste 48uur van een reactivatie optreedt. Bijgevolg is een snelle werking ter hoogte van locatie van replicatie essentieel in het voorkomen van een recurrente episode van HSV. (6) Verder is het voorkomen van blootstelling aan het virus tijdens de partum essentieel wanneer de primaire infectie laattijdig in de zwangerschap optreedt. (10)
16 Voor stromale keratitis werd gevonden dat een profylactische onderhoudsbehandeling met orale acyclovir effectief was in het verminderen van het aantal terugkerende episodes met 50%. (6)
Er zijn momenteel geen werkende vaccins tegen HSV-1 en HSV-2 voorhanden. De ontwikkeling van een vaccin dat met een subunit bescherming biedt tegen genitale HSV-1 infectie is al een stap in de juiste richting maar verder onderzoek is nog nodig. (13) (8)
2.3.6. Behandeling
Bij de immuun competente patiënt is behandeling bij HSV zelden aangewezen. Systemische acyclovir of lokale applicatie van Docosanol 10% crème zijn effectief in het verkorten van de ziekteduur bij extraoculaire aandoeningen.
De primaire oculaire infectie is ook vaak zelflimiterend, maar behandeling met orale antivirale medicatie, acyclovir 400mg 5xper dag of valacyclovir 1g 2x per dag gedurende 10 dagen, verlaagt de duur van de symptomen. (6)
HSV epitheliale keratitis kan behandeld worden door de basis van de ulceratie te kuisen en lokale topische antivirale trifluridine 1% (8 maal per dag) of gangciclovir 0.15% (5 maal per dag) aan te brengen. Aangezien antiviraal lokaal cytotoxisch is, kan ook de orale vorm gebruikt worden. Vergelijkende studies tussen de effectiviteit van beide ontbreken. (6)
De HEDS (Herpetic eye disease study) groep hebben aangetoond dat topisch corticosteroïd in combinatie met topische antivirale therapie effectief is in het verminderen van de stromale inflammatie en het verkorten van de duur van de symptomen. (6)
Alle kinderen waarbij een HSV-infectie vermoed wordt of gediagnosticeerd is, moeten behandeld worden met intraveneuze antivirale therapie door acyclovir 60mg/kg/dag. Neonatale herpes die gelokaliseerd is ter hoogte van de huid, ogen en mucosa wordt gedurende 14 dagen behandeld terwijl algemene aantasting of infectie van het centraal zenuwstelsel 21 dagen therapie vraagt. (10)
17
2.4. Varicella-zoster virus
Het varicella zoster virus (VZV) is de oorzakelijke kiem van de waterpokken en gordelroos. De waterpokken zijn een manifestatie van de primaire infectie, waarna het virus zoals het herpes simplex virus en cytomegalovirus latent aanwezig blijft in het centraal zenuwstelsel. Gordelroos is een reactivatie van het virus uit zijn slapende vorm en treedt op naarmate de leeftijd van de drager stijgt of het immuunsysteem gecompromitteerd is. Dit is vaak het geval bij patiënten onder immunosuppressie, recipiënten van orgaantransplantatie en patiënten met aids of een carcinogene pathologie. Na regressie van de symptomen kan Zoster gevolgd worden door een grote variatie aan pathologieën. (14)
2.4.1. Epidemiologie
Kilgore et al. heeft in 2003 aan de hand van de antilichaambepaling van anti-VZV immunoglobuline G bij 21 288 individuen aangetoond dat VZV ongeveer 99% van deze populatie heeft besmet. ZVZ wordt dus aanzien als een van de meest voorkomende pathogenen aanwezig in het centraal zenuwstelsel. (14)
2.4.2. Levenscyclus en pathogenese
Varicella, of de waterpokken, is een zeer besmettelijke infectie die voor de tijd van de immunisatie praktisch elk kind doormaakte.
Het virus verspreidt zich via contact met lichaamsvochten maar kan ook transplacentair worden doorgegeven. (8)
Primaire VZV-infectie begint met de besmetting van de orale mucosa en het respiratoir epitheel van de nasofarynx. Hier vindt de eerste replicatie plaats.
Het virus verspreidt zich naar de tonsillen en ander lokaal lymfoïd weefsel. Na 48-72uur verplaatst het virus zich naar T-cellen in het tonsillair lymfoïd weefsel, direct of via infectie van dentritische cellen (DC). Vervolgens wordt het virus door deze T-cellen naar de bloedbaan en de huid gebracht met een subklinische viremie tot gevolg. (4, 14, 15)
Tijdens een tweede incubatieperiode van 10-21 dagen repliceert het virus in de mucosale en epitheliale cellen van de respiratoire tractus. (4, 8)
Na deze incubatietijd uit het virus zich als een algemene vesiculaire uitslag ter hoogte van de huid typisch voor Varicella, samenvallend met een tweede viremische fase. Bij patiënten met een intact immuunsysteem zullen humorale specifieke anti-VZV antilichamen snel het virus in de bloedbaan klaren terwijl een lymfocyt gemedieerde immuunrespons de intracellulaire virale lading verminderd. Langdurige viremie komt voor bij immuun incompetente patiënten.
18 (4,14,15) Het virus zal via retrograad transport door de sensorische zenuwcellen verspreiden naar het centraal zenuwstelsel. Het blijft latent aanwezig in de ganglia van de craniale zenuwen, voornamelijk het ganglion trigeminus, de dorsale wortels en de autonome ganglia. (4)
Bij heractivatie door onderdrukking van de lokale of systemische immunologische afweermechanismen kan het virus een lokale infectie veroorzaken, zoster of gordelroos genaamd. Het virus verplaatst zich door de neuronen en satellietcellen langs de sensorische banen naar de huid of het oog. De infectie verspreidt zich volgens het dermatoom van de geïnfecteerde zenuwbaan. (4) Eens aangekomen verspreidt het virus zich intercellulair tot het doorbreekt door de huid en een vesiculaire besmettelijke uitslag teweegbrengt.
De leeftijd van de gastheer is de belangrijkste voorspellende factor van een Zoster infectie. Veroudering zorgt voor veranderingen in de T-cellen en een vermindering van het aantal neutraliserende anti-VZV antilichamen, waardoor het virus weer een kans heeft om te reactiveren. Dit is ook het geval wanneer het immuunsysteem wordt onderdrukt door maligniteit of immunosuppressieve therapie. (8)
19
2.4.3. Symptomatologie
Varicella wordt gekarakteriseerd door een acuut klinisch beeld dat bestaat uit koorts, malaise, hoofdpijn, vermagering, keelpijn en een mucocutaan exantheem met een jeukende vesiculaire uitslag op de huid. Deze vesikels hebben ongeveer een week nodig om te barsten en door korstvorming bedekt te worden. Vanaf dit moment zijn de vesikels niet meer besmettelijk. (8) Gordelroos presenteert zich meestal als een unilaterale pijnlijke vesiculaire uitslag die verdeeld is volgens het dermatoon van de thoracale zenuwen in 56% en de trigeminale zenuwen in 15% van de gevallen (8). De symptomen worden meestal voorafgegaan door een prodroom van koorts, malaise, hoofdpijn en pijn in het geïnfecteerd dermatoom. De initiële doorbraak van HZO kan met of zonder vesiculaire uitslag van de huid gepaard gaan, in het laatste geval ‘Zoster sine herpete’ genoemd.
Van de oudere bevolking die seropositief is voor VZV zal de helft complicaties ondervinden. De meest frequente complicatie is de postherpetische neuralgie (PHN), een chronisch neuropathisch pijnsyndroom dat maanden tot jaren kan persisteren. Herpes Zoster Oftalmicus (HZO) is de tweede meest voorkomende complicatie. (8)
2.4.4. Oculaire Varicella-Zoster
De oculaire presentatie kan onderverdeeld worden in de gevolgen van Varicella en die van Zoster met de meer ernstige symptomen voorkomend bij Zoster. Varicella manifesteert zich oculair meestal als een milde conjuctivitis en episcleritis. Bijkomende aantasting van de cornea kan voorkomen als ronde focale verzamelingen van lymfocyten en inflammatoire cellen. Deze aantasting is meestal mild en verdwijnt uit zichzelf na 1 tot 2 weken.
Herpes Zoster Oftalmicus (HZO) ontstaat door de infectie van de nervus oftalmicus die ontstaat uit trigeminale zenuwbundel. De nervus oftalmicus splitst verder in drie takken, de nervus nasociliare, de nervus frontalis en de nervus lacrimalis. De frontale tak is het meest frequent aangetast. De nasociliare zenuw innerveert de anterieure en posterieure ethmoïdale sinussen, de huid van beide oogleden, het topje van de neus, de conjuctiva rond het oog, de sclera, cornea, iris en het choroïdeum. HZO komt voor in 10-20% van de patiënten met een Zoster infectie. De infectie wordt ook zoals cutane zoster infectie voorafgegaan door een prodrome fase van koorts, hoofdpijn, malaise en pijn in het oog. (16)
20
Figuur 9. Traject en vertakkingen van de nervus oftalmicus. (17)
Het spectrum van symptomen is breed en afhankelijk van de geïnfecteerde structuur. De meest voorkomende oculaire aandoeningen zijn keratitis (76%), uveïtis (47%) en conjuctivitis (35%). (8)
HZO geassocieerde conjuctivitis geeft oedemateuze opzetting en petechiale bloedingen. Vaak zijn in zulke gevallen ook de oogleden betrokken. Patiënten kunnen blefaritis ontwikkelen en vertonen een ptose die het gevolg is van oedeem en inflammatie en gepaard gaat met vesiculaire aantasting van het geïnfecteerde ooglid.
Corneale infectie kan zich manifesteren als epitheliale keratitis, dendritisch of gepuncteerd, anterieure (nummulaire) en diepe stromale keratitis. Aantasting en beschadiging zijn het gevolg van directe infectie, antilichaam reacties, celgemedieerde hypersensitiviteitsreacties en neurotrofische schade.(1, 8, 17)
Er zijn noemenswaardige funduscopische verschillen met de herpes simplex keratitis. Dentritische uitlopers bij VZV vormen een medusa patroon, zijn verheven en niet uitgehold. De dendrieten zijn ook kleiner en hebben geen terminale bulbae, maar zijn scherp afgelijnd. (16)
Zowel de gestippelde als de dendritische aantasting kunnen leiden tot anterieure stromale corneale infiltraties. Bij deze aandoening worden meerdere granulaire infiltraties gevonden die meestal vlak onder zones van epitheliale keratitis liggen. Wanneer de infectie aanhoudt kunnen de infiltraties alle lagen van de cornea treffen en diepe stromale keratitis veroorzaken. Dit is een laattijdige manifestatie die pas naar 3 maanden vanaf de start van de symptomen gezien wordt.
21 Corneale inflammatie is dan vaak prominent, in combinatie met inflammatie van de voorkamer. Neurotrofische keratopathie is, zoals bij HSV, het eindstadium van keratitis met verdunning van de cornea en risico op perforatie. (17)
Acute retinale necrose is ook een complicatie die bij HZO kan voorkomen. De ernstigere versie, progressieve outer retinal necrose, wordt gezien bij immunogecomprimeerde patiënten. Beide aandoeningen kunnen leiden tot retinale loslating en uiteindelijk blindheid. (8)
Anterieure Uveïtis is vaak geassocieerd met HZO. De inflammatie is meestal mild en zelflimiterend, maar gaat gepaard met een lichte verhoging van de intraoculaire druk. Bij chronische inflammatie worden de endotheelcellen van de cornea beschadigd en kan ook cornea oedeem optreden. Wanneer de aandoening onbehandeld persisteert kunnen iris atrofie, corectopie, glaucoom en cataract voorkomen. (17)
De complicaties van HZO zorgen voor ernstige visuele aantasting. Patiënten rapporteren klachten die gaan van pijn in het oog en lichtgevoeligheid tot daling van de visuele functie door corneale neovascularisatie, verdunning en perforatie. (17)
Oculaire aandoeningen kunnen aansluitend volgen op HZO of door een cellulaire hypersensitiviteitsreactie jaren na de initiële presentatie van zoster optreden.
2.4.5. Preventie
Vaccinatie tegen het Varicella is commercieel beschikbaar. Varivax is een levend verzwakt vaccin, ontwikkeld uit een japanse variant van het varicella-zoster virus. Voor Zoster bestaat er sinds 2006 een goedgekeurd vaccin, Zostavax, dat gebruikt wordt bij patiënten ouder dan 50 jaar. Het is een vaccin dat dezelfde VZV-variant gebruikt, maar met een veel hogere virale lading. Het stimuleert de cellulaire immuniteit en verlaagt hierdoor de prevalentie van zoster opstoten alsook het voorkomen van gerelateerde morbiditeit en complicaties. Het gebruik van dit vaccin is niet aangewezen bij patiënten met een aangetast immuunsysteem. (8)
22
2.4.6. Behandeling
Algemeen gezien is Varicella bij de gezonde individu een zelflimiterend ziekte die geen behandeling vergt.
Varicella en Zoster kunnen tijdens de primaire infectie behandeld worden met valacyclovir, resulterend in een reductie van de duur en ernst van de symptomen inclusief de acute pijn. Voor patiënten onder immunosuppressiva is intraveneuze acyclovir gedurende 5-7 dagen aanbevolen en verlaagt de morbiditeit en mortaliteit. (14, 18)
Herpes Zoster Oftalmicus is meestal mild en zou zichzelf zonder medicatie kunnen oplossen. Er is echter aangetoond dat behandeling met acyclovir (800mg, 5 maal daags gedurende 7 tot 10 dagen), valacyclovir (1000mg, 3 maal daags gedurende 7 tot 14 dagen) of famciclovir (500mg, 3 keer per dag voor 7 dagen), toegediend binnen de 72 uur na de eerste symptomen, de duur en de ernst van de ziekte verminderen alsook de incidentie van oculaire complicaties en PHN. Bij immuungecompromitteerde patiënten is intraveneuze toediening van acyclovir aangewezen. De laattijdige complicaties van HZO reageren niet op antivirale therapie maar eisen lokale applicatie van corticosteroïden, meestal langdurig. Lokale anesthetica dient vermeden te worden aangezien deze cytotoxisch is voor de cornea. (8, 17)
23
2.5. Cytomegalovirus
Het humaan cytomegalovirus is het vijfde virus van de Herpesviridae familie en een van de grootste ziekteverwekkende virussen. Dit virus werd voor het eerst geïdentificeerd bij gezonde individuen die een mononucleose beeld vertoonden.
Transmissie is hoog op lage leeftijd en het grootste deel van de bevolking maakt de primaire infectie als kind door. In het gezonde individu dat immuun competent is verloopt infectie met het cytomegalovirus meestal asymptomatisch. Op latere leeftijd zorgt de infectie voor een aanhoudende malaise, hoge koorts en moeheid, samen met een lymfocytose en abnormale leverfunctie. CMV heeft zoals de andere herpesvirussen het vermogen om latent aanwezig te blijven in verschillende organen, inclusief het beenmerg.
In normale omstandigheden blijft het virus continu onderdrukt door het immuunsysteem. Bij een aangetaste immuniteit is CMV een opportunistische infectie die een risico op levensbedreigende pathologieën met zich mee brengt. CMV retinitis is daardoor de grootste oorzaak van infectieuze blindheid bij aidspatiënten. CMV is de meest voorkomende congenitale virale infectie en oorzaak van aangeboren afwijkingen, meer prevalent dan downsyndroom en foetaal alcoholsyndroom. (5, 19)
2.5.1. Epidemiologie
De seroprevalentie kan aangetoond worden bij 60% van de populatie in de ontwikkelde wereld en 100% van de populatie in de derdewereldlanden. De seroprevalentie van de totale bevolking wordt geschat op 50.4%. Voorspellende factoren zijn leeftijd, geboorteland en ook de socio-economische status.(8, 19, 20). Een studie in Duitsland toont aan dat de seroprevalentie ook hoger is bij vrouwen (62%) dan bij mannen (51%). De geografische variatie is te wijten aan factoren gerelateerd aan transmissie zoals bevolkingsdichtheid, seksuele gewoonten en interculturele verschillen in het kader van borstvoeding en kinderzorg. (21) In geïndustrialiseerde landen komt congenitale CMV infectie voor bij 0.4% tot 1.2% van alle levende pasgeborenen. (20)
2.5.2. Levenscyclus en pathogenese
HCMV kan bij primaire infectie een breed gamma aan celtypes infecteren, waarbij de klinische presentatie en besmettelijkheid afhankelijk zijn van het celtype. (22) Het virus kan worden doorgegeven via direct contact met nasale secreties, speeksel, tranen, urine, moedermelk en genitale secreties.
Een eerste replicatiecyclus heeft plaats in mucosale epitheliale cellen ter hoogte van de porte d’entree. Hier kunnen geïnfecteerde epitheelcellen in contact komen met monocyten
24 circulerend in de perifere bloedbaan en ook geïnfecteerd worden. HCMV stuurt deze monocyten om door extravasatie uit de bloedbaan te treden en perifere eindorganen te bereiken. (22) Wanneer het virus binnendringt in susceptibele cellen, zoals fibroblasten en endotheelcellen start het een lytische infectie. De replicatietijd van het cytomegalovirus is laag, waardoor de viremie op 1 dag kan verdubbelen. (19)
Als reactie op primaire infectie worden initieel immunoglobulines type M geproduceerd en vervolgens immunoglobulines G, deze laatste zullen levenslang aanwezig blijven. Belangrijker voor de controle van het virus zijn CD4+ T-cellen en CD8+ T-cellen. Ze binden antigenen gepresenteerd door geïnfecteerde cellen. Het immuunsysteem van een CMV seropositieve persoon heeft meer dan 1% van zijn perifere T-cellen specifiek toegewijd aan één CMV antigen, wat meer is dan voor andere virussen. (5)
Na de initiële infectie kan de inhibitie van virale lytische genexpressie het virus aanzetten tot een latente aanwezigheid met een subklinische chronische infectie tot gevolg. De latente status wordt grotendeels gecontroleerd door het celtype. CMV dragende monocyten kunnen zich rechtstreeks naar het beenmerg verplaatsen waar ze de CD34+ hematopoëtische stamcellen infecteren. (22) In deze stamcellen zullen specifieke humane cellulaire DNA-bindende eiwitten in de nucleus binden met de CMV promotor en transcriptie van virale genen inhiberen. (23) Dit maakt dat het beenmerg een belangrijk reservoir is voor latentie en waarin het virus levenslang aanwezig blijft. (22)
Reactivatie van het virus kan gebeuren door aantasting van het immuunsysteem, allogene stimulatie of signalen die differentiatie stimuleren. De differentiatie van CD34+ stamcellen tot mature dentritische cellen resulteert in reactivatie van de lytische genexpressie. (22) De ernst van de symptomen bij reactivatie is proportioneel aan de graad van immunosuppressie. (8) Ernstige pathologieën komen hoofdzakelijk voor bij patiënten met een aangetast imuunsysteem. Dit zijn meestal neonaten en patiënten die leiden aan aids of ontvanger zijn van orgaantransplantatie en bloedtransfusies. Door de daling van CMV specifieke CD4+ en CD8+ T-cellen kan het virus zich ongecontroleerd vermenigvuldigen. (19) Het is reeds aangetoond dat het virus bij ouderen ook een belangrijke oorzaak is van verhoogde mortaliteit, door interferentie met vaccinaties en de verhoging van het risico op cardiovasculaire aandoeningen door aantasting van het endotheel. (5)
25
2.5.3. Symptomatologie
De presentatie van primaire congenitale cytomegalovirus infectie, bij zowel de moeder als de foetus, is asymptomatisch in 85-90% van de gevallen. Neurosensorieel gehoorverlies kan voorkomen na een milde infectie van het labyrint. Neonaten met ernstige infecties kunnen een breed klinisch beeld vertonen, waaronder ook retinitis valt. (20) Wanneer de primaire infectie optreedt na de geboorte kan die asymptomatisch zijn of een mononucleose syndroom teweegbrengen. Het beeld van CMV mononucleose wordt gekarakteriseerd door een aanhoudende hoge koorts met malaise en moeheid, alsook een lymfadenopathie en lymfocytose. De klinische presentatie van de infectie wordt beïnvloed door de status van het immuunsysteem van de gastheer. (24)
In atypische gevallen kan CMV ook andere systemen infecteren. Voorbeelden zijn het centraal zenuwstelsel, het respiratoir stelsel vaak met secundaire infectie met andere pathogenen en het gastro-intestinaal stelsel. (19)
2.5.4. Oculaire aandoeningen
Klassiek veroorzaak CMV in het oog van de immuun gecompromitteerde gastheer een ontsteking van de retina. CMV bereikt de retina via de bloedvaten waar schade wordt veroorzaakt aan de retinale cellen, de bloedvaten en de oogzenuw. De initiële presentatie is vaak asymptomatisch of vertoont een milde aantasting met oedeem en vasculaire opzetting. (23)
Bij neonaten met een uitgesproken congenitale CMV infectie komt retinitis voor bij 23 tot 29%. Neonaten die susceptibel zijn voor ernstige infecties hebben meestal een aangetast of onderontwikkeld immuunsysteem, zoals bij leukemie, lymfosarcoma of na niertransplantatie. (25)
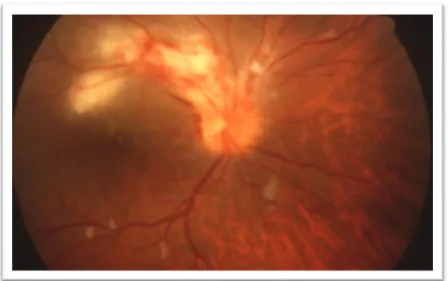
HCMV is een opportunistische infectie bij patiënten met een actieve hiv-infectie waarbij het aantal CD4+ T-cellen gedaald is tot minder dan 50cellen/µl. In 85% van de gevallen manifesteert de infectie zich als een retinitis. Deze infectie kan ook voorkomen bij patiënten die actieve primaire T-cel respons hebben tegen het virus, met name bij recipiënten van immunosuppressieve therapie ten gevolge van beenmerg- of orgaantransplantatie.(23, 26) CMV retinitis ontstaat gemiddeld na 9 maanden sinds de transplantatie, vaak als gevolg van het stoppen van de preventieve toediening van anti-CMV medicatie na 3 maanden. (23) Wanneer het virus zich verder verspreidt naar gezonde delen van de retina ontstaan necrosehaarden, die indien onbehandeld kunnen leiden tot retinale loslating en volledige blindheid.
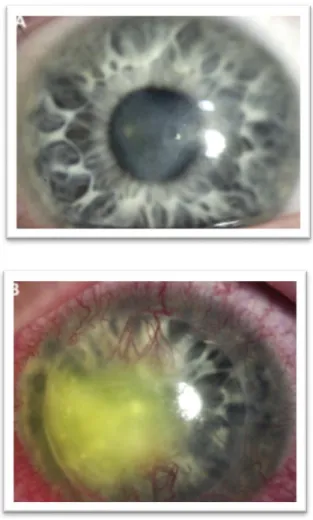
26 De retinitishaard is herkenbaar door de granulaire of witte infiltraties, wijzend op oedeem en necrose. Bloedingen in de retina ontstaan door aantasting van de endotheelcellen van de bloedvaten en kleuren rood aan. Op funduscopie komen bij CMV retinitis twee presentaties voor. Een eerste is een reeks van diffuse zones van witte infiltraties die een retinaal bloedvat of de oogzenuw volgen. Dit contrast leidt tot de klassieke beschrijving van het beeld als ‘pizza pie’ of ‘cottage cheese with ketchup’. Een tweede beeld is dat van de bosbrand waarbij focale granulaire infiltraties, die centrifugaal geordend zijn, worden afgewisseld met een variërende hoeveelheid bloedingen. (8)
Figuur 10. Klassieke presentatie CMV retinitis (8)
Figuur 11. Uitgebreide Retinitis met bosbrand beeld (8)
De aandoening kan evolueren en complicaties veroorzaken zoals retinale loslating, infectie van het contralaterale oog, retinale neovascularisatie, posterieure cataract die leiden tot visus daling of blindheid. Natuurlijke resolutie kan zich voordoen al dan niet met recidieven. (24)
27 Het virus kan in uitzonderlijke gevallen anterieure uveïtis, corneale endotheliitis of acute retinale necrose veroorzaken. De klinische presentatie van uveïtis bij CMV is die van verhoogde intraoculaire druk met een chronische aantasting van de iris en ciliaire structuren. Bij endotheliitis van de cornea treedt er verlies op van de endotheelcellen met het optreden van stromaal oedeem, afzetting van infiltraties, ontsteking van de iris en verhoogde intraoculaire druk. ARN is een ernstige, laattijdige aandoening en gaat gepaard met anterieure uveïtis, vitritis en ter hoogte van de retina een veralgemeende diffuse necrotiserende retinitis met zones van ‘full thickness’ necrose en occusieve vasculitis. (23,24)
2.5.5. Preventie
Bij patiënten met aids is het behouden van het aantal CD4+ cellen boven de 100 cellen per µl aangewezen als preventieve maatregel voor CMV retinitis. Na transplantatie wordt Ganciclovir preventief toegediend bij patiënten gedurende een periode van drie maanden. (19,23)
2.5.6. Behandeling
CMV infecties worden klassiek behandeld met valganciclovir en ganciclovir, in combinatie met foscarnet in sommige gevallen. Cidofovir heeft ook enige werking tegen het virus, maar wordt niet gebruikt als standaard ten gevolge van zijn renale toxiciteit. Deze antivirale middelen binden competitief het DNA-polymerase van het cytomegalovirus en inhiberen hierdoor de replicatie. (19,24)
Onbehandeld kan een patiënt met CMV retinitis tot een jaar overleven, de prognose is echter goed en met adequate therapie kan volledige omkering van het visusverlies optreden.
CMV retinitis wordt behandeld door het toedienen van anti-CMV medicatie (ganciclovir) intraveneus of via vitreale injectie. Aangezien CMV vooral bij aidspatiënten en immuun gecompromitteerde patiënten voorkomt is het omkeren van de immunodeficiëntie een belangrijk therapeutisch doel. Bij patiënten na orgaantransplantatie dient de immunosuppressieve behandeling tot een minimum beperkt te worden. Wanneer de patiënt hiv+ is of aan aids lijdt is het aangewezen om ‘highly active antiviral therapy (HAART) te starten. HAART vertraagt de progressie van CMV retinitis en verkleint de kans op visusdaling. Wanneer het aantal CD4+ cellen de kaap van 100 cellen per µl bereikt heeft kan anti-CMV medicatie gestopt worden. (24)
28
2.6. Laboratorium diagnostiek van oculaire herpetische infecties
De diagnose van herpetische oogaandoeningen wordt meestal gesteld door het verloop en het klinisch beeld van de ziekte. Funduscopie en fluoresceïnce angiografie zijn essentiële onderzoeken, die vaak wegens de typische presentatie van deze aandoeningen een diagnose kunnen stellen. Door de grote overlap van de oculaire aandoeningen bij verschillende virussen kan de diagnose toch best bevestigd worden door laboratorium analyse van het oogvocht. Polymerase Chain Reaction (PCR) analyse en de bepaling van een lokale specifieke antilichaamproductie in voorkamervocht zijn effectieve hulpmiddelen bij het identificeren van het etiologisch pathogeen wat een gerichte behandeling faciliteert. (23, 27-29)
2.6.1. Polymerase chain reaction
De kwantitatieve polymerase chain reaction is een amplificatietechniek die de onderzoeker toelaat in ‘real-time’ een hoeveelheid van een bepaalde DNA-sequentie te meten. PCR maakt gebruikt van de intensiteit van fluorescentie signalen, die resulteren uit de afbraak van een probe tijdens de amplificatie van de doelwit DNA-sequentie. Errera et al. rapporteert een succespercentage van 100% in het opsporen van viraal herpetisch DNA in voorkamervocht.(30) Ook bij patiënten met een virale uveïtis in combinatie met een onderdrukt immuunsysteem is PCR analyse de gouden standaard als diagnostisch middel. (27) Bij CMV retinitis is de concentratie van CMV DNA in het voorkamervocht rechtstreeks gerelateerd aan de grootte van de aangetaste retinale zone, maar die echter 10 maal lager kan zijn dan in vitreaal vocht. Aangezien de afname van vitreaal vocht een invasieve en tijdrovende procedure is geniet de voorkamerpunctie de voorkeur voor diagnostische doeleinden.(23, 31)
2.6.2. Goldmann-Witmer coëfficiënt
De Goldmann-Witmer coëfficiënt is een waarde die indirect de aanwezigheid van een lokale antilichaamproductie in het oog, specifiek voor een bepaald pathogeen, aantoont. De GWC kan worden berekend door de verhouding van de concentratie van specifieke immunoglobulines in het voorkamervocht op de concentratie van de totale hoeveelheid immunoglobulines te delen door diezelfde verhouding in het serum.
(𝑃𝑎𝑡ℎ𝑜𝑔𝑒𝑒𝑛 𝑠𝑝𝑒𝑐𝑖𝑓𝑖𝑒𝑘 𝐼𝑔𝐺 𝑣𝑜𝑜𝑟𝑘𝑎𝑚𝑒𝑟𝑣𝑜𝑐ℎ𝑡𝑇𝑜𝑡𝑎𝑎𝑙 𝐼𝑔𝐺 𝑖𝑛 𝑣𝑜𝑜𝑟𝑘𝑎𝑚𝑒𝑟𝑣𝑜𝑐ℎ𝑡 ) (𝑃𝑎𝑡ℎ𝑜𝑔𝑒𝑒𝑛 𝑠𝑝𝑒𝑐𝑖𝑓𝑖𝑒𝑘 𝐼𝑔𝐺 𝑠𝑒𝑟𝑢𝑚𝑇𝑜𝑡𝑎𝑎𝑙 𝐼𝑔𝐺 𝑠𝑒𝑟𝑢𝑚 )
Wanneer het resultaat van dit quotiënt een vooraf bepaalde standaardwaarde overschrijdt kan de GWC aantonend zijn voor een lokale specifieke antilichaamproductie. Theoretisch gezien
29 zou een GWC groter dan 1 bewijzend zijn voor de aanwezigheid van intraoculaire antilichaamproductie. (29)
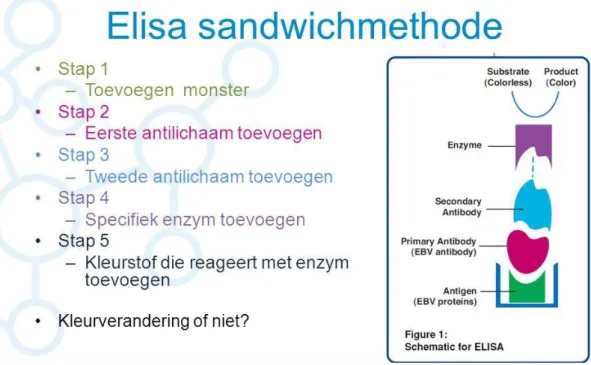
De concentraties van immunoglobulines wordt bepaald door de ELISAtechniek (Enzyme-linked immunosorbent Assay). Deze techniek is gebaseerd op een immunochemische reactie tussen het antigeen en antilichaam. De meeste ELISA testen maken gebruik van een een reactieplaat met ‘wells’. Een ‘well’ is een individuele groeiboden waarvan de onderlaag bedekt wordt met anti-antilichamen of antigenen. Voor antilichaam-detectie worden specifieke (capture) antigenen gebruikt die binden met de specifieke immunoglobulines van de patiënt gebruikt. Na spoeling worden de antilichamen geïsoleerd uit het staal. Vervolgens bindt dit complex met een antilichaam dat gemerkt is met een enzym (conjugaat). Dit complex in combinatie met zijn substraat zorgt voor een kleuring en fluorescentie signaal. Het signaal wordt gemeten door een fotospectrometer die gebruikt maakt van twee golflengtes en uitgedrukt in waarden van optische densiteit (O.D.). De resultaten van deze bepaling worden dan logaritmisch omgerekend waardoor een concentratie van het eiwit of immunoglobuline bekomen wordt.
Een positieve GWC, wijzend op intraoculaire antistofproductie kon in een studie van Bojanova et al. gevonden worden in 45% van de PCR positieve gevallen van anterieure uveïtis en 100% van de ARN gevallen.(32)
2.6.3. Vergelijking van PCR en GWC
Door de vaak milde initiële presentatie van de virale oculaire infecties is laattijdige diagnosestelling een groot probleem wat een invloed heeft op de morbiditeit, aangezien effectieve antivirale therapie beschikbaar is. Tijdens een eerste fase staat replicatie van het virus en rechtstreekse schade aan de cellen op de voorgrond. Naar mate de aandoeningen langer aanhouden worden virale deeltjes meer en meer geklaard en is de reactie van het immuunsysteem vooral schadelijk voor de functionaliteit van het oog door de instandhouding van de inflammatie.
In een studie van De Groot et al. resulteerde PCR-analyse bij patiënten met virale uveïtis in significant meer positieve resultaten tijdens de eerste twee maanden dan door GWC. Na dit tijdstip kon er geen viraal DNA van het HSV of VZV meer worden aangetoond in het voorkamervocht. Positieve GWC-resultaten daarentegen werden teruggevonden tijdens de volledige ziekteduur, maar waren meer frequent in latere stadia van de aandoeningen. Belangrijk om hierbij te melden is dat er geen patiënten lijdend aan aids of met een gecompromitteerd immuunsysteem in deze studie geïncludeerd waren. (31)
30 Aangezien de tijd tussen de start van de symptomen en de analyse van het voorkamervocht vaak niet gekend is heeft zowel de PCR en de GWC hun specifieke plaats in de diagnostiek, respectievelijk in de acute en chronische fase.
Het belang van de GWC voor de diagnosestelling van virale uveitis werd aangetoond door de Groot et al. en Rothova et al. Indien enkel PCR werd gebruikt zou in 48% (34% voor Herpes Simplex en Varicella-Zoster en 64% voor Toxoplasma Gondi) van de gevallen de diagnose gemist zijn. (28) Wanneer enkel PCR gebruikt werd voor virale posterieure uveïtis (HSV type 1 en 2, VZV en CMV) zou de diagnose gemist worden bij 21% van de patiënten. Voor het alleenstaand gebruik van GWC lag dit percentage op 29%.(33)
De Boer et al. heeft gevonden dat bij patiënten lijdend aan aids en CMV retinitis PCR positief was voor viraal DNA in 91% van de voorkamervocht stalen. Er kon in geen enkel van deze gevallen lokale antilichamen worden aangetoond door bepaling van de GWC. Bij patiënten zonder aids werden er wel positieve GWC-waarden gevonden. De consistente negatieve GWC-resultaten bij aids geassocieerde retinitis kan het gevolg zijn van relatieve hoge IgG waarden in het serum, als gevolg van de systemische infectie waardoor de antistoffenproductie in het oog gemaskeerd kan worden. (29)
Er kan geconcludeerd worden dat het aantonen van viraal DNA door PCR de gouden standaard is voor de laboratoriumdiagnostiek ,maar het aanvullend of afwisselend bepalen van de GWC is aangewezen.
31
3. Methodologie
3.1. Literatuuronderzoek
Voor de literatuurstudie werd gebruik gemaakt van PubMed.
Ik heb meerdere zoekopdrachten gebruikt waarvan de opstelling bestond uit een of meerdere MeSH Terms (herpes simplex keratitis, herpes zoster ophthalmicus, ELISA, uveitis etc.) en/of de afkortingen van MeSH Subheadings (virology VI, cytology CY, cerebrospinal fluid CF, etc.). Zowel de combinaties van MeSH termen en de toevoeging van MeSH Subheadings waren significant in het leveren van relevante artikels en het beperken van het aantal resultaten. Het gebruik van de filter op datum van publicatie reduceerde aanzienlijk de zoekresultaten en werd bij het zoeken naar artikels over epidemiologie, therapie en diagnostiek gebruikt.
Aangezien de Goldmann-Witmer coëfficiënt geen MeSH term is werd deze, in bepaalde gevallen, als algemene zoekterm toegevoegd aan de zoekopdracht.
Er werden via PubMed 35 artikels via de bovenstaande zoekstrategie weerhouden.
Vervolgens werden er nog 19 artikels gevonden, die gerelateerd waren aan artikels van de eerste selectie. Deze 54 artikels werden vervolgens gecontroleerd op hun impactfactor via Web of Science om de relevantie en betrouwbaarheid te evalueren. Artikels in Q1 en Q2 werden weerhouden. Uitzonderingen op deze voorwaarde werd toegekend voor artikels met grote aantallen citaties of die een meerwaarde aan klinische informatie opleverden. Er werden 39 artikels geselecteerd voor gebruik.
32
3.2. Procedure staalselectie
In de staalbank van het UZ Gent worden alle stalen bewaard na routineanalyses voor een vastgestelde periode om eventuele herevaluaties en bijkomstige onderzoeken aan te vragen. In het laboratorium informatiesysteem (LIS) kan door middel van query’s gezocht worden naar specifieke selecties van stalen.
Retrospectief werd er gezocht naar stalen van cerebrospinaal vocht en serum. Een eerste voorwaarde was dat er voldoende staalvolume aanwezig was voor de uitvoering van de testen: voor de bepaling op CSF is er minimaal 100 µl nodig per uitvoering. Een tweede voorwaarde was dat de CSF stalen na afname niet langer dan 6 dagen onbevroren bewaard mogen worden. Serumstalen mogen 14 dagen gekoeld bewaard worden voordat ze ingevroren worden. Beide voorwaarden werden steeds voldaan gezien de staalontvangst en staalregistratie een zo goed als directe invriesprocedure bevat.
Er werden twee staalselecties gecreëerd. In de eerste selectie werd er voor het cerebrospinaal vocht geprobeerd stalen te rekruteren die door PCR positief zijn bevonden op de aanwezigheid van viraal DNA (HSV-1, HSV-2, VZV, CMV). In het geval van de serumstalen werd er geopteerd voor een positieve bepaling van specifieke antilichamen tegen de virussen aangezien PCR niet standaard wordt uitgevoerd op serumstalen
In de tweede staalselectie werd er getracht om serumstalen en stalen van cerebrospinaal vocht te includeren, die als representatief kunnen gezien worden voor de praktijk in een tertiair centrum wanneer er een vermoeden is van een herpetische oculaire infectie. (Tabel 1)
Inclusiecriteria staalselectie
Serum en CSF afkomstig van eenzelfde patiënt
Vooraf bepaalde totale hoeveelheid IgG zowel op serum als CSF Verschil in tijd tussen staalafname serum en CSF < 1dag
33
3.2.1. Immunoglobuline G bepaling
3.2.2. Bepaling van anti-herpetische antistoffen
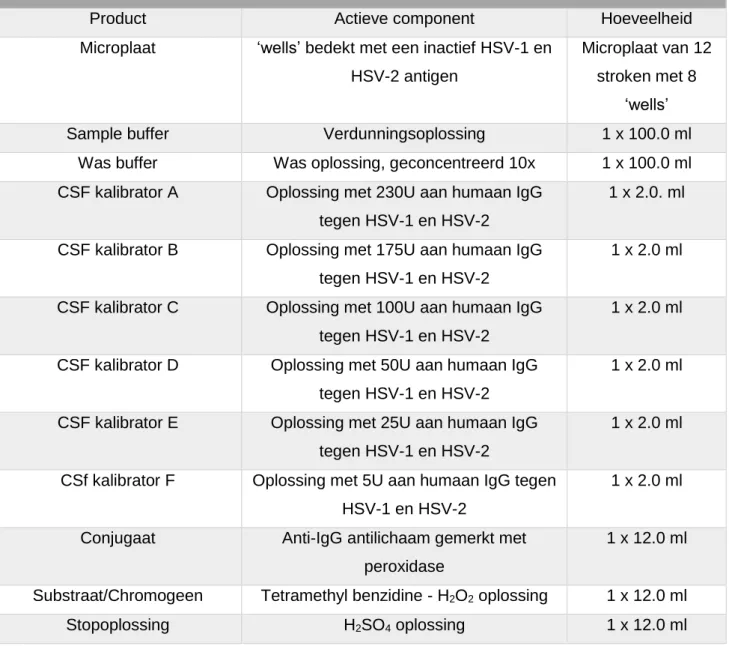
De anti-herpetische specifieke IgG werd bepaald met de IgG ELISA-kits van EUROIMMUN. (Lubbek, Duitsland) (Tabel 2) (Bijlage 2, 3) Er werd gekozen voor deze commerciële ELISA-kits omdat deze onderworpen zijn geweest aan een externe kwaliteitscontrole en handmatig kon uitgevoerd worden. Een noemenswaardig verschil tussen de kits is dat de ELISA-kit voor CMV maar vier kalibratoren bevat (A t.e.m. D, 100U – 5U).
De inhoud van de EUROIMMUN Anti-HSV-1/2-Pool IgG ELISA-kit
Product Actieve component Hoeveelheid
Microplaat ‘wells’ bedekt met een inactief HSV-1 en HSV-2 antigen
Microplaat van 12 stroken met 8
‘wells’
Sample buffer Verdunningsoplossing 1 x 100.0 ml
Was buffer Was oplossing, geconcentreerd 10x 1 x 100.0 ml CSF kalibrator A Oplossing met 230U aan humaan IgG
tegen HSV-1 en HSV-2
1 x 2.0. ml
CSF kalibrator B Oplossing met 175U aan humaan IgG tegen HSV-1 en HSV-2
1 x 2.0 ml
CSF kalibrator C Oplossing met 100U aan humaan IgG tegen HSV-1 en HSV-2
1 x 2.0 ml
CSF kalibrator D Oplossing met 50U aan humaan IgG tegen HSV-1 en HSV-2
1 x 2.0 ml
CSF kalibrator E Oplossing met 25U aan humaan IgG tegen HSV-1 en HSV-2
1 x 2.0 ml
CSf kalibrator F Oplossing met 5U aan humaan IgG tegen HSV-1 en HSV-2
1 x 2.0 ml
Conjugaat Anti-IgG antilichaam gemerkt met peroxidase
1 x 12.0 ml
Substraat/Chromogeen Tetramethyl benzidine - H2O2 oplossing 1 x 12.0 ml
Stopoplossing H2SO4 oplossing 1 x 12.0 ml
34
3.2.3. Voorbereiding en verdunning van de stalen
De ELISA-kits werden bewaard in een koelkast op een temperatuur tussen 2°C en 8°C. De bewaring van de stalen gebeurde op een temperatuur van -20°C om de integriteit van de inhoud te behouden. De reagentia werden op kamertemperatuur gebracht (18°C-25°C) 30 minuten voor de aanvang van de verdunningsprocedure.
De stalen van cerebrospinaal vocht en serum, alsook de was buffer, werden verdund met de verdunningsoplossing volgens het verdunningsschema aanbevolen door EUROIMMUN.
▪ Was buffer: 50 ml wasoplossing + 450 ml water = 1:10 verdunning ▪ Serumstalen: 10 µl serum + 1.0 ml samplebuffer = 1:101 voorverdunning
250 µl voorverdunning + 750 µl samplebuffer = 1:404 verdunning
▪ Cerebrospinaalvocht staal: 100 µl CSF + 100 µl samplebuffer = 1:2 verdunning
De kalibratoren werden niet verder verdund.
3.2.4. Procedure en meting
De ELISA-kits van EUROIMMUN bepalen de concentratie van specifieke immunoglobulines volgens de sandwich ELISA-techniek. (Figuur 12)