FACTOREN GEASSOCIEERD MET
PERSISTERENDE HYPERPARATHYREOÏDIE
EN GROEISNELHEID BIJ KINDEREN NA
NIERTRANSPLANTATIE
Rani De Pauw
Stamnummer: 01505182Karen Vanderstraeten
Stamnummer: 01413784Promotor: Dr. Agnieszka Prytula
Masterproef voorgelegd in het kader tot het behalen van de graad Master of Medicine in de Geneeskunde
FACTOREN GEASSOCIEERD MET
PERSISTERENDE HYPERPARATHYREOÏDIE
EN GROEISNELHEID BIJ KINDEREN NA
NIERTRANSPLANTATIE
Rani De Pauw
Stamnummer: 01505182Karen Vanderstraeten
Stamnummer: 01413784Promotor: Dr. Agnieszka Prytula
Masterproef voorgelegd in het kader tot het behalen van de graad Master of Medicine in de Geneeskunde
Deze pagina is niet beschikbaar omdat ze persoonsgegevens bevat.
Universiteitsbibliotheek Gent, 2021.
This page is not available because it contains personal information.
Ghent University, Library, 2021.
II
Voorwoord
Deze thesis werd in het kader van onze masterproef opgesteld. Dit kwam tot stand met de hulp van enkele mensen, die we dan ook graag bedanken.
Om te beginnen uiteraard onze promotor, Dr. Prytula. Zij haalde het beste in ons naar boven door motiverende woorden, was kritisch, maar steeds opbouwend en zeer bereikbaar. Met leerrijke feedback en begeleiding stond ze ons bij, waardoor we een mooi leerproces doormaakten.
Prof. Dr. Knops (UZ Leuven), Dr. Cransberg (Erasmus MC Rotterdam) en Dr. Bouts (AMC Amsterdam) bezorgden ons de geanonimiseerde patiëntendata van hun centra. We willen hen graag bedanken voor hun medewerking aan dit onderzoek. Bedankt ook Dr. El Amouri (UZ Gent) voor de hulp bij het opstellen van de database.
Robby De Pauw was een enorme hulp bij onze statistische analyse. Ook hij was steeds bereikbaar waardoor elke moeilijkheid snel werd opgelost en wij vlot verder konden werken aan de resultaten. Geen enkele vraag was te veel, daarom een welgemeende dankuwel. Hans Vanderstraeten maakte steeds tijd wanneer nodig om onze tussentijdse versies na te lezen en bij te sturen. Hij hielp ons om op een wetenschappelijke manier te denken en te schrijven, waardoor we groeiden in het kritisch denken.
Natuurlijk kon deze thesis niet tot stand zijn gekomen zonder elkaar. Snel hadden we door dat we elkaar goed aanvulden. Zo zorgde Rani dat we overzichtelijk werkten en Karen voor een strak tijdschema. De vele uren samenwerking leidden tot een intens teamwork. We konden ons geen betere thesispartner wensen.
Tenslotte willen we ook graag onze ouders en vriendjes, Thijs en Tim, bedanken. Niet alleen voor de hulp en ondersteuning tijdens het maken van de thesis, maar ook voor de bemoedigende woorden en eindeloze steun de voorbije vijf jaar in onze studies. Jullie hadden begrip voor de vele tijd die we aan onze studie besteedden en stimuleerden ons steeds door te gaan.
III
Inhoudstafel
Afkortingen...
Abstract ... 1
1. Inleiding ... 3
1.1 Niertransplantatie bij kinderen ... 3
1.1.1 Epidemiologie ... 3
1.1.2 Evolutie van pediatrische niertransplantatie ... 3
1.1.3 Indicaties ... 4
1.1.4 Richtlijnen ... 4
1.1.5 Gevolgen van niertransplantatie ... 5
1.2 Persisterende hyperparathyreoïdie na niertransplantatie ... 8
1.2.1 Definitie hyperparathyreoïdie ... 8
1.2.2 Mechanisme ... 9
1.2.3 Gevolgen van secundaire hyperparathyreoïdie ... 12
1.2.4 Factoren die aanleiding geven tot persisterende secundaire hyperparathyreoïdie ... 15
1.3 Factoren die groei beïnvloeden na niertransplantatie ... 16
1.3.1 Klinisch ... 16
1.3.2 Biochemisch ... 16
1.3.3 Medicatie ... 17
1.4 Doelstellingen van dit onderzoek... 18
2. Methode ... 20 2.1 Literatuuronderzoek ... 20 2.2 Studiecohorte ... 20 2.3 Datacollectie ... 21 2.4 Ethisch comité ... 23 2.5 Statistische analyse ... 23 3. Resultaten ... 24 3.1 Patiënt karakteristieken ... 24
3.2 Persisterende hyperparathyreoïdie na transplantatie... 28
3.2.1 Verloop van de PTH-waarde na transplantatie ... 28
3.2.2 Factoren die geassocieerd zijn met verhoogd PTH ... 29
3.2.3 Factoren die geassocieerd zijn met ernstig verhoogd PTH (twee keer boven de referentiewaarde)... 39
3.3 Groei na transplantatie ... 41
3.3.1 Verloop van de groei na transplantatie ... 41
3.3.2 Factoren die invloed hebben op de groeisnelheid twaalf maanden na transplantatie .. 41
3.4 Samenvatting ... 44
4. Discussie ... 44
4.1 Persisterende hyperparathyreoïdie na transplantatie... 44
4.1.1 Factoren die invloed hebben op een PTH boven de referentiewaarde ... 46
4.1.2 Factoren die invloed hebben op PTH, twee keer boven de referentiewaarde ... 49
IV
4.2.1 Factoren die invloed hebben op de groeisnelheid twaalf maanden na transplantatie .. 50
4.3 Kritische bedenkingen bij deze studie ... 54
4.3.1 Sterktes ... 54
4.3.2 Zwaktes ... 55
4.4 Belang voor de kliniek ... 55
4.5 Suggesties voor verder onderzoek ... 56
5. Conclusie ... 58
6. Referenties ... 59 7. Addendum ... 7.1 Aantal patiënten in de analyse ... 7.2 Abstract voor International Pediatric Nephrology Association Congress 2019 ...
V
Afkortingen
In volgorde van voorkomen:
PTLD – Post-transplantatie lymfoproliferatieve ziekte EBV – Epstein-barrvirus
CMV – Cytomegalovirus CKD – Chronic kidney disease IGF-I – Insulin-like growth factor 1 PTH – Parathyreoïd hormoon
iPTH – Intact parathyreoïd hormoon GFR – Glomerulation filtration rate
KDIGO – Kidney Disease Improving Global Outcomes RANKL – Receptor activator of nuclear factor kappa-B ligand FGF-23 – Fibroblast growth factor 23
K-DOQI – Kidney Disease Outcomes Quality Initiative
CKD-MBD – Chronic kidney disease - mineral and bone disorder TNAP – Tissue nonspecific alkaline phosphatase
SD – Standaarddeviatie
SDS – Standaarddeviatiescore
eGFR – Estimated glomerulation filtration rate IQR – Interquartile range
Tx – Transplantatie CI – Confidence interval OR – Odds ratio
S.E. – Standard error
LD/DD – Living donor/deceased donor VIF – Variance inflation factor
1
Abstract
Inleiding en doelstellingen – Niertransplantatie is de eerste keuze behandeling bij kinderen met eindstadium nierfalen in vergelijking met dialysebehandeling. Hoewel succesvolle niertransplantatie de meeste metabole abnormaliteiten corrigeert, kan secundaire hyperparathyreoïdie persisteren met renale osteodystrofie, groeiretardatie, spontane fracturen en een verhoogde cardiovasculaire mortaliteit als gevolg. Kinderen groeien beter na transplantatie, maar de groei is vaak suboptimaal en de gewenste grootte wordt meestal niet bereikt. Het doel van deze studie is drievoudig: observeren van het verloop van de PTH-waarde bij kinderen in het eerste jaar na niertransplantatie; analyse van de factoren geassocieerd met het persisteren van PTH boven de referentiewaarde en een PTH, twee keer boven de referentiewaarde; als laatste worden ook factoren die een invloed hebben op de groei na transplantatie geanalyseerd.
Methode – Een multicentrisch, longitudinaal, retrospectief onderzoek wordt uitgevoerd bij kinderen die een niertransplantatie ondergingen onder de leeftijd van 18 jaar in één van de volgende centra: UZ Gent, UZ Leuven, Erasmus MC Rotterdam en AMC Amsterdam tussen december 1996 en november 2018. 149 patiënten worden geïncludeerd. Er worden demografische gegevens, dialysegegevens, transplantatiekenmerken (type donor, pre-emptief), klinisch parameters (lengte, gewicht, BMI), medicatiegebruik en biochemische parameters verzameld op vijf momenten, namelijk: net voor transplantatie en drie, zes, negen en twaalf maanden na transplantatie. De statistische analyse wordt uitgevoerd met het software programma IBM SPSS Statistics 25. Het verloop van PTH wordt geanalyseerd met Lineair Mixed Models. Univariate en multivariate logistische regressies worden uitgevoerd voor de analyse van factoren geassocieerd met hyperparathyreoïdie en uni- en multivariate lineaire regressies worden uitgevoerd voor de analyse van factoren die de groei na transplantatie beïnvloeden. P≤ 0,05 wordt beschouwd als significant.
Resultaten – De probabiliteit op een PTH boven de referentiewaarde neemt af tijdens de maanden na transplantatie. De probabiliteit op een PTH boven de referentiewaarde na transplantatie daalt van 0,49 naar 0,29 over het verloop van twaalf maanden. De probabiliteit op een PTH, twee keer boven de referentiewaarde daalt van 0,17 naar 0,09.
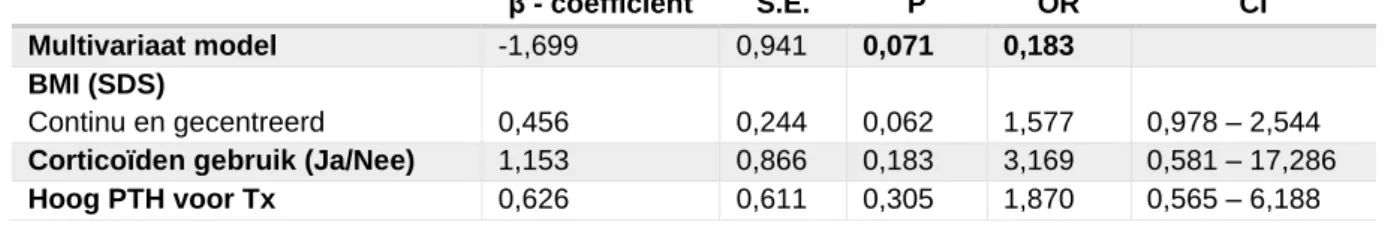
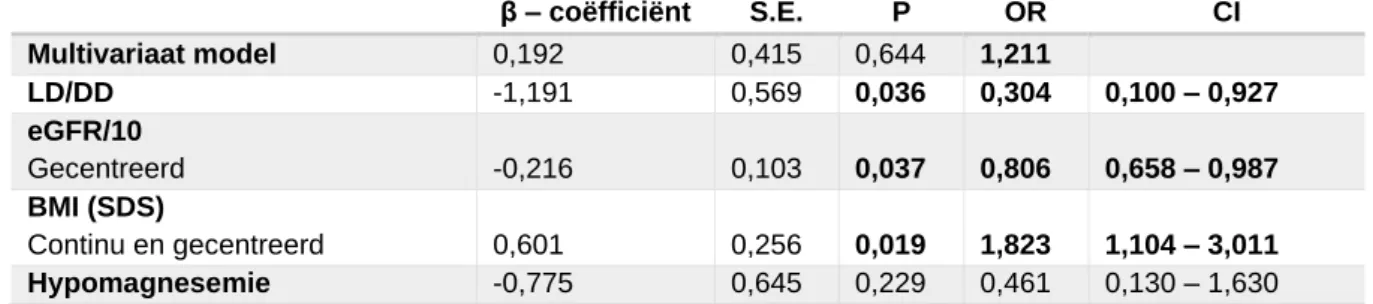
Negen maanden na transplantatie zijn transplantatie met een levende donor (β: -1,191; p= 0,036; 95% CI: 0,100-0,927), de BMI SDS (β: 0,601; p = 0,019; 95% CI 1,1046-3,011) en de eGFR (β: -0,216; p=0,037; 95% CI: 0,658 – 0,987) significant geassocieerd met een PTH boven de referentiewaarde. Twaalf maanden na transplantatie zijn een hogere BMI SDS (β: 0,493; p = 0,014; 95% CI : 1,104 - 2,430) en het hebben van een PTH boven de
2 referentiewaarde voor transplantatie (β: 1,103; p= 0,046; 95% CI: 1,021-8,898) significant geassocieerd met een PTH boven de referentiewaarde. Geen enkele medicatie blijkt op enig meetmoment significant geassocieerd te zijn met een PTH boven de referentiewaarde na transplantatie.
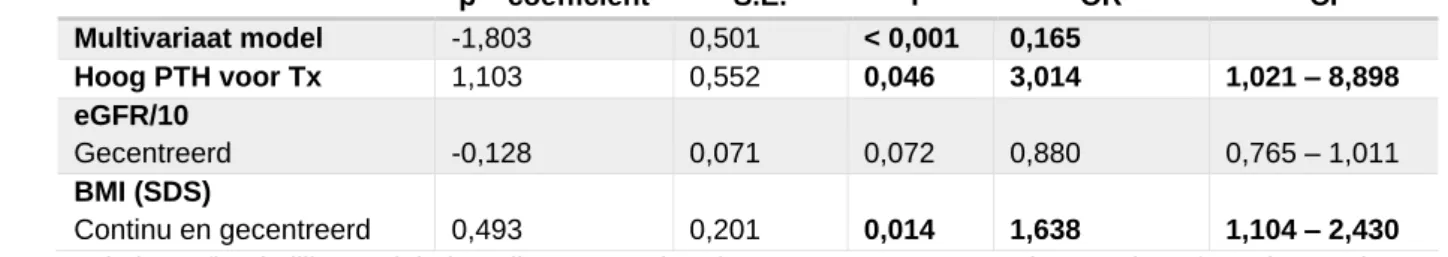
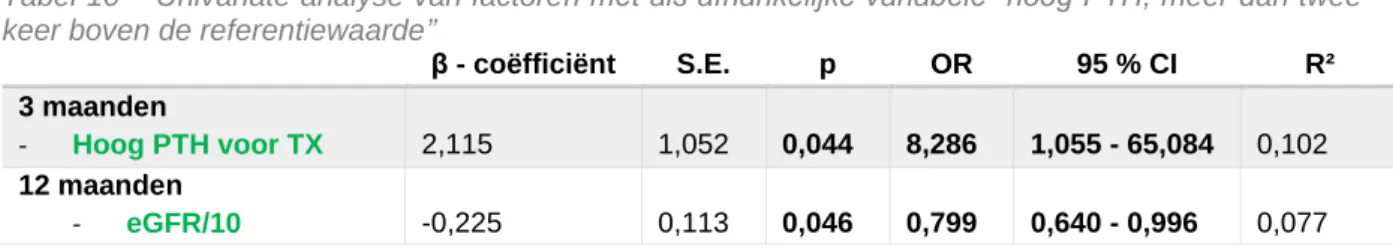
Een PTH boven de referentiewaarde voor transplantatie op het meetmoment drie maanden na transplantatie (β: 2,115; p= 0,044; 95% CI: 1,055-65,084) en de eGFR twaalf maanden na transplantatie (β: -0,225; p= 0,046; 95% CI: 0,640-0,996) zijn significant geassocieerd met een PTH, twee keer boven de referentiewaarde.
Er wordt geen inhaalbeweging van de groei gezien na transplantatie. De mediaan van delta SDS lengte twaalf maanden na transplantatie is gelijk aan -0,10. Het niet gebruiken van groeihormoon voor transplantatie (β: -0,324; p= 0,010; 95% CI: -0,569-(-0,079)), transplantatie met een levende donor (β: 0,482; p <0,001; 95% CI: 0,238-0,726) en een hogere eGFR (β: 0,063; p= 0,003 95% CI: 0,022-0,104) zijn significant geassocieerd met een betere groei in het jaar na transplantatie.
Discussie en conclusie – Het gebruik van een overleden donor, een hogere BMI SDS, een lagere eGFR en het hebben van een hoog PTH voor transplantatie zijn geassocieerd met het hebben van een PTH boven de referentiewaarde na transplantatie. Na transplantatie, waarbij men uitgaat van een stijging in eGFR hoger dan 60ml/min hebben nog een aanzienlijk deel kinderen een PTH boven de referentiewaarde. Het verbeteren van de glomerulaire filtratie volstaat dus niet altijd om PTH te normaliseren. Aangezien er een associatie is tussen BMI en een PTH boven de referentiewaarde, zowel voor als na transplantatie en een te hoge BMI ook op andere stelsels (zoals cardiovasculair, gynaecologisch,…) een negatief effect heeft, is het aanpakken van de BMI voor transplantatie belangrijk. Eveneens zal het onder controle krijgen van de PTH-waarde voor transplantatie van belang zijn.
Het hebben van hoog PTH voor transplantatie en een lagere eGFR waren de enige factoren die in deze studie worden aangetoond als beïnvloedend voor een PTH twee keer boven de referentiewaarde.
Factoren die geassocieerd zijn met een betere groeisnelheid na transplantatie zijn transplantatie met levende donor, het niet behandelen met groeihormoon voor transplantatie en een hogere eGFR. Er kon geen associatie aangetoond worden tussen de groeisnelheid na transplantatie en een PTH boven de referentiewaarde, de leeftijd van de patiënt of het gebruik van corticosteroïden.
3
1. Inleiding
1.1 Niertransplantatie bij kinderen
Niertransplantatie bij kinderen is een succesvolle procedure geworden die routinematig wordt uitgeoefend. De éénjaarsoverleving van de patiënt bedraagt 98%, de vijfjaarsoverleving 94%. De éénjaaroverleving van de donornier varieert tussen 93 en 98% en de vijfjaarsoverleving tussen 77 en 85%, rekening houdend met de verschillen tussen nieren van levende en overleden donoren (1). Niertransplantatie is de eerste keuze behandeling bij een nierziekte in het eindstadium. Niertransplantatie heeft meer voordelen in vergelijking met dialysebehandeling. Kinderen die een niertransplantatie ondergaan, hebben namelijk een betere levenskwaliteit, groei, ontwikkeling en langetermijnoverleving. Bovendien vermijden ze veel complicaties, zoals peritonitis en problemen met de veneuze toegang bij hemodialyse (2). Daardoor ligt de mortaliteit bij pediatrische niertransplantatie ontvangers 4-5 keer lager in vergelijking met degene die een langere dialysebehandeling krijgen (2-4).
1.1.1 Epidemiologie
In Europa bedraagt het aandeel van pediatrische niertransplantaties slechts 4% van alle uitgevoerde transplantaties (5). Ongeveer 20% van de pediatrische niertransplantaties wordt uitgevoerd bij kinderen jonger dan zes jaar en ongeveer 25% van de transplantaties wordt pre-emptief, voor een dialysebehandeling, uitgevoerd. De meeste pediatrische niertransplantaties worden uitgevoerd op tienerleeftijd (1).
1.1.2 Evolutie van pediatrische niertransplantatie
De eerste niertransplantatie werd uitgevoerd in de jaren ’50 bij een volwassene. Midden jaren ’70 werd dit voor het eerst uitgevoerd bij kinderen. De overleving van de patiënten, alsook van het donororgaan waren toen lager dan bij volwassen. Door beter inzicht in de werking van het immuunsysteem daalde de mortaliteit. Een verbetering in pre-transplantair beleid (zoals vaccinaties, meer effectieve dialyse,..) alsook in donorselectie droegen eveneens bij tot een verbeterde uitkomst. Gelijktijdig optimaliseerden ook de chirurgische technieken, postoperatieve zorg en de antivirale profylaxis. Dit zorgde voor een betere outcome na niertransplantatie bij kinderen. De langetermijnoverleving is vandaag beter dan bij volwassenen (6). Bij volwassenen bedraagt de overleving één jaar na transplantatie 95% en ongeveer 90% na 3-5 jaar (7). Verbetering van de overleving bij kinderen wordt weergegeven in figuur 1 (8).
4 Figuur 1 – Overleving van kinderen na niertransplantatie (8)
1.1.3 Indicaties
Een niertransplantatie wordt wijdverspreid beschouwd als eerste keuze ter behandeling van kinderen met terminaal nierfalen (2, 3). De oorzaken van nierfalen bij kinderen zijn verschillend ten opzichte van de oorzaken die gezien worden bij volwassenen. Bij volwassen zijn de belangrijkste oorzaken metabole ziekten: hypertensie en diabetes mellitus zijn het meest frequent (5, 9). De belangrijkste oorzaken van nierfalen bij kinderen zijn daarentegen: obstructieve uropathie secundair aan posterieure urethrakleppen (16%), renale dysplasie (16%), glomerulaire ziekten (28,5%), polycystische nieren (3%) en verscheidene minder frequent voorkomende ziekten (36%). Een uitgebreide evaluatie van de ontvanger dient te gebeuren, maar de meeste pediatrische patiënten zijn aanvaardbare kandidaten voor transplantatie (1). Ongecontroleerde maligniteit en infectie zijn twee contra-indicaties tot niertransplantatie (1, 2). Geïsoleerde milde mentale retardatie is niet per se een contra-indicatie, een substantiële intellectuele inhaalbeweging wordt routinematig gezien in pediatrische niertransplantatiepatiënten (1).
1.1.4 Richtlijnen
Evidence-based richtlijnen voor niertransplantatie bij kinderen ontbreken (10, 11). Dit leidt tot verschillen in de manier van behandelen tussen centra en landen (2, 11). Toewijzing van de schaarse donororganen blijft een belangrijke topic. Een algemeen aanvaarde regel is de prioriteit die aan kinderen gegeven wordt bij toewijzing. Langer op de wachtlijst staan, leidt immers tot schadelijke effecten op de groei en de fysieke en cognitieve ontwikkeling. In België is de organisatie hiervan geregeld op supranationaal niveau via Eurotransplant. Wanneer iemand jonger is dan 16 jaar, wordt hij in België als pediatrische patiënt beschouwd. Deze
5 patiënten krijgen extra punten op de wachtlijst. Sinds 2010 worden in België ook extra punten toegekend aan patiënten die ouder zijn dan 16 jaar wanneer ze nog groeipotentieel hebben. Bovendien worden organen van donoren jonger dan 16 jaar preferentieel gegeven aan ontvangers jonger dan 16 jaar.
In 2008 kreeg 26% van de pediatrische patiënten een donororgaan van een overleden persoon jonger dan 18 jaar (2). In België ondergaat ongeveer 25% van de kinderen een transplantatie met een levende donor, waarbij ouders in 80% van de gevallen de levende donor zijn (1, 2, 11). Transplantatie met een levende donor verbetert het resultaat voor het ontvangende kind, laat pre-emptieve transplantatie toe en zorgt voor een verkorting van de wachttijd (2, 11). In tegenstelling tot Nederland en Duitsland worden in België de ouders en patiënten zo neutraal mogelijk geïnformeerd over het verschil in transplantatie met een levende en overleden donor. Dit doet men omdat, door een langere levensverwachting, de kans op een tweede transplantatie hoger is en dus de mogelijkheid tot een levende donor beschikbaar blijft (11). Er is veel discussie over de minimumleeftijd vooraleer patiënten een transplantatie kunnen ondergaan. The European Society for Pediatric Nephrology (ESPN) raadt een minimumleeftijd van zes maanden aan. Lichaamsgewicht zou echter een betere factor zijn in de beslissing of een kind geaccepteerd wordt voor transplantatie. In de Belgische centra wordt 10 kg als minimumgewicht vooropgesteld (11). Naast gewicht speelt ook de grootte van het kind, de lichaamsbouw en de grootte van de bloedvaten een rol (3).
1.1.5 Gevolgen van niertransplantatie
De kortetermijnresultaten van kinderen die een niertransplantatie ondergaan zijn zeer goed. Patiënten dienen echter levenslang opgevolgd te worden. Belangrijke elementen hierbij zijn: de lange termijn functie van het transplantaat, groei, maturatie en fertiliteit, gezondheid van het bot, metabole problemen, neurocognitieve ontwikkeling en levenskwaliteit (3). Deze elementen kunnen een probleem geven op lange termijn. De belangrijkste oorzaken van sterfte na niertransplantatie zijn maligniteit en infectie. Urinaire infectie is een belangrijk probleem na transplantatie (4). Ook vasculaire complicaties blijven een belangrijke oorzaak van morbiditeit en verlies van de getransplanteerde nier (12). Cardiale sterfte bij kinderen met eindstadium nierziekte komt 1000 keer meer voor dan bij leeftijdsgenoten zonder nierziekte. Dit risico daalt na niertransplantatie, maar het daalt niet tot de normale basislijn (13). De cardiale schade is hoger bij patiënten die voor de transplantatie dialyse hebben gekregen, dan bij de pre-emptieve patiënten (14). De belangrijkste oorzaak van morbiditeit na niertransplantatie is botziekte (15, 16).
6 Hieronder wordt kort maligniteit en infectie besproken, omdat dit de belangrijkste oorzaken zijn van sterfte na transplantatie. Ook de gevolgen die rechtstreeks en onrechtstreeks te maken hebben met de ontwikkeling van de botstructuur worden besproken, omdat hierop de nadruk ligt in ons onderzoek.
1.1.5.1 Kanker
Patiënten hebben na transplantatie een verhoogd risico op de ontwikkeling van kanker, vooral op de ontwikkeling van infectie-gerelateerde maligniteiten (17). Na infectie is een post-transplantatie lymfoproliferatieve ziekte (PTLD) de meest voorkomende oorzaak van overlijden na transplantatie (4). Het is bijkomend de meest voorkomende maligniteit na transplantatie bij kinderen (17). Friedersdorff et al. spreekt over een incidentie van ongeveer 5%, Mynarek et al. rapporteert dat 1-2% van alle transplantatiepatiënten binnen de vijf jaar PTLD ontwikkelt (4, 17). PTLD heeft een grote variatie in ziekte-uiting, van indolente lymfeproliferatie tot maligne lymfomen (17). Infectie met het Epstein-barrvirus speelt een belangrijke rol in de ontwikkeling van PTLD. EBV infecteert de B-cellen waardoor deze vervolgens een maligne transformatie ondergaan. Risicofactoren voor het ontwikkelen van PTLD zijn, naast een infectie met EBV, moeilijk aan te duiden. Voor PTLD binnen de twaalf maanden na transplantatie zijn een seropositieve donor in combinatie met een seronegatieve ontvanger, polyclonale antilymfocytaire antilichamen, jonge leeftijd en CMV mismatch of CMV ziekte belangrijke risicofactoren. Voor het ontwikkelen van PTLD meer dan twaalf maanden na transplantatie zijn intensieve immuunsuppressie, Kaukasische etniciteit en mannelijk geslacht belangrijke risicofactoren. De rol van antivirale profylaxis ter preventie van PTLD is omstreden. Volgens recent onderzoek zou het echter geen effect hebben op EBV-geassocieerde PTLD incidentie bij pediatrische transplantatiepatiënten die beschouwd werden als hoog-risicogroep (17). Reductie van de immunosuppressieve medicatie kan zorgen voor een gedeeltelijke correctie van de immuunrespons en zorgt op deze manier voor een complete remissie van PTLD in 50% van de patiënten. Soms is dit echter niet mogelijk, wegens risico op afstoting, of is dit niet voldoende. Dan is verdere behandeling nodig. Het monoclonale anti-CD20 antilichaam kan in monotherapie of samen met chemotherapie toegediend worden. Een individuele behandeling is nodig voor patiënten met zeldzame subtypes of voor patiënten die refractair zijn. In de literatuur wordt een tweejaarsoverleving gerapporteerd van 70 à 80% (11).
1.1.5.2 Infecties
Infectie blijft een grote oorzaak van morbiditeit bij pediatrische patiënten. Screenen van potentiële donoren en ontvangers is noodzakelijk voor het identificeren en verminderen van infectieuze risico’s in de transplantpatiënt. Vroeg in de post-transplant periode (binnen de
7 dertig dagen na transplantatie) komen vooral bacteriële infecties voor, zoals urineweginfecties en bloedinfecties. In de intermediaire en late post-transplant periode (31-180 dagen en > 180 dagen respectievelijk) hebben kinderen een verhoogd risico voor infecties met virussen, zoals cytomegalovirus en Epstein-barrvirus. Ook het BK polyomavirus komt voor. Dit kan resulteren in polyomavirus-geassocieerde nefropathie met verlies van de donornier (17).
1.1.5.3 Groei
De groei van kinderen is vaak al vertraagd in een vroeg stadium van chronische nierziekte (CKD) (4). Dit komt door een dysregulatie in de verhouding groeihormoon/IGF-I, een nutritionele deficiëntie, metabole acidose, anemie, de verstoring in het mineraalmetabolisme van het bot en door inflammatie (18). De groei na transplantatie bij kinderen is vaak suboptimaal en de gewenste grootte wordt meestal niet bereikt (3, 19). Groeiretardatie heeft een grote impact op de levenskwaliteit van de patiënt (4). Wanneer kinderen voor de leeftijd van zes jaar getransplanteerd worden, is een inhaalbeweging van de groei te zien. Bij oudere kinderen niet, hun volwassen lengte wordt dus bepaald door de lengte op het moment van transplantatie (18, 19). Het chronisch gebruik van corticoïden bij transplantatie is vooral voor kinderen erg schadelijk, omdat hierdoor groeiretardatie optreedt (1). Andere determinanten van groei na niertransplantatie zijn werking van de donornier en het gebruik van recombinant groeihormoon (20). Toch is er de laatste 15 tot 20 jaar een enorme verbetering te zien in de lengte die uiteindelijk wordt bereikt (19).
1.1.5.4 Levenskwaliteit
Diseth et al. rapporteerde meer mentale problemen en een lagere levenskwaliteit bij kinderen die een transplantatie ondergingen dan in de controlegroep. De resultaten variëren echter want de meeste patiënten zijn best tevreden met hun leven (3). De bijwerkingen van immunosuppressiva, zoals hypertensie, diabetes en kanker hebben een groot effect op en de levenskwaliteit (1). Een derde van de pediatrische niertransplantatiepatiënten, die al langer dan tien jaar een functionerend donororgaan hebben, zijn niet tevreden over hun lichaamsbouw en zijn bezorgd over hun korte gestalte en mindere botkwaliteit (21).
1.1.5.5 Botkwaliteit
Hoewel succesvolle niertransplantatie de meeste metabole abnormaliteiten corrigeert, blijven sommige stoornissen ongecorrigeerd, wat kan leiden tot osteopenie, groeiretardatie, spontane fracturen, avasculaire necrose en een verhoogde cardiovasculaire mortaliteit. Vooral in het eerste jaar na transplantatie komt het meeste botverlies voor (19). Terpstra et al. toonde aan dat het risico op fracturen verhoogt in de eerste maanden na transplantatie en nadien geleidelijk aan af neemt. Na transplantatie blijven immers significante en persisterende
8 gebreken in het corticale bot, zoals corticale verdikking, aanwezig. Door de fracturen kunnen levenslange complicaties bij kinderen aanwezig blijven (22). Bartosh et al. rapporteerde een prevalentie van bot- en gewrichtsabnormaliteiten van 41%. 23% ervaart volgens deze studie fracturen (19). Haffner et al. toonde aan dat 10% van de patiënten, die een niertransplantatie ondergingen, een fractuur oploopt binnen de zes maanden na transplantatie (15). Volgens data van Bouquegneau et al. tenslotte zou 22% van de transplantatiepatiënten een fractuur oplopen in de eerste 5 jaar na de niertransplantatie (16). Groothoff et al. vond in 35% van de gevallen botziekten bij post-transplant kinderen (19). Dit wordt bevestigd door Damasiewicz et al. die een incidentie van 40% vermeldt (21). Ook de botdensiteit kan verstoord zijn. Het vrouwelijke geslacht, een leeftijd ouder dan 15 jaar en het hebben van hoge PTH-waarden zijn predictoren voor een lage botdensiteit (2).
Deze hoge prevalenties van verminderde kwaliteit van het bot en botziekte en het grote effect daarvan vooral bij kinderen, toont het belang van dit onderzoek aan.
1.2 Persisterende hyperparathyreoïdie na niertransplantatie
Zoals eerder gesteld blijft niertransplantatie de eerste keuze behandeling bij nierfalen, zowel bij volwassenen als bij kinderen (23). Niertransplantatie zorgt voor een correctie van de nierinsufficiëntie en de aanwezige metabole problemen. Een niertransplantatie zal echter niet altijd alle metabole problemen oplossen, waardoor secundaire hyperparathyreoïdie kan persisteren (24).
1.2.1 Definitie hyperparathyreoïdie
Hyperparathyreoïdie is het teveel aan parathyreoïd hormoon (PTH). Dit kan primair, secundair of tertiair zijn. Wanneer een te hoge PTH secretie optreedt door een bijschildklieradenoom, -carcinoom of -hyperplasie spreekt men van primaire hyperparathyreoïdie. De definitie van secundaire hyperparathyreoïdie wordt gebruikt indien een te hoge PTH secretie optreedt in respons op een laag calciumgehalte in het bloed. Tertiaire hyperparathyreoïdie is zeldzaam en treedt enkel op bij persisterende PTH secretie, zelfs wanneer de uitlokkende factor voor secundaire hyperparathyreoïdie opgelost is (25). In de circulatie wordt PTH teruggevonden in zijn actieve vorm (PTH 1-84), maar ook andere PTH-fragmenten kunnen aanwezig zijn. De actieve vorm en andere fragmenten accumuleren wanneer de nierfunctie achteruit gaat en worden herkend door de tweede generatie (‘intact’) analyse. De derde generatie PTH-analyse meet enkel 1-84 PTH en de ‘non-1-84’ PTH fragmenten niet (26). De normale waarde van intact PTH (iPTH) ligt tussen 10 en 65 ng/L (25, 27). De normale referentiewaarde van 1-84 PTH varieert van 5-58 ng/l(28).
9 Er bestaat onenigheid over de optimale PTH-waarde in post-transplant patiënten. Zo verschilt de drempelwaarde van hyperparathyreoïdie na niertransplantatie bij kinderen in de literatuur. Dit gaat gepaard met verschillen in prevalentie van secundaire hyperparathyreoïdie. In tabel 1 wordt een overzicht gegeven van deze verschillen. In dit werk worden patiënten met een PTH-waarde hoger dan 65 pg/ml aanzien als patiënten met een PTH boven de referentiewaarde. De gebruikte grenswaarde is gebaseerd op de richtlijnen van KDIGO. De tabel vermeldt ook welke factoren een significant verband hebben met secundaire hyperparathyreoïdie na transplantatie. Deze factoren worden in sectie 1.2.4 verder besproken. Tabel 1 – Verschillen in definitie, prevalentie en beïnvloedende factoren voor persisterende hyperparathyreoïdie na niertransplantatie bij kinderen
Definitie Prevalentie Beïnvloedende factoren Guzzo et al. (24) > 65 pg/ml 47 % PTH-waarde voor transplantatie
Duur dialyse Creatinineklaring Hypofosfatemie Matsuda-Abedini et al.
(29)
> 73 pg/ml 56 % Hogere leeftijd op moment transplantatie
Bonthuis et al. (30) > 65 pg/ml* 41 % -
* Geldig als GFR > 29 ml/min per 1,73 m2
1.2.2 Mechanisme
Het mechanisme van PTH wordt schematisch voorgesteld in figuur 2 (31). De calcium- en fosfaat homeostase in het bloed wordt gereguleerd door het parathyreoïd hormoon, geproduceerd door de bijschildklier (25). Actieve PTH secretie treedt onmiddellijk op bij een lage hoeveelheid calcium in het bloed, een calciumverlies door diuretica, hyperfosfatemie, vitamine D-deficiëntie, bij aanwezigheid van RANKL-inhibitoren (zie verder) en een teveel aan fibroblast-growth-factor-23 (FGF-23) (27).
10 Figuur 2 – Het werkingsmechanisme van PTH (31)
In een gezonde nier zal FGF-23, door samen met de co-receptor Klotho de FGF-23 receptor te activeren, zorgen voor een stijging in fosfaatexcretie en bijgevolg een daling in PTH en een daling in de synthese van actief vitamine D (15). FGF-23 zal enerzijds stijgen wanneer de Klotho receptor daalt bij CKD en anderzijds wanneer de nierfunctie daalt en hyperfosfatemie ontstaat, door een verminderde fosfaatexcretie (13, 15, 32). De daling in de Klotho receptor en bijgevolg de stijging van FGF-23 treedt vroeg op bij CKD, terwijl hyperfosfatemie pas later optreedt (figuur 3). Ming Chang Hu et al. maakt de opmerking dat de schaal in deze figuur niet representatief is. De stijging van FGF-23 ten opzichte van PTH is veel meer uitgesproken (32). Bij CKD is de nier niet meer in staat fosfaat te excreteren en zal hyperfosfatemie, zoals eerder vermeld, ook leiden tot een stijging in PTH en het verder stijgen van FGF-23. Er treedt een positieve feedback lus op met een steeds hogere FGF-23 en PTH-waarde en een steeds lagere waarde van actief vitamine D (32).
Bij patiënten met nierfalen treedt een calciumtekort op, door minder calciumreabsorptie, maar ook een fosfaatoverschot, door minder fosfaatexcretie, en een 1,25-dihydroxyvitamine D (calcitriol) tekort. Het tekort aan calcitriol treedt op doordat de werking van 1-alfa-hydroxylase afneemt bij patiënten met nierfalen. Dit enzym is noodzakelijk voor de omzetting van inactief vitamine D naar calcitriol (15, 25, 33, 34).
11
Figuur 3 – Verandering van biochemische parameters in functie van een dalende nierfunctie (32) Het half-leven van actief PTH is slechts enkele minuten. Het wordt verwijderd door de nieren en de lever (25). PTH zorgt, door zijn effect op de botten, de nieren en de darm, voor de synthese van actief vitamine D (calcitriol), voor de stijging van 1-alfa-hydroxylase, voor een toename van calcium en voor de daling van fosfaat (25, 27).
In de botten stimuleert PTH indirect de afgifte van calcium door het activeren van de osteoclasten. Osteoclasten zorgen voor het oplossen en het vernietigen van hydroxyapatiet en andere organische materialen waardoor botresorptie optreedt en calcium vrijkomt in het bloed. Voordat de osteoclastische activiteit optreedt, worden osteoblasten gestimuleerd door PTH waardoor hun expressie van RANKL, een activator voor nucleaire factor kappa-B ligand, stijgt en waardoor de osteoblasten differentiëren tot osteoclasten. Tenslotte zal PTH ook osteoprotegerin remmen, zodat RANKL niet meer geremd wordt en de differentiatie naar osteoclasten kan doorgaan (25, 35). PTH remt met andere woorden de RANKL-inhibitoren, zoals osteoprotegerin, waardoor botresorptie wel kan doorgaan en het calciumgehalte stijgt (25, 27). Zoals eerder vermeld zal bij aanwezigheid van RANKL-inhibitoren de PTH secretie stijgen.
In de nieren zorgt PTH op drie manieren voor de stijging van calcium. Enerzijds bereikt actief PTH de distale niertubulus en de ductus colligens waardoor de calciumreabsorptie daar zal stijgen. Anderzijds zorgt PTH voor een daling van fosfaatreabsorptie in de proximale tubulus. Een fosfaat ion vormt samen met calcium een onoplosbaar zout in het serum, waardoor de hoeveelheid calcium in het plasma daalt. Wanneer fosfaat nu daalt door de stijging van PTH,
12 zal er meer geïoniseerd calcium aanwezig zijn in het bloed (25). Tenslotte stimuleert PTH ook de productie van 1-alfa-hydroxylase in de nieren. Dit enzym zorgt dat de inactieve vorm van vitamine D wordt omgezet in een actieve. Vervolgens zal actief vitamine D zorgen voor de calcium reabsorptie onder andere in het duodenum, jejunum en ileum (25).
Eerder wordt reeds vermeld dat patiënten met nierfalen een hoger risico hebben op een calciumtekort, een fosfaatoverschot, een tekort aan 1,25-dihydroxyvitamine D en een teveel aan FGF-23. Hierdoor stijgt het risico op het ontwikkelen van secundaire hyperparathyreoïdie met als gevolg, door zijn werking op de botten, botziekte (15, 16, 25, 33, 34). De K-DOQI richtlijnen bevelen op dit moment aan dat de hoeveelheid calcium, fosfaat en PTH moet worden gemeten in elke patiënt die CKD heeft of waarbij de glomerulaire filtratie kleiner is dan 60ml/min. Deze aanbeveling wordt gebaseerd op het feit dat PTH en fosfaat begint te stijgen vanaf een filtratie kleiner dan 60 ml/min (34).
Magnesium moduleert PTH-secretie eveneens. In het artikel van Rodriguez-Ortiz et al. wordt vermeld dat magnesium in staat is PTH te verminderen wanneer de bijschildklieren een tekort aan calcium ervaren. Bij normale calciumwaarden was het effect van magnesium-inhibitie op PTH minder aanwezig (36).
1.2.3 Gevolgen van secundaire hyperparathyreoïdie
De twee belangrijkste gevolgen van secundaire hyperparathyreoïdie zijn renale osteodystrofie en progressieve cardiovasculaire ziekte. Ook het effect op de groei wordt nader bekeken.
1.2.3.1 Botziekte na niertransplantatie
De pathofysiologie van botziekte na niertransplantatie bestaat uit een reeks van factoren zoals het bestaan van renale osteodystrofie of CKD-MBD (chronic kidney disease and mineral and bone disorder) voor de transplantatie, de inname van immunosuppressiva, het minder goed functioneren van de getransplanteerde nier, persisterende secundaire hyperparathyreoïdie na transplantatie (15, 16, 37). De belangrijkste risicofactoren voor botziekte na niertransplantatie zijn secundaire hyperparathyreoïdie en het gebruik van immunosuppressiva (38).
Aangezien het ontstaan van botziekte afhankelijk is van een reeks van factoren is het niet altijd makkelijk de precieze oorzaak van botziekte aan te wijzen (39). Daarom wordt niet enkel secundaire hyperparathyreoïdie als oorzaak van botziekte besproken, maar ook de bovengenoemde factoren die hiertoe bijdragen na een niertransplantatie.
13 CKD-MBD VOOR TRANSPLANTATIE
Kinderen met een eindstadium van CKD kunnen metabole acidose ontwikkelen. Metabole acidose zal de afbraak van proteïnen, de aanmaak van endogene corticoïden en de resistentie aan groeihormoon bewerkstelligen (13). Het leidt eveneens tot botdemineralisatie en spierkatabolisme (40). Dit alles kan aanleiding geven tot het optreden van botziekte (13). Uit de studie van Harambat et al. bleek dat vooral kinderen met latere stadia van CKD een hogere prevalentie van metabole acidose hebben. Verder is er een positieve correlatie tussen de metabole acidose en het verergeren van secundaire hyperparathyreoïdie (41).
Zoals gezegd in sectie 1.2.2. treedt een verminderde fosfaatexcretie en calciumreabsorptie op bij patiënten met CKD, wat lijdt tot een stijging van PTH en secundaire hyperparathyreoïdie met belangrijke effecten op het bot (42, 43). Ook de stijging van 23 heeft gevolgen. FGF-23 speelt een rol bij de botmineralisatie door TNAP (Tissue Nonspecific Alkaline Phosphatase) in osteoblasten en osteocyten te onderdrukken. Wanneer TNAP onderdrukt wordt, kan zijn substraat pyrofosfaat ongeremd zijn werking verderzetten. Pyrofosfaat is een inhibitor van de botmineralisatie door te binden met de hydroxyapatietkristallen. Hierdoor zal bij een stijging van FGF-23 de botmineralisatie verslechteren (44).
Een vitamine D-deficiëntie, vaak voorkomend bij CKD patiënten, zorgt voor een stijging van PTH. Daarnaast zal een verlaagde 1,25-dihydroxyvitamine D-spiegel resulteren in een gedaalde calciumabsorptie in de gastro-intestinale tractus en bijgevolg hypocalciëmie, wat ook leidt tot de stijging van PTH, resulterend in botziekte (13).
IMMUNOSUPPRESSIVA
Glucocorticoïden worden in de meeste immunosuppressieve therapieën gebruikt na een transplantatie. De dosissen variëren van zeer hoog (0,5 mg/kg/dag) in de eerste maand naar 5 mg/dag gedurende de volgende vier tot zes maanden. Door de grote hoeveelheid glucocorticoïden treedt een snel verlies van trabeculair bot op (16, 45). De verklaring waarom botproblemen optreden na het gebruik van glucocorticoïden is multifactorieel. Door het gebruik van glucocorticoïden is er een verminderde botformatie, een hogere botresorptie en meer botnecrose. De apoptose van osteoblasten en de aanmaak van osteoclasten worden geïnduceerd door de stimulatie van RANKL. Verder zullen glucocorticoïden aanleiding geven tot een spierverzwakking. Dit leidt tot een immobiele patiënt met verergering van het botverlies. Echter, de botformatie en de functie van de osteoblasten zullen herstellen na het stoppen van glucocorticoïden.
Hypomagnesemie treedt vaker op bij het gebruik van tacrolimus dan cyclosporine (46). Hypomagnesemie heeft een negatief effect op de botdensiteit via verschillende mechanismen.
14 Eén van deze mechanismen is het verminderen van de secretie van PTH. Dit leidt tot lagere serum concentraties van 1,25(0H)2-vitamine D. Bovendien geeft hypomagnesemie ook aanleiding tot inflammatie. Inflammatie op zijn beurt leidt tot botverlies (47).
PERSISTERENDE SECUNDAIRE HYPERPARATHYREOÏDIE
Bij persisterende secundaire hyperparathyreoïdie zal calcium, samen met 1,25-dihydroxyvitamine D, stijgen door mobilisatie uit de botten (16). In de studie van Matsuda-Abidini et al. bleek dat 28% van de patiënten, die een transplantatie ondergaan, na 6 maanden leiden aan hypercalciëmie. Na een jaar is dat nog 23% (29). Verder zal door een overschot aan PTH de fosfaat reabsorptie in de niertubuli dalen. Hierdoor is de kans op hypofosfatemie groter. Dit leidt tot minder osteoblasten en een slechtere mineralisatie (16). Een hoge PTH-waarde resulteert voornamelijk in corticaal botverlies (16). Door bovenstaande verklaringen kampen patiënten met persisterende secundaire hyperparathyreoïdie na transplantatie nog steeds met botziekte (48, 49).
SOORTEN BOTZIEKTE
Zoals vermeld in sectie 1.1.5.5 komen na een niertransplantatie complicaties voor van de verstoring in het mineraalmetabolisme. Voorbeelden hiervan zijn: osteopenie, een hoge of net een lage bot turnover, fracturen, skeletale vervormingen, osteonecrose, groeistoornissen en botpijn (15, 16). De incidentie van deze complicaties wordt daar reeds vermeld.
De impact van secundaire hyperparathyreoïdie op het bot is groter voor kinderen en adolescenten, omdat botmassa en volwassen lengte bepaald worden tijdens de kindertijd en adolescentie. Verder onderzoek is nodig, zodat risicofactoren tot persisterende secundaire hyperparathyreoïdie worden aangetoond en zo vroegtijdig kunnen worden aangepakt (29).
1.2.3.2 Vertraagde groei
Directe effecten van PTH op de chondrocyten van de groeiplaat zijn niet bewezen. De effecten van PTH op de groei, komen voort uit de cruciale rol die PTH speelt in de ontwikkeling van renale osteodystrofie. Bij ernstige hyperparathyreoïdie is de groeiplaat gewijzigd en de groei aangetast. De meeste studies suggereren dat vermijden van ontwikkeling van een botziekte door strikte controle van de PTH-niveaus een goede groei mogelijk maakt, al is een directe correlatie tussen PTH-niveaus en groei niet wetenschappelijk aangetoond in klinische studies. Optimale waarden van PTH die de groei maximaliseren zijn echter nog niet bepaald (50).
1.2.3.3 Cardiovasculaire ziekte
CKD kan indirect, door verergering van ischemisch hartlijden, en direct, door vasculaire hypertensie en een hogere vullingsgraad van het ventrikel met daardoor linker
15 ventrikelhypertrofie, leiden tot hart- en vaatziekten. Hyperfosfatemie en secundaire hyperparathyreoïdie zorgen voor vasculaire calcificaties doordat meer calcium vrijkomt uit het bot. Tenslotte zal hypertensie, vaak voorkomend bij patiënten met een lage glomerulaire filtratiesnelheid (GFR), ook aanleiding geven tot calcificatie van bloedvaten door hogere schuifkrachten op het bloedvat (25, 27, 34, 44, 51).
1.2.4 Factoren
die
aanleiding
geven
tot
persisterende
secundaire
hyperparathyreoïdie
De factoren die bijdragen tot het persisteren van hyperparathyreoïdie na niertransplantatie zijn niet goed gekend. Vele biochemische en klinische parameters zijn reeds onderzocht, maar waren niet voorspellend voor hyperparathyreoïdie na niertransplantatie (29). Het bestuderen van factoren die leiden tot persisterende hyperparathyreoïdie kan interessant zijn om patiënten te identificeren die na transplantatie een farmacologische behandeling nodig hebben (24). Hieronder wordt kort besproken wat reeds bekend is omtrent deze factoren.
1.2.4.1 Klinisch
Een oudere leeftijd van het kind waarop de transplantatie wordt uitgevoerd, wordt aangetoond als predictor voor hyperparathyreoïdie één jaar na niertransplantatie. Dit kan verklaard worden doordat CKD bij deze patiënten langer aanwezig was (29). Geslacht is geen voorspellende factor (24, 29). Duur van de dialysebehandeling voor transplantatie is wel significant als predictor voor persisterende hyperparathyreoïdie (23, 24). Dit laatste kon de studie van Matsuda-Abedini et al., die vijf jaar eerder werd gedaan, niet aantonen (29). Het tijdstip waarop resolutie optreedt van de PTH-waarde is gerelateerd aan het hebben van een levende donor. Patiënten die binnen het jaar resolutie hadden van de serum PTH-waarde hadden vaker een levende donor (23).
1.2.4.2 Biochemisch
Voor verschillende biochemische parameters werd reeds een poging gedaan het verband met persisterende hyperparathyreoïdie aan te tonen. Een hoge PTH-waarde voor transplantatie en hypofosfatemie na transplantatie, gedefinieerd als een serumfosfaatwaarde <2,5 mg/dl, zijn significant voorspellende factoren voor persisterende hyperparathyreoïdie na transplantatie (24). Hypofosfatemie na niertransplantatie kan optreden doordat FGF-23 nog hoog is, terwijl de GFR gestegen is, doordat er een defect is in de tubulaire fosfaatreabsorptie of door de inname van corticoïden (15, 16, 29). De creatinineklaring, berekend uit een 24-uurs urinecollectie is eveneens een significante predictor van persisterende hyperparathyreoïdie (24). Zowel GFR, berekend volgens de formule van Schwartz en serumfosfaat konden in een studie van Matsuda-Abedini et al. niet als verklarende factoren aangetoond worden (29). Ook
16 hypercalciëmie, gedefinieerd als een calciumwaarde ≥10,5 mg/dl, is niet significant als voorspellende factor (24, 29).
1.2.4.3 Medicatie
Ondanks dat er geen significant verschil aangetoond werd, suggereert Guzzo et al. dat de gemiddelde PTH-waarde in patiënten, behandeld met groeihormoon voor transplantatie, hoger was dan bij patiënten die niet behandeld worden met groeihormoon (24). Toch is het gebruik van groeihormoon voor transplantatie in sommige studies geassocieerd met verhoogde PTH-niveaus. Groothof et al. vond echter geen significante effecten van groeihormoontherapie op PTH-niveaus (50).
1.3 Factoren die groei beïnvloeden na niertransplantatie
Niertransplantatie bij kinderen met een eindstadium nierfalen induceert een matige inhaalbeweging in groei. De uiteindelijke volwassen lengte bij een derde van de kinderen is echter onvoldoende (52). Hieronder worden de factoren besproken die mogelijks een invloed hebben op de groei bij kinderen na een niertransplantatie.
1.3.1 Klinisch
Een langere duur van dialyse resulteert in een slechtere groei achteraf. De lengte op het moment van dialyse is significant in het bepalen van de lengte op moment van transplantatie. Deze factoren worden aangenomen belangrijk te zijn in het bepalen van de volwassen lengte (53, 54).
De groei bij kinderen na transplantatie vertoont een negatief verband met de lengte en leeftijd op het moment van de transplantatie (53). In het artikel van Nissel et al. wordt eveneens bevestigd dat een jongere leeftijd op moment van transplantatie, bij voorkeur pre-pubertair, resulteert in een grotere groeispurt achteraf. Verder concluderen zij dat er geen significant verband is met het geslacht, de onderliggende nierziekte, het gebruik van een levende of overleden donor en de duur van dialyse (52). Dit laatste staat in contrast met de bevindingen van Jung en Mehls et al. (53).
1.3.2 Biochemisch
Het functioneren van de donornier speelt een belangrijke rol in de groei post-transplantie. Een GFR kleiner dan 40-50 ml/min per 1,73 m² heeft een negatieve impact op de groei, voornamelijk indien deze lage GFR-waarden voor een langere periode persisteren (52, 53). Verder zal een stijging van creatinine met 1,0 mg/dl resulteren in een delta SD lengte die gelijk is aan -0,15 (53).
17
1.3.3 Medicatie
Het gebruik van groeihormoon is effectief in het verbeteren van de groei bij kinderen na niertransplantatie. Recent werden praktische aanbevelingen omtrent het gebruik na niertransplantatie ontwikkeld door de European Society for Paediatric Nephrology. Het gebruik van groeihormoon bij kinderen na transplantatie wordt aanbevolen vanaf 1 jaar na transplantatie als een spontane inhaalbeweging van de groei uitblijft en het gebruik van corticoïd-vrije immunosuppressie niet mogelijk is (55). Het gebruik van groeihormoon voor transplantatie wordt aangeraden aangezien het de groei voor dialyse en transplantatie zal bevorderen (53). Het starten van groeihormoon op puberleeftijd is te laat om een optimale respons te hebben op de groei en de uiteindelijke lengte te verbeteren (54).
Daar corticoïden de groei nadelig beïnvloeden wordt corticoïd-vrije immunosuppressie steeds meer toegepast. Er bestaat geen twijfel dat het niet gebruiken van corticoïden leidt tot een betere groei. Vooral kinderen jonger dan vijf jaar, die geen corticoïden langdurig gebruiken, vertonen een enorme verbetering in groei in vergelijking met zij die dat wel gebruiken (54). In de studie van Amir Tejani et al. wordt gesteld dat er een direct inhiberend effect zou zijn van prednisolone op de groei (56).
18
1.4 Doelstellingen van dit onderzoek
De doelstelling van dit onderzoek is viervoudig:
1) Verloop van de PTH-waarde bij kinderen in het eerste jaar na niertransplantatie analyseren
2) Factoren analyseren die geassocieerd zijn met het persisteren van hyperparathyreoïdie 3, 6, 9 en 12maanden na niertransplantatie
3) Factoren analyseren die geassocieerd zijn met een ernstig verhoogd PTH (PTH > 2x referentiewaarde) 3 en 12 maanden na transplantatie
4) Analyse van de factoren die geassocieerd zijn met de groeisnelheid in het eerste jaar na transplantatie, in het bijzonder PTH
De toegevoegde waarde van deze studie ten opzichte van eerdere literatuuronderzoeken is dat een bredere selectie van factoren wordt geanalyseerd. Er wordt eveneens onderscheid gemaakt tussen verhoogd PTH en ernstig verhoogd PTH (>2x boven de referentiewaarde). Eerder onderzoek toonde aan dat kinderen na transplantatie een verhoogd PTH hebben, ondanks de hogere GFR ten opzichte van kinderen met CKD voor transplantatie (57). Mogelijk zijn het dus verschillende factoren die een rol spelen bij het ontstaan van hyperparathyreoïdie voor- en na transplantatie.
Op de factoren vitamine D en BMI wordt de nadruk gelegd. PTH en vitamine D vormen een strikt geregelde feedbackcyclus. Vitamine D zorgt voor een negatieve feedback naar de PTH-secretie (58). De invloed van een tekort aan vitamine D na niertransplantie op de PTH-waarde wordt geanalyseerd.
Obesitas bij kinderen die een niertransplantatie ondergaan, leidt tot een verminderde functie en overleving van de donornier, en zo een verminderde outcome van de patiënt (59). Een verband tussen PTH en BMI zal onderzocht worden aangezien eerdere studies de relatie tussen primaire hyperparathyreoïdie en obesitas reeds aantoonden. Waar obesitas meer aanwezig is bij patiënten met primaire hyperparathyreoïdie (60, 61).
Secundaire hyperparathyreoïdie bij getransplanteerde kinderen werd in voorgaande studies op zichzelf onderzocht en niet steeds in combinatie met de gevolgen voor de patiënt. Effecten op het bot door een verstoorde mineralisatie spelen een sleutelrol bij het hebben van problemen met de groei. PTH is een grote oorzaak van deze verstoorde mineralisatie. De effecten op de groei worden vooral verklaard door de grote rol die PTH speelt in de ontwikkeling van renale osteodystrofie. (50). Hier wordt gekeken of hyperparathyreoïdie geassocieerd is op de groei van kinderen na transplantatie.
19 Volgende hypothesen worden vooropgesteld:
“Een tekort aan vitamine D zal resulteren in het persisteren van hyperparathyreoïdie bij kinderen na transplantatie.”
“Een hoger BMI zal leiden tot het persisteren van hyperparathyreoïdie bij kinderen na transplantatie.”
“Kinderen met een PTH boven de referentiewaarde na niertransplantatie hebben een tragere groei.”
20
2. Methode
2.1 Literatuuronderzoek
Vooraleer werd overgegaan tot de analyse van de verzamelde data, werd een literatuurstudie uitgevoerd door middel van de online medische zoekmachine PubMed. Er werd gebruik gemaakt van een aantal zoektermen en combinaties hiervan: ‘secondary hyperparathyroidism’, ‘parathyroid hormone mechanism’, ‘hyperparathyroidism kidney transplantation’, ‘secondary hyperparathyroidism’, ‘parathyroid hormone’, ‘secondary hyperparathyroidism children renal transplantation’, ‘metabolic bone disease kidney transplantation’, ‘growth after pediatric kidney transplantation’,... Bij het verzamelen van artikels werd rekening gehouden met de datum van publicatie en het tijdschrift waarin het artikel verscheen. Hiervoor werd de impactfactor en de klassering van het tijdschrift waarin het artikel verscheen, gecontroleerd. In de inleiding werden de bekomen relevante studieresultaten neergeschreven. De referenties naar de artikels werden ingevoerd via EndNote, deze zijn te vinden in de referentielijst.
2.2 Studiecohorte
Kinderen en adolescenten die een niertransplantatie ondergingen in één van de volgende vier centra: Kinderziekenhuis Prinses Elisabeth van Universitair Ziekenhuis Gent, Kinderziekenhuis UZ Leuven, Sophia Kinderziekenhuis van Erasmus MC Rotterdam en Emma Kinderziekenhuis van AMC Amsterdam, behoren tot de studiepopulatie van dit multicentrisch retrospectief longitudinaal onderzoek.
Patiënten die voldeden aan volgende inclusiecriteria werden in de studie opgenomen:
1) Niertransplantatie ondergaan in één van bovenstaande vier centra met minimaal 1 jaar follow-up
2) Eerste niertransplantatie
3) Enkel niertransplantatie (niet gecombineerd met andere organen)
Op basis van onderstaande exclusiecriteria werden een aantal patiënten uitgesloten voor de studie:
1) Ouder zijn dan 18 jaar op het moment van transplantatie
2) Het ontbreken van een PTH-meting in het jaar na transplantatie 3) Een onbekende transplantatiedatum
21
2.3 Datacollectie
Data van de patiënten werd geanonimiseerd aangeleverd door de behandelende kindernefrologen van de vier centra. De variabelen die werden bekeken in deze analyse zijn terug te vinden in tabel 2.
Immunosuppressiva (soort en dosis), lengte, gewicht, BMI en biochemische parameters in het serum werden bepaald tijdens de consultaties in het centrum waar de patiënt opgevolgd wordt. Voor deze datacollectie werden vijf consultaties gekozen: net voor transplantatie en het dichtst bij drie, zes, negen en twaalf maanden na transplantatie. De momenten werden zo gekozen dat een PTH-waarde beschikbaar was. Zo werden vier verschillende meetmomenten na transplantatie bekomen, namelijk: drie maanden, zes maanden, negen en twaalf maanden na transplantatie.
Tabel 2 – Overzicht gebruikte variabelen Patiëntenkarakteristieken/ klinische data
- Geslacht - Duur van dialyse (maanden)
- Etniciteit - Lengte (cm)
- Leeftijd (jaren) - Gewicht (kg)
- Transplantatie met levende/ overleden donor
- BMI (kg/m²) - Pre-emptief
Biochemische parameters
- Intact pth (iPTH) (ng/l) - Fosfaat (mmol/l)
- Non-(1-84) moleculair PTH (ng/l)* - Magnesium (mmol/l) - 25- hydroxyvitamine D (ng/ml) - Albumine (g/l) - 1,25-dihydroxyvitamine D (pg/ml) - Creatinine (mg/dl)
- Totaal calcium (mmol/l) - eGFR (ml/min per 1,73 m2)
Medicatie
- Groeihormoon voor transplantatie - Vitamine D suppletie
- Alfacalcidiol (μg/dag) - Colecalciferol (IE/dag)
- Tacrolimus (mg/dag) - Cyclosporine (mg/dag)
- Azathioprine (mg/dag) - Everolimus (mg/dag)
- Mycofenolzuur (mg/dag) - Corticoïden (mg/dag)
*standaard bepalingsmethode in UZ Leuven
Enkele variabelen worden hieronder bijkomend toegelicht. ETNICITEIT
De etniciteit van de patiënten werd ingedeeld als “Kaukasisch” of “andere”.
PRE-EMPTIEF
Indien de patiënt niet pre-emptief werd getransplanteerd, zijn de mogelijke dialysevormen: hemodialyse, peritoneaal dialyse of een combinatie van beide.
22 LENGTE – GEWICHT - BMI
Lengte (cm), gewicht (kg) en BMI (kg/m²) werden met bijhorende standaarddeviatiescore (SDS) genoteerd op de verschillende meetmomenten. De standaarddeviatiescore diende enkel nog berekend te worden voor de centra in Nederland. Daarvoor werd de online TNO (de Nederlandse organisatie voor toegepast-natuurwetenschappelijk onderzoek) groeicalculator gebruikt.
Om beïnvloedende factoren voor een verandering in lengte te identificeren, werd een nieuwe variabele “delta SDS lengte” aangemaakt. De standaarddeviatiescore van de lengte werd bepaald aan de hand van groeicurves. Deze zijn opgesteld volgens een representatieve steekproef, verschillend voor Vlaanderen en Nederland. Delta SDS lengte is het verschil in de standaarddeviatiescore van de lengte op meetmoment vier met deze voor transplantatie. Op dezelfde manier werd de standaarddeviatiescore van BMI bepaald aan de hand van de groeicurves. Deze variabele werd gedefinieerd als “BMI SDS”. De standaarddeviatiescore is een maat voor afwijking van de meetwaarde ten opzichte van het gemiddelde.
GESCHAT GFR
GFR is een belangrijke indicator om de nierfunctie en de progressie van een nierziekte op te volgen. Echter is het zeer tijdrovend, duur en zeer uitdagend om de werkelijke GFR accuraat te bepalen in de praktijk. De glomerulaire filtratiesnelheid werd in deze analyse geschat met behulp van de Schwartz formule [GFR (ml/min per 1,73 m2) = (k x hoogte (cm)/ creatinine (mg/dl)], waarbij k = 0,55 voor jongens tot twaalf jaar en alle meisjes en k = 0,7 voor jongens tussen dertien en 21 jaar (29, 31, 62).
PTH
De bepaling van PTH gebeurde op een verschillende manier in UZ Leuven, ten opzichte van de andere centra. In Leuven werd 1-84 PTH bepaald. De andere centra maken gebruik van iPTH. Hyperparathyreoïdie wordt gedefinieerd als iPTH > 65 ng/l of 1-84 PTH > 56.9 ng/l. Opdat de waarden, bekomen met deze assay snit, vergeleken kunnen worden in de analyse, werden ze gecodeerd tot de dichotome variabele “een PTH boven de referentiewaarde”. Deze variabele laat toe de data uit de vier centra tegelijk te kunnen analyseren.
VITAMINE D
Naast het gebruik van de continue variabelen 1,25-(OH)2- vitamine D en 25-0H-vitamine D, werd ook de categorische variabele “Vitamine D-deficiëntie” aangemaakt om het mogelijke verband tussen een tekort aan vitamine D en het persisteren van hyperparathyreoïdie bij kinderen na transplantatie aan te tonen. Vitamine D-deficiëntie betekent dat de 25-OH-vitamine D-waarde kleiner is dan 10 ng/ml.
23 MAGNESIUM
Naast het gebruik van de continue variabele magnesium werd, net zoals bij vitamine D, de categorische variabele “hypomagnesemie” aangemaakt. Hypomagnesemie is de situatie waarbij magnesium <0,7 mmol/l.
MEDICATIE
De data van groeihormoon werd enkel bekeken voor transplantatie omdat het in het eerste jaar na transplantatie uitzonderlijk is om groeihormoon te gebruiken. Er wordt immers eerst een kans gegeven tot spontaan groeien in het eerste jaar na de niertransplantatie. Er werd gekeken of het al dan niet werd gebruikt door de patiënt. De dosis van vitamine D suppletie werd zowel voor als op de vier meetmomenten na de transplantatie genoteerd. De dosis van immunosuppressiva werd op de vier meetmomenten na transplantatie genoteerd.
REFERENTIEWAARDEN BIOCHEMISCHE PARAMETERS
De referentiewaarden werden bepaald volgens de richtlijnen van KDIGO.
2.4 Ethisch comité
Elk centrum zorgde voor een eigen toestemming van het Ethisch Comité. In Gent werd dit onderzoek voorgelegd aan de Commissie voor medische ethiek en goedgekeurd op 4 juli 2018 met als kenmerk EC/2018/0854. Alle patiëntengegevens werden geanonimiseerd.
2.5 Statistische analyse
Voor de statistische analyse werd gebruik gemaakt van het softwareprogramma IBM SPSS Statistics 25. Variabelen die normaal verdeeld zijn, worden gerapporteerd door het gemiddelde en de standaarddeviatie. Niet-normaal verdeelde variabelen werden weergegeven door de mediaan en de interkwartielafstand (25e – 75e percentiel). Het al of niet Gaussiaans verdeeld zijn werd nagegaan door de Shapiro Willk test, het QQ-plot en het histogram. Vervolgens werden univariate analyses uitgevoerd. Voor het vergelijken van een continue variabele tussen de patiëntengroep met een PTH boven de referentiewaarde en de groep met een normale PTH-waarde werd gebruik gemaakt van de parametrische ongepaarde student’s T-test voor normaal verdeelde variabelen en de niet-parametrische Mann Whitney U-test indien de variabelen niet normaal verdeeld waren. De Chi-kwadraat test werd gebruikt om categorische variabelen te vergelijken tussen patiënten met een PTH boven de referentiewaarde en een normale PTH-waarde. Voor rechtmatig gebruik van de Chi-kwadraat test moeten alle cellen een verwachte waarde groter (of gelijk) aan vijf hebben. Indien dit niet het geval was, werd de Fisher’s exact test toegepast. Zo werden de klinische en biochemische parameters vergeleken met het al of niet aanwezig zijn van een PTH boven de referentiewaarde. P≤ 0,05 werd als
24 significant beschouwd. Aangezien niet langer alleen het gemiddelde voorspeld diende te worden, maar ook de kans op een PTH boven de referentiewaarde, werd voor deze vier momenten een multivariate logistische regressie uitgevoerd met een PTH boven de referentiewaarde als uitkomstvariabele. In deze multivariate analyse werden de variabelen opgenomen die een significant verschil toonden in de univariate analyse. De regressiecoëfficiënt werd geschat op basis van de Likelihood methode. Zelfde analyses werden ook uitgevoerd met de afhankelijke variabele PTH, twee keer boven de referentiewaarde. Om het verband tussen de parameters enerzijds en delta SDS lengte anderzijds te onderzoeken, werd gebruik gemaakt van een lineaire regressie. Collineariteit in de multivariate modellen werd steeds nagegaan.
Voor het bekijken van het verloop van PTH over de tijd, werd Linear Mixed Models toegepast.
3. Resultaten
3.1 Patiënt karakteristieken
In deze studie werden patiënten die een niertransplantatie ondergingen in één van de vier centra tussen december 1996 en november 2018, gecontroleerd op in – en exclusiecriteria, zoals gedefinieerd in sectie 2.2. In totaal werden 157 patiënten geïncludeerd en retrospectief opgevolgd over het verloop van twaalf maanden, tenzij deze data nog niet over de periode van twaalf maanden beschikbaar waren. Uit de populatie van 157 patiënten werden acht patiënten uitgesloten: één patiënt omdat de exacte datum van transplantatie onbekend was, zes patiënten hadden geen PTH-meting binnen het jaar na transplantatie en een patiënt werd uitgesloten wegens ouder dan 18 jaar op het moment van transplantatie. Zo werd uiteindelijk een cohorte van 149 patiënten bekomen (figuur 4).
25 Patiëntenkarakteristieken werden vergeleken tussen de verschillende centra. Tabel 3 geeft de hoeveelheid data die beschikbaar was voor elke variabele per centrum en de p-waarde weer. Er is een significant verschil in pre-emptief, gewicht SDS en BMI SDS naargelang het centrum (p< 0,05).
26 Tabel 3 – Patiëntenkarakteristieken
Totaal UZ Gent UZ Leuven EMC
Rotterdam AMC Amsterdam p Aantal patiënten Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden 149 149 148 148 146 19 (12,8%) 19 (12,8%) 19 (12,8%) 19 (12,8%) 19 (13,0%) 53 (35,6%) 53 (35,6%) 52 (35,1%) 52 (35,1%) 51 (34,9%) 45 (30,2%) 45 (30,2%) 45 (30,4%) 45 (30,4%) 45 (30,8%) 32 (21,5%) 32 (21,5%) 32 (21,6%) 32 (21,6%) 31 (21,2%) Leeftijd op moment van Tx (jaar) Median (IQR) 9,01 (8,72) 8,26 (9,61) 10,73 (7,45) 8,97 (9,02) 7,97 (8,40) 0,580 Geslacht: n (%) Meisje Jongen 63 (42,3%) 86 (57,7%) 8 (42,1%) 11 (57,9%) 23 (43,4%) 30 (56,6%) 17 (37,8%) 28 (62,2%) 15 (46,9%) 17 (53,1%) 0,874 Donortype: n (%) Overleden Levend 81 (54,4%) 67 (45,0%) 11 (57,9%) 7 (36,8%) 36 (67,9%) 17 (32,1%) 21 (46,7%) 24 (53,3%) 13 (40,6%) 19 (59,4%) 0,051 Pre-emptief: n (%) Pre-emptief getransplanteerd Peritoneaal dialyse (PD) Hemodialyse (HD) PD + HD 41 (27,5%) 76 (51,0%) 19 (12,8%) 13 (8,7%) 4 (21,1%) 4 (21,1%) 7 (36,8%) 4 (21,1%) 11 (20,8%) Onbekend Onbekend Onbekend 17 (37,8%) 16 (35,6%) 7 (15,6%) 5 (11,1%) 9 (28,1%) 14 (43,8%) 5 (15,6%) 4 (12,5%) 0,001
Tijd aan dialyse (maanden)
Mediaan (IQR) 7,72 (19,30) 12,47 (18,63) Onbekend 4,47 (20,13) 9,82 (20,44) 0,110 Hoog PTH voor Tx: n (%) Ja Neen 97 (70,8%) 40 (29,2%) 15 (83,3%) 3 (16,7%) 22 (47,8%) 24 (52,2%) 33 (80,5%) 8 (19,5%) 27 (84,3%) 5 (15,6%) <0,001 Lengte SDS Mediaan (IQR) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden -1,20 (1,77) -1,36 (1,84) -1,40 (1,70) -1,30 (1,65) -1,09 (1,55) -1,70 (1,40) -1,40 (1,60) -1,40 (1,70) -1,50 (1,70) -1,20 (1,60) -0,75 (1,98) -1,10 (2,40) -1,10 (2,28) -1,20 (1,11) -1,25 (2,15) -1,63 (1,06) -1,72 (1,10) -1,50 (1,01) -1,53 (1,11) -1,64 (1,25) -0,97 (2,06) -0,73 (1,93) -0,89 (1,85) -0,70 (1,61) -0,61 (1,36) 0,110 0,062 0,220 0,149 0,093 Gewicht SDS Mediaan (IQR) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden -0,50 (1,42) -0,25 (1,63) -0,20 (1,60) -0,12 (1,71) -0,12 (1,73) -0,75 (1,53) -0,40 (0,80) -0,60 (1,30) -0,50 (1,50) -0,60 (1,40) -0,65 (1,95) -0,65 (2,00) -0,40 (2,33) -0,60 (1,95) -0,90 (1,90) -0,56 (1,37) -0,17 (1,22) -0,24 (1,54) -0,31 (1,52) -0,21 (1,71) -0,26 (0,81) 0,40 (1,44) 0,39 (2,02) 0,44 (1,66) 0,51 (1,47) 0,359 0,002 0,005 0,004 <0,001 BMI SDS Mediaan (IQR) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden 0,14 (1,40) 0,61 (1,60) 0,75 (1,42) 0,66 (1,62) 0,49 (1,43) 0,10 (1,63) 0,70 (1,50) 0,70 (1,60) 0,40 (1,40) 0,60 (1,40) -0,35 (1,38) -0,40 (1,50) 0,30 (1,70) 0,15 (1,38) 0,10 (1,25) 0,37 (1,17) 1,06 (1,21) 0,78 (1,11) 0,92 (1,71) 0,70 (1,80) 0,69 (1,52) 1,24 (1,67) 1,44 (1,33) 1,49 (1,54) 1,22 (1,88) 0,007 <0,001 <0,001 <0,001 <0,001
27 Mann-Withney-U testen, waarbij de centra twee aan twee vergeleken werden, tonen nog enkele interessante bevindingen aan. In Amsterdam en Rotterdam wordt significant vaker een levende donor gebruikt ten opzichte van Leuven en Gent (p= 0,001). Er zit eveneens een significant verschil in PTH boven de referentiewaarde voor transplantatie tussen Rotterdam, Amsterdam enerzijds en Leuven, Gent anderzijds (p=0,002). Uit de analyse blijkt ook dat de BMI SDS significant hoger ligt in Amsterdam, Rotterdam, ten opzichte van Gent en Leuven op de vijf verschillende meetmomenten (p<0,05).
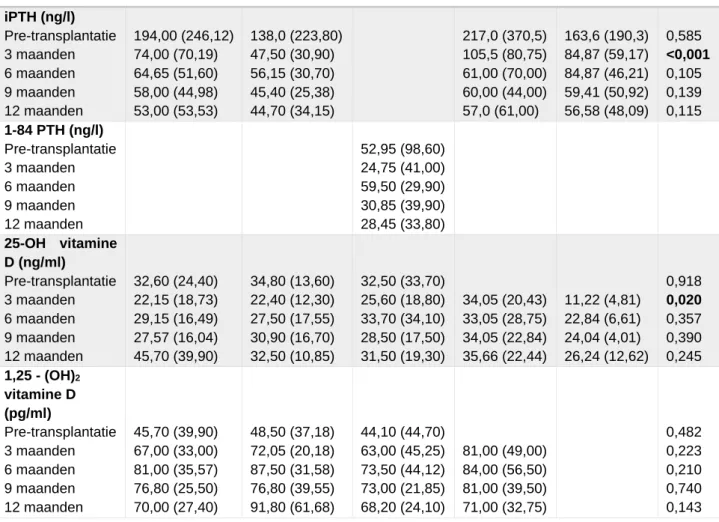
Tabel 4 geeft op zijn beurt de vergelijking van labogegevens tussen de verschillende centra. De mediaan (IQR) van de labowaarden over alle centra heen en afzonderlijk per centrum worden weergegeven. De p-waarde duidt aan of er een significant verschil is in labowaarden tussen de centra afzonderlijk. Er is een significant verschil in iPTH drie maanden na transplantatie, 25-0H vitamine D drie maanden na transplantatie, totaal calcium op drie, negen en twaalf maanden na transplantatie, in fosfaat op drie, zes en negen maanden na transplantatie en in magnesium op de vier meetmomenten (p< 0,05).
Tabel 4 – Labo gegevens patiënten, weergegeven door mediaan en IQR
Totaal UZ Gent UZ Leuven EMC
Rotterdam AMC Amsterdam p iPTH (ng/l) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden 194,00 (246,12) 74,00 (70,19) 64,65 (51,60) 58,00 (44,98) 53,00 (53,53) 138,0 (223,80) 47,50 (30,90) 56,15 (30,70) 45,40 (25,38) 44,70 (34,15) 217,0 (370,5) 105,5 (80,75) 61,00 (70,00) 60,00 (44,00) 57,0 (61,00) 163,6 (190,3) 84,87 (59,17) 84,87 (46,21) 59,41 (50,92) 56,58 (48,09) 0,585 <0,001 0,105 0,139 0,115 1-84 PTH (ng/l) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden 52,95 (98,60) 24,75 (41,00) 59,50 (29,90) 30,85 (39,90) 28,45 (33,80) 25-OH vitamine D (ng/ml) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden 32,60 (24,40) 22,15 (18,73) 29,15 (16,49) 27,57 (16,04) 45,70 (39,90) 34,80 (13,60) 22,40 (12,30) 27,50 (17,55) 30,90 (16,70) 32,50 (10,85) 32,50 (33,70) 25,60 (18,80) 33,70 (34,10) 28,50 (17,50) 31,50 (19,30) 34,05 (20,43) 33,05 (28,75) 34,05 (22,84) 35,66 (22,44) 11,22 (4,81) 22,84 (6,61) 24,04 (4,01) 26,24 (12,62) 0,918 0,020 0,357 0,390 0,245 1,25 - (OH)2 vitamine D (pg/ml) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden 45,70 (39,90) 67,00 (33,00) 81,00 (35,57) 76,80 (25,50) 70,00 (27,40) 48,50 (37,18) 72,05 (20,18) 87,50 (31,58) 76,80 (39,55) 91,80 (61,68) 44,10 (44,70) 63,00 (45,25) 73,50 (44,12) 73,00 (21,85) 68,20 (24,10) 81,00 (49,00) 84,00 (56,50) 81,00 (39,50) 71,00 (32,75) 0,482 0,223 0,210 0,740 0,143
28 Totaal calcium (mmol/l) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden 2,53 (0,23) 2,43 (0,23) 2,46 (0,17) 2,45 (0,14) 2,43 (0,20) 2,53 (0,24) 2,58 (0,19) 2,50 (0,15) 2,51 (0,13) 2,57 (0,25) 2,53 (0,20) 2,41 (0,21) 2,43 (0,17) 2,44 (0,11) 2,42 (0,18) 2,45 (0,21) 2,45 (0,18) 2,42 (0,17) 2,40 (0,13) 2,39 (0,20) 2,45 (0,17) 2,47 (0,11) 2,45 (0,16) 0,762 0,001 0,076 0,016 0,004 Fosfaat (mmol/l) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden 1,59 (0,46) 1,18 (0,49) 1,28 (0,36) 1,36 (0,36) 1,38 (0,32) 1,55 (0,56) 1,31 (0,50) 1,44 (0,46) 1,54 (0,31) 1,45 (0,21) 1,62 (0,44) 1,01 (0,45) 1,18 (0,21) 1,32 (0,31) 1,37 (0,30) 1,32 (0,51) 1,30 (0,41) 1,36 (0,39) 1,40 (0,34) 1,18 (0,57) 1,43 (0,40) 1,30 (0,28) 1,31 (0,43) 0,502 0,001 <0,001 0,040 0,287 Magnesium (mmol/l) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden 1,07 (0,31) 0,72 (0,13) 0,73 (0,08) 0,73 (0,10) 0,73 (0,09) 1,14 (0,42) 0,75 (0,09) 0,73 (0,10) 0,72 (0,08) 0,74 (0,10) 1,02 (0,29) 0,67 (0,12) 0,69 (0,09) 0,71 (0,11) 0,72 (0,08) 0,76 (0,16) 0,73 (0,12) 0,75 (0,14) 0,71 (0,09) 0,72 (0,13) 0,76 (0,04) 0,75 (0,07) 0,75 (0,07) 0,046 0,001 0,154 0,192 0,147 eGFR (ml/min per 1,73 m2) Pre-transplantatie 3 maanden 6 maanden 9 maanden 12 maanden nvt 94,63 (43,33) 97,25 (35,92) 94,66 (39,95) 88,98 (44,01) nvt 97,63 (44,70) 112,79 (48,89) 106,67 (39,51) 109,46 (44,15) nvt 89,72 (44,57) 90,30 (37,01) 89,47 (35,91) 81,94 (43,24) nvt 83,03 (47,77) 92,83 (43,36) 91,03 (41,41) 86,95 (50,81) nvt 97,51 (48,98) 95,46 (23,76) 93,61 (31,68) 90,63 (27,96) nvt 0,612 0,079 0,182 0,137
3.2 Persisterende hyperparathyreoïdie na transplantatie
3.2.1 Verloop van de PTH-waarde na transplantatie
In figuur 5 is het verloop te zien van de probabiliteit voor een PTH boven de referentiewaarde. Deze neemt af naarmate men verder weg gaat van het moment van transplantatie. Negen maanden na transplantatie is de probabiliteit op een PTH waarde boven de referentiewaarde 0,31. Dit neemt nog verder af. Twaalf maanden na transplantatie is de probabiliteit op een PTH waarde boven de referentiewaarde 0,29.