CHECKPOINT INHIBITOREN BIJ
OVARIUMCARCINOMEN
Silke Ceulemans
Stamnummer: 01509564
Promotor: Prof. dr. Hannelore Denys
Copromotor: Dr. Eline Naert
Masterproef voorgelegd in het kader tot het behalen van de graad Master of Medicine in de Geneeskunde
Deze pagina is niet beschikbaar omdat ze persoonsgegevens bevat.
Universiteitsbibliotheek Gent, 2021.
This page is not available because it contains personal information.
Ghent University, Library, 2021.
Voorwoord
Het schrijven van een masterproef leek altijd al een onmogelijke opdracht maar nu heb ook ik een masterproef op mijn naam. Het was een niet te vergeten ervaring die gepaard ging met de nodige uitdaging en inspanning. Het onderwerp van mijn masterproef bleek perfect voor mij: ovariumkanker ligt me nauw aan het hart en immunotherapie is een nieuwe, hoopvolle behandeling waar nog veel masterproeven aan besteed mogen worden. Het onderwerp leren kennen, samen met vrienden aan de masterproef werken en uiteindelijk je naam onder je masterproef kunnen zetten. Het zullen allemaal herinneringen worden die ik mee zal dragen bij het terugkijken op de masterjaren.
Graag had ik mijn promotor prof. dr. Hannelore Denys en copromotor dr. Eline Naert bedankt om mij te begeleiden doorheen dit traject. Dankzij hen leerde ik dit onderwerp kennen en heb ik deze masterproef tot stand kunnen brengen. Bij elke vooruitgang stonden zij klaar om te helpen en feedback te geven. Ik wil hen dus bedanken want zonder hen was deze masterproef niet mogelijk geweest.
Ik wil ook graag mijn vrienden en familie bedanken voor hun steun en begrip. In het bijzonder verdienen mijn ouders, Charlotte, Nora en Laurens een plaatsje in dit voorwoord. Zij stonden altijd klaar om te luisteren, na te lezen en te helpen. Het is dus ook mede dankzij hen dat ik deze masterproef heb kunnen verwezenlijken.
Tot slot zou ik graag deze masterproef opdragen aan mijn groottante, Christiane De Boeck. Zij was een belangrijke persoon in mijn jeugd maar ook zij verloor de strijd tegen ovariumkanker. De herinnering aan haar speelde mee in de keuze van dit onderwerp en vormde mee de drijfveer om deze masterproef zo goed als mogelijk tot zijn einde te brengen.
Inhoudsopgave
1. Abstract ... 1 2. Inleiding ... 3 2.1. Ovariumkanker... 3 2.1.1. Epidemiologie ... 3 2.1.2. Histologische classificatie ... 4 2.1.3. Moleculaire classificatie ... 4 2.1.4. Etiologie ... 5 2.1.5. Diagnosestelling ... 6 2.1.6. Stagering ... 7 2.1.7. Behandeling ... 8 2.1.8. Prognose ... 82.2. Immunotherapie: immuun checkpoint inhibitoren ... 9
2.2.1. Immunotherapie algemeen ... 9
2.2.2. Kanker immuunrespons ... 9
2.2.3. Immuun checkpoint inhibitoren ...13
2.2.4. Response criteria ...16
3. Methode ...22
4. Resultaten: checkpoint inhibitie in ovariumcarcinomen ...24
4.1. Initiële studies: monotherapie ...24
4.1.1. CTLA-4 blokkade ...24
4.1.2. PD-1/PD-L1 blokkade ...24
4.1.3. PD-L1 expressie ...27
4.1.4. Besluit monotherapie studies ...28
4.2. Combinatie studies in ovariumkanker ...28
4.2.1 Combinaties binnen checkpoint inhibitie ...28
4.2.2. Combinaties met targeted therapy ...29
4.2.3. Combinaties met chemotherapie ...33
4.2.5. Besluit combinatie studies ...37
4.3. Lopende studies in ovariumcarcinomen ...37
5. Discussie ...40
5.1. Wat kan er nu besloten worden uit voorgaande studies? ...40
5.2. Hoe ziet de toekomst eruit voor checkpoint inhibitie? ...40
5.2.1. ‘Het ovariumcarcinoom’ bestaat niet ...41
5.2.2. Patiëntenselectie en de nood aan biomarkers ...42
5.2.3. Rationele therapiekeuze ...43
5.2.4. Frontline setting ...44
5.2.5. Personalised cancer immunotherapy ...45
5.3. Hoe ziet de toekomst eruit voor ovariumkanker? ...45
6. Referentielijst ...46
1. Abstract
Inleiding
Jaarlijks worden zo’n 800-tal vrouwen gediagnosticeerd met ovariumkanker. De overgrote meerderheid hiervan bevindt zich al in een gevorderd stadium en kijken aan tegen een sombere prognose. Ondanks behandeling met chirurgie en chemotherapie zal het merendeel van deze patiënten hervallen. Falende screening en een daardoor tekortschietende behandeling maken dat artsen en patiënten machteloos staan tegenover deze silent killer. Immunotherapie is een belangrijke nieuwe speler in de behandeling van kanker en werkt vanuit een andere invalshoek dan de gebruikelijke kankerbehandelingen. Het primaire werkingsmechanisme is niet het doden van kankercellen maar het manipuleren van het immuunsysteem van de patiënt ten bate van de behandeling. Checkpoint inhibitie is een jonge klasse van immunotherapie en heeft reeds een bewezen effect in de behandeling van o.a. melanoom. Er is een toenemende belangstelling voor deze therapie, ook in de context van ovariumkanker als mogelijke, nieuwe therapie. Deze masterproef zal trachten een overzicht te geven van de evolutie en de stand van zaken van checkpoint inhibitoren in de behandeling van ovariumkanker.
Methode
De artikels en studies, gebruikt in deze masterproef, werden voornamelijk gevonden op PubMed en op ClinicalTrials.gov. Artikels werden geselecteerd o.b.v. geschiktheid, relevantie en eventuele full text. Er werd ook gekeken naar het jaartal van de artikels en studies. Aangezien het gaat om een relatief jong onderwerp werd er vooral gekeken naar recente artikels. In totaal werden 65 bronnen gebruikt voor deze masterproef.
Resultaten
De eerste studies met checkpoint inhibitoren in ovariumcarcinomen vonden plaats in een monotherapie setting bij patiënten in een late lijn van behandeling. In deze studies kon slechts een beperkt effect aangetoond worden waardoor er gekeken werd naar andere manieren om het antwoord op deze therapie te kunnen opkrikken.
De volgende generatie van studies richtte zich op het combineren van checkpoint inhibitie met andere behandelingen zoals targeted therapy en chemotherapie. Deze studies lijken een beter resultaat te bekomen dan de monotherapie studies. Het effect van checkpoint inhibitie is echter nog niet voldoende om reeds te kunnen implementeren in de behandeling van ovariumkanker.
Er zijn op dit moment heel wat lopende studies die mogelijke combinaties en de timing ervan in de behandeling onderzoeken. Er is een belangrijke evolutie te zien in deze studies, namelijk een shift van een late lijn naar de eerste lijn van behandeling. De resultaten van deze studies zullen dus afgewacht moeten worden vooraleer er sprake kan zijn van een nieuwe behandeling voor ovariumkanker.
Discussie
Checkpoint inhibitie en bij uitbreiding immunotherapie bieden dus mogelijks nieuwe vooruitzichten in de behandeling van ovariumcarcinomen. Nieuwe inzichten in ovariumkanker en de behandeling ervan hebben er ondertussen ook voor gezorgd dat er op een andere manier tegenaan wordt gekeken. Er is een groeiend inzicht dat er niet één ‘ovariumcarcinoom’ bestaat maar dat het zich op verschillende vlakken onderscheidt in subtypes. Al deze subtypes op eenzelfde manier behandelen, lijkt dus meer en meer obsoleet.
Er is nood aan patiëntenselectie om net die patiënten te selecteren die goed zullen antwoorden op checkpoint inhibitie. Deze selectie zal ook noodzakelijk zijn om deze dure, nieuwe therapieën maatschappelijk draagbaar te houden. Helaas zijn er tot op heden nog geen goede biomarkers geïdentificeerd die hiertoe zouden kunnen bijdragen. Er dient in de toekomst dus gestreefd te worden naar een onderbouwde en rationele therapiekeuze uitgevoerd in een geselecteerde patiëntengroep.
2. Inleiding
2.1. Ovariumkanker
2.1.1. Epidemiologie
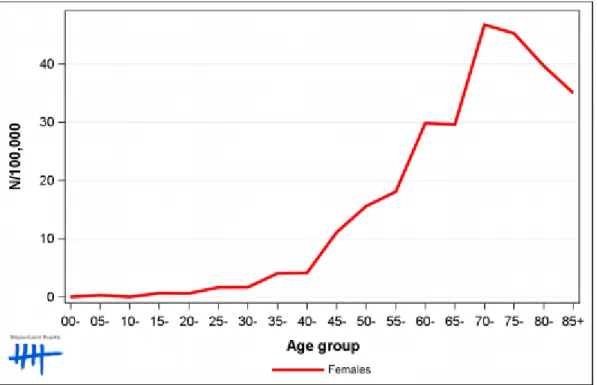
De diagnose ovariumkanker werd in 2017 bij 784 Belgische vrouwen gesteld en bekleedt hierdoor de 9e plaats in de top 10 meest voorkomende kankers bij vrouwen in België. Figuur 1 toont de leeftijdsspecifieke incidentie in België in 2017. Uit deze grafiek kan afgeleid worden dat het merendeel van de diagnoses op een leeftijd hoger dan 50 jaar wordt gesteld. De gemiddelde leeftijd op het moment van de diagnose is 66,7 jaar (1).
Figuur 1: Leeftijdsspecifieke incidentie van ovariumkanker in 2017
(Bron: Stichting kankerregister: Cancer Fact Sheet Ovarian cancer. Online 2019. Opgehaald op 25 november 2019, van https://kankerregister.org/media/docs/CancerFactSheets/2017/Cancer_Fact_Sheet_OvarianCancer_2017.pdf
Het Belgisch kankerregister drukt de mortaliteit van ovariumkanker uit in 5-year-relative survival proportion. In 2017 bedroeg deze gemiddeld 45%. Deze verschilt echter wel binnen de verschillende leeftijdscategorieën. Bij de jongste (15-44 jaar) en middelste (45-69 jaar) leeftijdscategorie bedraagt deze respectievelijk 76,8% en 53,7%. Bij de oudste leeftijdscategorie (70+ jaar) is deze slechts 29,5%. De oudere patiënten hebben dus een slechtere prognose en helaas maken zij het merendeel uit van de patiëntengroep (1).
2.1.2. Histologische classificatie
Ovariumkanker kan eigenlijk beschouwd worden als een verzamelnaam voor tumoren die wel een anatomische locatie delen maar op histologisch, moleculair en etiologisch vlak verschillen van elkaar (2). Binnen ovariumkanker kunnen er drie verschillende types onderscheiden worden: het epitheliaal ovariumcarcinoom (EOC), de gonadale stromale tumor en de kiemcel tumor (3). Het EOC vormt de meerderheid van deze drie types (~90%) zoals te zien in figuur 2 (4). Dit type tumor zal in deze paper verder besproken worden.
Het EOC bestaat op zijn beurt ook uit verschillende histologische types. Het sereuze EOC is het meest frequent voorkomende type en houdt het hooggradig en het laaggradig sereus carcinoom in. De andere frequente types zijn onder meer het endometroid carcinoom, het heldercellig carcinoom en het mucineuze carcinoom. Binnen deze subtypes vormt het hooggradig sereus carcinoom veruit de meerderheid (5).
Figuur 2: Types ovariumkanker en subtypes van epitheliaal ovarium carcinoom (6) (Bron: Physiopedia: Ovarian Cancer. Online 2018. Opgehaald op 1 december 2018, van https://www.physio-pedia.com/Ovarian_Cancer)
2.1.3. Moleculaire classificatie
Het hooggradig sereus carcinoom vormt de overgrote meerderheid van het EOC maar verschilt duidelijk op vele vlakken van de andere soorten binnen het EOC. Dit verschil is ook zichtbaar op moleculair vlak zoals te zien op figuur 3 (5).
Het hooggradig sereus carcinoom heeft in 95% van de gevallen een mutatie in TP53, wat zorgt voor chromosomale instabiliteit, en in 40-50% van de gevallen een inactiverende mutatie in BRCA1/2, wat normaal instaat voor DNA herstel (5).
De andere subtypes van het EOC kenmerken zich door andere mutaties. De belangrijkste mutaties in het laaggradig sereus carcinoom zijn de activerende mutaties in KRAS en BRAF. Beiden maken deel uit van de MAPK pathway (“cascade/route”) die belangrijk is in het cellulair antwoord op verschillende groei- en differentiatiefactoren. Andere mogelijke mutaties bevinden zich in ERBB2 (een oncogen dat codeert voor HER2/neu) en PIK3CA (5).
In het heldercellig carcinoom zijn er 2 belangrijke mutaties die beiden in 50% van de gevallen voorkomen. Dit is ten eerste een inactiverende mutatie in ARID1A, een tumor suppressor gen, en ten tweede een activerende mutatie in PIK3CA. Het endometroid carcinoom wordt
gekenmerkt door mutaties in o.a. ARID1A, CTNNB1, PTEN en PIK3CA. CTNNB1 codeert voor
β-catenine, deel van een pathway die proliferatie en overleving reguleert. PTEN is een tumor suppressor gen. Het mucineus carcinoom heeft in 75% van de gevallen een mutatie in het KRAS gen (5).
Figuur 3: Moleculaire alteraties in de verschillende types ovariumcarcinomen
(Bron: Kurman R. J., Shih Ie M. Molecular pathogenesis and extraovarian origin of epithelial ovarian cancer--shifting the paradigm. Human pathology 2011; 42 (7): 919-931.)
2.1.4. Etiologie
Verschillende van de histologische types van het EOC delen niet dezelfde plaats van oorsprong. Figuur 4 illustreert dit. De invasieve mucineuze ovariumtumoren zijn eigenlijk metastasen die vaak afkomstig zijn van tumoren van de gastro-intestinale tractus (o.a. van de maag, het colon en de appendix). De endometroide en heldercellige carcinomen zijn sterk geassocieerd met endometriose en de retrograde menstruatie die deze veroorzaakt (2). De hooggradige sereuze carcinomen zijn afkomstig van het oppervlakkige epitheel van het ovarium of van het distale deel van de eileider (2). Wanneer ze afkomstig zijn van het distale deel van de eileider, zeer frequent de fimbrae, dan vinden ze hun oorsprong in de ‘sereuze tubale intraepitheliale carcinomen’ (STIC’s). Dit is een occult invasief hooggradig sereus carcinoom in de eileider waarvan er maligne cellen zich kunnen inplanten in het ovarium en zich daar kunnen ontwikkelen tot een tumorale massa (5).
De laaggradige sereuze carcinomen daarentegen kennen een stapsgewijze evolutie van een benigne precursor naar een maligniteit, terwijl bij het hooggradige carcinoom geen duidelijke precursor kan aangetoond worden (5).
Figuur 4: De oorsprong van de verschillende types ovariumcarcinomen
(Bron: Vaughan S, Coward J I, Bast R C, Berchuck A et al. Rethinking ovarian cancer: recommendations for improving outcomes. Nature reviews. Cancer 2011; 11 (10): 719-725.)
Ovariumkanker is dus niet te beschouwen als één ziekte maar moet erkend worden als een verzamelnaam voor subtypes van tumoren die verschillen op histologisch, etiologisch en moleculair vlak. In de praktijk wordt deze ziekte echter nog altijd als één ziekte gezien en dat weerspiegelt zich in de huidige behandeling ervan (2, 5).
2.1.5. Diagnosestelling
Typisch presenteren deze patiënten zich met klachten van abdominale pijn of distensie en dit gedurende een periode van 3-4 maanden (3). Patiënten met ovariumkanker beperkt tot het ovarium kunnen weinig of geen symptomen hebben. De meerderheid van de gevallen wordt hierdoor pas in een gevorderd stadium ontdekt. Ovariumkanker wordt daarom ook een silent
killer (“stille moordenaar”) genoemd (4).
Na klinisch onderzoek wordt meestal m.b.v. een bloedafname het serum CA-125 gemeten. Echter niet alle patiënten met ovariumkanker zullen verhoogde waarden hebben. In stadium I is deze tumormerker vaak negatief maar in gevorderde stadia (III-IV) is deze meestal wel
positief. Het CA-125 is ook niet specifiek voor ovariumkanker en kan bij andere maligniteiten of goedaardige aandoeningen verhoogd zijn (4). Bij vermoeden van ovariumkanker is de volgende stap na het klinisch onderzoek een transvaginale echografie (3, 4).
De diagnose wordt gesteld aan de hand van een biopsie. Na diagnosestelling wordt preoperatief een CT-scan genomen. Deze beeldvorming dient als hulpmiddel voor de chirurgie en heeft als doel om de uitgebreidheid van de ziekte te bepalen. Een CT van de thorax moet ook genomen worden om pleurale effusie en ziekte uitbreiding boven het diafragma uit te sluiten. De CT-scan helpt dus bij stagering maar het finale stadium wordt chirurgisch bepaald (4).
2.1.6. Stagering
Ovariumkanker wordt gestageerd aan de hand van de FIGO (The International Federation of Gynecology and Obstetrics) classificatie, aangegeven in tabel 1.
Tabel 1: FIGO classificatie van ovariumtumoren
Stadium I: tumorgroei beperkt tot de ovaria
IA Groei beperkt tot één ovarium IB Groei beperkt tot beide ovaria
IC IA of IB maar met tumorcellen op het oppervlak van één of beide ovaria, geruptureerd kapsel, cytologisch positieve ascites of positieve peritoneale spoeling
Stadium II: tumorgroei in één of beide ovaria met extensie naar het bekken
IIA Extensie naar baarmoeder en/of eileiders IIB Extensie naar andere weefsels in het pelvis
IIC IIA of IIB maar met tumorcellen op het oppervlak van één of beide ovaria, geruptureerd kapsel, cytologisch positieve ascites of positieve peritoneale spoeling
Stadium III: tumorgroei in één of beide ovaria met cytologisch of histologisch bewezen extensie naar het
peritoneum buiten het bekken en/of metastasering in de regionale lymfe knopen IIIA Microscopische extensie naar het oppervlak van het abdominale peritoneum
IIIB Macroscopische peritoneale metastasering buiten het bekken met een diameter tot 2 cm met/zonder positieve lymfe knopen
IIIC Macroscopische peritoneale metastasering buiten het bekken met een diameter groter dan 2 cm met/zonder positieve lymfe knopen
Stadium IV: tumorgroei in één of beide ovaria met distale metastasen (als er pleurale effusie is, moet deze
cytologisch positief zijn om stadium IV te zijn en parenchymale lever metastasen betekenen stadium IV)
(Bron: Ledermann J. A., Raja, F. A., Fotopoulou C. et al. Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of oncology : official journal of the European Society for Medical Oncology 2013; 24 (6): vi24-vi32.)
De correcte stagering wordt door chirurgie bepaald en is tevens een sterke prognostische indicator. De meeste gevallen van ovariumkanker presenteren zich in stadium III of IV en hebben dus een ongunstige prognose. Vandaar komt de benaming ‘silent killer’ (3, 4).
2.1.7. Behandeling
Patiënten met stadium I tumoren ondergaan chirurgie met als doel resectie van de tumor en correcte stagering. Hierbij wordt een hysterectomie met bilaterale salpingo-oöphorectomie en omentectomie uitgevoerd met eventueel wegnemen van verdachte regionale lymfeklieren. Adjuvante cytotoxische platinum gebaseerde chemotherapie is een mogelijkheid voor bepaalde types stadium I tumoren maar verder onderzoek in deze patiëntengroep is nodig (3, 4).
Bij patiënten met stadium II-IV, de meerderheid, wordt complete cytoreductie van al het macroscopisch zichtbare tumorweefsel nagestreefd. Dit wordt een debulking operatie genoemd. Dit is een zeer belangrijk element in de behandeling aangezien optimale debulking geassocieerd is met een langere overleving. Het is zelfs zo dat residueel tumorweefsel een sterkere prognostische factor is dan de FIGO stadiëring waarbij patiënten met een suboptimale debulking een slechter resultaat te wachten staat. Er is ook evidentie rond het belang van een ervaren chirurg. De mate van cytoreductie is ook positief geassocieerd met gespecialiseerde training en chirurgische ervaring. Adjuvante cytotoxische platinum chemotherapie is wel aangeraden in deze patiëntengroep aangezien het risico op herval zeer groot is (3, 4).
De basis van de behandeling is dus chirurgie meestal met adjuvante chemotherapie. Het valt op dat ovariumkanker maar op één manier behandeld wordt, ondanks het groeiende besef dat ovariumkanker niet één ziekte is. De types ovariumkanker verschillen op veel vlakken maar worden allemaal op dezelfde manier behandeld. Ook op vlak van de behandeling zelf is er weinig veranderd. Wereldwijd is platinum chemotherapie al meer dan 20 jaar de standard of
care (“standaard van de zorg”). Er is dus algemeen bitter weinig veranderd in de behandeling
én de overleving van ovariumkanker (3, 4).
2.1.8. Prognose
Ondanks de behandeling hervalt ~70% binnen de 3 jaar en bedraagt de 5 jaars overlevingin België 45% (1). De overleving voor deze ziekte is gedurende de laatste decennia niet verbeterd (5). Deze slechte prognose wordt sterk bepaald door het feit dat de meerderheid van de gevallen in een reeds gevorderd stadium wordt ontdekt (3, 4). Tot op heden is er nog geen
goede screeningsmethode gevonden om ovariumkanker vroegtijdig te detecteren. Mogelijke screeningsmethoden met meting van het serum CA-125 en transvaginale echografie konden in studies geen overtuigende resultaten leveren (3). Ondanks de behandeling en de vooruitgang in de rest van de medische wereld verbetert de algemene overleving voor ovariumkanker niet. Er is dus nood aan nieuwe behandelingen voor ovariumkanker en studies hieromtrent.
2.2. Immunotherapie: immuun checkpoint inhibitoren
2.2.1. Immunotherapie algemeen
Immunotherapie is de manipulatie van het immuunsysteem van de patiënt met als doel de behandeling van een ziekte (7). In de context van kanker zorgt immunotherapie voor stimulatie of herstel van de capaciteit van het immuunsysteem om de kankercellen te lijf te gaan (8). Kanker immunotherapie benadert de kankercellen op een heel andere manier dan eerdere kankertherapieën zoals targeted therapy (“doelgerichte therapie”). Bij targeted therapy richten monoclonale antilichamen zich op één specifiek punt van de tumor en bereiken zo hun effect (dit wordt verder besproken in 4.2.2.) (8). Helaas ontstaat er vaak resistentie ondanks een goede initiële respons. Het hoge mutationele aanpassingsvermogen van kanker verklaart dit fenomeen. Kanker immunotherapie tracht dit probleem te omzeilen door het zeer adaptieve immuunsysteem van de patiënt te gebruiken tegen de kankercellen. Het doel van deze therapie is het verkrijgen van een duurzame immuunrespons die weerstand kan bieden tegen het mutationeel karakter van kanker (8, 9).
2.2.2. Kanker immuunrespons
Kanker kenmerkt zich door een variabele accumulatie aan genetische en epigenetische veranderingen. Deze abnormaliteiten zorgen voor een diverse waaier aan antigenen die de tumorcellen onderscheiden van de normale cellen, de zogenaamde neoantigenen (10).
2.2.2.1. De immuunrespons
Het zijn de T-cellen die het onderscheid kunnen maken tussen lichaamseigen en lichaamsvreemd via respectievelijk antigenen en neoantigenen. Deze T-cellen bestaan uit CD4+ en CD8+ cellen die beiden een verschillende functie en activatie kennen. CD4+ T-cellen staan in voor het aantrekken en activeren van andere T-cellen nodig voor de
immuunrespons. CD8+ T-cellen zijn cytotoxische cellen die een cel kunnen doden via vrijstelling van cytokines zoals TNF en IFN-y. Naïeve CD4+ en CD8+ T-cellen moeten echter eerst geactiveerd worden vooraleer ze hun functie kunnen uitvoeren. Het zijn voornamelijk de antigen-presenterende dendritische cellen die de activatie verzorgen. Dit gebeurt aan de hand van de expressie van het major histocompatibility complex (MHC) type I en type II proteïne op de dendritische cel (10-12).
MHC I proteïnes zijn op vrijwel elke lichaamscel aanwezig en presenteren peptides afkomstig van het endogene cytosol. Daarentegen is het MHC II proteïne slechts aanwezig op een beperkt aantal cellen, waaronder de dendritische cellen, en presenteert het antigenen die verkregen zijn door endo- en fagocytose. De naïeve CD8+ en CD4+ T-cellen herkennen respectievelijk de MHC I en MHC II complexen op de dendritische cel. Wanneer deze T-cel receptoren het antigen herkennen als lichaamsvreemd zal de receptor binden aan de dendritische cel en op die manier komt de T-cel activatie tot stand (12).
De immuunrespons tegen kankercellen
Aangezien vrijwel alle lichaamscellen MHC I expressie vertonen, kunnen de kankercellen zelf ook de neoantigenen presenteren aan geactiveerde CD8+ T-cellen. Deze T-cellen zullen de kankercellen vervolgens als lichaamsvreemd herkennen en zullen hen dan ook aanvallen (8, 13).
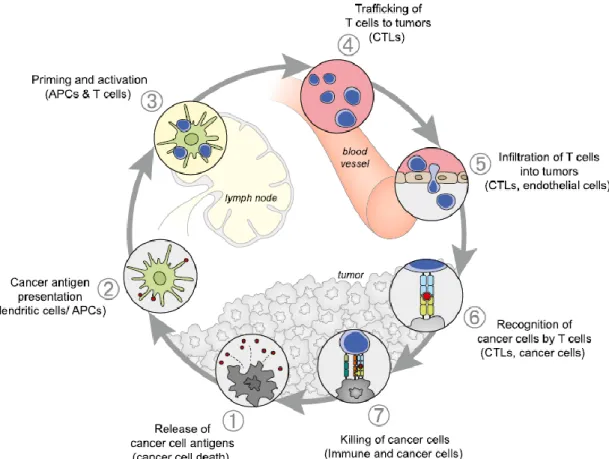
De immuunrespons tegen kankercellen bestaat uit een cyclus die moet doorlopen worden waarbij het op elk niveau kan fout lopen. Dit verklaart ook waarom het mogelijk is dat tumoren niet worden geëlimineerd ondanks een aanwezige T-cel respons (8). Deze cyclus omvat 7 stappen volgens het ‘cancer-immunity cycle’ model en wordt geïllustreerd in figuur 5. Bij elke stap kan het dus misgaan maar elke stap biedt misschien ook een mogelijkheid tot therapeutische interventie (8, 10).
The cancer-immunity cycle
De eerste stap omvat het vrijkomen van de neoantigenen in het proces van de oncogenese. Deze antigenen worden vervolgens gecapteerd door dendritische cellen. In de tweede stap presenteren de dendritische cellen de antigenen aan de T-cellen. De herkenning van het antigen en activatie van de T-cellen vormen de derde stap. Bij de activatie zal de balans tussen effector T-cellen en Treg cellen de aard van de immuunrespons bepalen.Treg cellen zijn immers een type CD4+ T-cellen dat de immuunrespons eerder inhibeert. Voor stap 4 en 5 verlaten de
T-cellen de lymfeknoop om naar de tumor te migreren en in het tumorbed te infiltreren. Eenmaal in het micromilieu van de tumor herkennen de T-cellen de tumorcellen en doden ze hen. Dat zijn stap 6 en 7. Bij het doden van de tumorcellen kunnen extra neoantigenen vrijkomen (8, 10).
Figuur 5: T-cel kanker immuunrespons voorgesteld als cyclus
(Bron: Chen, D. S., Mellman, I. Oncology meets immunology: The Cancer-Immunity Cycle. Immunity 2013; 39 (1): 1-10)
Deze T-cel immuunrespons wordt bepaald door een balans van co-stimulatoire en inhibitorische signalen. De inhibitorische signalen zijn immuun checkpoints (“controlepunten”) en bestaan voornamelijk uit ligand-receptor interacties (8, 13).
Onder normale fysiologische omstandigheden spelen de immuun checkpoints een cruciale rol in twee processen. Het eerste proces is het behoud van zelftolerantie, dit is de preventie van auto-immuniteit. Ten tweede reguleren ze de duur en amplitude van een fysiologische immuunrespons in de perifere weefsels om zo schade aan de gezonde cellen in deze weefsels tot een minimum te beperken (8, 13).
Immuunrespons in ovariumkanker
Bij patiënten met ovariumkanker kan de T-cel respons gedetecteerd worden aan de hand van de tumor infiltrating lymfocytes (“tumor infiltrerende lymfocyten”). De aan- of afwezigheid van deze cellen is ook van prognostisch belang. De prognose is immers positief gecorreleerd aan de aanwezigheid van deze tumor infiltrating lymfocytes (TILs) en voornamelijk aan die van de CD8+ T-cellen (12).
2.2.2.2. Het falen van de cancer-immunity cycle
Bij kankerpatiënten werkt de kanker immuunrespons niet optimaal en meerdere mechanismen kunnen hiervoor verantwoordelijk zijn (8, 12).
Een eerste mechanisme is een lage immunogeniciteit van de tumor, waarbij er dus weinig neoantigenen zijn die herkend kunnen worden. Een tweede mechanisme is immunoediting (“immuunsysteem aanpassen”) waarbij de tumor het immuunsysteem te slim af is. De T-cellen vallen immers de tumorcellen aan die ze kunnen herkennen. Door steeds deze cellen te doden, worden de tumorcellen die hieraan kunnen ontsnappen, uitgeselecteerd. Het ontsnappen kan op verschillende manieren gebeuren waaronder verlies aan tumor antigen expressie of MHC I expressie. Immuunsuppressie is een derde mechanisme en speelt een belangrijke rol in ovariumkanker (12).
Bij immuunsuppressie wordt de antikanker respons van de CD8+ TIL afgeremd. De Treg cellen dragen hier in grote mate toe bij door een immuunsuppressief milieu te creëren. Algemeen kan gesteld worden dat de immuunsuppressieve component in ovariumkanker een niet te onderschatten negatieve invloed heeft op de prognose (11-14).
Het overwinnen van deze immuunsuppressie kan dus een belangrijke therapeutische invalshoek vormen in de behandeling van kanker (12, 14).
Immuun checkpoints in de cancer-immunity cycle
Deze visie leidde uiteindelijk tot de ontwikkeling van immuun checkpoint inhibitoren (ICI). Dit zijn antilichamen gericht op de receptoren en liganden die de respons tegen tumorcellen reguleren. Het doel is dus om de endogene antitumor activiteit te verhogen door de inhiberende mechanismen van de kanker immuunrespons te blokkeren (8, 11, 13).
Immuun checkpoint inhibitie in de behandeling van ovariumcarcinomen zal de focus vormen voor deze paper.
2.2.3. Immuun checkpoint inhibitoren
CTLA-4 en PD-1/PD-L1 zijn de twee meest bestudeerde pathwaysin de context van kanker immunotherapie. CTLA-4 en PD-1 zijn beiden inhibitorische receptoren en PD-L1 is de ligand van PD-1. Deze pathways reguleren de T-cel immuunrespons op een verschillend niveau en via een verschillend mechanisme (13). Deze paper zal zich beperken tot het bespreken van deze twee pathways.
2.2.3.1. CTLA-4 pathway
CTLA-4 (Cytotoxic T-lymphocyte associated antigen 4) is een receptor waarvan de expressie uitsluitend op cytotoxische T-cellen of CD8+ T-cellen voorkomt. Zijn primaire functie is het reguleren van de amplitude van de vroege stadia van T-cel activatie (8, 13).
Werking van de CTLA-4 pathway
Een antigen, bijvoorbeeld van de tumor, wordt gepresenteerd op een antigen-presenterende cel, zoals de dendritische cel. Wanneer de T-cel receptor dit antigen herkent en bindt, bindt ook de CD28 receptor van de T-cel met CD80 en CD86, beiden costimulatoire liganden van de B7 familie, van de dendritische cel. Enkel bij antigenherkenning gaat CD28 zorgen voor een sterke amplificatie van het signaal van de T-cel receptor, dat zorgt voor activatie van de T-cellen. CTLA-4 heeft dezelfde liganden als CD28 maar heeft voor beiden een veel hogere affiniteit. Hierdoor kan het CD28 buiten spel zetten en kan het de verdere T-cel activatie temperen (11, 13).
CTLA-4 heeft ook een belangrijke invloed op 2 soorten CD4+ T-cellen. Ten eerste verhoogt het de immuunsuppressieve activiteit van Treg cellen. Ten tweede zorgt CTLA-4 ook voor
downmodulatie (“neerwaartse modulatie”) van T-helpercellen, een type CD4+ T-cel die de
activatie van CD8+ T-cellen faciliteert (11, 13).
CTLA-4 blokkade
De rationale voor het gebruik van anti-CTLA-4 antilichamen is dus om de inhibitie op een vooraf bestaande antikanker T-cel respons op te heffen en om mogelijks nieuwe responsen op gang te brengen (11). Deze blokkade wordt geïllustreerd in figuur 6.
Figuur 6: Blokkade van de CTLA-4 receptor op T-cellen door anti-CTLA-4
(Bron: Lee L., Gupta M., Sahasranaman S. Immune Checkpoint inhibitors: An introduction to the next-generation cancer immunotherapy. Journal of clinical pharmacology 2016; 56 (2): 157-169.)
2.2.3.2. PD-1/PD-L1 pathway
Expressie van de PD-1 (Programmed death 1) receptor op het T-cel oppervlak gebeurt na activatie van de T-cel. De receptor heeft twee mogelijke liganden, PD-L1 en PD-L2 (Programmed death ligand 1 en 2). PD-L1 lijkt de meest relevante ligand in het tumor micromilieu (15).
Werking PD-1-PD-L1 pathway
Binding van PD-L1 op PD-1 zorgt voor een verminderde signalering van de T-cel receptor. Het gevolg hiervan is een verminderde T-cel proliferatie, een verminderde cytokine productie en een verhoogde vatbaarheid voor apoptose. Zo limiteert de PD-1/PD-L1 pathway de activiteit van T-cellen in perifere weefsels op het moment van een inflammatoire respons op een infectie. Dit heeft als doel de auto-immuniteit te beperken (8, 13, 15).
PD-L1 expressie in kanker
PD-L1 is de voornaamste ligand van PD-1 en vertoont een brede expressie op o.a. T- en B-cellen, dendritische cellen en macrofagen (9). De PD-L1 expressie is frequent verhoogd bij vele types kanker, waaronder ovariumkanker, met expressie op tumorcellen en op voorgenoemde immuun cellen (8, 15). Het onderliggend mechanisme hiervan is het
ontsnappen aan de immuunrespons van de patiënt door een immuunsuppressief tumor micromilieu te creëren (9).
PD-1/PD-L1 blokkade
Bij de blokkade van de PD-1 receptor kan deze niet meer binden met één van zijn liganden waardoor er geen limitatie op de activiteit van de T-cellen meer is, zoals te zien in figuur 7. De blokkade heeft dus als doel de activiteit van effector T-cellen in zowel de weefsels als in het tumor micromilieu te verhogen (13).
Figuur 7: Blokkade van PD-1 receptoren op T-cellen
(Bron: Lee L., Gupta M., Sahasranaman S. Immune Checkpoint inhibitors: An introduction to the next-generation cancer immunotherapy. Journal of clinical pharmacology 2016; 56 (2): 157-169.)
Anti PD-L1 antilichamen verhinderen de werking van de PD-1 receptor door op zijn ligand te binden. Zo zorgen ook zij voor een verminderde limitatie van de activiteit van T-cellen. Ze hebben dus hetzelfde doel voor ogen als de anti PD-1 antilichamen (13).
2.2.3.3. Goedgekeurde immuun checkpoint inhibitoren
Het gebruik van ICI is reeds goedgekeurd in de behandeling van o.a. melanoom en niet-kleincellig longcarcinoom. De goedkeuring voor de verschillende producten verschilt tussen de VS en Europa. Tabel 2 met de reeds goedgekeurde ICI en hun indicaties illustreert dit (14).
Tabel 2: Goedgekeurde indicaties voor immuun checkpoint inhibitie
(Bron: Cook K. W., Durrant L. G., Brentville V. A. Current Strategies to Enhance Anti-Tumour Immunity. Biomedicines 2018; 6 (37).)
2.2.4. Response criteria
Immunotherapie is echter niet even werkzaam bij iedereen en bovendien hangt er een serieus prijskaartje aan deze behandeling. Het is daarom belangrijk om patiënten bij wie de behandeling wel aanslaat, te kunnen onderscheiden van patiënten bij wie dit niet het geval is. Immunotherapie met checkpoint inhibitoren leverde reeds een goede respons op bij patiënten met o.a. melanoom. De voorlopige resultaten bij ovariumkanker zijn bescheidener waardoor er dus noodzaak is om de onderliggende mechanismen die leiden tot respons op ICI te onderzoeken (16).
Histologisch kunnen tumoren ruwweg in twee categorieën verdeeld worden: geïnflammeerd en niet-geïnflammeerd. Wanneer een tumor inflammatie vertoont, toont dat aan dat er een vooraf bestaande antitumor immuunrespons is. Een niet-geïnflammeerde tumor vertoont deze immuunrespons niet en wordt als immunologically ignorant (“immunologisch onwetend”) omschreven (16).
Deze vooraf bestaande immuniteit blijkt noodzakelijk voor een objectieve respons op checkpoint inhibitoren. Het voornaamste doel van checkpoint inhibitoren is namelijk ook om de endogene antitumor respons te verhogen door de inhibitie op deze respons weg te nemen (16).
De geïnflammeerde tumor wordt gekarakteriseerd door een aantal factoren die hieronder worden beschreven en toegepast worden op ovariumkanker. Dit wordt ook geïllustreerd in figuur 8. Deze factoren staan niet los van elkaar maar zijn met elkaar verbonden (16).
Figuur 8: Indeling van immunologische kenmerken van tumoren in relatie tot een gunstig antwoord op checkpoint inhibitoren
(Bron: Hegde P. S., Karanikas V., Evers S. The Where, the When, and the How of Immune Monitoring for Cancer Immunotherapies in the Era of Checkpoint Inhibition. Clinical cancer research : an official journal of the American Association for Cancer Research 2016; 22 (8): 1865-1874.)
2.2.4.1. Tumor mutational burden (TMB)
Een hoge tumor mutational burden (“tumor mutationele last”) geeft aan dat een tumor gekenmerkt is door een hoog aantal mutaties. Bij tumoren met veel mutaties is het genereren van neoantigenen waarschijnlijker dan bij tumoren met zeer weinig mutaties. Deze
neoantigenen kunnen door de immuuncellen als vreemd worden herkend en kunnen zo een antitumor immuunrespons opwekken (16).
Bij patiënten met melanoom, niet-kleincellig longcarcinoom en uroheliaal carcinoom correleert de tumor mutational burden met het antwoord op PD-1/PD-L1 blokkade. Het is echter nog niet aangetoond of dit voor andere soorten immunotherapie ook zo is. Bij andere types kanker, waaronder ovariumkanker, is er een hogere waarschijnlijkheid dat tumoren met een hoge tumor mutational burden zullen reageren op immunotherapie, vooral op PD-1-PD-L1 blokkade (17).
Steeds meer evidentie wijst op deze bijdrage van de antigenic load (“hoeveelheid antigenen”) van een tumor tot een effectieve antitumor immuunrespons. Om deze reden kan de TMB mogelijks een sensitieve merker voor respons op ICI worden (9, 16).
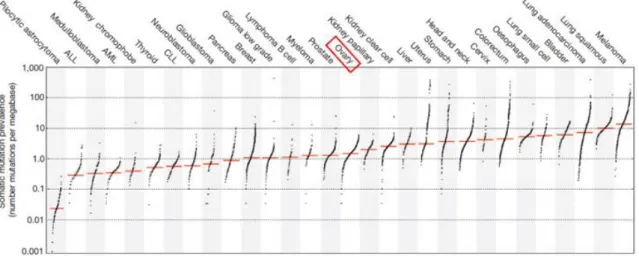
In ovariumkanker wordt algemeen een TMB van intermediair niveau gezien, geïllustreerd in figuur 9 (18).
Figuur 9: Prevalentie van somatische mutaties in humane kankertypes, waaronder ovariumkanker
(Bron: Alexandrov L. B., Nik-Zainal S., Wedge D. C. et al. Signatures of mutational processes in human cancer. Nature 2013; 500 (7463): 415-421.)
2.2.4.2. Tumor infiltrating lymphocytes (TIL)
Kenmerken van een vooraf bestaande immuunrespons zijn o.a. een overvloed aan TIL en een hoge densiteit aan CD8+ T-cellen. Deze CD8+ T-cellen maken een deel uit van de TIL en zijn in staat tot het herkennen en doden van cellen die expressie van een antigen vertonen (13). Deze cellen vertonen na activatie ook expressie van CTLA-4 en worden zo geïnhibeerd
worden. Blokkade van deze inhibitie door ICI kan de CD8+ T-cellen mogelijks opnieuw toelaten om kankercellen te doden (8).
Een actieve antitumor respons zorgt er ook voor dat CD8+ T-cellen het cytokine IFNy produceren. IFNy is verantwoordelijk voor PD-L1 inductie op tumorcellen en tumor infiltrerende immuun cellen, dit wordt onder 2.2.4.3. PD-L1 expressie verduidelijkt (16).
De TIL bestaan echter ook nog uit een ander type T-cel, namelijk de Treg. Deze T-cellen zijn mede verantwoordelijk voor het immuunsuppressieve tumor micromilieu. Deze cellen vertonen een hoge expressie van immuun checkpoint receptoren, zoals CTLA-4 en PD-1. Bij blokkade van deze immuun checkpoints is het dus waarschijnlijk dat ook de immuunsuppressieve functie van deze cellen wordt onderdrukt (11, 13).
Het kan dus belangrijk zijn om de aanwezigheid van TIL na te gaan. Dit omdat het een kenmerk is van een bestaande immuunrespons en deze respons op zijn beurt belangrijk is voor een respons op therapie met ICI (16).
2.2.4.3. PD-L1 expressie
PD-L1 expressie blijkt een brede expressie te vertonen op allerlei soliede tumoren, waaronder ovariumkanker, en hematologische tumoren (8, 9). Deze expressie wordt gezien als een middel voor de tumor om te ontsnappen aan de immuunrespons (9). De PD-L1 expressie is mogelijks een determinant van respons op blokkade van de PD-1/PD-L1 blokkade door zijn immuunsuppressieve rol in kanker (13). Er is aangetoond dat tumorexpressie van PD-L1 wel degelijk geassocieerd is met een positieve respons op deze inhibitie. Verder onderzoek is nodig over deze correlatie in het kader van ovariumcarcinomen (9).
Mechanisme PD-L1 expressie
PD-L1 expressie kan geïnduceerd worden door het cytokine IFNy, geproduceerd door T-cellen, en dit op verschillende celtypes. Dit is deel van een negatief feedback mechanisme. Geactiveerde T-cellen produceren IFNy, dit induceert op zijn beurt PD-L1 expressie op o.a. tumorcellen waardoor de activatie van de T-cellen wordt getemperd. Dit mechanisme wordt adaptieve immuun resistentie genoemd. PD-L1 expressie is dus een antwoord op de inflammatoire signalen van een actieve antitumor immuunrespons. Het is aangetoond dat TIL PD-L1 expressie op tumorcellen kunnen induceren en zo verminderde antitumor immuniteit veroorzaken (13, 15, 16).
Verband PD-L1 expressie met TIL en TMB
In vroegere studies werd gezien dat in ovariumcarcinomen de PD-L1 expressie voornamelijk op tumorcellen voorkwam en omgekeerd evenredig gecorreleerd was met de TIL. PD-L1 expressie hield in die studie ook verband met een slechtere prognose. Hierbij werd echter geen rekening gehouden met de verschillende histologische subtypes van EOC (15).
In een recentere studie werden resultaten gezien die de resultaten van de oudere studie tegenspreken. Deze studie toont aan dat PD-L1 geïnduceerd wordt door IFNy en dus ook gecorreleerd is met CD8+ TIL. De PD-L1 expressie wordt primair gezien op de tumor geassocieerde macrofagen en vertoont een sterke associatie met de TIL. Dit is gezien bij alle histologische subtypes van EOC. Enkel in het hooggradig sereus carcinoom is er een positief verband tussen PD-L1 expressie en overleving (15).
Er blijkt ook een correlatie te bestaan tussen tumor mutational burden en PD-L1 expressie. In kankers met een hoog aantal mutaties bleek de prevalentie van mutaties sterk te gelijken op de prevalentie van PD-L1 expressie. Dit suggereert ook dat de mutational load (“hoeveelheid mutaties”) verband houdt met de immunogeniciteit van een tumor (9).
PD-L1 expressie in ovariumkanker
Voor ovariumcarcinomen algemeen wordt een wisselende PD-L1 expressie gezien. De PD-L1 expressie ligt het hoogst bij het hooggradig sereus carcinoom (9, 15). Er moet echter nog meer onderzoek gebeuren over de correlatie van de PD-L1 expressie met de prognose en om met zekerheid hierover uitspraken te kunnen doen (9).
Daar er een correlatie is tussen PD-L1 en TIL moet er ook gekeken geworden naar het aanwezig zijn van zowel PD-L1 expressie als TIL. De combinatie hiervan wordt opnieuw het vaakst gezien bij het hooggradig sereus carcinoom (15).
2.2.4.4. Besluit response criteria
De aanwezigheid van TIL, CD8+ T-cellen en PD-L1 expressie zijn kenmerken van de vooraf bestaande antitumor immuunrespons. Deze respons is op zijn beurt mogelijks gecorreleerd met de TMB. Zoals vooraf gesteld blijkt deze vooraf bestaande antitumor immuunrespons noodzakelijk voor een objectief antwoord op immunotherapie met checkpoint inhibitoren. Daarom kunnen deze kenmerken mogelijks allemaal bijdragen tot het voorspellen van respons op ICI (16).
Tussen de geïnflammeerde en de niet-geïnflammeerde tumor bestaat er wel een histologische grijze zone. Deze tumoren die tussen de twee categorieën bengelen, kunnen mogelijks geconverteerd worden naar het geïnflammeerde type tumor door middel van combinaties van therapieën (16).
3. Methode
Voor deze masterproef werden artikels en studies bekomen uit verschillende bronnen. Er werden 17 artikels gevonden via PubMed. Voor deze zoektocht werden verschillende MeSH termen en overige zoektermen gebruikt, weergegeven in figuur 10. De overige zoekopdrachten in deze figuur, Journal en Author, werden bekomen dankzij suggestie van de promotor. Bij deze zoekopdrachten werden de vele resultaten, na verwijderen van duplicaten, eerst gescreend op basis van titel/abstract en full text beschikbaarheid. Vervolgens werden de full text van deze artikels gelezen en werden deze artikels geselecteerd op basis van geschiktheid en relevantie. Daar het gaat om een relatief jong onderwerp werd de focus op recente artikels gelegd. Via de PubMed optie ‘similar articles’ en de sneeuwbalmethode werden een extra 5 artikels geïncludeerd.
Figuur 10: Gebruikte zoektermen voor deze masterproef
Een overzicht van alle studies met checkpoint inhibitoren in ovariumkanker werd bekomen via Clinical trials (site: ClinicalTrials.gov). In totaal waren dit zo’n 168 studies, waarvan 17 duplicaten. Van deze studies werden er uiteindelijk, op basis van geschiktheid en relevantie, 31 studies gekozen. Er werd nog 1 studie geïncludeerd dankzij de sneeuwbalmethode. Van deze 32 studies zijn er 19 studies waarvan resultaten bekend zijn. Deze resultaten werden beschreven a.d.h.v. 16 overeenkomstige artikels, opgehaald via o.a. Google Scholar, en 4 overige bronnen (2 artikels van Merck Group site, 1 artikel van OncLive site en 1 artikel op ClinicalTrials.gov). De resultaten van deze studies werden verwerkt in de resultaten van deze
masterproef. De overige 13 studies zijn nog lopende en worden kort besproken a.d.h.v. de informatie op ClinicalTrials.gov.
Vervolgens werden op diverse sites bijkomende artikels en informatie gehaald. Zo werden epidemiologische gegevens over ovariumkanker teruggevonden op de site van het Belgisch kankerregister. Vervolgens werden ook 3 bijkomende artikels gevonden op de site van de Annals of Oncology. Op PubMed werden ook 3 artikels van MeSH definities gevonden en gebruikt in deze masterproef. Tot slot werd een afbeelding gebruikt van de site van Physiopedia en 2 bijkomende artikels van PubMed voor de bijlage. (deze werden niet geïncludeerd in het PRISMA flow diagram).
Een overzicht van de methode wordt gegeven in de vorm van een PRISMA flow diagram. Dit is te zien in figuur 11.
4. Resultaten: checkpoint inhibitie in ovariumcarcinomen
Checkpoint inhibitie, en bij uitbreiding immunotherapie, laat een nieuwe wind waaien in de behandeling van kanker. Na succesvolle toepassing in de behandeling van o.a. melanoom en niet-kleincellig longcarcinoom, werd checkpoint inhibitie ook onderzocht als mogelijke nieuwe therapie voor ovariumcarcinomen (14).
Onderstaande resultaten zullen trachten een beeld te scheppen van hoe dit proces begonnen is en welke evolutie het heeft ondergaan. Zo zijn er de initiële monotherapie studies die al snel werden opgevolgd door de combinatie studies. Mogelijke combinaties en hun resultaten worden hierbij toegelicht. Er zal ook besproken worden hoe de situatie er anno 2019 uitziet en wat de toekomst lijkt te bieden.
4.1. Initiële studies: monotherapie
Checkpoint inhibitie werd in de context van ovariumcarcinomen eerst uitgetest als monotherapie. Deze eerste studies vinden plaats in een late lijn van behandeling, bij een beperkte populatie ‘uitbehandelde’ patiënten. De resultaten van deze studies worden hieronder besproken.
4.1.1. CTLA-4 blokkade
NCT00039091 – Hodi et al.
De eerste studie met checkpoint inhibitoren in ovariumkanker werd uitgevoerd door Hodi et al. Hierbij werd ipilimumab als monotherapie toegediend bij 9 stadium IV patiënten waarbij de ziekte persisteerde of terugkwam na chirurgie en chemotherapie. Dit had een beperkt resultaat met een partiële respons (PR) bij 1 patiënt en stabilisatie van ziekte bij 3 patiënten (19). Momenteel wordt ipilimumab niet meer verder onderzocht als monotherapie (20).
4.1.2. PD-1/PD-L1 blokkade
NCT00729664 – Brahmer et al.
In de studie van Brahmer et al. werd BMS-936559, een anti-PD-L1 antilichaam, getest bij een populatie van 17 patiënten met stadium III of IV ovariumkanker met reeds tumor progressie na
minimum 1 lijn van behandeling. Bij 1 patiënt werd een partiële respons gezien en bij 3 patiënten werd een stabiele ziekte aangetoond (21).
UMIN000005714 – Hamanishi et al.
In een volgende studie onderzochten Hamanishi et al. de activiteit van nivolumab (anti-PD-1) bij 20 patiënten met ovariumkanker in een geavanceerde, hervallen of platinum-resistente setting. Deze patiënten moesten minstens 2 chemokuren reeds hebben ondergaan, van deze patiënten had 55% reeds meer dan 4 kuren chemotherapie achter de rug (22).
In deze studie werd bij 2 patiënten een complete respons (CR) gezien, waarvan één patiënt een sereus carcinoom had en de andere een heldercellig carcinoom had. Bij 1 patiënt werd een partiële respons wat overeenkomt met een overall response rate (“algemeen respons percentage”) van 15% (22).
NCT01375842 – Liu et al.
Het anti-PD-L1 antilichaam atezolizumab werd onderzocht door Liu et al. bij 12 patiënten met ongeneeslijke of gemetastaseerde ovariumkanker. Alle patiënten hadden reeds 1 of meer kuren van chemotherapie ondergaan en 11 patiënten hadden reeds 2 of meer lijnen van behandeling ondergaan in de recurrente setting (23).
In deze studie werd er 1 complete respons en ook 1 partiële respons bereikt. Deze patiënten waren histologisch van het sereuse of het gemengde type (23).
NCT01772004 – Disis et al.
In de JAVELIN solid tumor trial werden 125 patiënten met stadium III of IV, refractair of recurrent, ovariumkanker geïncludeerd. Deze patiëntengroep onderging algemeen reeds vele lijnen van behandeling. De mediaan van eerdere lijnen van behandeling was 3 bij deze patiënten (24).
Er werd een complete respons bereikt bij 1 patiënt en een partiële respons bij 11 patiënten. De histologische types van deze patiënten bestonden voornamelijk uit het sereuse type, maar er waren ook kankers van het endometroide en heldercellige type die een antwoord vertoonden op de therapie (24).
De patiëntengroep met 1 of minder voorgaande lijnen van behandeling, bestaande uit 19 patiënten, had een overall response rate (ORR) van 21,1% en een PFS-12 (progression-free survival op 12 maand) van 15,8%. De groep patiënten die reeds 3 of meer lijnen van behandeling had ondergaan, kende voor 81 patiënten een ORR van 7,4% en een PFS-12 van 9,5% (24).
NCT02054806 – Varga et al.
Een volgende studie is de KEYNOTE-028 waarbij pembrolizumab werd getest bij 26 patiënten met PD-L1 positieve geavanceerde of gemetastaseerde ovariumkanker. Meer dan 70% van deze patiënten onderging reeds 3 of meer voorgaande lijnen van behandeling (25).
Complete respons werd gezien bij een patiënt met een ovariumcarcinoom zonder metastasen. Deze patiënt had ook geen voorafgaande lijn van behandeling voor herval van ziekte ondergaan. Een partiële respons werd bij 2 patiënten, beiden met een adenocarcinoom, gezien. Deze patiënten hadden wel voorafgaande lijnen van behandeling ondergaan (25).
NCT02674061 – Mutalonis et al.
De grootste monotherapie studie is de KEYNOTE-100 trial. In deze studie werd pembrolizumab getest in 2 cohorten van patiënten met ovariumkanker, hervallen na chirurgie en chemotherapie (26).
In arm A werden 285 patiënten geïncludeerd die reeds 1 tot 3 lijnen van behandeling achter de rug hadden. De eerste 100 patiënten dienden als ‘training set’ voor PD-L1 expressie analyse. Arm B bestond uit 91 patiënten die reeds 4-6 lijnen van behandeling hadden ondergaan (26).
In armen A en B werden respectievelijk een overall response rate van 7,4% en 9,9% gezien. De studie meldde dat noch het aantal voorgaande lijnen van behandelingen, noch histologie, noch platinum-sensitieve status een invloed hadden op de ORR. Er werd wel vastgesteld dat de ORR in beide armen hoger was bij de sterk PD-L1 positieve tumoren. Dit verschil was echter niet statistisch significant (26).
Tabel 3: Monotherapie studies in ovariumcarcinomen
Studie Fase N Inclusie Behandeling Resultaten NCT00039091 (Hodi et al 2007) 1 9 Relapse Ipilimumab (Anti-CTLA-4) 10% PR, 33% SD NCT00729664 (Brahmer et al 2012) 1 17 Relapse BMS-936559 (Anti-PD-L1) 6% PR, 18% SD UMIN000005714 (Hamanashi et al 2015) 2 20 PROC Nivolumab (Anti-PD-1) 5% PR, 10% CR, 30% SD NCT01375842 (Liu et al 2019) 1B 12 Relapse Atezolizumab (Anti-PD-L1) 25% ORR NCT01772004 – JAVELIN ST (Disis et al 2016) 1B 125 PROC Avelumab (Anti-PD-L1) 9,6% PR, 44% SD NCT02054806 – KEYNOTE-28 (Varga et al 2015) 1B 26 Relapse PD-L1 + Pembrolizumab (Anti-PD-1) 11,5% ORR 26,9% SD NCT02674061 – KEYNOTE-100 (Mutalonis et al 2018) 2 376 Relapse Pembrolizumab Arm A: 1-3 lijnen Arm B: 4-6 lijnen Arm A: 7,4% ORR Arm B: 9,9% ORR PROC, platinum-resistant ovarian cancer; CR, complete response; PR, partial response; SD, stable disease; ORR, overall response rate
4.1.3. PD-L1 expressie
In onderstaande tabel werden de monotherapie studies opgenomen die ook PD-L1 expressie en de correlatie ervan met de ORR, onderzochten. Geen enkele van deze studies kon bewijzen dat er een significante correlatie is tussen PD-L1 expressie positiviteit en respons op monotherapie (22-26).
Tabel 4: PD-L1 expressie in monotherapie studies
Nivolumab (Hamanishi) Atezolizumab (Liu) Avelumab (JAVELIN ST) Pembrolizumab (KEYNOTE-028) Pembrolizumab (KEYNOTE-100) ORR 15% 25% 9,6% 11,5% 8% PD-L1 positiviteit op IHC +2/+3 TC IC 2/IC 3 ≥1% TC ≥1% CPS ≥10 ORR PD-L1 + 12,5% 25% 11,8% 11,5% 17,1% ORR PD-L1 - 25% - 7,9% - 5,0% ORR, overall response rate; IHC, immuunhistochemie; PD-L1 +, PD-L1 positief; PD-L1 -, PD-L1 negatief TC, tumorcellen; IC, immuuncellen; CPS, combined positive score
4.1.4. Besluit monotherapie studies
Algemeen kan gesteld worden dat de eerste studies vooral beoogden om de activiteit van checkpoint inhibitoren, als monotherapie, te onderzoeken en dit in een setting van gevorderd ovariumkanker. De studies bekwamen allen een beperkt resultaat waarbij de response rates bleven schommelen rond de 10-15% (20, 27).
Het kon zijn meerwaarde in de behandeling van ovariumcarcinomen niet bewijzen als monotherapie. Er moest dus op zoek gegaan worden naar een manier om betere resultaten te bereiken. Deze werd gevonden in de combinatie van therapieën en is ook de basis van alle volgende studies. Monotherapie lijkt momenteel in de context van de behandeling van ovariumkanker verlaten.
4.2. Combinatie studies in ovariumkanker
In combinatie studies worden verschillende therapeutische mechanismen aangesproken om zo een synergistisch effect te proberen bereiken. Het vinden van combinaties die goed op elkaar inwerken en ook het timen van deze therapieën in de behandeling, vormt een niet te onderschatten taak (20, 27, 28).
4.2.1 Combinaties binnen checkpoint inhibitie
Een eerste combinatie lag voor de hand: het associëren van 2 checkpoint inhibitoren. De blokkade van de CTLA-4 pathway én de PD-1/PD-L1 pathway zou een synergistisch effect kunnen hebben. CTLA-4 stimulatie zorgt immers voor een verminderde T-cel activatie en priming, terwijl de PD-1/PD-L1 interactie zorgt voor een gedaalde T-cel functie. Door beide te blokkeren zou de cancer-immunity cycle dus op 2 punten worden gestimuleerd en zou dus mogelijks een efficiëntere respons kunnen teweegbrengen (10, 28).
NCT02498600 - Burger et al.
De combinatie van twee ICI, namelijk ipilimumab (anti CTLA-4) en nivolumab (anti-PD-1) werd door Burger et al onderzocht. Hiervoor rekruteerden ze 100 patiënten met hervallen of persisterend ovariumkanker met een PFI van minder dan 12 maanden. Van deze patiënten had 82% een sereus histologisch type en 63% was platinum-resistent (29).
In de combinatie arm werd een significant betere response rate gezien dan in de arm die nivolumab monotherapie kreeg, namelijk 31,4% t.o.v. 12,2% (29).
Tabel 5: Combinatie studie: checkpoint inhibitie – checkpoint inhibitie
Studie Fase N Inclusie Behandeling Response rate NCT02498600 (Burger et al 2018) 2 100 Relapse (PFI <12m) Nivolumab + nivolumab onderhoud 12,2% RR Nivolumab + ipilimumab + nivolumab onderhoud 31,4% RR
PFI, platinum-free interval; RR, response rate
4.2.2. Combinaties met targeted therapy
Targeted therapy, letterlijk vertaald als ‘doelgerichte therapie’, wordt gedefinieerd als een therapie die interageert met de synthese van specifieke cellulaire componenten, typisch voor de aandoening, of deze synthese blokkeert. Het heef als doel om een specifieke dysfunctie, betrokken in de ziekte progressie, te hinderen of te stoppen (30).
Deze geneesmiddelen hebben reeds een traject van trials in ovariumkanker doorlopen. De trials evolueerden van monotherapie naar combinaties en vervolgens naar implementatie in eerste lijn behandeling. Hieronder volgen enkele belangrijke soorten van targeted therapy en hoe ze kunnen bijdragen tot het therapeutisch effect van checkpoint inhibitie in ovariumcarcinomen (27).
4.2.2.1. Anti-VEGF therapie
De vascular endothelial growth factors (VEGF) spelen een belangrijke rol in de groei en differentiatie van o.m. de vasculaire endotheliale cellen (31). Bij inhibitie van deze factor wordt de angiogenese geremd, wat nefast is voor de expansie van tumoren. Er ontstaat hypoxie in de tumor met als gevolg dat er een downregulatie is van de DNA herstel genen wat uiteindelijk zal leiden tot celdood. PD-L1 expressie wordt hierbij ook opgereguleerd. VEGF heeft ook verschillende immuun modulerende effecten waaronder het reduceren van de anti-tumor respons door inhibitie van T-cellen en stimulatie van proliferatie van Treg cellen. Door VEGF te inhiberen zou er, naast celdood, dus ook een efficiëntere anti-tumor respons mogelijk zijn (28, 32).
NCT02873962 – Liu et al.
Liu et al. onderzochten de combinatie van nivolumab (anti-PD-1) met bevacizumab in een populatie van 38 patiënten met recurrent ovariumkanker, waarvan er 20 platinum-sensitief waren en 18 platinum-resistent. Er werd een algemene ORR van 28,9% bekomen en voor de platinum-sensitieve en platinum-resistente groep een respectievelijke ORR van 40% en 16,7% (33).
4.2.2.2. PARP inhibitoren
Poly ADP-Ribose Polymerase (PARP) is een enzym dat een belangrijke rol speelt in het DNA-herstel mechanisme, met name het DNA-herstel van DNA single-strand breaks (“enkelstrengige breuken in DNA”) (27, 28). Wanneer dit enzym geïnhibeerd wordt, stapelen de enkelstrengige breuken zich op waardoor het replicatie proces in het gedrang komt met als gevolg dat uiteindelijk dubbelstrengige breuken in het DNA zich vormen. Normaal gezien worden deze dubbelstrengige breuken hersteld door een homoloog recombinatie herstel mechanisme. Deze breuken stapelen zich echter op in tumorcellen met een deficiëntie in dit mechanisme zoals bv. een BRCA 1 of 2 mutatie. De accumulatie van al deze DNA breuken zal aanleiding geven tot celdood. Dit mechanisme wordt synthetic lethality (“synthetische letaliteit”) genoemd (27, 28, 34, 35).
Omdat een PARP inhibitor (PARPi) het DNA herstel tackelt, zorgt het voor DNA-schade. Dit kan de neoantigen expressie een duwtje in de rug geven waardoor de tumor een hogere TMB kan ontwikkelen. Hierdoor kan herkenning van de tumor door het immuunsysteem in de hand gewerkt worden. Bij PARP inhibitie wordt upregulatie van PD-L1 door de tumorcellen en meer cytokine vrijstelling door de TIL gezien. Bovendien kan deze inhibitie interferon pathways triggeren waardoor ‘cold tumors’ als het ware ontdooid worden en T-cel inflammatie vertonen. Deze 2 mechanismen zouden kunnen zorgen voor een beter effect van ICI en vormen de rationale voor de combinatie van PARP inhibitie met checkpoint inhibitie (28, 32, 34, 35).
NCT02484404 – Lee et al.
In de studie van Lee et al. werden de combinaties van ICI met anti-VEGF therapie en PARP inhibitie met elkaar vergeleken. Deze studie includeerde 24 patiënten waarvan 19 patiënten met recurrent of gemetastaseerd ovariumkanker. Deze hadden allen 2 of meer lijnen van behandeling reeds ondergaan (32).
De combinatie van durvalumab (anti-PD-L1) met olaparib (PARPi) werd getest bij 12 patiënten. Dit resulteerde in een partiële respons bij 2 patiënten, beiden met ovariumkanker van het hooggradig sereuse type (32).
Bij combinatie van durvalumab met cediranib (anti-VEGF therapie) werd een partiële respons gezien bij 6 van de 12 patiënten. Van deze 6 patiënten hadden 2 patiënten ovariumkanker en met name één van het hooggradig sereuse en één van het heldercellig type. PD-L1 expressie werd ook hier gecontroleerd maar bleek niet samenhangend met respons op therapie (32).
NCT02657889 – Konstantinopoulos et al.
De TOPACIO trial onderzocht de effectiviteit van niraparib (PARPi) in combinatie met pembrolizumab bij 60 patiënten met platinum-resistent ovariumkanker. Deze patiënten hadden maximaal 5 lijnen van cytotoxische therapie ondergaan (36).
Er werd een ORR van 18% bekomen, dit hield in dat bij 3 patiënten een CR werd gezien en een PR bij 8 patiënten. Er werd een disease controle rate (DCR) van 65% bereikt (36). De ORR werd ook voor mogelijke biomarker subgroepen (tumor BRCA mutatie, HRD status, PD-L1 status) maar de respons kon hier niet mee worden gecorreleerd. De studie meldde wel een trend van hogere response rates bij patiënten met een kleiner aantal voorgaande lijnen van de behandeling (36).
NCT02734004 – Drew et al.
In een volgende studie, de MEDIOLA trial, werd de combinatie durvalumab met olaparib onderzocht. De populatie bestond uit 32 patiënten met hervallen platinum-sensitief, germline BRCA gemuteerd ovariumkanker. Van deze patiënten had 50% 2 tot 3 voorafgaande lijnen van chemotherapie ondergaan en iets meer dan 43% onderging 1 voorafgaande lijn (37). Er werd een DCR van 81% en een ORR van 72% bereikt. De ORR werd ook gesegregeerd naargelang het aantal voorgaande lijnen van behandeling. Voor 1, 2 en 3 of meer lijnen werden respectievelijk een ORR gezien van 77%, 67% en 70%. De ORR ligt in deze studie dus hoger voor patiënten met slechts 1 voorgaande lijn van behandeling (37).
Analyse van PD-L1 expressie en aanwezigheid van TIL kon geen significant verband met respons aantonen (37).
4.2.2.3. HDAC inhibitie
Een andere vorm van targeted therapy is de inhibitie van het histon deacetylase enzyme (HDAC). Entinostat, een HDAC-1 inhibitor, heeft verschillende immuun modulerende eigenschappen. Het speelt mee in de regulatie van het tumor micromilieu en van de immuun inhiberende cellen. Het heeft een pro-inflammatoire werking en zorgt voor een betere antigen presentatie (38).
Door deze werking te combineren met checkpoint inhibitie zou mogelijks een betere respons kunnen bereikt worden (38).
NCT02915523 – Cadoo et al.
Deze combinatie werd getest door Cadoo et al. in de ENCORE 603 trial in een populatie van 126 patiënten met progressief of recurrent ovariumkanker. Deze patiënten mochten 3 tot 6 voorafgaande lijnen van therapie hebben ondergaan, beiden armen hadden een mediaan van 4 voorafgaande lijnen (38).
Additie van entinostat aan avelumab kon helaas geen significante verbetering teweegbrengen in de PFS of ORR (38).
Tabel 6: Combinatie studies checkpoint inhibitie – targeted therapy
Studie Fase N Inclusie Behandeling Response rate NCT02484404
(Lee et al 2017)
1 24 Relapse Durvalumab + olaparib 17% PR, 66% SD Durvalumab + cediranib 50% PR, 25% SD
NCT02873962 (Liu et al 2018)
2 38 PSOC PROC
Nivolumab + bevacizumab PSOC: 40% ORR PROC: 16,6% ORR
NCT02734004 - MEDIOLA
(Drew et al 2018)
2 32 PSOC Durvalumab + olaparib 72% ORR 19% CR, 53% PR
NCT02657889 – TOPACIO
(Konstantinopoulos et al 2019)
1/2 62 PROC Pembrolizumab + niraparib 18% ORR 5% CR, 13% PR
NCT02915523 – ENCORE 603 (Cadoo et al 2019)
1/2 126 Relapse Avelumab + entinostat 5,9% ORR 17,6% SD Avelumab + placebo 4,9% ORR
7,3% SD
PSOC, platinum-sensitive ovarian cancer ; PROC, platinum-resistant ovarian cancer; CR, complete response; PR, partial response; SD, stable disease; ORR, overall response rate
4.2.3. Combinaties met chemotherapie
4.2.3.1. Platinum-gebaseerde chemotherapieOok de basistherapie van ovariumkanker, namelijk de platinum gebaseerde chemotherapie, vertoont een immuun modulerend effect. Paclitaxel bijvoorbeeld zorgt voor een verbeterde cytotoxische functie van de T-cellen bij behandeling van gevorderd ovariumkanker. Dit zou te wijten zijn aan de vrijstelling van antigenen die volgt uit de chemo-geïnduceerde apoptose. Van deze therapie is ook reeds aangetoond dat ze een stimulerende invloed zou hebben op dendritische cellen en de immuunsuppressie van het tumormilieu zou temperen (28, 39, 40). Deze chemotherapie kan dus mogelijks bijdragen tot de effectiviteit van checkpoint inhibitie in ovariumcarcinomen en werd in de volgende studies onderzocht.
NCT02440425 – Wenham et al.
Wenham et al. onderzochten de combinatie van paclitaxel met pembrolizumab (anti-PD-1) in 37 patiënten met platinum-resistent ovariumkanker. Het primaire eindpunt, een PFS van 6 maand, werd behaald bij 52,5% van de patiënten. De ORR en DCR waren hierbij respectievelijk 51,4% en 86,5% (29).
NCT02718417 - Merck and Pfizer Inc.
In de JAVELIN ovarian 100 trial werden 998 patiënten met o.a. stadium III of IV ovariumkanker geïncludeerd. Deze trial situeert zich in eerste lijn setting en had PFS als primaire eindpunt (41).
De behandeling carboplatin/paclitaxel met/zonder avelumab gevolgd door avelumab in onderhoudsbehandeling, kon geen superieure PFS bereiken in vergelijking met carboplatin/paclitaxel gevolgd door observatie. De studie werd dan ook vroegtijdig beëindigd wegens futiliteit (41).
4.2.3.2. Pegylated liposomal doxorubicin
Pegylated liposomal doxorubicin (PLD) behoort tot een andere klasse chemotherapie, de anthracyclines, die o.a. gebruikt wordt in de platinum-resistente setting. Ook deze soort chemotherapie vertoont immuun modulerende eigenschappen. Het is in staat om een
voor een verhoogde opname van tumor antigenen door dendritische cellen. Dit kan een immuunrespons tot stand brengen door verhoogde antigen verwerking én presentatie aan T-cellen (28, 40, 42).
Het immuunsuppressieve karakter van het tumor milieu kan echter de activatie van de dendritische cellen in de weg staan. PLD en checkpoint inhibitoren zouden daarom wel eens een goede match kunnen zijn (28, 40, 42).
NCT02431559 – O’Cearbhaill et al.
O’Cearbhaill et al. onderzochten de combinatie van durvalumab (anti-PD-L1) met PLD bij 40 patiënten met platinum-resistent ovariumkanker. Bij deze patiënten was, na een eerste of tweede lijn van platinum chemotherapie, behandeling met PLD geïndiceerd (43).
Het primaire einddoel van deze studie was de progression-free survival na 6 maanden (PFS-6) en deze bedroeg 42,9%. Secundair werd ook naar de tumor respons gekeken bij deze patiënten. Een CR en PR werden respectievelijk gezien bij 2 en 4 patiënten (43).
NCT02580058 - Pujade-Laurainea et al
In de JAVELIN Ovarian 200 studie werd PLD met avelumab (anti-PD-L1) gecombineerd bij patiënten met platinum refractair of resistent ovariumkanker. Hierbij werden 566 patiënten geïncludeerd. Deze patiënten hadden tot 3 voorafgaande lijnen van behandeling ondergaan en hadden nog geen behandeling ondergaan in hun platinum-resistente setting (44).
Er werden 3 armen met elkaar vergeleken: avelumab monotherapie, PLD in monotherapie en de combinatie van avelumab met PLD. De primaire eindpunten waren PFS en overall survival (OS). Avelumab in monotherapie kon geen betere PFS of OS bereiken dan PLD monotherapie. Ook de combinatie van avelumab met PLD kon geen significante verbetering teweeg brengen in PFS of OS t.o.v. PLD monotherapie (44).
Een secundair eindpunt van deze studie was ook de efficiëntie van therapie naargelang de PD-L1 expressie. Hierbij werd een tendens gezien tot betere PFS en OS in de PD-L1 positieve groep die behandeld werd met avelumab en PLD t.o.v. de PLD arm. Dit moet echter nog bevestigd worden door verdere analyses. In de combinatie arm werd voor de PD-L1 positieve en negatieve groep een ORR van respectievelijk 18,5% en 3,4% gezien (44).
Tabel 7: Combinatie studies checkpoint inhibitie - chemotherapie
Studie Fase N Inclusie Behandeling Response rate NCT02440425
(Wenham et al 2018)
2 37 PROC Paclitaxel + pembrolizumab 52,5% PFS-6 51,4% ORR 86,5% DCR NCT02431559 (O’Cearbhaill et al 2018) 1/2 53 PROC Durvalumab + PLD + durvalumab onderhoud 42,9% PFS-6 5% CR, 10% PR NCT02580058 – JAVELIN ovarian 200 (Pujade-Laurainea et al. 2019) 3 566 PROC PRROC Avelumab 3,7% ORR Avelumab + PLD 13,3% ORR PLD 4,2% ORR NCT02718417 – JAVELIN ovarian 100 (Merck and Pfizer Inc. 201X)
3 998 First line Chemo + observatie
Beëindigd wegens futiliteit
Chemo
+ avelumab onderhoud Chemo met avelumab + avelumab onderhoud
PROC, platinum-resistent ovarian cancer ; PRROC, platinum-refractory ovarian cancer; ORR, overall response rate ; PFS-6, progression-free survival 6 months ; DCR, disease control rate
4.2.4. Tripel combinaties
Er werd ook onderzoek gedaan naar combinaties van meer dan 2 therapieën om zo ook meer dan 2 werkingsmechanismen te combineren. De verschillende combinaties en de resultaten van deze studies worden hieronder toegelicht.
4.2.4.1. Chemotherapie en TLR agonisme
Zo is er onderzoek gedaan naar stimulatie van toll-like receptoren (TLR) via agonisten. De TLR 8 bevindt zich onder andere in dendritische cellen en zorgt bij activatie voor loslating van inflammatoire cytokines en maturatie van de dendritische cellen. Een selectieve TLR 8 agonist, motolimod, zou dus een antikanker immuunrespons kunnen bevorderen (42).
De studie van O’cearbhaill et al. was oorspronkelijk een triple studie met durvalumab, PLD en motolimod. Helaas werd in een andere studie aangetoond dat motolimod geen significante verbetering in OS kan teweegbrengen wanneer gecombineerd met PLD in een populatie van 297 patiënten. Motolimod werd dan ook geschrapt uit de studie van O’Cearbhaill et al (42, 45).