invent aris atie het belang v an dierpr oe ven en mogelijkheden t ot vermindering d aar van in fund amenteel neur owetenschappelijk onderz oek
factsheet
mens-diercombinaties
kn awfactsheet mens-diercombinaties
2019 Koninklijke Nederlandse Akademie van Wetenschappen (KNAW) © Sommige rechten zijn voorbehouden / Some rights reserved
Voor deze uitgave zijn gebruiksrechten van toepassing zoals vastgelegd in de Creative Commons licentie. [Naamsvermelding 3.0 Nederland]. Voor de volledige tekst van deze licentie zie http://www.creativecommons.org/licenses/by/3.0/nl/
Koninklijke Nederlandse Akademie van Wetenschappen Postbus 19121, 1000 GC Amsterdam
Telefoon + 31 20 551 0700 knaw@knaw.nl
www.knaw.nl
pdf beschikbaar op www.knaw.nl
Basisvormgeving: Edenspiekermann, Amsterdam Engelse vertaling samenvatting: Balance, Maastricht Opmaak en beeldbewerking: Ellen Bouma
Foto omslag: Wikimedia ISBN 978-90-6984-734-4
Deze publicatie kan als volgt worden aangehaald: KNAW (2019). Factsheet
factsheet
mens-diercombinaties
voorwoord
Wetenschappelijk onderzoek met menselijke geslachtscellen en embryo’s levert belangrijke nieuwe kennis op, maar er zitten ook tal van ethische en juridische vraag-stukken aan. In de Embryowet is daarom vastgelegd onder welke strikte voorwaar-den dit materiaal voor wetenschappelijk onderzoek mag worvoorwaar-den gebruikt. Daarbij worden niet alleen grenzen gesteld aan materiaal van volledig menselijke oorsprong, maar ook aan combinaties van menselijk en dierlijk materiaal. De huidige Embryo-wet reguleert echter niet alle mens-diercombinaties. Voor Embryo-wetenschappelijk onder-zoek zijn de zogenoemde chimeren en cybriden bijvoorbeeld van groot belang. Het kabinet is voornemens deze vormen ook in de Embryowet te reguleren en heeft de Gezondheidsraad hierover om advies gevraagd.
Zo’n advies vraagt een zorgvuldige afweging van de medisch-ethische dilemma’s en de mogelijke waarde van wetenschappelijk onderzoek met dit materiaal. Onderzoek met chimeren kan bijvoorbeeld bijdragen aan het herstel van functionaliteit van beschadigde organen en weefsel, zoals de lever, de huid en de alvleesklier. Onderzoek aan cybriden levert belangrijke inzichten in de functie van mitochondriën en moge-lijke aangrijpingspunten voor hieraan gerelateerde aandoeningen. We zijn bijzonder verheugd dat de Gezondheidsraad, mede op verzoek van de minister van Volksge-zondheid, Welzijn en Sport, de KNAW heeft gevraagd de wetenschappelijke kant van dit vraagstuk in kaart te brengen. Deze factsheet is hiervan het resultaat.
Combinaties van mens en dier spreken al vele eeuwen tot de verbeelding. Een van de bekendste mythische figuren is de centaur, die op de voorkant van deze factsheet staat afgebeeld: half mens en half paard. Maar waar het eerder om fictie ging, gaat het inmiddels om feiten. Die feiten komen nu voor als chimeren en cybriden – combina-ties van dierlijke en menselijke cellen die de afgelopen jaren mogelijk zijn geworden door geavanceerde biologische technieken.
5 voorwoord
De KNAW geeft in deze factsheet een feitelijke beschrijving van de stand van zaken en de te verwachten toekomstige ontwikkelingen in de wetenschap en toepassing hier-van. Ook signaleert de KNAW op basis van deze ontwikkelingen een aantal ethische vraagstukken. De KNAW doet hier echter geen aanbevelingen, omdat de analyse en de afweging van de verschillende – ook de niet-wetenschappelijke – belangen door onze collega’s van de Gezondheidsraad zullen worden gedaan.
Voor de totstandkoming van deze factsheet heeft de KNAW een expertbijeenkomst georganiseerd waaraan tal van deskundigen hun medewerking hebben verleend. Zonder hun medewerking had deze factsheet niet in zo’n korte tijd tot stand kun-nen komen. De KNAW is alle betrokkekun-nen veel dank verschuldigd en in het bijzonder de leden van de commissie die onder voorzitterschap van professor Anton Berns in korte tijd tot een gedegen verkenning van de status van het veld en de te verwachten ontwikkelingen zijn gekomen.
De KNAW hoopt dat de Gezondheidsraad met deze factsheet goed geïnformeerd een zorgvuldige afweging kan maken van de medisch-ethische dilemma’s enerzijds en de mogelijke waarde van wetenschappelijk onderzoek met dit materiaal anderzijds. Persoonlijk vind ik dit een mooi voorbeeld van een goede samenwerking tussen adviesorganen in Nederland. Daarnaast hoop ik dat ook anderen de factsheet met interesse zullen lezen – het gaat om technieken die hopelijk van waarde zullen zijn voor de wetenschap en ons allen.
Wim van Saarloos
inhoud
voorwoord
41. inleiding
8 1.1 Aanleiding factsheet 8 1.2 Werkwijze KNAW-commissie 9 1.3 Leeswijzer factsheet 92. mens-diercombinaties
11 2.1 Inleiding 112.2 Mens-diercombinaties op genetisch niveau 11 2.3 Mens-diercombinaties op cellulair niveau 13
3. chimeren
163.1 Definities en technieken 16
3.2. Wetenschappelijke ontwikkelingen 19 3.3 Toepassingen voor zorg en gezondheid 22 3.4 Alternatieve methoden 23
3.5 Ethische overwegingen 28
4. cybriden
314.1 Definities en technieken 31
4.2 Wetenschappelijke ontwikkelingen 33 4.3 Toepassingen voor zorg en gezondheid 34 4.4 Alternatieve methoden 34
7 inhoud
5. conclusies
37 5.1 Definities 37 5.2 Onderzoek 38 5.3 Toepassing 38 5.4 Alternatieven 39 5.5 Ethiek 39appendices
1 Tabel mens-diercombinaties 41 2 Verklarende woordenlijst 443 Instellingsbesluit KNAW-commissie mens-diercombinaties 46
4 Opdrachtverzoek KNAW voor GR-advies regulering cybriden en iPS-chimeren 50 5 Adviesaanvraag over regulering cybriden en iPS-chimeren 51
6 Deelnemerslijst bijeenkomst mens-diercombinaties 54
1. inleiding
1.1 Aanleiding factsheet
De Embryowet stelt regels over handelingen met menselijke geslachtscellen en embryo’s. In artikel 25 worden grenzen gesteld aan handelingen met mens-diercom-binaties. In de wetsevaluatie van 2012 is opgemerkt dat een aantal varianten niet geregeld is in de Embryowet. Er is bepleit om hier verder over na te denken, omdat een aantal van deze varianten, waaronder mens-dierchimeren en -cybriden, van belang kunnen zijn voor medisch-wetenschappelijk onderzoek en op termijn moge-lijk kunnen voorzien in weefsels en organen voor transplantatie. Om tot zorgvuldige besluitvorming te komen over de wijze van regulering acht het kabinet advisering door de Gezondheidsraad gewenst (Appendix 5 Adviesaanvraag over regulering cybriden en iPS-chimeren). Het kabinet acht hierbij drie elementen van belang: 1. medisch-wetenschappelijke noodzaak; 2. medisch-ethische reflectie; en 3. maatschappelijke discussie en politieke bezinning.
Voor het eerste element heeft de minister de Gezondheidsraad gevraagd de KNAW te betrekken door de stand van zaken van het wetenschappelijke veld, zowel binnen Nederland als daarbuiten, in kaart te brengen. Hiertoe heeft de Gezondheidsraad een opdrachtverzoek gestuurd naar de KNAW (Appendix 4 Opdrachtverzoek KNAW voor GR-advies regulering cybriden en iPS-chimeren). Middels deze factsheet komt de KNAW tegemoet aan het verzoek van de Gezondheidsraad. Een KNAW-factsheet bevat geen aanbevelingen, maar geeft een feitelijke beschrijving van de stand van zaken en de te verwachten toekomstige ontwikkelingen in de wetenschap en toepas-sing hiervan. Ook wordt op basis van deze ontwikkelingen een aantal ethische vraag-stukken gesignaleerd. De nadere analyse hiervan is de taak van de Gezondheidsraad.
9 1. inleiding
1.2 Werkwijze KNAW-commissie
De opdracht aan de KNAW-commissie (Appendix 3 Instellingsbesluit KNAW-commis-sie mens-diercombinaties) volgt uit het opdrachtverzoek van de Gezondheidsraad en omvat de volgende taken:
1. Het organiseren van een bijeenkomst waarin de huidige stand van de weten-schap wordt belicht met betrekking tot onderzoek met en toepassingen van iPS-chimeren en cybriden, in Nederland en daarbuiten. De bijeenkomst zal zowel de huidige stand van het wetenschappelijk onderzoek behandelen als visies van experts en belanghebbenden op de nabije toekomst, inclusief toepassingen in zorg en gezondheid. Ook mogelijke alternatieven voor onderzoek met en toepas-singen van iPS-chimeren en cybriden worden behandeld, omdat vooralsnog niet is te voorspellen vanuit welke onderzoeksterreinen mogelijke doorbraken zullen komen.
2. Een beknopte factsheet met bevindingen van de bijeenkomst opleveren. 3. Het mondeling presenteren van eindresultaten en conclusies van de factsheet
tijdens de vergadering van de Commissie Ethiek en recht van de Gezondheidsraad op 15 januari 2019, met mogelijkheid tot discussie met de leden van deze com-missie.
De bijeenkomst onder punt 1 heeft plaatsgevonden op 5 december 2018. Appendix 6 bevat de lijst met deelnemers. De onderhavige factsheet is die welke is bedoeld onder punt 2.
De KNAW-commissie volgt in haar werkwijze de handleiding adviezen en verken-ningen van de KNAW. In afwijking van de handleiding en vanwege de korte tijdslijnen heeft de externe reviewprocedure alleen mondeling en op hoofdlijnen plaatsgevon-den. De Gezondheidsraad is voornemens de resultaten van de factsheet te verwerken in het advies aan de minister van Volksgezondheid, Welzijn en Sport (VWS), maar behoudt zich het recht voor de tekst te redigeren en onderdelen uit de factsheet te gebruiken. Om de onafhankelijkheid van de KNAW-commissie en de transparantie van de besluitvorming te borgen zal de KNAW-factsheet als eigenstandig document worden gepubliceerd.
1.3 Leeswijzer factsheet
In deze factsheet geeft de KNAW een overzicht van de mens-diercombinaties van cel-len of celbestanddecel-len die resulteren in organismen waarvan één of meer weefsels geheel of gedeeltelijk van menselijke oorsprong zijn. De focus ligt hierbij op chimeren en cybriden, zoals gedefinieerd in de adviesvraag van de minister van VWS, maar ook
aanverwante technieken die kunnen resulteren in mens-diercombinaties worden besproken. De redenen hiervoor zijn dat: 1. deze aanverwante technieken tot mens-diercombinaties kunnen leiden die niet goed te onderscheiden zijn van chimeren en cybriden; en 2. dergelijke mens-diercombinaties vergelijkbare wetenschappelijke en maatschappelijke uitdagingen en kansen bieden. We willen hier alvast opmerken dat verschillende van deze aanverwante technieken waarschijnlijk niet binnen de reik-wijdte van de (nog aan te passen) Embryowet lijken te kunnen vallen, omdat er geen sprake is van het gebruik van menselijke embryo’s.
De factsheet beschrijft in hoofdstuk 2 het spectrum van mens-diercombinaties, waaronder chimeren en cybriden. In hoofdstuk 3 worden voor chimeren (en aanver-wante technieken) en in hoofdstuk 4 voor cybriden (en aanveraanver-wante technieken) de volgende aspecten behandeld: definities en technieken, wetenschappelijke ontwik-kelingen, toepassingen voor zorg en gezondheid, alternatieve methoden en ethische overwegingen. Hoofdstuk 5 bevat de conclusies.
11 2. mens-diercombinaties
2. mens-diercombinaties
2.1 Inleiding
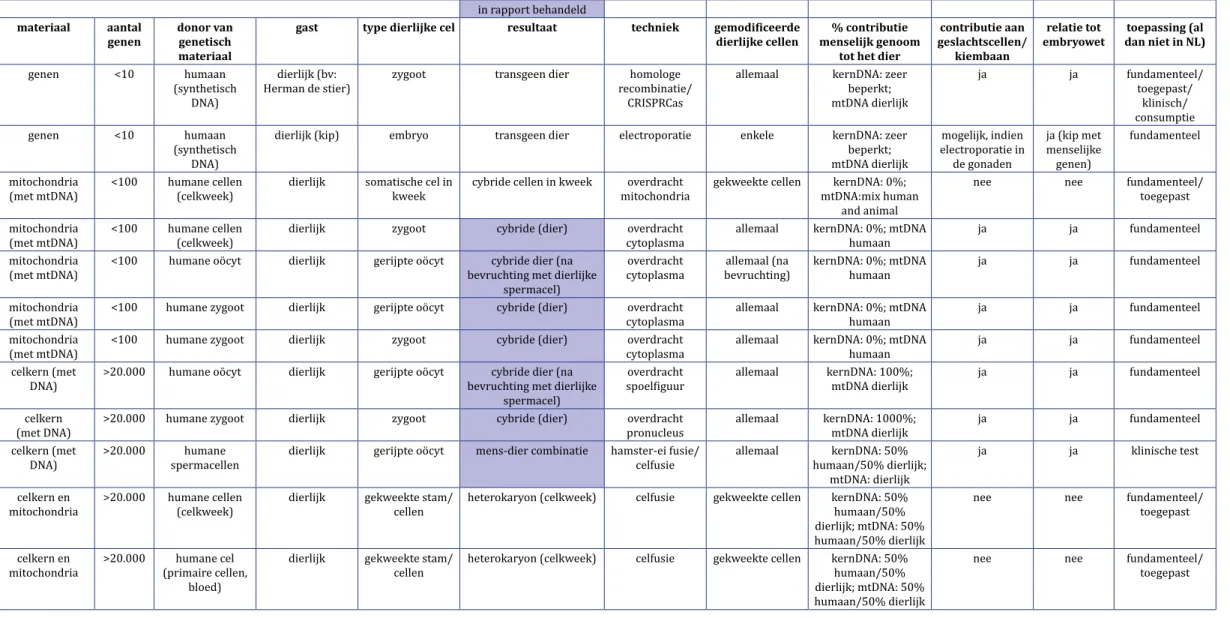
Naast en binnen de door de minister van VWS genoemde mens-diercombinaties chimeren en cybriden bestaat een diversiteit aan mens-diercombinaties met elk hun eigen wetenschappelijke en maatschappelijke implicaties. Zowel op het niveau van het genetisch materiaal (binnen een cel) als op het niveau van cellen zijn uiteenlo-pende combinaties te maken van dierlijk en menselijk materiaal (zie ook de tabel in Appendix 1). In dit hoofdstuk geven we een overzicht van al deze combinaties en bespreken we tot welke daarvan we ons beperken en waarom. Appendix 2 bevat een verklarende woordenlijst.
2.2 Mens-diercombinaties op genetisch niveau
Op het niveau van het combineren van genetisch materiaal van mens en dier zijn twee groepen te onderscheiden: transgene dieren en cybriden/mitochondriële overdracht. 2.2.1 Transgene dieren
Bij transgene dieren (een organisme dat één of meer genen afkomstig van een andere diersoort in zijn erfelijk materiaal draagt) kan sprake zijn van mens-diercombinaties. Hierbij worden door genetische-modificatietechnologieën menselijke genen toege-voegd aan het genoom van een dier. Het maken van transgene dieren is in Neder-land alleen toegestaan in het laboratorium wanneer aan bepaalde voorwaarden is voldaan. Transgene dieren worden vooral gebruikt om de functie van genen te
bestuderen of om mensspecifieke eiwitten te produceren. Over het algemeen betreft het de introductie van een beperkt aantal genen en het resulterende dier behoudt in zeer sterke mate de soortspecifieke eigenschappen. De genome-editingtechnologieën worden steeds krachtiger, met als voorbeeld de recente CRISPR/Cas9 genome edi-ting, die nog aanzienlijke verdere ontwikkelingsmogelijkheden biedt. Dat betekent dat ook veel complexere genoommodificaties van dieren mogelijk worden dan tot nu toe het geval is. Dit kan belangrijke inzichten opleveren ten aanzien van verou-dering en een groot aantal ziekten (KNAW 2016). Ook wordt het daardoor mogelijk om weefsels van dieren uitgebreider te ‘humaniseren’. Dit kan worden ingezet om de groei van humane cellen in dieren (chimeren, zie paragraaf 2.3.1) te vergemak-kelijken, maar ook om dierlijke weefsels te ‘humaniseren’, waardoor ze bijvoorbeeld minder snel worden afgestoten bij transplantatietoepassingen (xenotransplantatie, zie paragraaf 2.3.3).
Er vindt ook onderzoek plaats waarbij menselijke cellen dierlijke genen tot expres-sie brengen om de functionaliteit van een specifiek dierlijk gen tegen de genetische achtergrond van de mens te bestuderen. Dit is beperkt tot in vitro (‘in glas’, buiten een normale biologische omgeving) celkweekstudies.
Vanwege de adviesvraag van de minister van VWS zullen we verder niet ingaan op transgene dieren, behalve wanneer deze techniek gebruikt wordt in combinatie met andere technieken.
2.2.2 Cybriden
Een ‘cytoplasmic hybrid’ of ‘cybrid/cybride’ is een cel waarbij de celkern en cytoplast (alle onderdelen van een cel behalve de kern waaronder cytoplasma, mitochondriën en andere cytoplasmatische organellen en de celmembraan) afkomstig zijn van verschillende cellen. De KNAW hanteert in deze factsheet als definitie voor cybride ‘een diploïde kern van een cel geplaatst in de cytoplast van een andere cel’. Wanneer de ontkernde cel van een eencellig embryo (of een rijpe oöcyt) wordt gebruikt om een cybride te maken met een diploïde kern van dezelfde soort, kan deze tot een levensvatbaar organisme uitgroeien en spreekt men van ‘kloneren’. De donorkern kan dan in principe afkomstig zijn van elke lichaamscel. Met cybriden gemaakt met cytoplasten van weefselcellen is dit niet mogelijk, wel zou men deze cellen kun-nen herprogrammeren tot iPS-cellen. Een aan cybriden nauw verwante techniek is mitochondriële overdracht. Hierbij worden alleen de mitochondriën van de ene cel in een andere cel ingebracht. Omdat met deze techniek ook cellen gecreëerd kunnen worden met een mengeling van mitochondriaal DNA van een soort en kern-DNA van een andere soort, zullen we deze ook meenemen in onze beschouwing, ook al valt dat formeel niet onder de adviesvraag van de minister van VWS, waar alleen gesproken wordt van ‘cybriden’.
13 2. mens-diercombinaties
Andere constructen die enigszins verwant zijn aan cybriden zijn: 1) dubbelkernige cellen verkregen door de fusie van celkernbevattende cellen van twee verschillende soorten en 2) (diploïde) eencellige embryo’s (zygoten) waarbij de rijpe eicel van de ene diersoort is en de spermacel van de andere diersoort. Deze laatste komt ook van nature voor en staat bekend als een ‘hybride’. Denk bijvoorbeeld aan een muilezel, voortkomend uit paard- en ezelgameten. In de voortplantingsgeneeskunde is ‘hybridi-sering’ ook toegepast in de vorm van de ‘hamstereicel-test’, waarbij een hamsteroöcyt bevrucht wordt door een menselijke spermacel om de kwaliteit van de spermacellen te testen. Dubbelkernige cellen (afkomstig van cellen van twee verschillende soorten) en hybriden zullen we in onze beschouwing van mens-diercombinaties verder niet behan-delen, omdat het zeer onwaarschijnlijk is dat ze een rol van betekenis kunnen vervullen bij onderzoek en toepassingen, met uitzondering van celkweekstudies.
Verder kan er binnen de cybriden een onderscheid gemaakt worden tussen cybri-den met een menselijke kern in een dierlijke cytoplast en een dierlijke kern in een menselijke cytoplast. Deze laatste categorie zullen we in de factsheet verder buiten beschouwing laten om een aantal redenen. Vooralsnog lijken met deze combinaties geen belangwekkende fundamentele vragen beantwoord te kunnen worden, terwijl er ook geen toepassingsmogelijkheden in het verschiet lijken te liggen. Zo wordt de kans dat deze mens-diercombinaties levensvatbaar zijn als gevolg van incompatibi-liteiten tussen kern en mitochondriaal DNA zeer klein geacht. Bovendien bevat het menselijk cytoplasma maar een zeer geringe hoeveelheid genetisch materiaal (in de mitochondriën) dat louter betrokken is bij de metabole functies van de mitochon-driën. Hierdoor kan er geen sprake van zijn dat via deze route een organisme met wezenlijke ‘menselijke’ eigenschappen zou kunnen ontstaan. Ten slotte dient voor een dergelijke cybride een menselijke zygote of rijpe eicel gebruikt te worden en deze zijn niet (of amper) beschikbaar voor andere dan reproductieve doeleinden.
2.3 Mens-diercombinaties op cellulair niveau
Op het niveau van het combineren van cellen van dieren en mensen zijn ook drie groepen te onderscheiden: mens-dierchimeren, xenotransplantatie van mens naar dier en xenotransplantatie van dier naar mens.
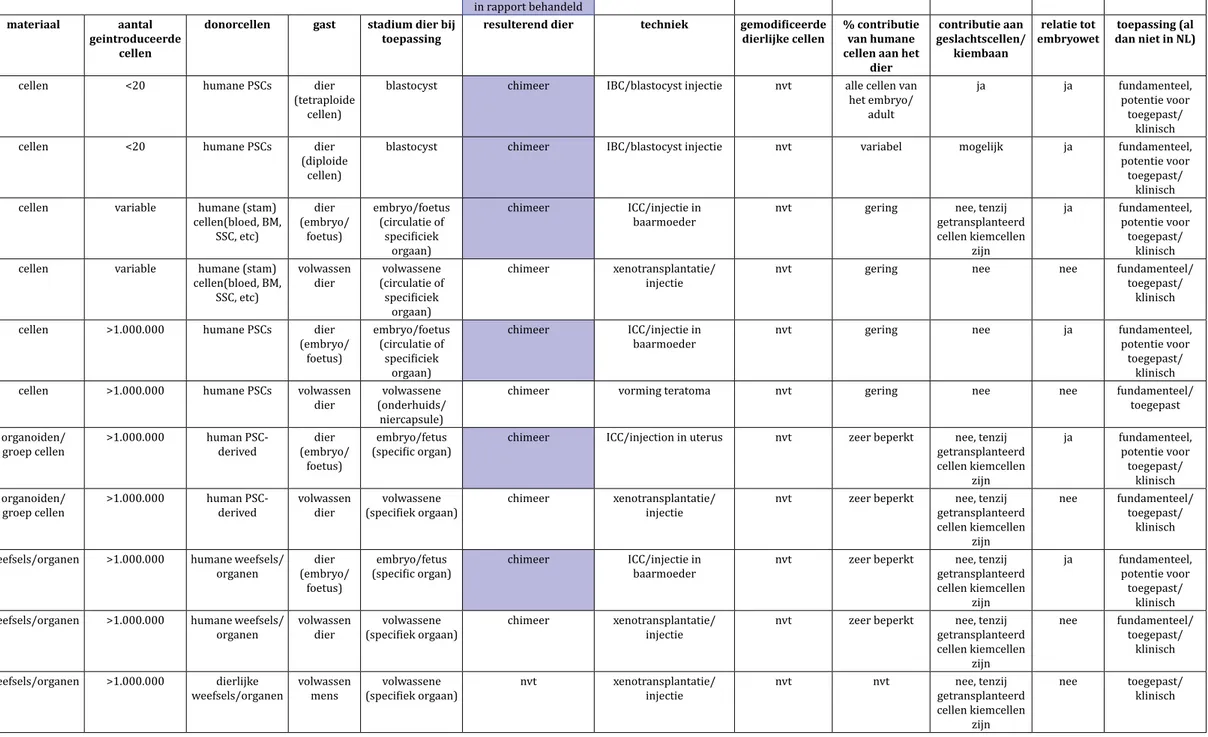
2.3.1 Mens-dierchimeren
Een chimeer is een komposiet organisme dat al vóór de geboorte bestaat uit celpo-pulaties afkomstig van meerdere bevruchte eicellen of cellen die daarvan afkom-stig zijn. Organismen waarin cellen van een ander organisme ná de geboorte zijn geïntroduceerd rekenen we dus niet tot de chimeren, maar beschouwen we als xenotransplantatie (zie paragraaf 2.3.1 en 2.3.2). Er kan verder nog een (enigszins
arbitraire) onderverdeling gemaakt worden in primair en secundair chimerisme, waarbij primair chimerisme het gevolg is van een combinatie van cellen die net na de bevruchting plaatsvindt, en secundair chimerisme waarbij de combinatie plaatsvindt nadat de organogenese (vorming van organen) is gestart, bij zoogdieren is dit na implantatie in de baarmoeder.
Chimerisme kan daarmee in diverse gradaties voorkomen: van een vrijwel gelijkma-tige bijdrage van de oorspronkelijke twee cellen/celpopulaties aan het resulterende organisme tot aan een kleine bijdrage van de ene populatie aan een specifiek type weefsel van een organisme dat verder uit de andere celpopulatie bestaat. Succes-volle chimeervorming is daarbij voor een groot deel afhankelijk van de evolutionaire verwantschap van twee organismen: hoe nauwer de verwantschap, hoe makkelijker combinatie plaatsvindt. Dit betekent voor mens-diercombinaties bijvoorbeeld dat de bijdrage van menselijke cellen aan een zich ontwikkelend muizenembryo klein is, terwijl dit bij nauwer verwante dieren zoals niet-humane primaten waarschijnlijk anders zal liggen.
In deze factsheet zullen we nader ingaan op de situatie waarin aan een dierlijk embryo menselijke cellen worden toegevoegd en niet andersom. De reden hiervoor is dat er momenteel geen onderzoek plaatsvindt naar het toevoegen van dierlijke cellen aan menselijke embryo’s en met deze aanpak lijken ook geen belangrijke vraagstuk-ken beantwoord te kunnen worden. Bovendien zijn er praktische en ethische/juridi-sche restricties bij het gebruik van humane (‘rest’)-embryo’s.
2.3.2 Xenotransplantatie van mens naar dier
Dit betreft dieren waarin menselijke cellen of orgaanfragmenten (bijvoorbeeld van de thymus) zijn getransplanteerd, die ofwel gaan functioneren als zelfstandig orgaan dan wel integraal deel gaan uitmaken van bestaand weefsel. We gebruiken hier als definitie voor xenotransplantatie het postnataal inbrengen van cellen of organen van de ene soort in de andere. In een dergelijke transplantatie bepaalt zowel de aard van de donorcel of het donororgaan alsook de plaats waar het transplantaat in de gastheer wordt geplaatst hoe het zal integreren in bestaande weefselstructuren en hoe het zal functioneren. Over het algemeen zal het transplantaat zich hechten op de plaats van implantatie, dit met uitzondering van cellen afgeleid van bijvoorbeeld een hematopoietisch systeem, die zich van nature door het gehele organisme versprei-den. Zo spreekt men van een ‘patient-derived xenograft’ wanneer het weefsel van een patiënt afkomstig is. Deze techniek wordt momenteel veel toegepast in onderzoek waarbij muizen ‘gehumaniseerd’ worden door bijvoorbeeld het vervangen van het hematopoietische systeem van de muis door dat van de mens. Dit wordt bijvoor-beeld ingezet om inzicht te krijgen in hoe het immuunsysteem van kankerpatiënten
15 2. mens-diercombinaties
effectiever kan worden geactiveerd om tumorcellen te elimineren. In paragraaf 3.4.2 wordt de voortgang van onderzoek op dit terrein geschetst.
2.3.3 Xenotransplantatie van dier naar mens
Er wordt al vele jaren onderzoek gedaan naar xenotransplantatie van dier naar mens als alternatief voor menselijke donororganen. Naast de overdracht van virussen en andere pathogenen is afstoting van het donororgaan door het menselijke afweersys-teem een groot obstakel. Om dit obstakel te overwinnen wordt onder meer gewerkt aan het genetisch ‘humaniseren’ van dierlijke organen. De recente transplantatie van een hart van een genetisch gemodificeerd varken in een baviaan dat vervolgens gedu-rende een halfjaar functioneel bleef, geeft aan dat gestaag voortgang wordt gemaakt. De transplantatie van hartkleppen van varkens naar mensen, wat al jaren routine-matig wordt gedaan, is volgens deze opvatting overigens geen xenotransplantatie, omdat het transplantaat alleen uit bindweefsel en niet uit levende cellen bestaat. In paragraaf 3.4.3 wordt de voortgang van onderzoek op dit terrein geschetst.
3. chimeren
3.1 Definities en technieken
Onder een embryo verstaan wij een cel of een samenhangend geheel van cellen, van dierlijke of menselijke oorsprong, die of dat in staat is opeenvolgende stadia van embryonale ontwikkeling door te maken. Hiermee hanteren wij de definitie zoals die over het algemeen bij wetenschappelijk onderzoek wordt gebruikt; deze is ruimer en wijkt af van de definitie die wordt gehanteerd in de Embryowet, die stelt dat een
menselijk embryo een cel of een samenhangend geheel van cellen is met het ver-mogen uit te groeien tot een mens (dus een volledige ontwikkeling doormaakt). Een
chimeer is een komposiet organisme, dat al vóór de geboorte bestaat uit celpopula-ties afkomstig van meerdere bevruchte eicellen of cellen die daarvan afkomstig zijn. Organismen waarin cellen van een ander organisme ná de geboorte zijn geïntrodu-ceerd rekenen we dus niet tot de chimeren. Deze organismen zijn ‘gexenotransplan-teerd’ (zie 2.3.2). Chimeren kunnen dus gezien worden als het tegenovergestelde van een monozygote tweeling, waarbij twee individuen juist gevormd worden uit één bevruchte eicel. Er kan verder nog een onderverdeling gemaakt worden in primair chimerisme, een combinatie van cellen net na bevruchting, en secundair chimerisme, waarbij de combinatie plaatsvindt nadat de organogenese is gestart (McLaren 1974). In praktische zin betekent dit een embryonale ontwikkeling langer dan veertien dagen, de grens die de Embryowet stelt voor humane embryo’s.
3.1.1 Primaire chimeren
Een primaire chimeer kan in uitzonderlijke gevallen spontaan ontstaan, ook bij mensen, wanneer twee embryo’s met elkaar fuseren in de eileider of baarmoeder, of
17 3. chimeren
bijvoorbeeld wanneer een eicel en een tweede poollichaampje elk worden bevrucht door een spermacel. Zulke spontane chimeren zijn niet visueel te onderscheiden van mensen geboren uit één bevruchte eicel, tenzij er een combinatie van een mannelijk en vrouwelijk embryo heeft plaatsgevonden, waarbij fertiliteitsproblemen kunnen ontstaan. Wanneer een combinatie plaatsvindt van twee verschillende diersoorten, is er sprake van interspecies chimeren. Interspecies chimeren komen van nature niet voor. De eerste experimentele interspecies chimeren werden gevormd door twee embryo’s van verschillende muizensoorten (Mus musculus en Mus caroli) te combineren. Hiervoor werden cellen van een M. caroli-embryo ingebracht in een blastocyste (een hol bolletje in de vroege embryonale ontwikkeling, vóór implantatie in de baarmoeder) van M. musculus (Rossant & Frels 1980). Later zijn door morula’s (embryonaal stadium van vóór de blastocyste) te aggregeren ook chimeren gemaakt van bijvoorbeeld schaap (Ovis aries) en geit (Capra hircus) (Fehilly et al. 1984), en Europees rund (Bos taurus) met Zeboe (Bos indicus) (Summers et al. 1983). Indien de gebruikte cellen van de embryo’s totipotent (cellen die in principe nog alle andere cellen kunnen vormen waaruit een organisme bestaat) zijn, dan kan chimerisme over het gehele dier verspreid zijn; in principe kunnen alle weefsels en organen bestaan uit een mengvorm van de twee diersoorten, al kan de individuele bijdrage aan speci-fieke weefsels sterk verschillen.
Een chimeer kan ook gevormd worden door pluripotente cellen (embryonale stam-cellen (ES): pluripotente stamstam-cellen afkomstig van de binnenste celmassa van een blastocyste) of geïnduceerde pluripotente stamcellen (iPS: gedifferentieerde cellen die geherprogrammeerd zijn, zodat ze zich gedragen als embryonale stamcellen) te combineren met een embryo. De laatste jaren is aanzienlijke voortgang geboekt bij het ontwikkelen van iPS-cellen van de mens (hiPS). Met name is meer inzicht gekre-gen in de verschillen tussen de vroege ontwikkelingsstadia (naïeve en ‘primed’ hiPS en hES), waarbij aangenomen wordt dat naïeve hiPS/hES een grotere capaciteit heb-ben om bij te dragen aan de ontwikkeling van een chimeer organisme.
De bijdrage aan de vorming van een orgaan kan gestuurd worden als een van de twee bij elkaar gevoegde celpopulaties, afkomstig van verschillende soorten, dit orgaan niet kan vormen. Zo zijn pluripotente stamcellen van een rat gecombineerd met een embryo (blastocystestadium) van een muis die door middel van genetische modi-ficatie geen alvleesklier kon vormen. In de gevormde chimere muis waren diverse organen en weefsels opgebouwd uit cellen van rat en muis, maar de alvleesklier werd vrijwel geheel gevormd uit rattencellen. Dit principe wordt interspecies blastocyst
complementation (IBC) genoemd (Kobayashi et al. 2010). Met dezelfde techniek is
het wellicht mogelijk om menselijke weefsels en organen te vormen in een dier zoals een varken of een rund. Als de gebruikte cellen patiëntspecifiek zijn (hiPS, geherpro-grammeerde ‘volwassen’ cellen), is het in theorie mogelijk om een orgaan te vormen dat getransplanteerd kan worden naar de patiënt zonder dat deze door het afweer-systeem wordt afgestoten.
Vooralsnog zijn voor de ontwikkeling van een primair chimeer organisme vroege dierlijke embryo’s nodig als fusiepartner. Met de ontwikkeling van trophectoderm-stamcellen (voorlopercellen van onder andere de placenta) (Kime et al. 2018) wordt het wellicht mogelijk om vroege embryonale structuren te vormen zonder dat daar embryo’s voor nodig zijn. Na implantatie in de baarmoeder zouden deze kunnen resulteren in een levensvatbaar dier. Dat zou betekenen dat chimeren geheel zonder het gebruik van geslachtscellen (eicellen en sperma) tot stand zouden kunnen wor-den gebracht.
3.1.2 Secundaire chimeren
Bij een secundair chimeer worden menselijke cellen die zich al verder ontwikkeld hebben en nog de capaciteit hebben om één of meer weefsels te vormen geïnjecteerd in het zich ontwikkelende dierlijke embryo. Er is sprake van een gradueel onder-scheid met primaire chimeren, waarbij van secundair chimerisme gesproken wordt vanaf het moment van de vorming van organen. Als gevolg van secundair chimerisme kunnen deze menselijke cellen integreren in een of enkele weefsels en kan hun func-tionaliteit in dat weefsel bestudeerd worden. Tot weefselstamcellen gedifferentieerde hiPS- of organoïde culturen die zijn verkregen van adulte weefsels kunnen daarbij de uitgangscellen leveren. Dergelijke cellen kunnen worden ingebracht in een dierlijk embryo in een later stadium van ontwikkeling (in utero), waarbij dat embryo zodanig genetisch is gemodificeerd, dat het zelf niet meer in staat is het betreffende weefsel te vormen. Men spreekt dan van interspecies conceptus complementation (ICC), een variant van IBC (Nagashima & Matsunari 2016). Een voor de hand liggende toepas-sing van een secundaire mens-menschimeer zou transplantatie van hematopoieti-sche stamcellen zijn in een zich ontwikkelende foetus met een genetisch defect in het beta-globine gen of factor VIII. Met in-uterotransplantatie van allogene mesenchy-male stamcellen in foetussen met osteogenesis imperfecta is reeds geëxperimenteerd (Götherstrom et al. 2014).
De omgekeerde strategie, waarbij dierlijke cellen aan menselijke embryo’s worden toegevoegd, wordt voor zover de commissie bekend niet toegepast. Het valt echter niet uit te sluiten dat met verbeterde methoden om de vroege ontwikkeling van menselijke embryo’s in vitro te bestuderen deze benadering inzicht kan geven in de capaciteit van bijvoorbeeld niet-humane primaatstamcellen om deel te nemen aan de vroege ontwikkeling van humane embryo’s en de factoren die daarbij een rol spelen.
19 3. chimeren
3.2. Wetenschappelijke ontwikkelingen
3.2.1 Stand van het onderzoek
Veel onderzoek heeft zich de laatste tien jaar geconcentreerd op het vaststellen van de ontwikkelingscompetentie van pluripotente stamcellen (ES en iPS). Hiervoor wer-den pluripotente cellen (ES en iPS) van muizen in een blastocystestadium-embryo geïnjecteerd en het embryo in een schijnzwangere dragermuis gebracht om na de geboorte te onderzoeken in hoeverre de pluripotente cellen hadden bijgedragen aan de vorming van de verschillende weefsels en organen. Om de ontwikkelingscompe-tentie van humane pluripotente cellen te toetsen zijn hES en hiPS ingebracht in mui-zenembryo’s en de ontwikkeling van de chimeren is halverwege de dracht beëindigd, zodat geen mens-muischimeren konden worden geboren (James et al. 2016; Gafni et al. 2013; Theunissen et al. 2014). De bijdrage van de humane cellen aan de vorming van deze mens-dierchimeren bleek zeer beperkt.
Pluripotente cellen van een rat zijn in staat een levensvatbare chimeer te vormen wanneer ze gecombineerd worden met een muizenembryo en vice versa (Kobayashi et al. 2010). Muis en rat staan echter evolutionair en genetisch gezien dicht bij elkaar en het is de vraag of cellen van organismen die evolutionair verder uit elkaar staan voldoende met elkaar kunnen communiceren om een chimeer te vormen. Zo bleken pluripotente cellen van muis en rat niet in staat om bij te dragen aan de vorming van een chimeer wanneer ze gecombineerd werden met een varkensembryo (Wu et al. 2017). Wanneer humane iPS (hiPS)-cellen werden ingebracht in in vivo geprodu-ceerde varkensblastocysten (diploïd), de potentiële chimeren vervolgens werden ingebracht in de baarmoeders van surrogaatzeugen en de embryo’s na 21-28 dagen werden geanalyseerd (draagtijd varkens is ca. 115 dagen), bleek dat de contributie van de hiPS-cellen aan de embryo’s extreem laag was (Wu et al. 2017).
Gebruikmakende van IBC of ICC kan in theorie een orgaan met uitsluitend humane cellen worden gevormd in een dier (Nagashima & Matsunari 2016). Hiervoor lijkt het varken (en het rund) als dier het meest geschikt, vanwege de overeenkomstige anatomie en orgaangrootte. Een bijkomend voordeel van deze diersoorten is dat voor onderzoek embryo’s verkregen kunnen worden door eicellen uit slachthuisovaria in vitro te bevruchten. Met deze techniek zijn Japanse onderzoekers erin geslaagd een functionele varkensalvleesklier te maken door injectie van embryonale cellen van een varken in een blastocyste van een varken dat door genetische modificatie niet in staat was een alvleesklier te vormen (Matsunari et al. 2013). Omdat bloedvaten, maar ook andere celtypen, in een orgaan voor afstotingsreacties kunnen zorgen indien ze afkomstig zijn van het dier waarin het orgaan gevormd wordt, zal moeten worden onderzocht of ook deze componenten gevormd kunnen worden vanuit de ingebrachte humane cellen. In een muizenmodel dat door middel van genetische
modificatie geen bloedvaten kon vormen, bleken rattenpluripotente cellen echter niet in staat om het volledige bloedvatstelsel te vervangen, terwijl muizenpluripo-tente cellen dat wel konden (Takabe et al. 2018; Roelen 2018). Dit geeft aan dat zelfs bij nauw verwante dieren cellen niet zomaar uitwisselbaar zijn. Een belangrijke vraag blijft dan ook in hoeverre humane pluripotente cellen in een varkens- (of run-der)omgeving wel in staat zijn om deel te nemen aan de orgaanvorming.
3.2.2 Te verwachten wetenschappelijke ontwikkelingen
Primaire chimeren
Een groot struikelblok bij het onderzoek naar primaire mens-dierchimeren is momenteel nog de onzekerheid in hoeverre humane ES- en iPS-cellen hetzelfde ontwikkelingsstadium hebben als de pluripotente cel zoals aanwezig in het vroege preïmplantatie-embryo. Dit wordt van groot belang geacht voor het tot wasdom brengen van deze techniek (Wu et al. 2016). Op de korte termijn zal dit betekenen dat weefselkweekcondities voor humane iPS- en ES-cellen verder geoptimaliseerd dienen te worden om de ‘naïeve’ pluripotente staat van deze celtypen te induceren en te behouden. Ook dienen de relevante signaaltransductiepaden van deze hiPS- en hES-cellijnen vergeleken te worden met die van het zich in vivo ontwikkelende embryo.
Daarnaast dient het onderzoek zich te richten op de interspeciescommunicatie van verschillende celtypen in wisselende dier-dier- en mens-diercombinaties door mid-del van iPS- en ES-celinjecties in blastocysten van verschillende diersoorten. Dit zal leiden tot een beter begrip van de compatibiliteit van signaaltransductiepaden, snel-heid van celdeling en repressie van apoptose (geprogrammeerde celdood), en kan zicht geven op wat nodig is om effectieve chimeervorming mogelijk te maken. Inade-quate celcommunicatie zou opgeheven kunnen worden door middel van genome editing van gastheergenen die coderen voor noodzakelijke liganden of receptoren, waardoor de juiste interacties tussen beide diersoorten bewerkstelligd worden. Zoals hierboven vermeld, laten studies zien dat primaire chimeervorming voor de anatomisch en morfologisch meest geschikte modellen zoals het varken nog zeer beperkt is, althans met de humane iPS (hiPS)- en ES (hES)-cellen zoals momenteel beschikbaar. Deze incompatibiliteit zou het gevolg kunnen zijn van het onvoldoende ‘naïef’ zijn van de hiPS/hES-cellen, een te grote evolutionaire afstand tussen de mens en de voor dit onderzoek gebruikte gastheerembryo’s, waardoor belang-rijke signaaltransductiepaden niet meer goed functioneren of van verschillen in celcyclusregulatie waardoor humane cellen niet synchroon meeontwikkelen in het zich ontwikkelende gastheerembryo. Het is overigens mogelijk dat de waarge-nomen mens-dierincompatibiliteit alleen betrekking heeft op de vroege fase van
21 3. chimeren
embryogenese, bijvoorbeeld voor de vorming van de kiemlagen, maar mogelijk niet voor de latere organogenese.
De komende jaren zal ongetwijfeld veel onderzoek verricht worden naar deze incompatibiliteit, bijvoorbeeld door gebruik van blastocysten van verschillende diersoorten die op de evolutionaire ladder dichterbij of juist verder van de mens af staan. De recente ontwikkelingen op het gebied van in vitro gekweekte blastoïde en gastruloīde (de fase na de blastoïde fase waarin organogenese van weefsels begint) structuren zijn indrukwekkend en stellen wetenschappers nu in staat om interspe-cies chimeren in vitro te bestuderen. Door trophoblast en embryonale stamcellen samen te groeien en te differentiëren, eventueel in combinatie met extra-embryonale endodermcellen (binnenste kiemblad), kan het vroege ontwikkelingsstadium van chimeercombinaties worden nagebootst en vergeleken met in-vivo-experimenten. Hiertoe zullen wel van de verschillende diersoorten die als gastheer kunnen die-nen trophoblast (voorloper van placenta en vruchtvliezen) en ES-cellijdie-nen gemaakt dienen te worden. Vooralsnog is men er niet in geslaagd deze van varken of rund te verkrijgen.
De bijdrage van donorcellen aan interspecies modelsystemen blijkt in grote mate afhankelijk te zijn van het vrijmaken van een ‘niche’ waar de donorcellen zich kun-nen nestelen zonder directe competitie met gastheercellen. Voor de alvleesklier is dit reeds beschreven (zie paragraaf 3.2.1). Op basis van de kennis in de ontwikke-lings- en celbiologie zullen de juiste targetgenen geïdentificeerd moeten worden om de ontwikkeling van specifieke organen te verhinderen. Naast cruciale genen voor ontwikkeling van bijvoorbeeld nier, hart en pancreas zal ook gezocht worden naar combinaties waarmee bijvoorbeeld ook het endotheel (bloedvatcellen) van dieren wordt vervangen of het endotheel met genetische modificatietechnieken zodanig wordt ‘gehumaniseerd’, dat afstotingsreacties tegen deze cellen bij orgaantransplan-tatie kunnen worden voorkomen. De CRISPR/Cas9 genome-editingtechnologie zal ook ingezet moeten worden om retrovirale en andere potentieel gevaarlijke geneti-sche elementen, zoals PERVs in varkens, systematisch te verwijderen om zodoende een virusvrije gastheer te genereren. Specifieke voorzorgen zijn ook noodzakelijk om risico’s van zoönose (overdraagbare ziekten van dier naar mens) en prionen (ziek-makende eiwitstructuren) te minimaliseren. Ook in de onderzoeksfase dient met dit risico rekening te worden gehouden. Daarnaast kan de CRISPR/Cas9 genome-edi-tingtechnologie worden ingezet om humane ES- en iPS-cellen zodanig te modificeren, dat voorkomen wordt dat menselijke cellen kunnen bijdragen aan de ontwikkeling van menselijk hersenweefsel of gameten in de chimeer, dit vanuit de gedachte dat dit ethisch meer acceptabel zou zijn. Onderzoek aan chimeren op neuronaal niveau zou echter belangrijke inzichten kunnen opleveren over ziekten zoals ALS.
Secundaire chimeren
Ook voor secundaire chimeren worden verschillende mens-diercombinaties onder-zocht door middel van in-vivostudies waarbij humane cellen eerst in vitro worden gedifferentieerd om ze in een later stadium in de gastheer in te brengen. Te verwach-ten valt dat hier de belemmeringen om chimere organen te vormen minder groot zullen zijn. Dit wordt ondersteund door de observatie dat weefselspecifieke stamcel-len substantieel kunnen participeren in specifieke organen van een andere diersoort. Onderzoek met secundaire chimeren kan belangrijke nieuwe inzichten geven in de functie en eventuele defecten in menselijke cellen en biedt perspectieven bij de bestudering van ernstige aandoeningen en de ontwikkeling van nieuwe interventies. Zo zou het de geschiktheid van humane stamcellijnen voor de toepassing bij de mens kunnen valideren. Injectie in de baarmoeder van een dierlijke gastheer heeft dan het voordeel dat deze cellen niet worden geëlimineerd door het adaptieve immuun-systeem dat zich na de geboorte ontwikkelt. Men kan hier bijvoorbeeld denken aan alvleesklier β-cellen, levercellen, maar in feite alle celtypen die geheel in celcultuur kunnen worden gegenereerd en, eenmaal gevalideerd, middels injectie in de patiënt direct kunnen worden ingezet voor genezingsdoeleinden waarvoor geen complex driedimensionaal orgaan de novo behoeft te worden gevormd (zoals het geval is bij hart of nieren).
3.3 Toepassingen voor zorg en gezondheid
Resultaten uit onderzoek met mens-dierchimeren zullen nieuwe inzichten opleveren die de effectievere behandeling van aandoeningen mogelijk maken. De aard van het wetenschappelijk onderzoek is zodanig, dat moeilijk valt te voorspellen voor welke aandoeningen dat zal zijn en wat de behandeling in zou houden. Het zou op elk van de volgende terreinen kunnen liggen, maar ook daarbuiten: de ontwikkeling van nieuwe medische interventies, partiële regeneratie van beschadigde organen of volle-dige vervanging.
Voor het ontwikkelen en testen van medische interventies zouden mens-dierchime-ren ontwikkeld kunnen worden die bepaalde menselijke weefsels hebben waarop een medische interventie dient aan te grijpen of juist niet. Dit als alternatief voor of voorstadium van onderzoek bij mensen. Hierbij valt te denken aan het bestuderen van de werking en bijwerkingen van medicamenteuze interventies, bijvoorbeeld levertoxiciteitstesten, of het testen van stamcellen bedoeld voor therapeutische toepassing. Het kan hier gaan om zowel wetenschappelijk onderzoek gericht op interventies voor grote groepen patiënten als testen bedoeld om een behandeling af te stemmen op een individuele patiënt.
Het succesvol produceren van menselijke organen in mens-dierchimeren door mid-del van blastocyst complementation of de gerichte productie van secundaire chimeren
23 3. chimeren
zoals eerder beschreven, vereist dat eerst een reeks complexe biologische proble-men wordt opgelost. Behalve dat het gebruik van dieren met organen van ongeveer dezelfde grootte als bij de mens een relevante overweging kan zijn, moet ook het juiste orgaan ontbreken in het donordier, hetgeen genetische modificatie van het dier vereist (Kobayashi et al. 2010; Matsunari et al. 2013; Usui et al. 2012; Yamaguchi et al. 2017; Hamanaka et al. 2018).
Ook heeft het de voorkeur dat de bloedvaten in het orgaan afkomstig zijn van de mens en niet van het dier (Hamanaka et al. 2018). Het genereren in dieren van afsto-tingsvrije organen geschikt voor transplantatie bij de mens is het hoofddoel van dit onderzoek: patiënteigen hiPS-cellen zullen nodig zijn om een lichaamseigen (autoloog) orgaan te maken met eigen bloedvaten dat niet afgestoten wordt. Een eventueel alternatief is het genereren van organen in chimeren met ‘universele’ donor-(hiPS-)cellijnen of met hES- of hiPS-cellen die HLA gematcht kunnen worden met de patiënt, vergelijkbaar met de wijze waarop dat nu gebeurt bij conventionele heterologe donororganen. Het immuunsysteem van de ontvanger ‘specifiek’ tolerant maken voor het getransplanteerde orgaan zou eveneens een bijdrage kunnen leveren. Het is twijfelachtig of dit allemaal realiseerbaar is bij chimeren gevormd uit dier-soorten met een relatief grote evolutionaire afstand (mens en varken of mens en schaap). Naar verwachting zal de kans van slagen groter zijn wanneer combinaties worden gemaakt van zoogdieren die evolutionair dichter bij elkaar staan. Voor de mens betekent dit de niet-menselijke primaten. Al met al lijkt het produceren van transplanteerbare organen middels mens-dierchimeren een langetermijndoel dat waarschijnlijk niet binnen de komende tien jaar kan worden gerealiseerd, ook al zijn onverwachte doorbraken nooit uit te sluiten.
3.4 Alternatieve methoden
3.4.1 Celkweekstudies en in-silicomodellering
Om kennis te verkrijgen van embryonale ontwikkeling van de mens en inzicht te ver-garen in hoe defecten ontstaan, zijn er voor primaire en secundaire mens-dierchime-ren geen goede alternatieven wanneer het de studie van organogenese betreft. Wel is er een reeks alternatieve benaderingen:
• Het kweken van menselijke embryo’s in het laboratorium. Dit is momenteel in Nederland en veel andere landen toegestaan tot rond dag 13/14 na fertilisatie en biedt belangrijke inzichten in hoe de vroege embryonale ontwikkeling van een menselijk embryo wordt gestuurd (Deglincerti et al. 2016; Shahbazi et al. 2018). • Het bestuderen van de weefselvorming van organoïden in celkweek.
waarvan de eigenschappen kunnen worden bestudeerd en die kunnen dienen voor genetische screens en het testen van interventies.
• Een deel van de vraagstellingen kunnen ook worden bestudeerd in al dan niet genetisch gemodificeerde dieren, waarbij de laatste de mogelijkheid bieden om bijvoorbeeld de consequenties van genetische defecten zoals die voorkomen bij de mens te analyseren.
• In toenemende mate worden biologische systemen ook ‘vertaald’ naar computer-modellen (in silico) die – veelal in combinatie met experimentele systemen – kun-nen bijdragen aan onze kennisverdieping op dit gebied.
Wel heeft elk van deze methoden zijn eigen specifieke wetenschappelijke of maat-schappelijke beperkingen.
3.4.2 enotransplantatie van mens naar dier
Menselijke cellen, weefselstamcellen en ook fragmenten van organen kunnen veelal goed worden gepropageerd in immuundeficiënte dieren. Immuundeficiënte muizen blijken hier geschikt voor. Met name voor onderzoek is dit een belangrijke benadering. Zo zijn humane iPS- (hiPS-)cellen in vitro gedifferentieerd tot een beginnende lever, een leverknop. Deze leverknop is vervolgens getransplanteerd naar de lever van een immuundeficiënte muis waar deze cellen de juiste leverfuncties uitoefenden (Takebe et al. 2013). Een mogelijk nadeel van een op deze manier verkregen orgaan is dat het niet uitsluitend uit humane cellen zal bestaan. Dit zou echter kunnen worden onder-vangen door levercellen van de muis middels een conditionele genetische modifica-tie op een gewenst moment te elimineren. Op deze wijze kan de functionaliteit van humane leverstamcellen worden bestudeerd.
Een ander voorbeeld van de integratie van menselijke cellen in een weefsel van een dier is de injectie van astrocyt-voorlopercellen (een bepaalde zenuwcel) in de herse-nen van pasgeboren muizen. Toen deze muizen volwassen waren geworden, bleken de menselijke astrocyten nog volop aanwezig en bij te dragen aan de functionaliteit van het bestaande neurale netwerk van de muizenhersenen (Han et al. 2013). Ze verhoogden de ‘long-term potentiation’, een maatstaf voor de capaciteit van neurale circuits. Dit kwam ook tot uiting in een verbeterd leervermogen van deze muizen. Dit type orgaanspecifieke transplantaties kan dus inzicht verschaffen in specifieke func-tionaliteiten van humane cellen in de context van een functioneel orgaan en maakt de daaraan ten grondslag liggende celbiologische en biochemische processen toeganke-lijk voor studie.
Ook transplantatie van menselijke orgaanfragmenten kan resulteren in een functio-neel xenotransplantaat. Orgaanfragmenten getransplanteerd in immuundeficiënte
25 3. chimeren
dieren kunnen daar als een menseigen orgaan blijven functioneren (bijv. thymus) en kunnen zo dienen om functionaliteiten of de effectiviteit respectievelijk toxiciteit van medicamenteuze behandelingen te testen.
Wellicht kan xenotransplantatie van mens naar dier ook een alternatief vormen voor de toepassing van chimeren bij de groei van transplantatieorganen. Dan moet deze techniek toepasbaar worden gemaakt voor dieren zoals varken of rund. Het dier zou hier dan als tijdelijke omgeving dienen voor de uitgroei van een orgaan totdat het getransplanteerd kan worden naar de mens. Daar doen zich dan wel ook de proble-men voor die bij ICC (paragraaf 3.1.2) zijn genoemd.
3.4.3 Xenotransplantatie van dier naar mens
We hebben een chimeer eerder gedefinieerd als een komposiet organisme dat al vóór de geboorte bestaat uit celpopulaties afkomstig van meerdere bevruchte eicellen of cellen die daarvan afkomstig zijn. Een voor de hand liggend alternatief voor mens-dierchimeren is de introductie van organen van dierlijke oorsprong bij de mens ná de geboorte.
Daarvoor is een vereiste dat deze organen zodanig ‘vermenselijkt’ zijn, dat immuno-logische afstoting kan worden voorkomen. De volgende onderzoeksterreinen verdie-nen hier aandacht:
a. Het genetisch modificeren van dieren (bijv. varken) waarbij genen die coderen voor eiwitten die bijdragen aan afstotingsreacties (zoals glycosyltransferases) worden geëlimineerd of genen die actief beschermen tegen afstoting worden toegevoegd aan het diergenoom. Additionele eliminatie van genen die coderen voor endogene virussen, mobiele DNA-elementen en prionen die de ontvanger van het orgaan zouden kunnen infecteren, is eveneens vereist.
b. Immunosuppressie. Parallel aan de genetische modificatie van dieren om organen geschikt te maken of te optimaliseren voor toepassing bij de mens is onderzoek gaande naar hoe immunologische afstoting voorkomen kan worden door her-programmering van het immuunsysteem van de orgaanontvanger. Er wordt veel onderzoek verricht naar het functioneren van het immuunsysteem, enerzijds om het te mobiliseren tegen ziekten zoals kanker, anderzijds om veelvoorkomende reactiviteiten tegen eigen weefsels (auto-immuunziekten) te mitigeren. In principe zou naast immunosuppressie vervanging van het bestaande immuunsysteem door een nieuw lichaamseigen systeem middels chemotherapie en stamceltransplantatie zoals wordt geëxploreerd als behandelingsmethode van multiple sclerose ook een bijdrage kunnen leveren om afstoting van een donororgaan tegen te gaan.
3.4.4 Orgaantransplantatie menselijke donoren
Orgaantransplantatie bij mensen is op dit moment de enige oplossing voor een aantal, vaak levensbedreigende, gezondheidsproblemen waarbij essentiële organen zoals hart, long, nier, alvleesklier of lever niet of nauwelijks functioneren. Vervanging van deze organen door transplantatie van een donororgaan van een levende (bijv. bij nier, long en harttransplantatie) of overleden donor biedt dikwijls jarenlang herstel en een goede kwaliteit van leven zonder medisch-technische ondersteuning zoals nierdialyse, zuurstofvoorziening of een kunsthart. Orgaantransplantatie kent echter ook nog steeds twee serieuze problemen: afstoting van het orgaan (en de bijwerkin-gen van antiafstotingsmiddelen zoals kanker) en een tekort aan donoren.
3.4.5 Ontwikkeling van devices
Op het gebied van de ontwikkeling van kunstorganen (devices) en andere technologi-sche hulpmiddelen worden gestaag vorderingen geboekt en langdurige toepassingen liggen in het verschiet voor orgaansystemen zoals nier en hart.
3.4.6 Toepassing van stamcellen
Transplantatie van stamcellen zal naar verwachting een alternatief kunnen zijn voor transplantatie van organen die zouden kunnen worden gerevitaliseerd door de kolo-nisatie met stamcellen en die voor hun functioneren niet afhankelijk zijn van de de
novo vorming van complexe structuren (zoals dit wel het geval is bij hart, long, nier).
Hiervoor zijn in principe drie mogelijke stamcelbronnen beschikbaar: adulte stam-cellen (waaronder stamstam-cellen van navelstrengbloed, huidstamstam-cellen, darmstamcel-len, hoornvliesstamceldarmstamcel-len, enz.), humane embryonale stamcellen (hES) of geïndu-ceerde pluripotente stamcellen (hiPS). Adulte stamcellen vormen alleen cellen in het orgaan waar ze uit voortkomen en over het algemeen enkel de orgaanspecifieke epitheel- maar niet de stromale (bindweefsel- en bloedvat)component. Pluripotente stamcellen daarentegen zijn mogelijk breder inzetbaar, omdat ze – indien ze de juiste differentiatiesignalen ontvangen – in principe alle celtypen in het menselijk lichaam kunnen vormen.
a. hiPS- en hES-cellen: Het lichaam heeft tussen de tweehonderd en driehonderd ver-schillende celtypen. Hoewel pluripotente stamcellen in principe al deze celtypen kunnen vormen, zijn er ook risico’s verbonden aan het gebruik van pluripotente stamcellen voor celtherapie, die mogelijk ook gelden voor chimeren. Ongedif-ferentieerde pluripotente stamcellen kunnen mogelijk teratomen (goedaardige tumoren) of teratocarcinomen (kwaadaardige tumoren) vormen. Desondanks
27 3. chimeren
worden zowel in vitro gedifferentieerde hiPS- als hES-cellen gebruikt in klinische
trials voor de behandeling van ouderdomsblindheid; de eerste uitkomsten laten
weinig risico’s zien, stabilisatie van de achteruitgang van het zicht en in een twee-tal gevallen zelfs verbetering van het zicht (da Cruz et al. 2018). In de komende jaren zijn klinische trials te verwachten met transplantatie van dopaminerge neu-ronen afkomstig van pluripotente stamcellen naar de hersenen van parkinsonpa-tiënten en op termijn de transplantatie van β-cellen als alternatief voor medica-menteuze therapie of de transplantatie van een alvleesklier bij diabetes mellitus. b. Adulte stamcellen kunnen alleen cellen vormen van het oorspronkelijke orgaan
of van de oorspronkelijke kiemlaag. In de nabije toekomst is er een aantal veel-belovende toepassingen voor adulte stamcellen, waarvan sommige zelfs al in klinische trials getoetst worden; deze zouden kunnen bijdragen om een deel van het donortekort op te lossen. Voorbeelden zijn: ‘limbale’ stamcellen in het oog waaruit transplanteerbaar hoornvlies gemaakt kan worden. Dit hoornvlies is in staat oogschade ontstaan na brandwonden volledig te herstellen, zonder dat afstoting optreedt (Rama et al. 2010). Een tweede voorbeeld is de combinatie van huidstamcellen met gentherapie voor de behandeling van een erfelijke huidziekte,
epidermolysis bullosa (Hirsch et al. 2017). Met deze therapie was het mogelijk om
meer dan 70% van de huid volledig te herstellen. Hematopoietische stamcellen van zowel beenmerg als navelstrengbloed voor behandeling van bloedziekten zijn al tientallen jaren de meest bekende en klinisch toegepaste adulte stamcellen voor succesvolle stamceltherapie. Andere celtherapieën die onderzocht worden en in aanmerking komen voor routinematige toepassing zijn mesenchymale cel-len, huidepitheel, insuline producerende β-celcel-len, retinaepitheel, L-dopa produ-cerende neuronale cellen en levercellen. Een voordeel van adulte stamcellen is dat het onwaarschijnlijk is dat ze tumoren vormen na transplantatie. Aangezien deze cellen in celcultuur kunnen worden vermeerderd, biedt dit ook de optie om eventuele genetische defecten in dergelijke cellen te corrigeren middels genome-editingtechnieken. Echter, niet alle organen hebben een stamcelpopulatie (bijv. het hart) en het kan ook moeilijk zijn om ze te verkrijgen (bijv. de hersenen). HiPSC, hESC en adulte stamcellen (organoïden) alsook gedifferentieerde cellen kun-nen worden ingezet voor orgaan-printingtechnieken waarbij een 3D-structuur wordt opgebouwd met verschillende celtypen. Een voorgevormde bio-afbreekbare matrix kan daarbij als structurele ondersteuning dienen (Ong et al. 2018).
3.4.7 Regeneratie van organen
Een meer fundamentele onderzoeksrichting betreft het inzicht verkrijgen in het regeneratieproces van complexe organen. Een aantal diersoorten zoals platwormen heeft het vermogen om ledematen en andere structuren na beschadiging of verwij-dering te regenereren (Reddien 2018). De vraag is of zo’n regeneratieve functie in
weefselstamcellen van diersoorten die dit vermogen niet hebben of hebben verloren gedurende de evolutie kan worden hersteld en of daarmee (in de verre toekomst) als het ware in vivo een patiënt zelf een nieuw functioneel orgaan kan vormen.
Voor eenvoudige weefsels zoals huid komt ook in-vivoherprogrammering in zicht zoals recentelijk beschreven voor het herstel van epitheel vanuit in een wond aanwe-zige mesenchymale cellen bij de muis (Kurita et al. 2018).
3.5 Ethische overwegingen
De KNAW acht het van belang ook een aantal ethische vragen en overwegingen met betrekking tot mens-diercombinaties op cellulair niveau aan te reiken voor de voorgenomen nadere reflectie door (onder andere) de Gezondheidsraad (Jochemsen et al. 2017). Dit mede omdat de reikwijdte van artikel 25b van de Embryowet (‘een uit menselijke en dierlijke dan wel alleen menselijke embryonale cellen tot stand gebrachte chimère zich langer dan veertien dagen te laten ontwikkelen of in te bren-gen in een mens of een dier’) niet geheel duidelijk lijkt te zijn. In de Tweede Evalu-atie van de Embryowet werd al de volgende aanbeveling gedaan: ‘De wetgever moet helderheid scheppen over de vraag of art. 25b EW van toepassing is op onderzoek waarvoor het nodig is mens-dier chimeren die zijn ontstaan door transplantatie van (ES- of) iPS-cellen in een dierlijk embryo, in de baarmoeder van een dier te plaatsen. Indien dat het geval is, moet de wetgever zich bezinnen op de vraag of een catego-risch verbod niet te streng is, gezien het mogelijk grote belang van het onderzoek gericht op de ontwikkeling van therapeutische toepassing van IBC. Is artikel 25b niet van toepassing, dan moet de wetgever zich afvragen of regulering van dergelijk onderzoek wenselijk is.’ In de volgende paragraaf worden hiertoe diverse vragen opgeworpen en overwegingen aangereikt.
3.5.1 Mens-dierchimeren
• Is de definitie van embryo volgens de Embryowet van toepassing op mens-dier-chimeren? Zo ja, op welke soort chimeren precies?
• Is de bovengrens die aan de ontwikkeling van een menselijk embryo wordt gesteld in de Embryowet van veertien dagen ook voor chimeren een relevante grens? Zo niet, is het dan nodig een andere grens te stellen en welke? In dagen of in termen van ontwikkelingsstadia zoals innesteling in de baarmoeder/primaire versus secundaire chimeren, geboren worden, reproductieve mogelijkheden? Dit mede in het licht van de ontwikkeling van verbeterde in-vitrotechnieken, waardoor ook latere stadia van embryo-ontwikkeling toegankelijk worden voor onderzoek.
29 3. chimeren
wordt in de maatschappelijke en ethische discussie bepleit als alternatief voor
interspecies blastocyst complementation, een variant van primaire chimeren, met
het argument dat dit minder ‘vermenselijkte’ dieren zou opleveren (Jochemsen et al. 2017). Maar is het onderscheid tussen primaire en secundaire chimeren hier wel van wezenlijk belang? Er is wetenschappelijk gezien namelijk een gradueel onderscheid tussen primaire en secundaire chimeren, waarbij de mate waarin en de wijze waarop celpopulaties bijdragen aan het organisme niet noodzakelijk samenhangen met dit onderscheid.
• Maakt het uit in welke mate en aan welke soort weefsels de menselijke celpopula-tie bijdraagt aan de chimeer? Zijn er eigenschappen die we als wezenlijk mense-lijk willen beschouwen? Is dat reden om deze eigenschappen uit te willen sluiten? Het uitsluiten van een bijdrage van menselijke cellen aan het brein van dieren zou chimeervorming bijvoorbeeld ongeschikt maken voor het ontwikkelen van een in-vivomodel voor de bestudering van hersenziekten zoals ALS. En moet de ont-wikkeling van menselijke gameten in de dierlijke ontvanger worden voorkomen (Dondorp & Johnson 2017)? Of kan de achterliggende zorg (voor zover überhaupt realistisch) worden weggenomen door te voorkomen dat chimeren zich voort-planten?
• Omdat diersoorten zoals varken en rund waarschijnlijk evolutionair te ver van de mens afstaan voor kansrijk onderzoek naar en toepassing van chimeervorming, komen niet-humane primaten als ontvanger van menselijke cellen c.q. bron van menselijke organen in beeld. Is dit toelaatbaar en zo ja, in welke gevallen en tot welk stadium van ontwikkeling?
• Hoeveel onderzoek is nodig om te kunnen concluderen dat het transplanteren (bij patiënten) van via chimeren verkregen organen veilig is met betrekking tot de overdracht van virussen en andere zoönosen?
• De ontwikkeling van chimeren zou er in de toekomst toe kunnen leiden dat trans-plantatieorganen niet alleen voor bestrijding van ziekte en voortijdig overlijden gebruikt kunnen worden, maar ook voor levensverlenging en ‘mensverbetering’. Hoe dient dit meegewogen te worden?
• Is de bescherming van de menselijke donor van het materiaal adequaat geregeld, denk bijvoorbeeld aan privacy, erfelijke gegevens en geïnformeerde toestemming? 3.5.2 Alternatieven
Afhankelijk van de vraag- en doelstelling zijn er verschillende alternatieven voor het doen van onderzoek naar en de toepassing van chimeren. Deze alternatieven roepen echter vaak zelf ook ethische vragen op. Hierbij een drietal voorbeelden:
• Ten eerste: wetenschappelijk onderzoek met humane embryo’s kan van groot belang zijn om inzicht te krijgen in de vroege embryonale ontwikkeling en afwijkingen die daar kunnen optreden. Een actuele vraag is of de tijdslimiet van veertien dagen die de Embryowet voor dergelijk onderzoek stelt wel adequaat is.
Zou, mede in het licht van nieuwe onderzoeksvragen en mogelijkheden voor een langere embryokweek in vitro, een andere, latere tijdslimiet ethisch en juridisch verdedigbaar zijn – en zo ja, welke, en op welke gronden?
• Ten tweede: xenotransplantatie van dier naar mens. Vooral vanwege het risico op infecties van dier naar mens (en vice versa) is dit in de meeste landen verboden. Via genome-editingtechnieken (bijv. CRISPR/Cas) kan dit risico worden verkleind en volgens sommigen nagenoeg worden geëlimineerd. Ook hier is de vraag dus hoeveel onderzoek nodig is om te kunnen concluderen dat deze toepassing vol-doende veilig is.
• Ten derde: de snelle ontwikkelingen op het gebied van genome editing maken het zeer waarschijnlijk dat genetische modificatie ter correctie van genetische defec-ten een belangrijk toepassingsgebied gaat worden dat een deel van de toepas-singen van mens-dierchimeren zou kunnen vervangen. Ook de ethische aspecten die hierbij in overweging dienen te worden genomen, behoren aandacht te krijgen (KNAW 2016).
31 4. cybriden
4. cybriden
4.1 Definities en technieken
Een ‘cytoplasmic hybrid’ of ‘cybrid’ is een cel waarbij de celkern en cytoplast (alle onderdelen van een cel buiten de kern waaronder cytoplasma, mitochondriën, andere organellen en het celmembraan) afkomstig zijn van verschillende cellen (van dezelfde of een andere soort). De KNAW hanteert in deze factsheet als definitie voor cybride ‘een diploïde kern van een cel geplaatst in de cytoplast van een andere cel’. Een cybride kan verkregen worden door de (diploïde) kern van een cel in een ont-kernde cel te plaatsen. De ontont-kernde cel kan afkomstig zijn van een eencellig embryo (of rijpe oöcyt) dat na kerntransplantatie in principe tot een organisme kan uitgroeien, dit in tegenstelling tot een weefselcel die dat vermogen niet heeft. Wanneer de verkre-gen cybride cel verder deelt, zullen uiteindelijk bijna alle eiverkre-genschappen van de nieuw gevormde cel bepaald worden door de genetische informatie die aanwezig is in de chromosomen van de oorspronkelijke kern. Alleen de genetische informatie die aanwe-zig is in de mitochondriën, de energie producerende organellen van de cel, is afkomstig van de cytoplast. Bij zoogdieren zijn mitochondriën altijd afkomstig van de moeder en het mitochondriaal DNA dat slechts een beperkt aantal genen bevat, dus ook eventuele defecte genen, erft derhalve maternaal over (Wallace 2018).
4.1.1 Cybriden binnen een soort
De techniek van het maken van een cybride organisme kan worden toegepast om diverse combinaties van celkernen met cytoplasten te maken. Zo kan de kern van een cel van een organisme geplaatst worden in de cytoplast van een cel van de eigen
soort of van het individu zelf. Als de cytoplast is afgeleid van een zygote (of rijpe oöcyt) en deze uitgroeit uit tot een volwaardig, levend organisme, dan spreken we van een kloon. Schaap Dolly is een beroemd voorbeeld van een cybride van een ont-kernde rijpe oöcyt met daarin de celkern van een uiercel van hetzelfde individu. Ook niet-humane primaten zijn inmiddels gekloneerd (Liu et al. 2018).
Een actuele toepassing van cybriden bij mensen betreft menselijke embryo’s die tot stand komen met behulp van ‘mitochondrial replacement therapy (MRT)’ (Eyre-Walker 2017), een kunstmatige voortplantingstechniek die wordt toegepast in het Verenigd Koninkrijk en de Verenigde Staten om maternale overerving van erfelijke ziekten veroorzaakt door defecten in mitochondriale genen te voorkomen. Die ziekten worden vermeden door de celkern van de defecte eicel (met abnormale mitochondriën) te transplanteren naar een ontkernde donoreicel (met gezonde mitochondriën) en die cybride eicel vervolgens te bevruchten (reageerbuisbevruch-ting) en bij de moeder terug te plaatsen (Greenfield et al. 2017). Andersom kan overigens ook: eerst bevruchten en dan transplanteren van de kern. De celkern en de cytoplast kunnen echter ook afkomstig zijn van verschillende diersoorten. De rest van dit hoofdstuk zal mens-diercybriden behandelen, in de zin dat de kern van een menselijke cel in een dierlijk cytoplast wordt ingebracht. Zoals betoogd in hoofdstuk 2 zullen we mens-diercybriden waarin een dierlijke kern in een menselijke cytoplast wordt ingebracht hier buiten beschouwing laten.
4.1.2 Mens-diercybriden
Als mens-diercybride hanteert de KNAW hier de definitie van ‘een menselijke (diploïde) kern in de cytoplast van een dierlijke cel’. Cybriden tussen diersoorten worden over het algemeen gemaakt met het doel om de interactie tussen eiwitten die gecodeerd worden door de genen aanwezig in de kern en in de mitochondriën te bestuderen. De eiwitten die nodig zijn voor het functioneren van mitochondriën worden voornamelijk gecodeerd door genen in de kern en voor een klein deel door mitochondriale genen. Deze eiwitten vormen samen functionele complexen die van-wege de evolutionaire ontwikkeling per diersoort kunnen verschillen. Door cybride cellen van verschillende diersoorten te maken kan de interactie tussen deze eiwitten worden bestudeerd.
Cybriden afkomstig van verschillende diersoorten hebben over het algemeen subop-timaal functionerende mitochondriën, wat sterker geldt voor cybriden van diersoor-ten met een grotere evolutionaire afstand. Dit heeft als gevolg dat cybriden waarbij de donorkern en de van een zygote (of rijpe oöcyt) afgeleide cytoplast afkomstig zijn van verschillende diersoorten in de praktijk niet verder uitgroeien tot levensvatbare organismen. Zo is uitgebreid geprobeerd cybriden te maken van nauw verwante soorten zoals twee soorten buidelratten en ook van zebra en paard, maar dit heeft
33 4. cybriden
niet geleid tot levensvatbare organismen. De kans dat een cybride gevormd uit een menselijke kern en een cytoplast van een nauw verwante diersoort van de mens (bijv. een niet-humane primaat) zou kunnen leiden tot een levensvatbaar organisme wordt door de KNAW-commissie als uiterst gering ingeschat.
4.2 Wetenschappelijke ontwikkelingen
4.2.1 Stand van het onderzoek
Mens-diercybriden die gebruikmaken van dierlijke embryo’s als recipiënt voor menselijke celkernen worden voornamelijk aangewend als cytoplasmatisch milieu om herprogrammering van somatische celkernen te bestuderen, waarbij het de vraag is in hoeverre de eiwitten in oöcyten van dieren deze rol kunnen vervullen. De co-evolutie van kerngenen en mitochondriale genen in de verschillende diersoorten maakt dat cybriden afgeleid van duidelijk verschillende diersoorten geen levensvat-bare organismen kunnen vormen en zelfs de vroegste fase van embryonale ontwik-keling niet ondersteunen. Wellicht dat dit mogelijk is met cybriden tussen mens en niet-humane primaten. Het gevolg is dat er maar weinig onderzoek wordt gedaan met cybriden geproduceerd met somatische humane celkernen en oöcyten van dieren, met uitzondering van de bovengenoemde herprogrammering van humane somatische celkernen. Het onderzoeksveld richt zich voornamelijk op cybriden van somatische cellen, waarbij de nadruk bovendien nog ligt op mens-menscybriden teneinde inzicht te krijgen in de bijdragen van de mitochondriale genen aan ernstige ziekten die zich zowel vroeg als laat in het leven kunnen manifesteren. Het betreft dan vrijwel uitsluitend onderzoek met gekweekte weefselcellen. Zo wordt veel onderzoek gedaan naar de rol die mitochondriale genen mogelijk spelen bij degene-ratieve ziekten zoals Alzheimer en Parkinson (Swerdlow et al. 2017). Vooralsnog lijkt er dus geen grote, belangrijke rol te zijn voor cybriden waarbij menselijke celkernen worden gecombineerd met ontkernde zygoten van dieren.
4.2.2 Te verwachten wetenschappelijke ontwikkelingen
Evolutionair is het interessant om beter inzicht te krijgen in hoe een organel met deels eigen genetische informatie zich ontwikkelt gedurende de evolutie van dier-soorten. Evolutie van mitochondriën wordt mogelijk gemaakt door een relatief hoge mutatiefrequentie van mitochondriaal DNA dat wordt getolereerd dankzij het grote aantal mitochondriën dat aanwezig is in een cel en de selectie voor functionaliteit van een mitochondrion die plaatsvindt gedurende oöcytrijping (Wallace 2018). Tot nu toe is het alleen gelukt om dier-diercybriden te laten uitgroeien tot volwassen exemplaren bij dieren die ook onderling kunnen kruisen (Lagutina et al. 2013).
Wel blijft bestudering van ‘herprogrammering’ van menselijke weefselkernen door middel van transplantatie van humane celkernen in zygoten van dieren een benade-ring die ook in de toekomst nog kan bijdragen aan ons inzicht in het verloop van dit herprogrammeringsproces. Daarbij zijn deze mens-diercybriden vooral nuttig voor de productie van ‘betere’ hiPS-cellen. Met name de herprogrammering van humane celkernen in oöcyten van evolutionair gerelateerde niet-humane primaten zou wetenschappelijk interessant zijn om te exploreren (Narbonne et al. 2012). De beperkte toegang tot oöcyten/zygotes van niet-humane primaten en de daarbij komende ethische overwegingen maken het onwaarschijnlijk dat dit onderzoek een vlucht zal nemen. Het is wel mogelijk om ‘mitochondrial replacement’ uit te voeren gebruikmakend van bestaande cellijnen van niet-humane primaten. Zo kunnen de humane mitochondriën in bestaande hiPS-lijnen vervangen worden door die van ver-schillende diersoorten en kan worden bestudeerd wat hiervan de effecten zijn op het energiemetabolisme en de mogelijkheid om bij te dragen aan vroege embryonale ont-wikkelingsstadia zoals die zijn beschreven voor de toepassing van hES- en hiES-cellen. Dit kan leiden tot inzichten hoe mitochondriale functies kunnen worden verbeterd en hoe de aandoeningen die hieraan zijn gerelateerd kunnen worden aangepakt.
4.3 Toepassingen voor zorg en gezondheid
Mens-diercybriden werden vroeger gebruikt om onderzoek te doen naar de kwali-teit en bevruchtingscapacikwali-teit van humane zaadcellen in de klinische context met de ‘hamstereicel-test’. Tegenwoordig worden hiervoor alternatieve tests gebruikt. Voor zover de commissie het kan overzien, liggen er op dit moment geen directe klinische toepassingen voor cybriden in het verschiet. Voor de correctie of vervanging van defecte mitochondriën zijn er reeds andere technieken beschikbaar zoals mens-menscybriden of in ontwikkeling (genome editing, zie paragraf 4.4.1).
Voor de volledigheid merken wij hier op dat cybriden een belangrijke rol spelen bij het kloneren en daarmee genereren van genetisch identieke dieren, een veelvuldig toegepaste methode in een aantal landen. Daarnaast kunnen cybride technieken in principe een belangrijke rol vervullen bij het ‘terughalen’ van uitstervende diersoor-ten door celkerntransplantatie (verkregen uit weefselkweekcellen) in zygodiersoor-ten van verwante diersoorten.
4.4 Alternatieve methoden
Binnen de vraagstelling die ten grondslag ligt aan deze factsheet ziet de KNAW geen evidente toepassingen van cybriden. Daarmee wordt de beschouwing van eventuele alternatieven ook sterk beperkt.
35 4. cybriden
4.4.1 Genome editing
Als alternatief voor onderzoek met mens-diercybriden waarbij het doel mitochondri-ale ‘replacement’ is, komt genetische modificatie van mitochondriaal DNA in aanmer-king (Reddy et al. 2015). De technieken daarvoor zijn beschikbaar. Naar alle waar-schijnlijkheid is het corrigeren van defecten in het mitochondriaal DNA een van de eerste genetische modificaties die voldoende veilig in de kiembaan kunnen worden uitgevoerd.
4.4.2 Herprogrammering
Gezuiverde eiwitten of celextracten (van eigen of ander diersoort) zoals die voor-komen in zygoten kunnen worden aangewend om te onderzoeken hoe specifieke eiwitcomponenten de ontwikkeling van preïmplantatie-embryo’s sturen. Aangezien vroege embryo’s zichzelf blijken te kunnen organiseren en in de beginfase van ont-wikkeling daarbij vrijwel alleen gebruikmaken van in de eicel aanwezige componen-ten, kan hiermee veel kennis worden opgedaan over dit proces naast het verwerven van inzicht in de oorzaken van afwijkingen gedurende deze vroege fase van embryo-nale ontwikkeling.
4.5 Ethische overwegingen
Ook met betrekking tot mens-diercombinaties op genetisch niveau acht de KNAW het van belang een aantal ethische vragen en overwegingen aan te reiken voor de nadere reflectie door (onder andere) de Gezondheidsraad. Zij acht in dit verband, mede gegeven de adviesaanvraag, mens-diercybriden van belang, waarbij een menselijke kern in een dierlijk cytoplast wordt geplaatst.
Daarnaast vraagt de KNAW aandacht voor de nieuwe genome-editingtechnologieën die steeds krachtiger kunnen worden ingezet om omvangrijkere genoommodificaties van dieren te realiseren dan tot nu toe het geval was. Het wordt hierdoor ook moge-lijk om weefsels van dieren op genetisch niveau veel uitgebreider te ‘humaniseren’. Dit vraagt om een ethische bezinning die sterke raakvlakken heeft met de bezinning op andere mens-diercombinaties zoals cybriden en chimeren. Daarbij tekent de KNAW aan dat de inzet van genome-editingtechnieken voor het genereren van dieren met een reeks menselijke genen biologisch gezien aanzienlijk minder belemmerin-gen kent dan het maken van chimeren en cybriden en ook waarschijnlijk eerder tot toepassingen voor zorg en gezondheid kan leiden (KNAW 2016).