FACIOSCAPULOHUMERALE
MUSCULAIRE DYSTROFIE: GENETICA
EN
EPIGENETICA:
WAT
ZIJN
MOGELIJKE INTERVENTIEPLAATSEN
VOOR
TARGETED
THERAPY
BIJ
FSHD1-PATIËNTEN?
Anna Vander Heyde
Stamnummer: 01508594
Promotor: Prof. dr. Sofie Symoens
Masterproef voorgelegd in het kader tot het behalen van de graad Master of Medicine in de Geneeskunde Academiejaar: 2019 - 2020
Deze pagina is niet beschikbaar omdat ze persoonsgegevens bevat.
Universiteitsbibliotheek Gent, 2021.
This page is not available because it contains personal information.
Ghent University, Library, 2021.
Voorwoord
Voor u ligt de masterproef ‘FSHD: genetica en epigenetica: wat zijn de mogelijke interventieplaatsen voor targeted therapie bij FSHD1-patiënten?’. Deze masterproef is geschreven in het kader van mijn opleiding Geneeskunde aan de UGent van september 2018 tot december 2019.
Het schrijven van de masterproef was niet altijd eenvoudig, maar na uitvoerige literatuurstudie ben ik erin geslaagd de onderzoekvraag te beantwoorden. Het schrijven van deze masterproef heeft mij meer geleerd over genetica en wetenschappelijk onderzoek, maar daarnaast ook mijn zelfstandigheid verbeterd. Dit was nooit mogelijk geweest zonder mijn promotor, Sofie Symoens. Zij was bereid mijn vragen te beantwoorden en mij constructieve feedback te geven opdat het een mooi en correct eindresultaat zou worden.
Daarnaast zou ik ook graag mijn ouders, zussen en vrienden willen bedanken voor hun tips en steun tijdens het schrijven van mijn masterproef. Zij hebben mij geholpen de masterproef tot een goed einde te brengen.
Ik wens u veel leesplezier.
Anna Vander Heyde
Inhoudstafel 1 Abstract ... 1 2 Inleiding ... 2 2.1 Kliniek ... 2 2.2 Diagnose en behandeling ... 4 2.3 DUX4 proteïne ... 6 2.4 Genen ... 7 2.5 Epigenetica ... 11
2.5.1 Methylatie van de CpG dinucleotiden ... 11
2.5.2 Histon modificaties ... 12
2.5.3 RNA: niet-coderende D4Z4 RNA-fragmenten ... 13
2.6 DUX4 expressie ... 15 2.6.1 DUX4-s en DUX4-fl ... 15 2.6.2 Skeletspierspecificiteit ... 17 2.7 Vraagstelling ... 17 3 Methode ... 19 4 Resultaten... 21 4.1 FSHD-modellen ... 21
4.1.1 Diermodellen met deelaspecten van FSHD ... 21
4.1.2 Transgeen FSHD-muismodel ... 22 4.2 Therapieën... 23 4.2.1 mRNA ... 24 4.2.2 DNA ... 29 4.2.3 Epigenetica ... 35 4.2.4 Andere ... 36 5 Discussie ... 37
5.1 Vergelijken van ingrijpen ter hoogte van de epigenetica, het DNA en mRNA ... 37
5.2 Vergelijken van verschillende interventietechnieken: AO, small molecules, CRISPR/dCAS ... 39
5.3 Vergelijken van interventieplaatsen... 40
5.4 Veiligheid ... 43
5.5 Verder onderzoek is nodig want ... 44
1
1 Abstract
Achtergrond: Facioscapulohumerale musculaire dystrofie (FSHD) is een erfelijke autosomaal dominante aandoening die klinisch aanleiding geeft tot een progressieve spierdegeneratie. Het is één van de meest prevalente spierdystrofieën en wordt gekenmerkt door complexe genetische en epigenetische veranderingen. De laatste jaren zit het onderzoek rond FSHD in de lift na de ontdekking van het DUX4-proteïne. Expressie van DUX4-proteïne staat centraal in de pathogenese van FSHD. Ondanks exponentieel onderzoek bestaat er nog geen effectieve therapie in de behandeling van FSHD.
Doel: Deze masterproef beschrijft de belangrijkste genetische en epigenetische veranderingen bij personen met FSHD1. Het doel is inzicht te geven in de pathogenese van FSHD1 en een overzicht te bieden van in de literatuur besproken mogelijkheden omtrent potentiële interventieplaatsen voor doelgerichte therapie bij FSHD1, welke ingrijpen op de epigenetica, het DNA en RNA.
Methode: Literatuur omtrent FSHD1 en targeted therapie werd nagegaan in databanken Pubmed, Embase en Web of Science.
Resultaten: Heel wat interventieplaatsen voor doelgerichte therapie bij FSHD1 patiënten zijn reeds geïdentificeerd ter hoogte van de epigenetica, het DNA en RNA. Echter, veel van deze interventieplaatsen zijn nog onvoldoende onderzocht op vlak van effectiviteit en veiligheid zowel in vivo als in vitro.
Interpretatie: Deze masterproef geeft een overzicht van de tot nu toe gekende effectiviteit en veiligheid van een potentiële interventieplaats bij targeted therapie. Het doet aanbevelingen waar er tekortkomingen zijn en verder onderzoek nodig is. Recente ontwikkeling van een levensvatbaar transgeen diermodel zorgt dat in vivo testing van potentiële therapieën mogelijk wordt en biedt nieuwe mogelijkheden in de ontwikkeling van een effectieve therapie bij FSHD1.
2
2 Inleiding
Facioscapulohumerale musculaire dystrofie (FSHD) is een autosomaal dominante aandoening die de dwarsgestreepte spieren van het skelet treft. De prevalentie van de ziekte is 1:15000-1:20000(1), wat het één van de meest prevalente erfelijke spieraandoeningen maakt (1, 2). Klassiek is FSHD een traag progressieve ziekte waarbij de eerste symptomen tot uiting komen rond de leeftijd van 15-30 jaar. Beide delen van het lichaam kunnen getroffen zijn, typisch echter is dat één zijde van het lichaam sterker getroffen is dan de andere. Er is een grote variabiliteit in leeftijd van ontstaan, aangetaste spiergroepen en ernst van het klinisch beeld. Zo zijn er bijvoorbeeld patiënten die quasi asymptomatisch zijn, bij deze patiënten spreekt men van non-penetrantiei van de ziekte.
Er bestaan 2 vormen van FSHD, nl. FSHD1 en FSHD2. 95% van de patiënten valt onder FSHD1 en slechts 5% onder FSHD2 (1). Beide vormen geven aanleiding tot hetzelfde klinisch beeld maar hebben een verschillende genetische oorzaak.
Recent onderzoek heeft aangetoond dat er zowel binnen FSHD1 en FSHD2 ook een onderscheid kan gemaakt worden op basis van verschillen in de morfologie van de getroffen spiercellen. Men spreekt van ‘atrofic’ FSHD (aFSHD) en ‘disorganised’ FSHD (dFSHD). Spiercellen die vallen onder de categorie aFSHD hebben myotuben die zeer dun en atrofisch zijn. Spiercellen die vallen onder dFSHD hebben myotuben die zeer groot zijn en slecht georganiseerd zijn (3).
2.1 Kliniek
De ziekte manifesteert zich typisch ter hoogte van de spieren van het aangezicht (facio), de schouders (scapulo) en de bovenarmen (humero). Later volgen ook skeletspieren van de onderste ledematen, meestal eerst de enkel dorsiflexoren en de proximale spieren van het been (Afbeelding 1).
3
Ter hoogte van het aangezicht is er klassiek aantasting van de musculus orbicularis oculi, de musculus orbicularis oris en de musculus zygomaticus major. De patiënt heeft moeilijkheden met het sluiten van de oogleden, heeft een asymmetrie van de mond in rust en kan de mondhoeken niet naar boven brengen (Afbeelding 1) (4).
Ter hoogte de bovenste ledematen zijn de musculus trapezius en de musculus serratus anterior meestal aangetast wat leidt tot scapular winging, vaak bilateraal en asymmetrisch (Afbeelding 1). De spieren van de bovenarm, voornamelijk de biceps en de triceps, vertonen selectieve atrofie terwijl het distale deel van de musculus deltoideus en de spieren van de onderarm gespaard blijven. De musculus supraspinatus en infraspinatus blijven ook relatief gespaard (Afbeelding 1). Ter hoogte van de borstkas en rug zijn de musculus rectus abdominalis, de musculus erector spinae en de musculus pectoralis major de meest frequent aangetaste spieren. De atrofie van de rectus abdominalisspier geeft een asymmetrisch uitstekende buik, wat frequent foutief wordt aanzien als buikvet en bijdraagt tot lumbale lordose. Bewegingen waarbij de spieren van de buik
Afbeelding 1: Klinische kenmerken bij FSHD (overgenomen van Mul K et al. 2016) 1. (A) zwakte van de m. orbicularis oculi, wat
moeilijkheden geeft voor het sluiten van de ogen en (C) de onmogelijkheid tot het volledig verbergen van de wimpers bij het krachtig sluiten van de ogen. (B) Zwakte van de m. zygomaticus major, wat aanleiding geeft tot asymmetrie van de mond in rust en (D) moeilijkheden om de mondhoeken naar boven te brengen. 2. Asymmetrisch bilateraal scapular winging (recht prominenter dan links) 3. Horizontale axillaire vouw, distale atrofie van de m. deltoideus, atrofie van de spieren van de bovenarm en behoudt van de spieren van de onderarm 4. Horizontale axillaire vouw bilateraal en een asymmetrisch vooruitstekende buik.
4
nodig zijn, zoals van een liggende naar een zittende houding gaan, worden moeilijk voor de patiënt. Combinatie van de abdominale spieratrofie met atrofie van de musculus erector spinae geeft problemen met evenwicht en aanleiding tot frequente valaccidenten. De musculus pectoralis major geeft asymmetrisch een extra anterieure okselplooi. De respiratoire spieren zijn niet primair betrokken (Afbeelding 1).
Ter hoogte van de lagere ledematen zijn klassiek betrokken: de musculus adductor magnus, de hamstrings, de quadriceps en de musculus tibialis anterior. Functioneel kan dit de oorzaak zijn van een dropvoet.
Andere kenmerken die frequent voorkomen bij FSHD zijn klachten van vermoeidheid en chronische pijn, voornamelijk ter hoogte van de lage rug, benen, schouders en nek. 15% van de FSHD-patiënten ontwikkelt gehoorverlies voor de hoge frequenties. 25% van de patiënten ontwikkelt retinale telengectasie, een kluwen van bloedvezels achteraan het oog. Slechts minder dan 1% van de mensen met retinale telengectasie ervaart hierdoor echter visuele problemen. 10% van de FSHD-patiënten hebben een onregelmatige hartslag. 1% tot 13% van de FSH- patiënten hebben ademhalingsproblemen door de ernst van de spierzwakte (5).
2.2 Diagnose en behandeling
De diagnose van de FSHD1 wordt gesteld door een grondige anamnese en genetische testing. Volgens de richtlijnen van 2015 van Tawil (2015) wordt er bij vermoeden van FSHD1 eerst nagegaan of er een eerstegraadsverwant gekend is met FSHD1. Indien er een eerstegraadsverwant gekend is waarbij FSHD1 genetisch geconstateerd is, is genetisch onderzoek niet nodig en wordt de diagnose van FSHD1 gesteld. Indien er geen eerstegraadsverwant is gaat men over tot genetisch onderzoek (Afbeelding 2)) (6). MRI’s worden genomen in het kader van FSHD en kunnen specifieke kenmerken aantonen zoals vervanging van spier- door vetweefsel, inflammatie en oedeem. Ze correleren sterk met de klinische expressie van de aandoening en kunnen, voordat klinische tekens aanwezig zijn, aangeven welke spieren betrokken zullen zijn. Het gebruik van MRI’s is nog niet opgenomen in de richtlijnen. Men moet hierbij opmerken dat de richtlijnen dateren van 2015 en het gebruik van MRI’s bij FSHD recent in opmars is gekomen (7).
Genetisch onderzoek bij FSHD1-patiënten is gebaseerd op veranderingen die gezien worden in de genetica van personen met FSHD1 die niet gezien worden bij gezonde personen. De genetica achter FSHD is niet eenvoudig en meerdere genetische kenmerken moeten aanwezig zijn
5
alvorens de ziekte tot uiting komt (zie paragraaf 2.4). Kenmerkend in de genetica van een FSHD1-patiënt zijn: (1) Een contractie ter hoogte van de D4Z4 repeats op chromosoom 4; en (2) de aanwezigheid van een specifiek haplotype, namelijk haplotype A, ter hoogte van de contractie. Genetische onderzoek voor het stellen van de diagnose van FSHD1 is gestoeld op deze 2 kenmerken (Afbeelding 2).
Naast de genetische veranderingen gezien bij FSHD1-patiënten, zijn er ook epigenetische veranderingen waar te nemen. Zo ziet men (1) hypomethylatie ter hoogte van de contractie en (2) histonmodificaties (zie paragraaf 2.5). De epigenetische veranderingen worden niet gebruikt voor
6
het stellen van de diagnose. De genetica en epigenetica bij FSHD1 patiënten worden hieronder meer uitgebreid besproken (6).
Een effectieve behandeling voor FSHD bestaat momenteel nog niet. De huidige therapie is louter symptomatisch en gericht op het verbeteren van de kracht en de functie van de aangetaste spieren. Specifieke oefeningen op maat van de patiënt om kracht en functie te proberen behouden of het aanleren van alternatieve methoden ter compensatie van het functieverlies kunnen aangewezen zijn. In geselecteerde gevallen kan chirurgie een hulpmiddel zijn om de symptomen van de patiënt te verlichten (6).
2.3 DUX4 proteïne
De onderliggende genetische oorzaak van FSHD is een abnormale expressie van het double homeobox 4 eiwit (DUX4). De abnormale productie van DUX4 proteïne in skeletspiercellen wordt op dit moment gezien als het belangrijkste kenmerk van FSHD (8).
DUX4 is een primaat specifiek proteïne, het wordt enkel gevonden in halfapen, apen en de mens. De expressie is in normale omstandigheden strikt gereguleerd en beperkt zich tot de testis en embryonale ontwikkeling. In testis brengen voornamelijk de kiemcellen DUX4 tot expressie. Tijdens de embryonale ontwikkeling wordt het voornamelijk in blastomerenii, wat embryo’s in het
klievingsstadium zijn, gevonden. DUX4 is een transcriptiefactoriii en is essentieel voor de activatie
en regulatie van genen tijdens de vroege embryonale ontwikkeling. In de verdere ontwikkeling van cellen naar een meer gedifferentieerd weefsel wordt de expressie van het DUX4 proteïne onderdrukt (9).
Skeletspiercellen van FSHD-patiënten falen in het onderdrukken van de expressie van het DUX4 proteïne. DUX4 komt hierdoor tot expressie in skeletspiercellen. De precieze trigger die aanleiding
Afbeelding 3: functionele domeinen van het DUX4 proteïne (aangepast van
7
geeft tot activatie van de expressie van DUX4, is nog onbekend. Wel is geweten dat er bepaalde genetische (zie paragraaf 2.4) en epigenetische (zie paragraaf 2.5) omstandigheden nodig zijn alvorens expressie mogelijk is. Expressie van DUX4 is enkel mogelijk bij extreme chromatine relaxatie, zoals in de embryonale ontwikkeling en bij FSHD (8, 10).
In totaal bevat het DUX4 eiwit 3 functionele domeinen: 2 homeodomeinen en 1 C-terminaal domein. De 2 homeodomeinen zijn gelegen ter hoogte van het N-terminale deel van het eiwit en zijn essentieel voor het maken van een actief proteïne (11). De homeodomeinen zijn in staat DNA te binden en beïnvloeden de myogeneseiv van de skeletspiercel. Ze geven aanleiding tot een
daling van de myogene proliferatiev en inhibitie van de myogene differentiatievi (11, 12). Het
C-terminaal domein is niet essentieel voor een actief proteïne, maar wel essentieel voor de toxiciteit van het DUX4-proteïne. Het is de oorzaak van de apoptose van skeletspiercellen bij FSHD1-patiënten (11, 12).
Naast het beïnvloeden van de myogene capaciteit van de cel en inductie van apoptosevii is DUX4
als transcriptie activator en regulator ook in staat andere genen te activeren en hun expressie te reguleren. Aberrante expressie van DUX4 geeft onder meer aanleiding tot een daling van de aangeboren immuunrespons, activatie van de verworven immuunrespons en stijging van de oxidatieve stress (13-16). Algemeen kan men stellen dat DUX4 een transcriptoomviii induceert dat
karakteristiek is voor een minder gedifferentieerde cel, wat overeenkomt met zijn normale functie in de vroege embryonale ontwikkeling (17).
2.4 Genen
De productie van een eiwit begint bij DNA dat coderende sequenties of exonen bevat. De flow van informatie gaat volgens een vast patroon: DNA dirigeert de synthese en de sequentie van RNA. RNA dirigeert op zijn beurt de synthese en sequentie van de eiwitten. De vorming van RNA uit DNA gebeurt door een proces dat men transcriptie noemt. De vorming van eiwitten uitgaande van mRNA (messenger RNA) gebeurt door translatieix (18).
De genen die betrokken zijn in de pathogenese van FSHD zijn gelegen op het uiteinde van de lange arm (q) van chromosoom 4, ter hoogte van de 4q35 regio (Afbeelding 4) (2, 10). Ter hoogte van de 4q35 regio liggen D4Z4 tandem repeatsx. D4Z4 macrosatelliet repeats hebben een lengte
van 3,3 kb (kilobasepaar). Gezonde personen hebben tussen de 11 en 100 herhalingen van de D4Z4 unit. FSHD1 patiënten hebben een contractie ter hoogte van de 4q35 regio. Deze contractie geeft aanleiding tot een verlies van D4Z4 repeats, waardoor ze slechts 1-10 D4Z4 units hebben
8
(Afbeelding 4). Het aantal D4Z4 kopieën correleert met het fenotype. Hoe lager het aantal repeats, hoe vroeger de ziekte begint en hoe ernstiger het verloop (19). Een volledig verlies van de D4Z4 repeats geeft geen aanleiding tot FSHD wat stelt dat de aanwezigheid van minstens 1 D4Z4 repeat essentieel is in het ziekteproces van FSHD (1, 2).
Elke D4Z4 repeat bevat een promotor sequentiexi en 2 exonenxii : exon 1 (E1) en exon 2 (E2). E1
is coderend en omvat het DUX4 open reading frame (ORF). Het ORF is de sequentie van nucleotidenxiii die de genetische informatie bevat voor het DUX4 proteïne. E2 is kort en bevat
delen van de 3’ untranslated region (UTR)xiv. De 3’UTR is niet coderend en geeft geen aanleiding
tot eiwit. Enkel de meest distale D4Z4 repeat is in staat om DUX4 proteïne tot expressie te brengen (Afbeelding 4). Alle andere D4Z4 repeats kunnen transcriptie ondergaan, maar zijn niet stabiel en worden na transcriptie direct afgebroken. Hierdoor zijn zij niet in staat tot productie van het DUX4 proteïne (3, 20, 21).
De reden hiervoor is dat FSHD-patiënten naast een contractie ter hoogte van de D4Z4 regio ook een specifiek haplotype nodig hebben, namelijk haplotype A. Een haplotype is een specifieke set van gelinkte single nucleotide polymorfismenxv (SNP) die altijd samen voorkomen. Ter hoogte van
de D4Z4 regio is het haplotype direct distaal gelegen van de D4Z4 regio en het flankeert de laatste
D4Z4
Afbeelding 4: Humaan chromosoom regio 4q35 (aangepast van Gatica L.V. et al, 2016). Gezonde individuen (normal) hebben D4Z4
‘tandem repeats’ (zwarte driehoeken) die sterk gemethyleerd zijn (blauwe pinnen) en gevolgd worden door haplotype A of B (4qA/B; respectievelijk rood en groen). FSHD1-patiënten hebben een gedaald aantal D4Z4 ‘tandem repeats’, een daling van de methylatie ter hoogte van de D4Z4 repeats en haplotype A. FSHD2-patiënten hebben een normaal aantal D4Z4 ‘tandem repeats’, een daling van de methylatie ter hoogte van de D4Z4 repeats, haplotype A en een mutatie in SMCHD1 (niet weergegeven, gelegen op chromosoom 18). DUX4C (oranje driehoek) is gelegen upstream van de D4Z4 regio in een getrunceerde en ‘inverted’ D4Z4 repeat.
9
D4Z4 repeat. In de algemene populatie komen op die plaats 2 haplotypes voor die de D4Z4 regio flankeren: haplotype A en haplotype B. Enkel haplotype A is geassocieerd met FSHD (Afbeelding 4)(2, 22, 23).
Haplotype A is essentieel in de aanmaak van stabiele DUX4 mRNA transcripten. Dit blijkt uit het feit dat enkel de meest distaal gelegen D4Z4 repeat, wanneer direct geflankeerd door haplotype A, aanleiding geeft tot mRNA transcripten die stabiel zijn en translatie ondergaan tot DUX4 eiwit. Repeats die niet distaal gelegen zijn, en dus niet direct geflankeerd worden door haplotype A, worden overgeschreven tot mRNA maar worden direct gedegradeerd. Ook wanneer de meest distale repeat direct geflankeerd wordt door haplotype B geeft dit geen aanleiding tot stabiele DUX4 mRNA transcripten (2, 23).
Haplotype A bezit een speciale DNA-sequentie, nl. een pLAM sequentie en een degeneratievexvi
6.2 kb β-satelliet repeat (Afbeelding 4). De pLAM sequentie bevat exon 3, welke net als exon 2, delen van de 3’UTR bevat. Het is niet coderend en geeft geen aanleiding tot het ontstaan van een eiwit maar ondergaat wel transcriptie naar mRNA. Exon 3 bevat een niet klassiek polyadenylatie signaal (PAS)xvii, nl ATTAAA. Het PAS-signaal wordt alleen mee overgeschreven tijdens de
transcriptie van de meest distale D4Z4 repeat. Het wordt niet mee overgeschreven tijdens de transcriptie van meer proximaal gelegen D4Z4 repeats. Het PAS-signaal is hierdoor enkel een
Afbeelding 5: Distale D4Z4 repeats met haplotype A: (aangepast van Ansseau et al., 2017) Elke D4Z4 repeat bestaat uit een promotorsequentie (P),
een eerste exon (E1) dat het open reading frame (ORF) bevat voor DUX4 en een kort niet-coderend tweede exon (E2). De laatste D4Z4 repeat wordt bij patiënten met FSHD gevolgd door haplotype A (kader), bestaande uit een pLAM-sequentie en een β-microsatelliet repeat. De pLAM sequentie bevat een onvertaald exon 3 (E3) met een polyadenylatie signaal (PAS; oranje streep binnen exon 3) en cleavage site (CS). Het DSE, downstream van PAS-signaal (paarse streep). Het distal auxilary element, gelegen in de tweede β-satelliet repeat van haplotype A (rode streep).
10
onderdeel van mRNA afkomstig van de meest distale repeat. Het verleent aan het transcript de nodige stabiliteit opdat het niet direct afgebroken wordt en is belangrijk voor een correct functioneren (22).
Opvallend is dat men ondanks het gebruik van een niet-klassiek PAS-signaal toch vrij robuuste DUX4 mRNA transcripten verkrijgt. Er zijn verschillende sequenties, naast het PAS-signaal, die de efficiëntie van transcriptie en cleavage and polyadenylatie (CPA) kunnen beïnvloeden (xvii). De cleavage site (CS) is de plaats waar het primair transcript geknipt wordt (Afbeelding 5). Ter hoogte van de D4Z4 regio zijn er 3 mogelijke CS, die elk in verschillende mate gebruikt worden (24). Nucleotiden rond deze regio kunnen de efficiëntie van CPA beïnvloeden (25). Het ‘distal auxilary element’ (DAE) is gelegen distaal van het PAS-signaal (Afbeelding 5) (22). Het ‘downstream sequence element’ (DSE) is een G/U-rijke sequentie meer dan 30 nucleotiden downstream (xix) van de CS (25) (Afbeelding 5).
FSHD2 patiënten hebben geen verlies van D4Z4 repeats. Zij hebben een mutatie in een gen betrokken in de epigenetische repressie van de D4Z4 regio (2). De expressie wordt in 80% van de gevallen veroorzaakt door een mutatie in het SMCDH1-gen (structural maintenance of chromosome flexible hinge domain containing 1), gelegen ter hoogte van chromosoom 18 (Afbeelding 4). SMCDH1 is een gen betrokken in de epigenetische repressie van repetitieve regio’s (26). Mutaties in SMCDH1 bij patiënten die ook een contractie hebben ter hoogte van de D4Z4 repeats geven aanleiding tot een zeer uitgesproken klinisch beeld van FSHD. Het SMCHD1-gen is een ‘modifier’xviii van de ziekte-ernst bij FSHD1. Het feit dat een epigenetische modifier
betrokken is in het ontstaan van FSHD (FSHD2) en een invloed kan uitoefenen op de mate van ziekte-expressie (FSHD1) pleit voor het feit dat er naast de genetische component ook een epigenetische component is in de pathogenese van FSHD (1, 2).
Zoals eerder vermeld is recent gebleken dat er binnen FSHD1 en FSHD2 nog een indeling kan gemaakt worden op basis van de morfologie van de getroffen cellen, nl. aFSHD en dFSHD. Overexpressie van DUX4 proteïne is gelinkt aan aFSHD, maar bleek geen verklaring voor het dFSHD subtype. Het dFSHD subtype, waarbij de cellen slecht georganiseerd zijn, wordt veroorzaakt door aberrante expressie van het DUX4C proteïne (3). Het DUX4C proteïne is een DUX4 homoloog proteïne dat afkomstig is van een gen gelegen 42 kb upstreamxix van het
proximale D4Z4 element (Afbeelding 4) (2, 3). DUX4C verschilt van DUX4 enkel ter hoogte van zijn C-terminaal domein. Het is 50 basenparen korter en de laatste 32 residuen hebben 40% homologie met DUX4 (3).
11
2.5 Epigenetica
Epigenetische mechanismen zijn omkeerbare erfelijke veranderingen in de genfunctie die optreden zonder de sequentiexx van DNA in de celkern te wijzigen. Ze beïnvloeden de genfunctie
door chromatine meer of minder toegankelijk te maken, wat vaak gepaard gaat met chromatine relaxatie of condensatie (18). Algemeen zijn er 3 mechanismen belangrijk in de epigenetische regulatie van de D4Z4 regio, namelijk: (1) methylatie van CpG eilanden (zie paragraaf 1.5.1), (2) veranderingen ter hoogte van de histonen (zie paragraaf 1.5.2), (3) korte niet-coderende RNA-sequenties (zie paragraaf 1.5.3).
2.5.1 Methylatie van de CpG dinucleotiden
xxiEen belangrijk mechanisme in de epigenetica is de methylatie van DNA. DNA methylatie gebeurt door DNA-methyltransferasen en veroorzaakt chromatine condensatie. Chromatine condensatie maakt het DNA ontoegankelijk en veroorzaakt onderdrukking van genexpressie (1, 2, 23). Het gebeurt bij voorkeur op het cytosine residu van CpG dinucleotiden. De D4Z4 regio bestaat voor meer dan 70% uit CpG dinucleotiden, hierdoor is het zeer gevoelig voor DNA methylatie (27). In normale somatische cellen is de D4Z4 regio een sterk gemethyleerde regio, waardoor de genen die daar gelegen zijn niet tot expressie komen (Afbeelding 4).
Afbeelding 6: DUX4 expressie (overgenomen van Statland et al.,2014) boven: chromatine
condensatie ter hoogte van de D4Z4 regio maakt het DNA ontoegankelijk. Midden: chromatine relaxatie ten gevolge van contractie bij FSHD1 patiënten. Chromatine wordt permissief voor expressie. Onder: chromatine relaxatie ten gevolge van een SMCHD1 mutatie bij FSHD2 patiënten. Chromatine wordt permissief voor expressie
12
Patiënten met FSHD hebben een daling van de methylatie ter hoogte van deze CpG dinucleotiden in de D4Z4 regio. Bij FSHD1 patiënten is de hypomethylatie een gevolg van de contractie ter hoogte van de D4Z4 repeats (28). Bij FSHD2 patiënten is de hypomethylatie een gevolg van een mutatie in een gen betrokken in de epigenetische repressie van de D4Z4 regio (SMCDH1) (29). DNA hypomethylatie geeft chromatine relaxatie, wat het meer toegankelijk maakt voor transcriptie (Afbeelding 4, Afbeelding 6).
2.5.2 Histon modificaties
Histonen zijn de belangrijkste eiwitten in chromatinexxii. Ze zijn essentieel voor de vorm waaronder
het DNA en chromatine voorkomen in de celkern. Histon modificaties leiden tot veranderingen aan de structuur van chromatine wat op zijn beurt de genexpressie kan beïnvloeden (18). Er bestaan histonmodificaties die geassocieerd zijn met de activatie van genen, zoals acetylatie van histon 3 lysine 9 (H3K9Ac) en trimethylatie van histon 3 op lysine 4 (H3K4me3) (30). Histonmodificaties die geassocieerd zijn met de repressie van genen zijn onder andere trimethylatie van histon 3 op lysine 27 (H3K27me3) en trimethylatie van histon 3 op lysine 9 (H3K9me3). In de stamcelpopulatie heeft de D4Z4 regio bivalente kenmerken, het bevat zowel activerende als repressieve kenmerken. De bivalente kenmerken zorgen ervoor dat de cellen DUX4 onderdrukken maar in de mogelijkheid zijn tot adequate expressie. Bij verdere differentiatie naar myoblasten worden de cellen van de controle populatie univalent en geassocieerd met een repressieve conformatie (H3K9me3 en H3K27me3) (30). Hierdoor wordt DUX4 onderdrukt in de skeletspiercellen van gezonde personen. Deze histonmodificaties komen overeen met het normale expressiepatroon van DUX4 en zijn normale functie die wordt uitgeoefend in de kiemcellen en tijdens de vroege embryonale ontwikkeling (30, 31).
FSHD-cellen zijn in de stamcelpopulatie bivalent. Tijdens de differentiatie naar meer gedifferentieerd weefsel ziet men, in vergelijking met cellen van een controle populatie, een verlies van de repressieve merker H3K9me3 en een beperkte toename van de activerende merker H3K4me3. Er is geen verschil in de aanwezigheid van H3K27me3 tussen de controle cellen en de FSHD-geassocieerde cellen (zie addendum 3: Figuur A) (30, 31).
Ondanks het verlies van repressieve merkers is 95% van de FSHD getroffen cellen toch in staat DUX4 te onderdrukken. Minder dan 5% van de FSHD-cellen is hier niet toe in staat. Het zijn deze cellen die aanleiding geven tot de aberrante DUX4 expressie (8, 14, 30). De 5% FSHD-cellen die DUX4 niet op een adequate wijze kunnen onderdrukken verschillen in histonmodificaties ten
13
opzichte van de 95% cellen die DUX4 wel onderdrukken. DUX4 exprimerende FSHD-cellen hebben in vergelijking met DUX4 onderdrukkende cellen, 4 keer minder H3K27me3 en 4 keer meer H3K9Ac (30). Deze merkers zorgen ervoor dat eiwitten, die in normale omstandigheden de genexpressie onderdrukken, niet meer in staat zijn chromatine te binden. DNA verliest ter hoogte van de D4Z4 regio zijn repressieve conformatie en wordt meer toegankelijk.
2.5.3 RNA: niet-coderende D4Z4 RNA-fragmenten
Een derde epigenetisch mechanisme dat kan bijdragen aan veranderingen in genfunctie speelt zich af op RNA-niveau.
Zoals eerder vermeld wordt DNA omgezet naar RNA, wat op zijn beurt kan worden omgezet naar proteïnen (ix). Echter, niet al het RNA wordt omgezet naar eiwitten, bepaalde delen van het DNA worden actief overgeschreven naar RNA maar ondergaan geen translatie naar eiwitten. RNA dat op deze manier ontstaat noemt men ‘niet-coderend RNA’ (ncRNA). Ter hoogte van de D4Z4 regio ontstaan korte niet-coderende siRNA’s en miRNA’s (respectievelijk small interfering RNA en microRNA) (32). Tevens kunnen er lange niet-coderende RNA-fragmenten ontstaan. (33, 34). siRNA’s en miRNA’s zijn korte niet-coderende RNA-fragmenten die geassocieerd zijn met de epigenetische regulatie van de genfunctie. Ze zijn op verschillende plaatsen in het genoom betrokken bij de repressie van genen (32). Ter hoogte van de D4Z4 regio’s zijn de korte endogene niet-coderende RNA-sequenties betrokken in de onderdrukking van DUX4 expressie in skeletspiercellen. Korte niet-coderende RNA-fragmenten vindt men zowel in controle cellen als in cellen van FSHD-patiënten. Zowel in controle cellen als bij FSHD-patiënten dragen deze korte niet-coderende fragmenten bij tot de epigenetische repressie van DUX4. Dit epigenetisch mechanisme is intact bij mensen met FSHD (32, 34).
In FSHD1-cellen kan men naast deze korte miRNA en siRNA-fragementen ook een lang niet-coderend RNA-fragment terugvinden, nl DBE-T. DBE-T RNA is een lang ncRNA-fragment dat gecodeerd wordt door de D4Z4 regio. De transcriptional start sitexxiii (TSS) van DBE-T is upstream
van de D4Z4 regio gelegen (33). Dit is specifiek voor FSHD1-cellen en kan men niet terugvinden in controle-cellen (33). Deze sequentie wordt gecodeerd door een regio binnen de D4Z4 repeats en de TSS van dit RNA-fragment is gelegen upstream van de D4Z4 regio.
14 Afbeelding 7: DBE-T transcriptie (aangepast van Cabianca et al., 2012): BOVEN: bij gezonde personen wordt de D4Z4 regio en de
regio upstream (p13-E11: blauwe dubbele pijl, NDE: rode dubbele pijl, niet op schaal) sterk gebonden en onderdrukt door PCR2. Dit geeft onderdrukking van de D4Z4 tandem repeats (blauwe driehoeken) en van de andere genen gelegen ter hoogte van de 4q35 regio. ONDER: bij FSHD1 patiënten geeft de contractie een verlies van de PCR2-binding en suppressie ter hoogte van de regio upstream van de D4Z4 regio (p13-E11 en NDE regio). Hierdoor wordt DBE-T RNA transcriptie mogelijk. DBE-T RNA rekruteert het ASH1L-proteïne, wat de repressie van de D4Z4 regio en andere genen ter hoogte van de 4q35 regio antagoniseert. (PcG= polycomb group, hier representatief voor PCR2).
DBE-T RNA ontstaat in myogene cellen van FSHD1-patiënten door de contractie ter hoogte van de D4Z4 regio met verlies van repressie. D4Z4 regio’s zijn in staat om PCR2 (polycomb repressive complex) te rekruteren (33). PCR2 is geassocieerd met de repressieve merker H3K27me3. PCR2 binding geeft een stijging van de repressieve merker H3K27me3 zowel upstream van de D4Z4 regio als ter hoogte van de D4Z4 regio zelf (19, 33). Verlies D4Z4 repeats geeft een daling van
15
PCR2 rekrutering en van zijn geassocieerde H3K27me3 merker ter hoogte van de regio upstream van de D4Z4 repeats (NDE en p13E-11) maar niet ter hoogte van de D4Z4 repeats zelf (19, 33). Dit verlies van suppressie maakt transcriptie van DBE-T RNA in FSHD1-patiënten mogelijk (19, 30, 33).
2.6 DUX4 expressie
2.6.1 DUX4-s en DUX4-fl
Expressie van DUX4 heeft meerder voorwaarden:
1. FSHD1: daling van het aantal D4Z4 repeats tot 1 à 10 D4Z4 repeats.
FSHD2: een mutatie in een chromatine modifier gen, gelegen op een ander chromosoom. 2. De aanwezigheid van haplotype A
3. Permissief DNA
Indien aan bovenstaande voorwaarden is voldaan, is het DNA toegankelijk voor transcriptie. De D4Z4 regio ondergaat bidirectionele transcriptie, het wordt zowel in de sense als antisense richting overgeschreven. Beide richtingen geven aanleiding tot functionele RNA-transcripten van de D4Z4 regio (32). Op deze manieren ontstaan 3 soorten RNA-fragmenten: 1. Korte niet-coderende sense en antisense siRNA en miRNA’s, welke betrokken zijn in de epigenetische repressie van de D4Z4 regio (zie paragraaf 2.5.3). 2. DUX4-full length (DUX4-fl) mRNA 3. DUX4 short length (DUX4-s) mRNA (32).
Afbeelding 8:DUX4 genexpressie. (overgenomen van Gatica L.V. et al., 2016)
2 mRNA's, DUX4-fl (rood) en DUX4-s (groen), ontstaan door alternative splicing. De aterix geeft de cryptische splice site donor aan. Grijs geeft de terminale D4Z4 repeat aan. Exonen (Ex)1,2,3 en het 4qA haplotype, bestaande uit het PAS-signaal (ATTAAA), zijn aangegeven
16
Het DUX4-s mRNA en DUX4-fl mRNA zijn beide stabiele en gepolyadenyleerde RNA-transcripten die het DUX4 ORF omvatten (xv). Het DUX4-fl mRNA omvat zowel de 2 homeodomeinen als het C-terminale domein. Het is toxisch voor somatische cellen. Het is het DUX4-fl mRNA dat aanleiding geeft tot het DUX4-proteïne en geassocieerd is met FSHD-fenotype (Afbeelding 6) (2, 9).
Het DUX4-s mRNA omvat de 2 homeodomeinen maar maakt gebruik van een andere ‘splice donor site’ (xvii) dan het DUX4-fl mRNA. Hierdoor verliest het de C-terminale regio en is het niet toxisch (Afbeelding 8) (9). DUX4-s mRNA kan men zowel in myogene FSHD-cellen als in myogene cellen van gezonde personen terugvinden. Daarnaast is DUX4-s teruggevonden in ander weefsel van gezonde personen, naast skeletspiercellen. Zo heeft men het gevonden in cellen afkomstig van het hart, ovaria en eierstokken. DUX4-s expressie is in tegenstelling tot DUX4-fl niet beperkt tot myogene cellen (9).
De reden waarom DUX4-s teruggevonden wordt in gezonde cellen heeft te maken met de epigenetische repressie van de DUX4 regio in gezond weefsel. Tijdens het proces van RNA-splicing wordt gebruik gemaakt van een niet klassieke, cryptische splice donor site. In normale omstandigheden krijgt deze cryptische splice donor site geen voorkeur ten opzichte van de normale splice donor site, welke gebruikt wordt voor de aanmaak van DUX4-fl. De suppressie van de D4Z4 regio in gezond en gedifferentieerd weefsel zorgt ervoor dat de normale splice donor site onderdrukt wordt. Dit geeft aanleiding tot het gebruik van de cryptische splice donor site en het ontstaan van DUX4-s mRNA (9) (Afbeelding 9).
Expressie van DUX4-fl mRNA is toxisch. In de meeste gevallen beperkt de expressie zich tot de myogene cellen van FSHD-patiënten. In beperkte mate is het ook teruggevonden in myogene cellen van gezonde eerstegraadsverwanten van FSHD-patiënten. De concentratie van het DUX4-fl mRNA was echter veel lager dan bij patiënten (8, 35). Myogene cellen van FSHD-patiënten brengen bovendien niet allemaal DUX4-fl tot expressie. Minder dan 5% van de myogene cellen brengt DUX4-fl mRNA tot expressie en meer dan 95% van de cellen is in staat de expressie te onderdrukken. Meer dan 95% van de myogene FSHD-cellen is in staat om DUX4-fl mRNA op een adequate wijze te onderdrukken (9, 30). Het is het sporadisch falen in de suppressie van DUX4 in deze subset van de cellen die aanleiding geeft tot enorme pieken van DUX4 expressie, welke bursts worden genoemd. De sporadische expressie van DUX4 in een beperkt aantal cellen is voldoende om het FSHD-fenotype te veroorzaken. Dit alles wijst erop dat expressie van DUX4 geen ongereguleerd proces is. Timing en hoeveelheid zijn bepalend in de pathogenese van FSHD (36).
17
2.6.2 Skeletspierspecificiteit
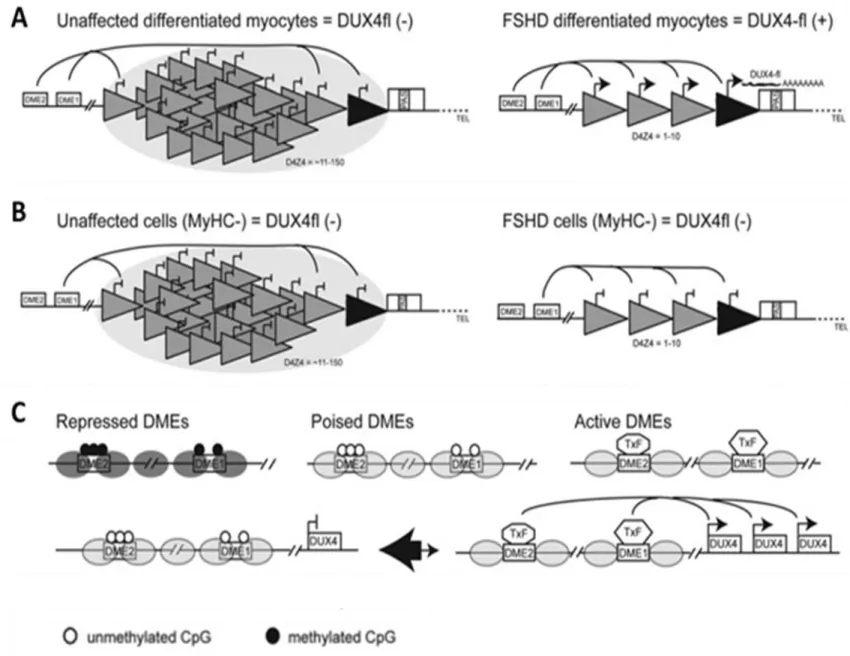
De vraag die zich opdringt is waarom DUX4-fl enkel tot expressie komt in skeletspiercellen van FSHD-patiënten, hoewel DUX4-s mRNA ook in ander somatisch weefsel teruggevonden kan worden. Dit heeft te maken met de aanwezigheid van skeletspier specifieke enhancersxxiv, gelegen
upstream van het DUX4-gen (DME1 en DME2) (36). Deze skeletspier specifieke enhancers kunnen zich in 3 verschillende toestanden bevinden: actieve toestand, permissieve toestand en repressieve toestand (zie addendum 3: Figuur B) (36). In gedifferentieerde myogene cellen bevinden de enhancers zich in een permissieve staat, ze zijn gehypomethyleerd maar wel bezet met nucleosomen. In normale omstandigheden is er geen interactie mogelijk tussen de enhancers en de D4Z4 repeats door de sterke repressie van de D4Z4 regio (30, 36). FSHD wordt gekenmerkt door relaxatie van de D4Z4 repeats met een daling van de repressie. Dit maakt interactie mogelijk tussen de myogene enhancers en de D4Z4 repeats. De trigger die zorgt voor interactie tussen de enhancers en de D4Z4 regio is nog onbekend (36)
2.7 Vraagstelling
DUX4 is toxisch voor somatische cellen en verantwoordelijk voor de kliniek van FSHD. De expressie van DUX4 is echter een complex gegeven dat sterk gereguleerd is. De expressie gebeurt op een stochastische manier met slechts sporadische expressie en dit in minder dan 5% van de cellen. Dit alles maakt een effectieve therapie moeilijk.
Momenteel bestaat er nog geen effectieve behandeling voor FSHD. De huidige therapie is symptomatisch en gericht op het verbeteren van de kracht en functie van de aangetaste spieren. Specifieke spieroefeningen op maat van de patiënt zijn aangewezen. In geselecteerde gevallen kan bepaalde chirurgie ook helpen om de symptomen van de aandoening te verlichten (6). De laatste jaren is de kennis over de genetische en epigenetische achtergrond van FSHD enorm toegenomen en heeft men meer en meer inzicht gekregen in de pathogenese van de aandoening. Daarnaast is de kennis en ervaring met targeted therapie sterk gegroeid. Targeted therapie is een behandeling met medicatie die de synthese van specifieke cellulaire componenten, karakteristiek voor de aandoening van een individu, blokkeert of ermee interageert. Op deze manier stopt of onderbreekt het de specifieke biochemische dysfunctie die betrokken is in de progressie van de ziekte. De vraag naar een effectieve doelgerichte therapie in de behandeling van FSHD stijgt.
18
Deze masterproef kijkt naar de mogelijkheden om via targeted therapie in te grijpen in het moleculaire proces dat de basis vormt voor FSHD. Waar en hoe kan men met doelgerichte therapie ingrijpen en wat zijn de tot nu toe geëvalueerde gevolgen hiervan?
Door de complexe pathogenese van FSHD zijn er zeer veel mogelijkheden voor doelgerichte therapie. Deze masterproef beperkt zich tot het evalueren van onderzoeken die als doel hebben het onderdrukken van de expressie van DUX4-fl mRNA bij FSHD1 patiënten. Alleen targets gelegen op het niveau van de epigenetica, het DNA en RNA worden besproken. Op deze niveaus kan men het meest specifiek ingrijpen ter hoogte van de oorzaak zelf, de genetische en epigenetische mechanismen. De restrictie tot FSHD1 patiënten wordt ingevoerd omdat zij 95% van de FHSD-patiënten vormen. Restrictie tot DUX4-fl werd ingevoerd omdat dit proteïne verantwoordelijk is voor het merendeel van de klachten. Therapie die de activiteiten van DUX4 tegengaat op eiwit-niveau, therapie specifiek voor patiënten met FSHD2 of therapie gericht op het onderdrukken van DUX4C vallen buiten de scope van deze studie.
19
3 Methode
Voor het schrijven van de narrative review werden artikels gezocht in Pubmed, Web of Science en Embase. Als zoektermen werden ‘facioscapulohumerale dystrophy’, ‘targeted therapy’, ‘gene therapy’ gebruikt. Alle termen werden zowel als MeSH termen gebruikt en als ‘zoekterm’ in de titel of de abstract van artikels. Alle termen werden zowel in het enkelvoud als in het meervoud door de zoekmachines gehaald. Er werd gebruik gemaakt van de functies ‘restrict to mesh major topic’ en de subheadings ‘therapy’ en ‘farmacology’. Daarnaast werd de zoekstrategie opgeslagen en werd maandelijks gekeken tijdens het schrijven van de review of er geen nieuwe relevante artikels bijgekomen waren. Triage van de resultaten gebeurde op basis van titel, abstract, publicatietype, kwaliteit en datum van publicatie. Artikels mochten geen case-control studie zijn of review, moesten gepubliceerd zijn in een Q1 of Q2-tijdschrift en mochten niet ouder zijn dan 10 jaar. Een uitzondering hierop is de inleiding waarin reviews werden gebruikt. Andere reviews en oudere artikels, niet gebruikt wegens te gedateerd maar wel relevant voor de onderzoeksvraag, werden gebruikt voor het zoeken naar recentere artikels. Dit werd gedaan door te zoeken naar artikels die de geëxcludeerde artikels citeerden. Zowel in vitro als in vivo studies werden geïncludeerd. De artikels moesten handelen over de moleculaire achtergrond van en/of de mogelijke moleculaire therapieën voor FSHD in het algemeen of specifiek voor FSHD1. In het totaal werden op deze manier 85 artikels geselecteerd. Van deze artikels werden uiteindelijk 47 artikels gebruikt voor het schrijven van de ‘narrative review’. Reden voor het wegvallen van artikels na selectie waren: het niet beschikbaar zijn van het volledige artikel, te kleine studiepopulatie, dubbel door geselecteerd in meerdere databanken, buiten de scope van de onderzoeksvraag.
20 Afbeelding 9: Prisma flow diagram
21
4 Resultaten
4.1 FSHD-modellen
Het doel van deze studie is het zoeken naar interventieplaatsen voor targeted therapie die aangewend kunnen worden bij mensen. Alvorens er humane klinische trials kunnen gepland en uitgevoerd worden, moet de interventieplaats uitgebreid getest worden in vitro en in vivo. In vitro, testen op cellulair niveau, en in vivo, testen op dieren, zijn essentieel bij genetische aandoeningen zoals FSHD. Ze laten toe inzicht te krijgen in de verschillende ziektemechanismen van een bepaalde pathologie. Daarnaast zijn ze noodzakelijk om mogelijke therapieën te testen ter voorbereiding van klinische trials. In vitro testing beslaat testen uitgevoerd buiten het lichaam van een organisme. FSHD wordt in vitro voornamelijk nagegaan in spiercellijnen die gemaakt worden om DUX4 tot expressie te brengen. In vivo testen van FSHD is lang een uitdaging geweest door de afwezigheid van een representatief diermodel. De complexiteit van de aandoening heeft het maken van een diermodel die de ziekte in zijn totaliteit weergeeft vertraagd. In vivo testen van targeted therapie gebeurt daarom vaak in modellen die slechts specifieke aspecten van de aandoening weergeven. Recent is men erin geslaagd een representatief en levensvatbaar transgeen diermodel te maken dat vergelijkbaar is met het FSHD-fenotype.
4.1.1 Diermodellen met deelaspecten van FSHD
4.1.1.1 AAV-muismodellenAfbeelding 10: AAV-vectoren (aangepast van Ansseau et al., 2015): BOVEN: 1ste generatie AAV-vectoren met CMV-promotor en
SV40 polyA-signaal. Het DUX4 ORF is aan het 3’einde getagd met V5-tag, op deze manier produceren ze een DUX4-fl dat aan zijn carboxyl-einde gefuseerd is met het V5 epitoop.ITR: AAV2 inverted terminal repeats. ONDER: 2de generatie AAV-vectoren die de
terminale D4Z4 repeat en de pLAM sequentie recapituleert, maar zo gemaakt opdat het DUX4 produceert carboxy-terminaal gefuseerd met V5-epitoop.
1
stegeneratie AAV-vectoren
22
Bij AAV-muismodellen injecteert men een muis met een AAV-vector die een specifiek miRNA bevat. Bij FSHD1 brengt de AAV-vector miDUX4 tot expressie. Op deze manier geven ze aanleiding tot productie van het DUX4-proteïne in het muismodel. De eerste generatie staat onder sterke virale controle via een CMV-promotor en SV40 polyA-signaal (Afbeelding 11). Dit in vivo model geeft aanleiding tot een hoge expressie van DUX4-fl. Het heeft histologische en functionele kenmerken van FSHD (37). Nadelen zijn dat de hoge DUX4-fl expressie in de cellen van dit model niet overeenkomen met de lage concentraties van DUX4-fl in een beperkt aantal FSHD1-cellen. Deze vectoren zijn niet bruikbaar voor humane gentherapie (38). Ze kunnen enkel gebruikt worden om de effecten van DUX4-fl te evalueren, aangezien hier enkel DUX4-fl tot expressie komt. De aanmaak van DUX4-s vereist namelijk ‘alternative splicing’, waarvoor elementen uit de 3’UTR aanwezig moeten zijn (zie paragraaf 2.6).
De 2de generatie AAV-vectoren bevatten in plaats van de CMV-promotor en SV40 polyA de D4Z4
promotor en de 3’UTR met onder andere DUX4 exon 2 en 3 en het natuurlijke PAS-signaal (Afbeelding 11). Deze 2de generatie vectoren kan wel gebruikt worden voor onderzoek naar
humane gentherapie en is een betere representatie van de genetica achter FSHD (20).
4.1.1.2 Spier xenografts
Dit in vivo model omvat de transplantatie en regeneratie van humane skeletspiercellen in immuundeficiënte muizen. Na transplantatie en regeneratie ziet men dat meer dan 90% van de nuclei, satellietcellen en myonuclei in het getransplanteerde gebied afkomstig zijn van de mens (39). Xenograft spieren hebben een andere baseline expressie dan humane biopsies maar de relatieve waarden van FSHD vs. donor biopten en die van FSHD vs. donor xenografts zijn vergelijkbaar (39). Dit model is bruikbaar voor studies die kijken naar moleculaire uitkomsten.
4.1.2 Transgeen FSHD-muismodel
DUX4 is een primaat specifiek proteïne. In muizen bestaat er een DUX4 homoloog, nl Dux. DUX4 en Dux hebben een partiële functionele homologie. Deze homologie is echter te gering opdat Dux representatief zou zijn voor humaan DUX4 (40). Een transgeen muismodel dat humaan DUX4 tot expressie brengt is noodzakelijk. Het maken van een transgeen muismodel heeft lang geduurd. De belangrijkste redenen hiervoor zijn: de primaatspecificiteit van DUX4 en de toxiciteit van DUX4.
23
Er bestaan vier levensvatbare transgene FSHD-muismodellen, elk met specifieke kenmerken (zie addendum 2). Alle vier de modellen vertonen expressie van DUX4 mRNA in hun skeletspiercellen. De drie meest recente transgene muizen hebben belangrijke kenmerken van het FSHD-fenotype zoals spierzwakte, inflammatie en fibrose. Ze geven een representatie van mild, matig of ernstig FSHD-fenotype (41-44) .
4.2 Therapieën
24
Binnen facioscapulohumerale musculaire dystrofie zijn er verschillende mogelijke interventieplaatsen die men kan gebruiken voor targeted therapie (Afbeelding 11). Het doel van de targeted therapie is een effectieve behandeling die meer is dan louter symptomatisch en invloed heeft op de moleculaire mechanismen achter de aandoening.
In deze paper ligt de focus op therapieën die het DUX4 proteïne onderdrukken. Onderdrukking van het DUX4 proteïne kan op verschillende niveaus (Afbeelding 11) Therapieën die ingrijpen ter hoogte van de epigenetica, het DNA en het mRNA worden besproken. Therapieën die ingrijpen ter hoogte van het DUX4 proteïne, zijn activiteiten en zijn targets vallen buiten de scope van deze paper. De mogelijke therapieën werden geëvalueerd op effectiviteit en veiligheid. Effectiviteit werd nagegaan aan de hand van veranderingen in de epigenetica, de concentratie van DUX4-fl mRNA en DUX4 targets (ZSCAN4, TRIM43, MBD3L2). Veiligheid werd nagegaan aan de hand van effecten op de spierdifferentiatie en de aanwezigheid van off-targets.
4.2.1 mRNA
Ter hoogte van het mRNA kan men ingrijpen via antisense oligonucleotiden (AO) of small molecules.
4.2.1.1 Antisense oligonucleotiden
Antisense Oligonucleotiden (AO) zijn korte enkelstrengige DNA-achtige moleculen van 8-30 basenparen lang. Ze kunnen chemisch gemodificeerd worden om specifiek te interfereren met mRNA verwerking en stabilisatie. AO gaan selectief hybridiseren met pre-mRNA of mRNA via baseparing. AO werken via (1) exon skipping, (2) splice modulatie of (3) interferentie tijdens het proces van cleavage and polyadenylatie (CPA) (21, 24, 45). De laatste twee werkingsmechanismen zijn mogelijk binnen FSHD1. Exon skipping is geen mogelijke therapie bij FSHD1. De reden hiervoor is dat de coderende sequentie van DUX4 volledig binnen het eerste exon is gelegen (21).
Moeilijkheden bij het gebruik van AO als mogelijke strategie bij FSHD zijn dat AO moeilijke door de membraan dubbellipide structuur van cellen gaan. FSHD-cellen hebben geen afwijkingen ter hoogte van hun membraanstructuur. Dit in tegenstelling tot andere gekende spierdystrofieën zoals Duchenne musculaire dystrofie (DMD), waarbij afwijkingen beschreven zijn die de cel penetrantie bevorderen (21). De beperkte cel penetrantie zorgt ervoor dat de dosis die de cellen uiteindelijk binnendringt laag is. Voor het verkrijgen van een therapeutisch effectieve dosis en het behoud
25
hiervan moeten AO in hoge en herhaalde dosissen gegeven worden. Dit verhoogt de kans op neveneffecten en off-target effecten.
4.2.1.1.1 Cleavage and polyadenylatie
1. PAS-signaal
Essentieel in de vorming van het DUX4 proteïne is het PAS-signaal. Het PAS-signaal verleent aan het transcript stabiliteit en beschermt het tegen degradatie. Targetten van het PAS-signaal is een goed doelwit om een daling te krijgen van het DUX4 mRNA.
Targetten van het PAS-signaal met AO in FSHD myotuben geeft een significante reductie van DUX4 mRNA en DUX4 target genen (TRIM43, ZSCAN4, MBD3L2) (45). Er is op zijn minst een partiële reductie bij 96% van de genen die significant gestegen zijn in FSHD-myotuben. 89% van de genen die significant gedaald zijn in FSHD-myotuben met AO tegen het PAS-signaal zijn op zijn minst een beetje gestegen in FSHD-myotuben (45). De inhibitie van DUX4 mRNA is dosis afhankelijk (45). Het gebruik van AO toonde weinig off-target effecten en gaf geen verstoring van de cellulaire differentiatie (24, 45). Het gebruik van AO tegen PAS-signaal is pas toxisch bij een dosis van 500 µmol/l terwijl de dosis voor 50% reductie 1-3 µmol/l is. De maximale respons is bij 10-20 µmol/l (45). Hieruit kan men concluderen dat het gebruik van chemisch gemodificeerde AO veilig lijkt in vitro.
AO tegen het PAS-signaal werden in vivo al getest in spier xenografts. Hier zag men een daling van het DUX4-fl mRNA tot bijna ondetecteerbare waarden (45). Het gebruik van chemisch gemodificeerde AO’s is tevens niet toxisch bevonden in klinische trials voor Duchenne musculaire dystrofie (21).
2. AO tegen cleavage site
Er bestaan 3 verschillende cleavage sites (CS) bij FSHD1 patiënten voor de vorming van het primair DUX4 transcript. Deze liggen 16-22 basenparen ‘downstream’ van het PAS-signaal (Afbeelding 5). Eén CS gaf een efficiënte daling van het DUX4 mRNA en DUX4 target genen (ZSCAN4, TRIM43, MBD3L). Hierbij zag men een dosisafhankelijke reductie van meer dan 50%. AO’s tegen de andere 2 CS gaven een minder efficiënte reductie (< 50%) (24). Een mogelijke verklaring voor het verschil in efficiëntie is het verschil in lengte van de primer of het aantal mismatches in AO-design (24). Dit is niet bewezen.
Een off-target onderzoek toonde een lage kans op off-target effecten bij AO gericht tegen alle CS (24). AO’s tegen de CS hadden geen effect op de spierdifferentiatie. Gebruik van AO’s houdt nog een ander risico in: redirectie van de CS met gebruik van een alternatief PAS-signaal. Humaan
26
mRNA bevat vaak meerdere PAS-signalen. Bij redirectie stoppen AO’s het gebruik van de CS, wat het gewenste effect is, maar als gevolg hiervan wordt een alternatieve PAS gebruikt, welke een nieuwe CS genereert. Dit is een gevaarlijk mechanisme dat al oorzakelijk gebleken is in andere aandoeningen waaronder beta-thalassemie en oculofaryngeale musculaire dystrofie (24). De CS die een efficiënte daling gaf in het DUX4 mRNA gaf aanleiding tot redirectie naar een plaats 40 nucleotiden upstream van de normale CS. Het gebruik van deze CS als potentiële therapie is daarom niet verder onderzocht (24).
3. AO tegen downstream sequence element (DSE)
DSE is een U/GU-rijke sequentie gelegen meer dan 30 nucleotiden downstream van de cleavage site (Afbeelding 5). DSE heeft een impact op de efficiëntie van cleavage and polyadenylatie. Dit zou een potentieel doelwit kunnen zijn. AO tegen DSE geven een beperkte daling van het DUX4 mRNA (minder dan 50%) (24). De reden voor de beperkte efficiëntie van AO tegen DSE kan zijn dat DSE gelegen is binnen een gesloten chromatine conformatie, wat chromatine minder toegankelijk maakt voor de AO’s. Dit is echter niet bewezen (24).
4.2.1.1.2 mRNA splicing
mRNA splicing is, naast het proces van CPA, een ander belangrijk proces tijdens de mRNA maturatie (xv). AO kunnen gebruikt worden voor: (1) exon skipping, (2) destabilisatie van mRNA Exon skipping is zoals eerder vermeld geen mogelijkheid binnen FSHD1. De reden hiervoor is dat de coderende sequentie van DUX4 volledig gelegen is binnen het eerste exon. Destabilisatie van het mRNA met inductie van een ‘loss of function’ mutatie is een mechanisme dat wel gebruikt kan worden bij FSHD1 patiënten. ‘Loss of function’ mutaties veroorzaken een vermindering in de hoeveelheid of de functionele activiteit van een eiwit (18). AO veroorzaken een ‘loss of function’ mutatie door het targetten van een splice donor site of een splice acceptor site (21).
AO werden gemaakt tegen splice donor en acceptor site van exon 2 en 3. Twee AO’s gaven een efficiënte daling van het DUX4 mRNA en target genen (MURF, atrogin1, TP53): AO’s tegen splice acceptor site van exon3 (E3) en AO’s tegen splice acceptor site van exon2 (E2). AO’s tegen splice acceptor site van E3 geven een alternatief spliced intron 2. Ze geven een daling van 50% van het DUX4 mRNA. AO’s tegen E2 geven een alternatief spliced intron 2. Ze geven een daling van 30% in het DUX4 mRNA (21). Beide AO werden getest in primaire FSHD myoblasten. De studie van Jennifer Chen (2016) testte ook AO’s voor splice switching. De efficiëntie van DUX4 mRNA
27
suppressie was minder dan AO’s tegen het PAS-signaal en daarom werd hier niet verder op ingegaan (45).
In vivo zijn al testen gedaan met de AO tegen de splice acceptor site van E3 in een muismodel met een lokale myopathie. Co-injectie van AAV-vector die een lokale myopathie veroorzaakt en DUX4 3’UTR bevat met een AO tegen splice acceptor site van E3 gaf een duidelijke daling in het DUX4 mRNA. Ten opzichte van de controle zag men een 30-voudige daling van de hoeveelheid. Echter was er nog steeds een duidelijke hoeveelheid DUX4 mRNA te detecteren (21).
4.2.1.2 Small molecules
Small molecules die gebruikt worden binnen FSHD1 omvatten onder andere siRNA en miRNA. SiRNA’s en miRNA’s zijn essentieel in het proces van RNAi (RNA-interference). AAV-muismodellen zijn AAV-muismodellen gebaseerd op het RNAi-mechanisme. RNAi is een proces waarbij RNA-moleculen genexpressie inhiberen. Dit kan op verschillende manieren en kan zowel transcriptie als translatieprocessen beïnvloeden. RNAi-processen zijn intact bij patiënten met FSHD1 (zie paragraaf 1.5).
Afbeelding 12 : Inhibitie van DUX4 expressie door siRNA’s (aangepast van Jong Won Lim et al., 2015). BOVEN: distale deel van
4q35 regio met D4Z4 repeats. ONDER: uitvergroting van distale D4Z4 repeats met pLAM sequentie. Exons 1-3 worden weergegeven met rechthoeken. Dikke horizontale lijnen komen overeen met DUX4 mRNA. Dunne horizontale lijnen zijn de verschillende sense en antisense D4Z4 transcripten. Richting van transcriptie is weergegeven met pijlen. Korte RNA-fragmenten worden weergegeven met korte verticale lijnen. Endo-RNA geeft de positie van endogene siRNA’s (zie paragraaf 1.5.4) weer. De twee rijen hieronder geven de positie weer van exogeen siRNA’s tegen de D4Z4 regio. De bovenste van deze 2 rijen geeft exogene siRNA’s weer die DUX4 mRNA levels reduceren met ≥50%. De onderste van deze twee rijen geeft exogene siRNA’s weer die minder dan 50% reductie geven van DUX4 mRNA levels. De positie van de siRNA’s wordt weergegeven relatief ten opzichte van de DUX4 TSS (TSS=1)
28 4.2.1.2.1 siRNA tegen coderende DUX4 mRNA-sequenties
De doelwitten hieronder beschreven werden in vitro getest in FSHD2 spiercellijnen. De reden hiervoor is dat epigenetische veranderingen in FSHD1 cellen moeilijk te evalueren zijn. Dilutie van het effect treedt op door de 3 niet gecontraheerde allelen die wel heterochromatine hebben, nl 1 4q allel en 2 10q-allelenxxv. Op chromosoom 10 is ook een D4Z4 tandem repeat array gelegen. In
FSHD2 cellen is er een relaxatie op beide chromosomen, waardoor de effecten beter te evalueren zijn (34, 46).
siRNA tegen DUX4 mRNA coderende sequentie geeft een robuuste daling (≥ 50%) van het DUX4 mRNA in FSHD2 cellen (13, 34) (Afbeelding 12). De daling van het DUX4 mRNA gebeurt 12-24 uur na transfectiexxvi van de cel (34). De daling van het DUX4 mRNA wordt verkregen door directe
degradatie van het transcript (34).
In vivo testing gebeurde in AAV-based muismodellen. De studie van Wallace (2012) gaf een daling van 64% van het DUX4 mRNA en een daling van 90% van het DUX4 proteïne (37). Deze studie maakte gebruik van 1ste generatie AAV-vectoren. De studie van Wallace (2018) maakte gebruik
van 2de generatie AAV-vectoren. Zij gaven een activiteit aan van small molecules in AAV-based
muismodellen (42). Deze laatste studie focuste op veiligheid eerder dan op effectiviteit waardoor de activiteit niet verder is onderzocht.
4.2.1.2.2 siRNA tegen upstream RNA
siRNA tegen RNA afkomstig upstream van de DUX4 coderende sequentie geeft een even robuuste daling van DUX4 mRNA en target genen (ZSCAN4, RFPL2) als siRNA rechtstreeks tegen het coderende DUX4 mRNA (Afbeelding 12) (33, 34). Deze daling werd aangetoond in FSHD2-cellen om de veranderingen beter te kunnen evalueren. De daling gebeurt pas na 3-4 dagen (34). Daling van het DUX4 mRNA tegen de upstream sequenties gebeurt op een andere manier dan siRNA rechtstreeks tegen de coderende sequenties. siRNA gericht tegen de upstream regio’s geeft een suppressie van de transcriptie. Dit doen ze op een DICER/AGO afhankelijke manier (34), met een stijging van repressieve merkers en onafhankelijk van mRNA degradatie. siRNA tegen upstream RNA geeft een stijging van de repressieve merker H3K9me2 methylatie ter hoogte van de upstream regio en nabij de TSS. Deze verandering ziet men niet bij siRNA rechtstreeks tegen het coderende DUX4 mRNA (34). De stijging is gecorreleerd met een toegenomen binding van het AGO2-proteïne (34). Het AGO2-proteïne is een eiwit dat RNAi-gemedieerde silencing kan geven (34). Dit wijst op een correlatie tussen AGO2 binding ter hoogte
29
van de D4Z4 regio en de epigenetische repressie van DUX4 mRNA die men krijgt na het geven van siRNA tegen de regio’s upstream van de coderende mRNA sequentie.
In FSHD1 is er een tekort aan repressieve mechanismen. De AGO2-repressie van het DUX4 mRNA kan gestimuleerd worden door het geven van additioneel exogeen siRNA tegen de upstream RNA’s (34). Deze mogelijke interventieplaats werd nog niet getest in vitro of in vivo.
4.2.1.2.3 Small molecules: veiligheid
Small molecules worden via vectoren in cellen tot expressie gebracht. Het gebruik van AAV-vectoren is reeds veilig gebleken in klinische trials voor kanker (37). Small molecules kunnen echter op zichzelf ook toxisch zijn. Ze kunnen toxiciteit geven op 2 manieren: (1) toxiciteit door saturatie van de natuurlijke miRNA biogenese pathway, en (2) ongewenste sequentie specifieke silencing van off-target genen (38).
Toxiciteit door saturatie van de natuurlijke miRNA biogenese pathway kan men testen in vivo in AAV-based muismodellen. Mens en muis hebben homologe miRNA biogenese en gene-silencing machinerie. Ongewenste sequentie specifieke silencing van off-target genen kan men nagaan enkel in humane cellen en niet in muiscellen aangezien mens en muis andere transcriptomen hebben.
Alle potentiële targets van small molecules moeten op beide onderdelen getest worden. Wallace (2018) testte 2 sequenties die de DUX4 coderende sequenties targetten. Eén van beide gaf aanleiding tot dosis-afhankelijke toxiciteit door oversaturatie van de natuurlijke pathway. Beide sequenties gaven weinig off-targets, evenveel als te verwachten door toeval. De small molecules die de DUX4 niet-coderende sequenties targetten zijn op geen van beide vlakken reeds getest (34).
4.2.2 DNA
Directe inwerking op het DNA kan de epigenetische toestand van de cel veranderen, de chromatine conformatie beïnvloeden en de transcriptie van het DUX4 mRNA onderdrukken. De meeste therapieën werken via een combinatie van de verschillende mechanismen
30
4.2.2.1 CRISPR/dCAS
CRISPR/dCAS is een techniek die de genexpressie beïnvloedt door de epigenetische toestand te veranderen. Via een small guide RNA (sgRNA) wordt een specifieke sequentie in het genoom herkent. Het sgRNA rekruteert vervolgens een CRISPR/dCAS-platform die een transcriptionele effector bezit. Op deze manier wordt een transcriptionele effector in de nabijheid gebracht van een specifiek gen en kan hij de genexpressie op die plaats beïnvloeden (Afbeelding 13) (46) (site (47)).
4.2.2.1.1 Doelwitten
In myogene FSHD1-cellen wordt gebruik gemaakt van een transcriptionele repressor (dCAS9-KRAB). sgRNA gericht tegen de promotor, direct upstream van exon 1 (#6), of sgRNA gericht tegen NDE/exon 1 (#3-5) geven een daling tot 45% van de endogene DUX4-fl expressie (Afbeelding 14) (46). Deze sgRNA’s gaven daarnaast een daling tot 35-60% van de DUX4 target genen (TRIM 43, ZSCAN4, MBD3L). NDE is een regio gelegen net upstream van de D4Z4 array
Afbeelding 13 werkingsmechanisme CRISPR/dCAS (overgenomen van abm, 2016 [online afbeelding]): sgRNA target
een specifieke sequentie in het DNA en rekruteert dCAS9, welke gefuseerd is aan een transcriptionele effector (oranje bol). De transcriptionele effector kan zowel een transcriptie activator (blauwe bol) als een transcriptie repressor (rode bol) zijn van een gen gelegen in de buurt van het target DNA. (15/11/2019,
31
(Afbeelding 14). Het gebruik van CRISPR/dCAS heeft weinig off-target effecten en heeft geen effect op de spierdifferentiatie (46). Andere mogelijke targets upstream van D4Z4 repeats of binnen DUX4 D4Z4 repeats gaven geen duidelijke daling van het DUX4 mRNA.
In vivo werden deze mogelijkheden nog niet getest. De grootste uitdaging bij de CRISPR/dCAS-techniek is het leveren van dCAS9 in de cel (35, 46).
4.2.2.2 Multiproteïne complexen
Een multiproteïne complex is een complex van verschillende eiwitten die na assemblage een functionele eenheid vormen.
4.2.2.2.1 NuRD (Nucleosome remodeling deacetylase)
NuRD is een multiproteïne complex dat chromatine remodelling en histon deacetylase activiteit geeft. NuRD bindt gemethyleerd DNA via zijn MBD2 subunit. Binding van NuRD complex ter hoogte van de D4Z4 regio is betrokken in de repressie van DUX4-fl mRNA (48). Verschillende componenten van het complex zijn essentieel in de onderdrukking van DUX4 mRNA in FSHD1 myocyten. Echter, niet al deze componenten zijn essentieel in de onderdrukking van het DUX4 mRNA in controle myocyten. FSHD1-cellen zijn dus gevoeliger voor derepressie van controle cellen (34, 49).
Afbeelding 14: Targets CRISPR/dCAS9 (aangepast van Himeda et al., 2016): Weergave van de 4q35 regio met onderaan
een uitvergroting van enkel de terminale D4Z4 repeat. Locaties van sgRNA sequenties (balkjes) zijn weergegeven relatief ten opzichte van TSS (*) (# 1-11). sgRNA 3-5, gericht tegen NDE en E1, en sgRNA 6 is gericht tegen promotor en intron 2 geven een efficiënte reductie van DUX4 mRNA.
32
4.2.2.2.1.1 NuRD componenten
HDAC1 en HDAC2 (histon deacetylase core proteïnen) zijn nodig voor de deacetylase activiteit van het multiproteïne complex. Uitschakeling van HDAC1 of HDAC2 geeft geen significant effect op de levels van DUX4 mRNA in controle cellen. Gelijktijdige uitschakeling van HDAC1 en HDAC2 geeft een significante stijging (100-voudig) van DUX4 mRNA en activeert DUX4 target genen (ZSCAN4, TRIM43) in controle cellen. Uitschakeling van HDAC1 of 2 geeft een significante stijging van DUX4 mRNA in FSHD1-cellen (≥ 20-voudig), gelijktijdige uitschakeling geeft een 140-voudige stijging in het DUX4 mRNA (48).
CHD4, een ATP-afhankelijke chromatine remodeller, is essentieel in de suppressie van DUX4-fl mRNA in FSHD1 cellen maar niet in controle cellen. Uitschakeling van CHD4 in controle cellen gaf geen toename in DUX4-fl levels, in FSHD1 cellen gaf uitschakeling een 20-voudige toename van de DUX4-fl mRNA levels en activeert target genen (ZSCAN4, TRIM 43) (48).
MBD2, is een proteïne dat gemethyleerd DNA bindt. Uitschakeling heeft geen effect op de DUX4 mRNA levels in controle cellen of in FSHD2-cellen. MBD2 uitschakeling in FSHD1 myocyten geeft een matige maar significante stijging van de DUX4 mRNA levels en target genen (ZSCAN4, TRIM43) (48). Het verschil tussen FSHD1 en FSHD2 cellen wijst op een context afhankelijk effect van DUX4 suppressie (48).
Interfereren met elk van deze componenten via siRNA’s vormt een mogelijke therapie zijn. Dit is nog niet getest in vitro of in vivo.
4.2.2.2.1.2 MBD3L-proteïnen
In FSHD1 is er een bepaalde downstream pathway die de werking van het NuRD eiwitcomplex onderdrukt. De MBD3L-proteïnen zijn een target van DUX4 en stijgen bij DUX4 expressie. Deze eiwitten zijn in staat om de plaats van MBD2 in het NuRD eiwitcomplex in te nemen. NuRD is niet meer tot repressie van DUX4 expressie (48). Dit vormt een autonome feedbackloop: MBD3L stijgt in FSHD1 cellen na DUX4 expressie, dit verhindert de werking van NuRD, wat bijdraagt tot verdere productie van DUX4.
Onderdrukken van MBD3L zou kunnen door gebruik van small molecules of RNAi (48). Deze interventieplaats is nog niet onderzocht in vitro of in vivo.
4.2.2.2.2 PcG
PcG (Polycomb group proteïns) bestaan uit 2 klassen van repressieve multiproteïne complexen, nl. PCR1 en PCR2 (respectievelijk Polycomb repressive complex 1 en Polycomb repressive
33
complex 2). Deze groep van multiproteïne complexen is geassocieerd met silencing van genetische regio’s (Afbeelding 7). PCR1 en PCR2 kunnen getarget worden via small molecules.
PCR1 en 2 binding is toegenomen ter hoogte van de D4Z4 regio en ter hoogte van de regio net proximaal van de D4Z4 repeats. De D4Z4 repeats zijn in staat beide PCR-complexen te rekruteren op een nog onbekende manier (19, 33). PCR1 rekrutering ter hoogte van de D4Z4 regio is ‘copy number dependent’. Toename van het aantal kopieën geeft een toename van PCR1 rekrutering (19). PCR2 rekrutering ter hoogte van de D4Z4 repeats is niet ‘copy number dependent’ (19). Een daling van het aantal kopieën geeft geen daling van PCR2 binding.
RNAi-gemedieerde uitschakeling van PCR1 geeft een significante stijging van DUX4 in controle cellen (19). Uitschakeling van PCR1 heeft geen effect op de spierdifferentiatie (19). RNAi-gemedieerde uitschakeling van PCR2 geeft een stijging van DBE-T RNA (33). DBE-T RNA uitschakeling via small molecules geeft een daling van DUX4 mRNA. DBE-T werkt enkel in CIS, exogene toediening van DBE-T RNA geeft geen stijging van DUX4 (33). DBE-T rekruteert ASH1L ter hoogte van de regio upstream van D4Z4 repeat array (33).
4.2.2.3 ASH1L
ASH1L is een methylatransferase die het PCR2 complex antagoniseert (Afbeelding 7) (35, 50). Het is geassocieerd met de activerende merkers H3K36me2 en H3K4me3, die beiden zijn toegenomen in FSHD-cellen (30, 33). Binding van ASH1L geeft een toename van de activerende merkers H3K36me2 en H3K4me3 en antagoniseert de werking van het PCR2 complex (zie paragraaf 1.5) (33). ASH1L kan getarget worden via small molecules (33, 35). Een beperkte daling van ASH1L geeft een significante daling van meer dan 70% in DUX4-fl mRNA levels en van DUX4 target genen (TRIM43, ZSCAN4, MBD3L) in FSHD1 myocyten (35). Tevens ziet men een daling van de methylatie van de activerende merker H3K36 ter hoogte van DUX4 (exon/intron1) en een stijging van de methylatie van exon3. De betekenis van het laatste is tot nu toe ongekend maar het brengt het methylatiepatroon dichter bij het normale (35). ASH1L heeft geen effect op de spierdifferentiatie (35). In de studie van Charis L Himeda (2018) worden ook geen significante off-targets gezien (35). Targetten van ASH1L is nog niet getest in vivo.
Targets die zorgen voor een stijging van PCR1 of PCR2 complex activiteit zouden goede interventieplaatsen zijn voor targeted therapie in FSHD1.Deze mogelijkheid is niet onderzocht in vivo of in vitro.