Androgenen vóór en na gonadectomie bij
transgender vrouwen
Delphine de Meijer en Sarah Nobels Stamnummer: 01309266 - 01413711 Promotor: prof. dr. Guy T’Sjoen
Copromotor: dr. Justine Defreyne en dr. Sarah Collet
Masterproef voorgelegd in het kader tot het behalen van de graad Master of Medicine in de Geneeskunde aan UGent
Deze pagina is niet beschikbaar omdat ze persoonsgegevens bevat.
Universiteitsbibliotheek Gent, 2021.
This page is not available because it contains personal information.
Ghent University, Library, 2021.
Voorwoord
Ongeveer anderhalf jaar geleden zijn we vol goede moed beginnen schrijven aan deze thesis. Bij het opstellen van dit voorwoord is dan ook het einde in zicht. Deze opdracht heeft een mooi resultaat opgeleverd en was vooral zeer leerrijk. Daarom willen we graag de mensen bedanken die ons hebben geholpen doorheen dit traject.
In het bijzonder danken we prof. dr. Guy T’Sjoen (promotor - diensthoofd Endocrinologie UZ Gent) voor zijn klinische blik op onze masterproef. Hij leidde ons in de juiste richting, zodat we deze masterproef succesvol hebben kunnen afwerken. Ook bood hij ons de kans onze resultaten voor te stellen op de Research Day van de dienst Endocrinologie op 4 oktober 2019 te UZ Gent, wat ons veel nuttige feedback heeft opgebracht. Graag bedanken we ook iedereen die toen aanwezig was.
Zonder dr. Justine Defreyne (copromotor - doctoraatsstudente UZ Gent) was onze masterproef niet geworden zoals hij nu is. Zij voorzag ons van de nodige commentaar en heeft ons enorm geholpen met het tot stand komen van de inleiding, methodologie, resultaten en discussie. Ook haar tips en tricks wat betreft de statistiek waren voor ons erg waardevol. Jammer genoeg is onze samenwerking met dr. Defreyne vroegtijdig stopgezet wegens haar zwangerschapsverlof. We wensen haar alle geluk toe met haar kindje.
Met dr. Sarah Collet (copromotor - doctoraatsstudente UZ Gent) kenden we een korte, maar aangename samenwerking. We bedanken haar voor haar hulp en geruststelling wanneer we dit nodig hadden.
Tot slot danken wij elkaar voor de steun en voor de toffe en vlotte samenwerking gedurende anderhalf jaar.
Bedankt,
Delphine de Meijer en Sarah Nobels 12 december 2019
Inhoudsopgave
VOORWOORD ... ABSTRACT ... INLEIDING ... 1 1. TERMINOLOGIE ... 1 1.1 GENDERIDENTITEIT ... 1 1.2 GENDEREXPRESSIE ... 2 1.3 GENDERAMBIVALENTIE ... 2 1.4 GENDERINCONGRUENTIE ... 21.5 GENDER NON-CONFORMITEIT ... 2
1.6 GENDERDYSFORIE ... 2
1.7 TRANSGENDER VERSUS TRANSSEKSUALITEIT ... 3
2. PREVALENTIE ... 4
2.1 VLAANDEREN ... 4
2.2 WERELDWIJD ... 4
3. JURIDISCHE GESLACHTSAANPASSING IN BELGIË ... 5
4. GENDERAFFIRMERENDE ZORG ... 6
4.1 PSYCHOLOGISCHE BEGELEIDING ... 6
4.2 GENDERAFFIRMERENDE HORMONALE THERAPIE ... 6
4.2.1
Algemeen ... 6
4.2.2
Complicaties ... 7
4.3 STEM-EN COMMUNICATIETHERAPIE ... 9
4.4 GENDERAFFIRMERENDE CHIRURGIE ... 9
4.5 REPRODUCTIVITEIT ... 9
5. ANDROGENEN BIJ CISGENDER VROUWEN ... 11
5.1 TOTAAL TESTOSTERON ... 11
5.1.1
De secretie ... 11
5.1.2
Impact van de concentratie ... 12
5.1.3
Testosteron bij trans vrouwen ... 14
5.2 VRIJ TESTOSTERON ... 15 5.3 DHEA(S) ... 15 5.4 SHBG ... 17 VRAAGSTELLING ... 18 METHODOLOGIE ... 19 RESULTATEN ... 23 1. BASELINE KARAKTERISTIEKEN ... 23 1.1 AANTAL ... 23 1.2 LEEFTIJD ... 23 1.3 BMI ... 23 1.4 MEDICATIE ... 23 1.5 TOTAAL TESTOSTERON ... 23 1.6 SHBG ... 23 1.7 VRIJ TESTOSTERON ... 24 1.8 DHEAS ... 24 2. PROSPECTIEF ... 26
2.1 TOTAAL TESTOSTERON ... 26 2.2 SHBG ... 28 2.3 VRIJ TESTOSTERON ... 29 2.4 DHEAS ... 32 2.5 LH ... 35 2.6 FSH ... 36 3. CROSS-SECTIONEEL ... 37 3.1 TOTAAL TESTOSTERON ... 37 3.2 SHBG ... 37 3.3 VRIJ TESTOSTERON ... 37 3.4 DHEAS ... 37 DISCUSSIE ... 38 CONCLUSIE ... 43 REFERENTIELIJST ... 45 BIJLAGEN ... 49
Abstract
Doelstelling
Deze masterproef wenst voornamelijk de evolutie van vrij testosteron en DHEAS voor en na de orchidectomie en het gelijktijdig staken van de androgeendeprivatietherapie te onderzoeken bij trans vrouwen. Dit is tot op heden nog niet beschreven bij deze doelgroep. Tevens wil deze masterproef nagaan of een orchidectomie de testosteronconcentratie al dan niet meer gaat reduceren in vergelijking met het verder geven van anti-androgenen (Androcur) zonder orchidectomie, alsook of deze hormoontherapie en ingreep een invloed uitoefenen op de androgeenproductie van de bijnieren.
Methodologie
Data werden verkregen via de ENIGI-studie. De studiepopulatie werd opgedeeld in 2 groepen: groep A (n = 85) kreeg hormonale therapie (anti-androgenen (cyproterone acetaat, Androcur) en oestrogenen) tot op het moment van orchidectomie. Na de orchidectomie werd de anti-androgene behandeling gestopt en werd enkel de oestrogeentherapie gecontinueerd. Groep B (n = 33) nam gedurende de gehele studietermijn zowel anti-androgenen als oestrogenen in en onderging geen orchidectomie.
Om na te gaan of androgeenconcentraties verschillen tussen trans vrouwen met orchidectomie (groep A) en zonder orchidectomie (groep B) werden de (totale en vrije) testosteron-, DHEAS-, SHBG-, LH- en FSH-concentraties bij deze twee groepen zowel prospectief als cross-sectioneel vergeleken. De hormoonconcentraties werden bepaald bij het eerste bezoek (baseline), bij het laatste bezoek preoperatief (groep A) versus na 12 maanden genderaffirmerende hormoontherapie (groep B) en bij het eerste bezoek postoperatief (groep A) versus na 24 maanden gender affirmerende hormoontherapie (groep B).
Competitieve chemiluminescente immunoassays werden uitgevoerd voor serumtestosteron, Sex Hormone-Binding Globulin (SHBG), Luteïniserend Hormoon (LH) en Follikel Stimulerend Hormoon (FSH). Dehydroepiandrosteronsulfaat (DHEAS) werd gemeten met behulp van electrochemiluminescente immunoassays. Vrij testosteron werd berekend met een formule afgeleid van de wet van massa-actie, gebruikmakend van de totale testosteron serumconcentratie, serum-SHBG en serumalbumine (1). Totaal testosteron is niet informatief gezien de oestrogeen effecten op SHBG.
Resultaten
In groep A (met orchidectomie en stop Androcur postoperatief) daalde het vrij testosteron van baseline (9,62 [7,90 – 11,30] ng/dL) naar preoperatief (0,28 [0,20 – 0,39] ng/dL) (P<0,001) en daalde vervolgens verder naar postoperatief (0,21 [0,14 – 0,36] ng/dL) (P=0,001). In groep B
(zonder orchidectomie en doornemen Androcur) daalde het vrij testosteron van baseline (8,82 ± 3,20 ng/dL) naar 0,35 [0,25 – 0,48] ng/dL na 12 maanden hormonale therapie en bleef stabiel na twee jaar hormonale therapie (P=0,809). DHEAS daalde in groep A van 309,62 ± 139,93 µg/dL op baseline naar 261,50 [154,25 – 370,25] µg/dL preoperatief en daalde verder naar 232,42 ± 112,28 µg/dL postoperatief (P<0,001 resp. P<0,001). In groep B werd tijdens
het eerste jaar hormonale therapie een daling waargenomen vanaf baseline (van 388,97 ±
140,03 µg/dL naar 307,50 [203,50 – 393,75]) (P<0,001), maar werd een stijging opgemerkt gedurende het tweede jaar van hormonale therapie naar 336,26 ± 149,30 (P<0,001). Cross-sectioneel werd zowel voor vrij testosteron (P=0,001) als voor DHEAS (P=0,006) een significant verschil aangetoond indien postoperatief werd vergeleken met 2 jaar hormonale therapie.
Conclusie
Een significante daling van vrij testosteron na inname van cyproterone acetaat en een verdere daling na orchidectomie werd beschreven. Dit impliceert dat een orchidectomie voor een verdere reductie zorgt van de vrije testosteronconcentratie. Indien therapie-ontrouwe personen werden geëxcludeerd, bleef de totale testosteronconcentratie van pre- naar postoperatief stabiel. Dit suggereert dat een orchidectomie het totaal testosteron niet additioneel onderdrukt. Hierbij moet vermeld worden dat de gebruikte meettechniek voor totaal testosteron niet sensitief genoeg was om de lage concentraties aanwezig in deze studiepopulatie voldoende betrouwbaar te detecteren, met implicaties op vrije testosteronconcentraties. Of orchidectomie een additionele bijdrage heeft in de onderdrukking van totale testosteronconcentratie kan niet beantwoord worden omwille van het SHBG-effect van de oestrogeenbehandeling, maar de onderdrukking van vrije testosteronconcentratie is onmiskenbaar groter na orchidectomie in vergelijking met anti-androgeentherapie. DHEAS vertoonde hetzelfde patroon als vrij testosteron, nl. een daling na inname van cyproterone acetaat met een verdere afname na orchidectomie. Dit is een opmerkelijke bevinding en doet een vermoeden rijzen van testiculaire DHEAS-productie.
1
Inleiding
1. Terminologie
1.1 Genderidentiteit
Genderidentiteit is de perceptie van een persoon zijn/haar gender, al dan niet in overeenstemming met het geslacht toegewezen bij de geboorte, op basis van kenmerken van de externe genitalia (2). Bij cisgender personen is de genderidentiteit congruent met het geslacht toegewezen bij de geboorte. Bij transgender personen verschilt de genderidentiteit van het geslacht toegewezen bij de geboorte. Gender is echter geen binair construct waarbij enkel het mannelijk of vrouwelijk gender bestaat, maar moet eerder beschouwd worden als een continuüm (3).
Het genderidentiteitsspectrum omvat een grote variëteit aan opties. Daarom wordt vaak de overkoepelende term ‘transgender’ gehanteerd. Indien men arbitrair een opsplitsing wenst te maken (voor research doeleinden), kan men de groep onderverdelen in trans mannen, trans vrouwen, gender non-binaire personen en travesties (4). Trans mannen, ook transgender mannen genoemd, zijn mensen met vrouwelijk toegekend geboortegeslacht, maar mannelijke genderidentiteit. Trans vrouwen, ook transgender vrouwen genoemd, hebben een mannelijk toegekend geboortegeslacht, maar een vrouwelijke genderidentiteit (4), (5). Gender queer of
non-binaire personen identificeren zich eerder ergens tussen de mannelijke en vrouwelijke
genderidentiteit. Deze groep kan zich noch man, noch vrouw voelen of zowel man als vrouw of soms man, soms vrouw (5), (6).
Cross dressers en travesties zijn personen die zich kleden of gedragen als een ander
gender, maar zich niet per se dagdagelijks als dit gender identificeren. Drag queens en kings behoren hier ook toe, maar hebben eerder een doel van performance. Vrouwen die zich kleden en gedragen als mannen worden veel minder gezien als travestie, afhankelijk van de culturele context (7).
2
1.2 Genderexpressie
Genderexpressie definieert hoe het individu bepaalde aspecten van de genderidentiteit uit naar anderen aan de hand van zijn of haar voorkomen, kledingstijl en/of gedrag in het dagelijkse leven. De genderexpressie hoeft niet conform te zijn met de genderidentiteit (5), (8). Genderexpressie wordt echter vaak beïnvloed door genderstereotypen (8).
1.3 Genderambivalentie
Genderambivalentie is de evenwaardige identificatie met een ander geslacht, als met het geslacht toegewezen bij de geboorte of met geen van beide (9).
1.4 Genderincongruentie
Bij genderincongruentie is de genderidentiteit niet uniform met het geslacht toegewezen bij de geboorte (9).
1.5 Gender non-conformiteit
De mate waarin iemands genderidentiteit of -expressie niet overeen komt met de culturele normen, voorgeschreven voor personen van een bepaald geslacht in een bepaalde maatschappij, horend bij een bepaalde tijdsgeest, noemt men gender non-conformiteit (9).
1.6 Genderdysforie
Wij beperken ons hier tot genderdysforie bij de volwassene en adolescent, aangezien onze studiepopulatie tot deze subgroep behoort. De DSM-V beschrijft genderdysforie bij de volwassene en adolescent als volgt:
“A. Genderdysforie is het ongemak of leed dat wordt veroorzaakt door een discrepantie tussen iemands ervaren of uitgedrukte geslacht en het geslacht van een persoon toegewezen bij de geboorte, dat minstens zes maanden duurt en minimum twee van volgende kenmerken vertoont (2):
3
- Een duidelijk verschil tussen iemands ervaren of uitgedrukte genderidentiteit enprimaire of secundaire geslachtskenmerken (bij jonge adolescenten de te verwachten secundaire geslachtkenmerken).
- Een sterke wens om de primaire en/of secundaire geslachtskenmerken aan te passen,
voortvloeiend uit een duidelijke discrepantie tussen de ervaren of uitgedrukte genderidentiteit (of bij adolescenten: wens om secundaire geslachtkenmerken niet tot uiting te laten komen).
- Een sterk verlangen naar andere primaire en/of secundaire geslachtskenmerken dan
deze conform het geslacht toegewezen bij de geboorte.
- Een sterke wens tot een ander of alternatief geslacht te behoren, verschillend van het
toegewezen geslacht.
- Een sterke wens behandeld te worden als het andere geslacht of als een alternatief
geslacht, verschillende van het toegewezen geslacht.
- Van mening zijn dat men de typische gevoelens en reacties heeft van het andere
gender of van een alternatief gender, verschillend van het toegewezen geslacht. B. Significante stress, sociale, beroepsmatige en andere beperkingen van functioneren gaan hiermee gepaard.” (2)
Niet alle gender non-conforme personen ervaren genderdysforie tijdens hun leven. Daarnaast bestaan er verschillende opties om genderdysforie te verlichten: een aanpassing van de sociale genderrol, wat zich enkel uit in kledij en/of gedrag, een aanpassing van de hormonale status met behulp van genderaffirmerende hormonale therapie of een aanpassing van de externe geslachtskenmerken met behulp van chirurgie (10).
1.7 Transgender versus transseksualiteit
In het verleden werd vaak verwezen naar transgender personen met de term ‘transseksuelen’, maar dit is een verouderde term die in onbruik is geraakt. Transgender zijn heeft immers niets met seksualiteit te maken, maar wordt er wel makkelijk mee verward. Tegenwoordig worden termen als ‘transgender’, ‘trans man’, ‘trans vrouw’, etc. gebruikt (5).
4
2. Prevalentie
2.1 Vlaanderen
Hoewel men vroeger uitging van een lage prevalentie van transgender personen, is genderincongruentie veel frequenter dan uit onderzoek bleek. Dit was hoofdzakelijk te wijten aan de manier van dataverzameling. Oudere studies zoals De Cuypere et al. (2007), rapporteerden het aantal trans personen in België als zijnde 7,74/100.000 trans vrouwen en 2,96/100.000 trans mannen (11), gebaseerd op het aantal personen die genderaffirmerende chirurgie ondergingen in 2003, wat achteraf een onderschatting van de ware prevalentie bleek te zijn.
De studie van Van Caenegem et al. (2015) bevroeg genderidentiteit in een steekproef van de algemene Vlaamse populatie. Deze studie toonde aan dat genderambivalentie aanwezig was in 2,2% en 1,9% van de Vlaamse mannen en vrouwen respectievelijk en dat genderincongruentie aanwezig was in 0,7% en 0,6% van de Vlaamse mannen en vrouwen respectievelijk. Tevens werd gevonden dat binnen de LBG groep (lesbian, bisexual and gay) genderambivalentie en -incongruentie voorkwam bij 1,8% en 0,9% van de Vlaamse mannen en bij 4,1% en 2,1% van de Vlaamse vrouwen respectievelijk (9).
2.2 Wereldwijd
De meta-analyse van Arcelus et al. (2015) toonde aan dat wereldwijd gemiddeld 6,8/100.000 trans vrouwen en 2,6/100.000 trans mannen voorkomen. De landen die geïncludeerd werden, waren: de Verenigde Staten, Zweden, Verenigd Koninkrijk, Australië, Nederland, Polen, Singapore, Duitsland, Spanje, België, Servië en Ierland. Mogelijks was dit zelfs een onderschatting aangezien het voornamelijk ging om personen die klinische hulp zochten (12). Winter et al. (2016) includeerde echter, net zoals de studie van Van Caenegem et al. (2015), hele populaties en rapporteerde prevalentiecijfers gaande van 0,5% tot 1,3% genderincongruente mannen en 0,4% tot 1,2% genderincongruente vrouwen. De landen die hierbij geïncludeerd werden, waren: Verenigde Staten, Verenigd Koninkrijk, Nieuw-Zeeland, Nederland en België (8).
5
3. Juridische geslachtsaanpassing in België
België heeft sinds 2007 een wet betreffende de transseksualiteit. Deze wet stelde de transpersoon ertoe in staat aangifte te doen van zijn of haar geslachtsaanpassing bij de ambtenaar van de burgelijke stand. Bij deze aangifte werd een verklaring van de psychiater en chirurg overhandigd waaruit bleek (13):
1° ‘dat de betrokkene de voortdurende en onomkeerbare innerlijke overtuiging heeft tot het andere geslacht te behoren dan datgene dat is vermeld in de akte van geboorte’;
2° ‘dat de betrokkene een geslachtsaanpassing heeft ondergaan die hem zodanig in overeenstemming heeft gebracht met dat andere geslacht, waartoe betrokkene overtuigd is te behoren, als dit uit medisch oogpunt mogelijk en verantwoord is’;
3° ‘dat de betrokkene niet meer in staat is om overeenkomstig het vroegere geslacht kinderen te verwekken’.
Deze wetgeving verplichtte de transpersoon dus tot een chirurgische geslachtsaanpassing en sterilisatie voor de juridische aanpassing van de geslachtsregistratie of voornaamswijziging, wat absoluut niet conform was met de internationale mensenrechten (13), (14), (15).
Elf jaar later, op 1 januari 2018 trad een nieuwe wetgeving in werking. Deze keer wel conform met de internationale mensenrechten. De wet is vanaf dan namelijk gebaseerd op het principe van de zelfbeschikking. Dit betekent dat de transpersoon zelf beslist of hij/zij zijn/haar geslacht en voornaam juridisch wil aanpassen en dat geen medische diagnose of operatie meer nodig is (14), (15).
6
4. Genderaffirmerende zorg
4.1 Psychologische begeleiding
Psychologische begeleiding kan helpen de genderidentiteit en -expressie te ontdekken en zo de transitie te vergemakkelijken, maar is geen vereiste om toegang te krijgen tot genderaffirmerende zorg (10).
4.2
Genderaffirmerende hormonale therapie
4.2.1 Algemeen
Alleen de feminiserende hormonale therapie wordt hier vermeld aangezien deze masterproef zich toespitst tot trans vrouwen.
Genderaffirmerende hormonale therapie is een geïndividualiseerde therapie, gebaseerd op wat de patiënt wil bekomen, rekening houdend met co-existente morbiditeit, gebruik van andere medicatie en sociaal en economische kwesties (10).
Feminiserende hormonale therapie omvat het gebruik van bio-equivalente oestrogenen (oraal of transdermaal) en anti-androgenen om de endogene testosteronactiviteit te remmen. De meest gebruikte anti-androgenen zijn cyproterone acetaat, spironolactone, en GnRH- agonisten. Cyproterone acetaat (Androcur) werkt niet alleen als antagonist op de testosteronreceptor, maar oefent ook een anti-gonadotrope werking uit, waardoor de hypofyse minder LH en FSH aanmaakt, met het gevolg dat de Leydigcellen minder testosteron aanmaken (16), (17). Spironolactone is niet alleen een kaliumsparend diureticum, maar werkt ook als antagonist op de androgeenreceptor en blokkeert rechtstreeks de secretie van testosteron (18), (17). GnRH-agonisten tenslotte, onderdrukken de GnRH – LH/FSH-as door middel van een korte stimulatie waardoor uitputting van het gonadotropine wordt verkregen. Ook worden ze gebruikt
7
om de puberteit te onderdrukken (18). In Europa is cyproterone acetaat het meest gebruikte anti-androgeen (18).Figuur 2: Effecten van oestrogeen- en anti-androgeen therapie bij transgender vrouwen (20)
4.2.2 Complicaties
Net zoals bij andere therapieën, zijn aan de behandeling met anti-androgenen/oestrogeen ook complicaties verbonden.
Mogelijke bijwerkingen van cyproterone acetaat zijn levertoxiciteit en verhoogde incidentie van depressiviteit (21), (22). Het gebruik van spironolactone kan leiden tot hyperkaliëmie (21). Dit resulteert in een noodzaak tot laboanalyses met controle van elektrolyten, lever-, nier- en sekssteroïdeparameters alsook controle van de bloeddruk. Omwille van deze mogelijke bijwerkingen wordt aangeraden het eerste jaar de hormoonconcentraties te monitoren om de drie maanden en nadien één- of tweemaal per jaar (10), (18). Adequate testosteronsuppressie wordt gekenmerkt door een testosteronspiegel die <55 ng/dL bedraagt.
8
Oudere studies toonden aan dat oestrogeenbehandeling gepaard ging met een verhoogd risico op een thromboembolisch event, coronaire hartziekten en cerebrovasculaire ziekten (18), (23), (24). Een recentere studie heeft echter aangetoond dat dit verhoogde risico te wijten was aan het gebruik van een op vandaag niet meer toegepaste behandeling met ethinyl oestradiol (25). Dit oestrogeen wordt om deze reden niet meer gebruikt in de behandeling van trans vrouwen en is vervangen door 17-ß-oestradiol (18), (23), (24).Een van de redenen voor het optreden van complicaties, is het overschrijden van de voorgeschreven dosis van oestrogenen. Bij sommigen heerst het idee dat een hogere dosis hormonen voor een snellere en betere transitie zou leiden (22). Deze gedachtegang is vaak het gevolg van slechte arts-patiëntcommunicatie. Het is namelijk belangrijk om vooraf de mogelijke uitkomsten en limieten samen te bespreken, zodat de patiënt niet teleurgesteld is in het resultaat. Bij deze bespreking is het cruciaal om de nadruk te leggen op het feit dat er geen lineair verband is tussen fysische veranderingen en hormoondosissen en dat verhoging van de dosis niet voor een betere transitie zorgt. Bovendien houdt de verhoging van hormoondosissen een groot risico in (21), (22). Men kan hierbij benadrukken dat niet iedereen op dezelfde manier reageert op de hormoontherapie, wat mogelijks verklaard kan worden door verschillen in androgeen- en/of oestrogeenreceptoren (26). Na doorgedreven onderzoek zijn er nog steeds geen beïnvloedende factoren geïdentificeerd die het antwoord op de hormoontherapie kunnen voorspellen (27), (28).
Een bijkomende maatregel die genomen dient te worden om complicaties van hormoontherapie te voorkomen, is de hormoonspiegel binnen de fysiologische concentratie van het gewenste geslacht te houden (18), (21). Daarenboven zijn, zoals hierboven reeds aangehaald, regelmatige biochemische controles (serumspiegels van sekssteroïden, lever- en nierparameters) aan te raden. Voor transgender vrouwen vindt screening voor prostaatcarcinoom plaats volgens de richtlijnen toegepast op cisgender mannen. Ook cardiovasculaire risicofactoren moeten opgevolgd en waar nodig behandeld worden, conform met internationale cardiovasculaire richtlijnen (29). Bij patiënten die risico lopen op osteoporose dient de botdensiteit goed te worden opgevolgd (18). Als gevolg van de onenigheid over het risico op borstkanker, is er geen eenduidige richtlijn over het screenen ernaar.
9
4.3 Stem-en communicatietherapie
Deze soort therapie helpt op een veilige manier de stem en communicatie aan te passen, met als resultaat een stem- en communicatiepatroon passend bij de genderidentiteit. Deze therapie is vooral gewenst bij trans vrouwen, aangezien bij trans mannen de exogene androgenen de stem zwaarder en mannelijker maken. Exogene oestrogenen bij trans vrouwen hebben echter niet de eigenschap de stem vrouwelijker te maken (10), (30).
Als met deze therapie geen bevredigende resultaten worden bekomen, kan geopteerd worden voor stemchirurgie. Ook na de operatie wordt stem- en communicatietherapie sterk aanbevolen om het heelkundige resultaat alsnog te verbeteren en de stem op een gezonde manier te gebruiken (10).
4.4 Genderaffirmerende chirurgie
Personen die feminiserende chirurgie wensen, kunnen opteren voor volgende ingrepen: borstaugmentatie (implantaten, lipofilling), genitale chirurgie (penectomie, orchidectomie,
vaginoplastie, clitoroplastie, vulvoplastie) en andere ingrepen zoals faciale
feminisatiechirurgie, stemchirurgie, liposuctie, lipofilling, shaving van de adamsappel, bilvergroting (implantaten, lipofilling), haarreconstructie etc. (10). Hierbij dient opgemerkt te worden dat de keuze om over te gaan tot genderaffirmerende chirurgie gemaakt wordt door het individu.
Er wordt aanbevolen om minstens 12 maanden feminiserende hormonale therapie aan te houden voorafgaand aan de borstaugmentatie. Dit is geen vereiste, maar heeft als doel maximale effecten van de hormonale therapie op de borstontwikkeling te bekomen, vooraleer chirurgisch ingegrepen wordt. Dit zorgt voor betere esthetische resultaten (10).
Daarnaast induceert hormoontherapie voorafgaand aan orchidectomie een periode van reversibele testosteronsuppressie voordat onomkeerbare chirurgie wordt ondergaan (10).
4.5 Reproductiviteit
Aangezien genderaffirmerend therapie een negatief effect heeft op de vruchtbaarheid, is het van belang dit voor het starten van hormonale therapie te bespreken (10).
10
Motmans, Wyverkens & Defreyne (2018) concludeerden een duidelijk verschil in kinderwens naargelang de genderidentiteit. Het verschil tussen trans mannen en trans vrouwen is dat 38,8% van de trans mannen geen kinderen wil en 28,4% in de toekomst kinderen zou willen. 29,1% van de trans vrouwen had reeds een vervulde kinderwens, 8,7% had in het verleden een kinderwens en 11,7% kon deze wens niet vervullen (4). Een verklaring voor deze discrepantie is het verschil in leeftijd tussen de genderidentiteiten: trans mannen zijn bij aanmelding significant jonger en trans personen met een kinderwens zijn gemiddeld jonger dan trans personen zonder kinderwens. Een gonadectomie heeft geen invloed op het hebben van een kinderwens (4). Auer et al. (2018) toont tevens niet alleen een verschil in kinderwens aan tussen trans mannen en vrouwen, maar ook de kinderwens vóór en tijdens de genderaffirmerende therapie is verschillend. Vóór de therapie gaf 46,2% trans mannen aan kinderen te willen krijgen in tegenstelling tot 15,4% trans vrouwen. Na de start van genderaffirmerende therapie waren beide groepen vergelijkbaar, namelijk 25,0% van de trans mannen en 21,9% van de trans vrouwen gaf aan een actuele kinderwens te hebben (31). Opties voor fertiliteitspreservatie bij trans vrouwen zijn cryopreservatie van sperma (i.e. cryopreservatie van geëjaculeerd sperma via masturbatie of vibratoriële stimulatie, post-puberaal), chirurgische sperma-extractie (i.e. percutane aspiratie van sperma van teelballen of bijballen, post-puberaal) en cryopreservatie van onvolgroeid testiculair weefsel (i.e. een11
5. Androgenen bij cisgender vrouwen
5.1 Totaal testosteron
Testosteron behoort tot de groep van de androgenen en is meteen ook het meest potente androgeen (33), (34). Testosteron wordt beschouwd als het mannelijke hormoon omdat de serumconcentratie bij mannen tot 10 maal hoger ligt dan bij vrouwen (33), (35), maar vrouwen zijn gevoeliger aan testosteron dan mannen (33).
5.1.1 De secretie
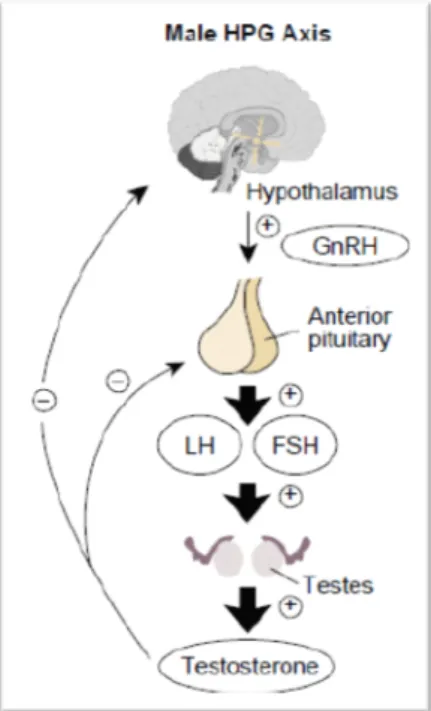
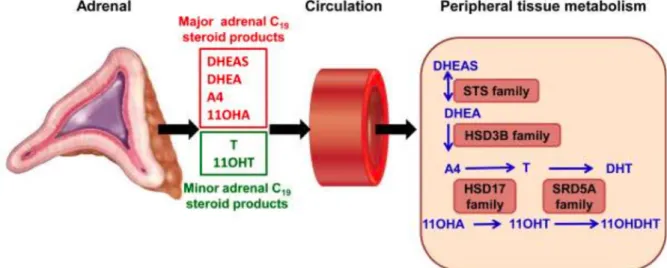
De aansturing tot secretie van testosteron vindt zijn oorsprong in de hypothalamus, zowel bij vrouwen als bij mannen. Hier worden onder andere GnRH (Gonadotropin Releasing Hormone) en CRH (Corticotropin Releasing Hormone) geproduceerd en gesecreteerd. Deze hormonen bereiken via de bloedbaan de hypofyse, namelijk via het hypofysair portaal systeem. GnRH en CRH triggeren de hypofyse om respectievelijk LH (Luteïniserend Hormoon) en ACTH (AdrenoCorticoTroop Hormoon) vrij te stellen (36). ACTH stimuleert de bijnierschors tot aanmaak van DHEAS, dat door enzymatische conversie initieel wordt omgezet in androsteendion en vervolgens in testosteron (33). LH stimuleert in het vrouwelijke lichaam de ovaria tot productie en secretie van testosteron (33), (37) en bij de man stimuleert het de Leydigcellen in de testes (36).
Bij vrouwen produceren de bijnieren en de ovaria ieder 25% van het testosteron en de overige 50% wordt omgezet vanuit androsteendion (voorloper van testosteron) dat zich in de circulatie bevindt (33), (36), (38), (39). Bij mannen wordt het testosteron voor meer dan 95% aangemaakt t.h.v. de testis. Ook bij mannen levert de bijnier een bijdrage aan de productie ervan (36).
De testosteronsecretie volgt een circadiaans ritme met hoge concentraties in de ochtend (33). Er is ook een relatie met de menstruele cyclus, namelijk tijdens de vroege folliculaire fase is de concentratie het laagst, met een piek peri-ovulatoir (33), (36), (38). Ook de menopauze heeft een zekere invloed op de testosteronconcentratie bij cis vrouwen (35). Door de toename van LH tijdens de menopauze is er een stijging waar te nemen in de testosteronconcentratie. Daarenboven is er een daling in het SHBG (Sex Hormone Binding Globulin, het eiwit waaraan testosteron met hoge affiniteit bindt), waardoor het vrije testosteron stijgt van premenopauzaal
12
naar postmenopauzaal (35), (36). Ondanks deze stijging tijdens de menopauze, verlaagt de testosteronsecretie met de leeftijd. Deze daling wordt ook waargenomen bij mannen (33), (34), (36), (37), (38), (39), (40).5.1.2 Impact van de concentratie
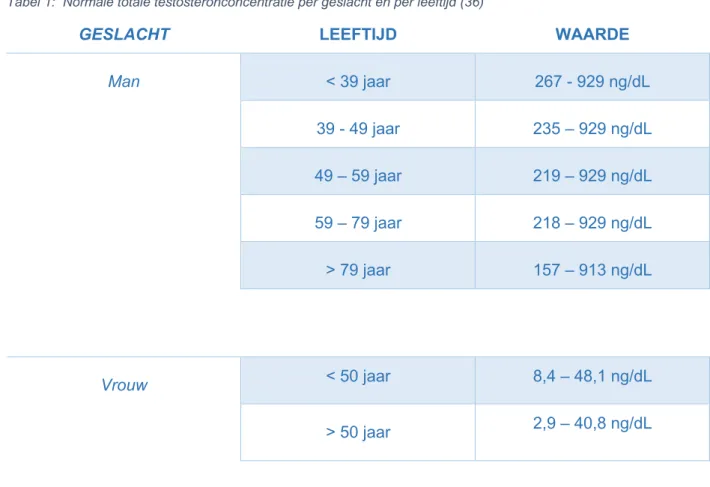
Testosteronconcentraties kunnen interindividueel verschillen. Het totaal testosteron verschilt naar gelang het geslacht en de leeftijd van het individu. Voor mannen jonger dan 39 jaar is dit 267-929 ng/dL, tussen 39-49 jaar 235-929 ng/dL, tussen 49-59 jaar 219-929 ng/dL, tussen 59-79 jaar 218-929 ng/dL en boven de 59-79 jaar 157-913 ng/dL. Vrouwen jonger dan 50 jaar hebben een totale testosteronconcentratie van 8,4-48,1 ng/dL en vanaf 50 jaar wordt dit 2,9-40,8 ng/dL (41).
Tabel 1: Normale totale testosteronconcentratie per geslacht en per leeftijd (36)
GESLACHT LEEFTIJD WAARDE
Man < 39 jaar 267 - 929 ng/dL 39 - 49 jaar 235 – 929 ng/dL 49 – 59 jaar 219 – 929 ng/dL 59 – 79 jaar 218 – 929 ng/dL > 79 jaar 157 – 913 ng/dL Vrouw < 50 jaar 8,4 – 48,1 ng/dL > 50 jaar 2,9 – 40,8 ng/dL
Een suprafysiologische of subfysiologische testosteronconcentratie kan bij vrouwen pathologisch zijn. Er is grote onenigheid over de normale ranges van testosteron bij de vrouw (37).
13
Te hoge concentraties
Polycystisch ovarieel syndroom (PCOS) is een frequent voorkomende endocrinologische
en gynaecologische aandoening bij vrouwen in reproductieve leeftijd (42). Kenmerkend is een ovariële dysfunctie, gekarakteriseerd door onder andere hyperandrogenisme (te hoge concentratie aan vrij testosteron) en polycystische ovaria (42), (43), (44), (45). Hoewel PCOS echografische en biochemische kenmerken heeft, wordt de diagnose klassiek gesteld aan de hand van de Rotterdam criteria (minstens 2/3 criteria dienen aanwezig te zijn om de diagnose te bevestigen): onregelmatige menses, tekenen van hyperandrogenisme en/of obesiteit (44). De aandoening gaat gepaard met een verhoogd risico op morbiditeit, voornamelijk het ontwikkelen van diabetes mellitus type 2, obesitas, hypertensie en metabool syndroom (37), (42), (45), (46).
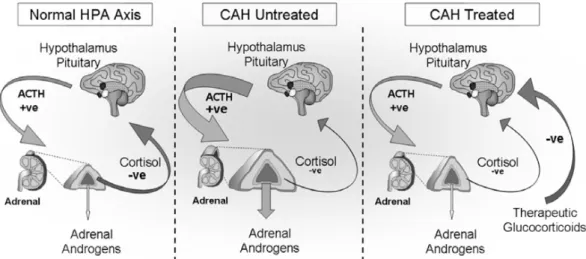
Verhoogde testosteronspiegels worden ook gezien bij congenitale adrenale
bijnierhyperplasie (CAH). CAH is gekenmerkt door een deficiëntie van een enzyme, meestal
21-hydroxylase, maar minder frequent ook door 5- en 11-hydroxylase (47), (48). Door de deficiëntie kan er geen cortisol worden aangemaakt. Het feedbackmechanisme zorgt vervolgens voor ACTH-dependente stimulatie van de bijniersecretie, wat leidt tot hyperplasie van de bijnier en overproductie van cortisolvoorlopers tot op het niveau van de defecte enzymatische stap. Deze voorlopers stapelen op en worden via een andere pathway omgezet tot DHEAS, androstenedion en testosteron (49), (50).
14
Het feit dat depressies vaker voorkomen bij vrouwen dan bij mannen, deed de vraag rijzen of er enig verband was met geslachtshormonen. Het verschil in het aantal depressies tussen de geslachten is het grootst rond de leeftijd van 50-59 jaar. Dan heeft 48% van de vrouwen versus 24% van de mannen klachten van depressiviteit, een ongelukkig gevoel of droefheid (34). Onderzoek wijst uit dat er wel degelijk een verband bestaat tussen testosteron en depressie; zowel lage (34), (35), (52) als hoge (34), (53), (54) hoeveelheden vrij testosteron werden in verband gebracht met depressie (34). Bij vrouwen met een hoge serumconcentratie aan vrij testosteron daalde deze concentratie na inname van antidepressiva naar vrouwelijke ranges (53).Te lage concentraties
Een lage hoeveelheid testosteron kan voorkomen na bilaterale oophorectomie. Dit is een bilaterale wegname van de eierstokken. Vrouwen die deze ingreep hebben ondergaan, hebben een grotere kans op een laag testosteron (50-80% daling) (34), (37), (38), (39), (55), omdat de eierstokken een bron zijn van het androgeen (55).
Zowel in kader van bilaterale oophorectomie als in het algemeen is er enige tegenstrijdigheid of lage concentraties van testosteron aanleiding kunnen geven tot veranderingen van het
seksueel verlangen (34), (37), (38), (40), (39), (55), (56). Er is een complexe associatie
tussen testosteron en seksueel verlangen (38), (56), maar men moet zich bewust zijn van het belang van de (sociale) context rondom de patiënt (39), (56). Ook vrouwen op orale
contraceptie (al dan niet met anti-androgenen) kunnen klachten vertonen van een laag libido,
als gevolg van de testosteron daling (57), (58).
Evenzeer osteoporose en een grotere hoeveelheid lichaamsvet kunnen zich gaan ontwikkelen bij lage concentraties van het hormoon (34).
Zoals hierboven reeds beschreven, is er een mogelijkheid dat zowel lage concentraties testosteron als hoge concentraties aanleiding kunnen geven tot depressie (34).
5.1.3 Testosteron bij trans vrouwen
Transgender personen die verlangen om fysische kenmerken van het gewenste geslacht te ontwikkelen, kunnen opteren voor hormoonbehandeling (21). Anno 2011 had 71% van de trans vrouwen toegang tot hormoontherapie (59).
15
Het doel van de feminiserende hormonale therapie is voornamelijk om de endogene hormoonspiegel van testosteron te laten dalen naar hormoonspiegels die overeenkomen met deze van het gewenste geslacht, namelijk vrouwelijke hormoonspiegels. Dit zorgt voor de regressie van de secundaire mannelijke geslachtskenmerken en het ontwikkelen van vrouwelijke secundaire geslachtskenmerken (18), (21), (23): onder andere borstgroei, een vrouwelijke vetdistributie en het verminderen van masculiene haargroei (18) (23), (60) (cfr.figuur 2).
5.2 Vrij testosteron
Vrij testosteron is het testosteron dat niet gebonden is aan bindingsproteïnen zoals SHBG en albumine. Ook wel het actieve of biologisch beschikbaar testosteron genoemd (36). Dit gaat om 2% van het totale testosteron (36). Meestal ligt de vrije testosteronconcentratie bij vrouwen tussen 0,02-0,064 ng/dL (33) en bij mannen tussen 6-25 ng/dL (41).
Bij volwassenen mannen staat (vrij) testosteron in voor de aanmaak van sperma, alsook voor genactivatie in Sertolicellen die de differentiatie van spermatogonia stimuleren (61), (62). Vrij testosteron kent een leeftijdsgeassocieerde daling. Bij gezonde mannen verminderen de serumconcentraties namelijk met 50% tussen de leeftijd van 25 en 75 jaar. Dit komt neer op een daling van 1,2% per jaar, in tegenstelling tot serumconcentraties van totaal testosteron die relatief stabiel blijven tot de leeftijd van 55 jaar en vervolgens afnemen met 0,85% per jaar. Deze sterkere reductie in serumconcentratie van vrij testosteron is te verklaren door de leeftijdsgeassocieerde stijging in SHBG-concentratie (36).
5.3 DHEA(S)
Dehydroepiandrosterone (DHEA) is een steroïde dat geproduceerd wordt door de bijnier, in de zona reticularis. De testes blijken ook een bron voor DHEA te zijn (36), (63), (64), (65), maar dit zou niet het geval zijn voor de ovaria volgens Cumming et al. (1982) (66). Echter, Labrie et al. (2010, 2017) (67), (68) meent dat de ovaria wel bijdragen in DHEA-productie. Postmenopauzaal zelfs voor 20% van het DHEA (68).
DHEA heeft drie werkingsmechanismen. Allereerst werkt DHEA als precursor voor actieve androgenen (nl. testosteron). Dit steroïde heeft zelf een licht androgene werking, maar wordt
16
in de perifere weefsels omgezet naar meer potente androgenen. Bij de man treedt deze conversie op ter hoogte van de prostaat, de testes en de haarfollikels (36). Bij de vrouw zou dit in elk perifeer weefsel gebeuren (68), behalve in de baarmoeder (67). Ten tweede werkt DHEA ook als een neurosteroïde in het centraal zenuwstelsel en ten derde wordt DHEAgebruikt als ligand voor een specifieke DHEA-receptor (36).
DHEAS (dehydroepiandrosteronsulfaat) is de gesulfateerde vorm van DHEA en wordt gesecreteerd in de circulatie. Het enzym sulfotransferase (SULT2A1) is verantwoordelijk voor deze sulfatering en bevindt zich voornamelijk in de lever, de dunne darm en de adrenale cortex (69), (70). Omgekeerd ontstaan slechts kleine hoeveelheden DHEA uit DHEAS, wat suggereert dat veranderingen in circulerend DHEAS niet per se veranderingen in beschikbaar
DHEA teweegbrengen (36), (65).
Net zoals testosteron dalen DHEA en DHEAS met toenemende leeftijd (37), (71). Bij vrouwen zou de DHEA-secretie gemiddeld 60% gedaald zijn bij start van de menopauze en daarna nog verder dalen (68). Echter, studies tonen aan dat het begin van de menopauze gepaard gaat met een lichte stijging van DHEAS met opnieuw een daling naar het einde toe (37), (71). Deze stijging werd ook gezien bij vrouwen die een bilaterale oophorectomie ondergingen. De fysiologische rol van deze veranderingen is nog niet duidelijk (37). Tevens kan een laag DHEAS aanleiding geven tot symptomen van depressie (52).
17
5.4 SHBG
SHBG of Sex Hormone-Binding Globulin is geen androgeen, maar een transportproteïne dat testosteron bindt en zo een onderscheid maakt tussen gebonden, niet werkzaam testosteron en vrij, werkzaam testosteron. In serum zijn 98 tot 99,5% van de sekssteroïden gebonden aan proteïnen, waaronder SHBG. Plasma SHBG-productie vindt plaats in hepatocyten, maar ook de testes blijken mee te delen in de productie. De testiculaire vorm wordt niet in het plasma gesecreteerd, maar wel in de tubuli seminiferi van de testes (36), (72). De bindingscapaciteit van testosteron aan de testiculaire vorm blijkt echter lager dan aan het plasma SHBG. In gezonde mannen is testosteron voor 44% gebonden aan SHBG en 54% gebonden aan albumine. SHBG bindt testosteron 100 keer sterker vergeleken met albumine, maar de albumineconcentratie in serum is hoger, waardoor de bindingscapaciteit van beide proteïnen voor testosteron uiteindelijk gelijk is. Slechts 2% van het totaal testosteron circuleert vrij in het bloed. Ook estradiol wordt gebonden door SHBG, maar ongeveer driemaal zwakker dan testosteron (36).
SHBG wordt hormonaal gereguleerd door onder andere oestrogeen, androgenen en schildklierhormonen. Oestrogeen en schildklierhormonen stimuleren de SHBG-productie, terwijl androgenen inhiberend werken. De concentratie van Sex Hormone-Binding Globulin is twee- tot driemaal hoger bij vrouwen dan mannen (36).
18
Vraagstelling
1. Deze masterproef wenst de evolutie van serumconcentraties vrij testosteron na orchidectomie en het gelijktijdig staken van de androgeendeprivatietherapie te bestuderen aangezien dit op heden nog niet is beschreven.
2. Een eventuele invloed van de anti-androgene therapie (Androcur) en de orchidectomie op de androgeenproductie van de bijnier is eveneens nog niet beschreven bij deze doelgroep. DHEAS-serumconcentraties werden geanalyseerd om deze invloed na te gaan.
3. Tevens wilt deze masterproef onderzoeken of een orchidectomie samen met het gelijktijdig staken van de anti-androgeenmedicatie, de testosteronconcentratie al dan niet meer gaat onderdrukken in vergelijking met het verder geven van Androcur zonder orchidectomie.
19
Methodologie
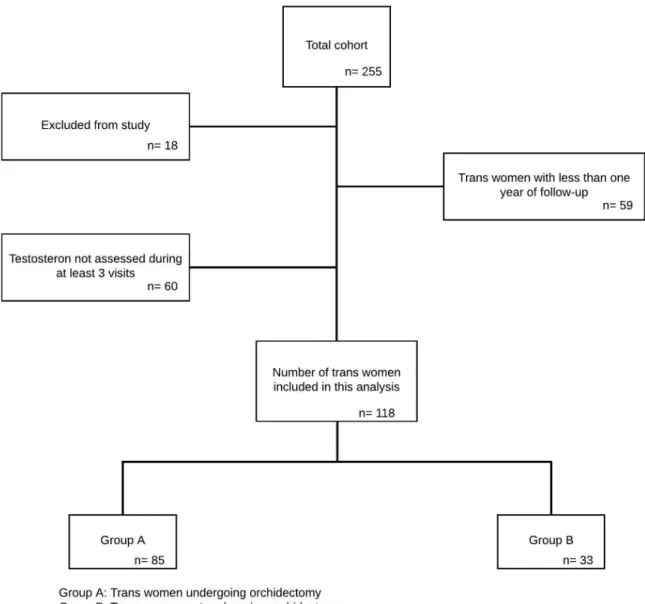
Deze masterproef maakt gebruik van data verkregen via de ENIGI-studie. ENIGI staat voor European Network for the Investigation of Gender Incongruence en bestaat uit een endocrien en een psychologisch luik. Het endocriene luik is een samenwerking van vier Europese gendercentra, namelijk Gent, Amsterdam, Florence en Oslo. ENIGI is een multicenter prospectieve cohortstudie en is nog steeds lopende. Het onderzoek bestudeert de klinische effecten en veiligheid van genderaffirmerende hormonale therapie bij trans personen (73). Van 15 februari 2010 tot en met 3 juli 2018 werden 255 trans vrouwen geselecteerd via het Universitair Ziekenhuis van Gent. Alle patiënten waren 16 jaar of ouder op moment van selectie. Ze ondergingen allemaal een gestandaardiseerde diagnostische procedure om de diagnose van genderincongruentie en/of –dysforie te bevestigen voor de start met de feminiserende hormoontherapie. Iedere patiënt werd behandeld volgens de WPATH Standards of Care, versie 7 (10). Exclusiecriteria waren: te jong, vooraf reeds gebruik van hormonen, afwijking van het protocol, twijfel omtrent transitie, stop van de transitie, reeds chirurgie ondergaan, uitstel omwille van fertiliteitspreservatie of geen reden. Alle patiënten zijn voor de start van de studie door de arts zowel mondeling als schriftelijk geïnformeerd omtrent het ENIGI endocriene protocol. Het Ethisch Comité van het Universitair Ziekenhuis van Gent keurde de studie goed en schriftlijk informed consent werd verkregen van de participanten. Enkel data van patiënten met meer dan een jaar follow-up en een minimum van drie testosteronbepalingen werden gebruikt om te analyseren of de testosteronconcentratie veranderde bij trans vrouwen na de orchidectomie. 118 trans vrouwen werden uiteindelijk geïncludeerd in deze masterproef. De visites vonden plaats op baseline en na 3, 6, 9, 12, 18, 24 en 36 maanden genderaffirmerende hormoontherapie. Tijdens deze visites werden serumstalen afgenomen en geanalyseerd op testosteron, vrij testosteron, SHBG, LH en FSH met immuno-assay. Enkel op baseline, 12, 24 en 36 maanden werd DHEAS bepaald op nuchtere bloedstalen. In Dekker et al. (73) kan het volledige studieprotocol van het endocriene luik van ENIGI teruggevonden worden.
20
De studiepopulatie werd opgedeeld in 2 groepen. Groep A kreeg hormonale therapie (anti-androgenen en oestrogenen) tot op het moment van orchidectomie. Na de orchidectomie werd de Androcur behandeling gestopt en werd enkel de oestrogeentherapie gecontinueerd. Groep B onderging geen orchidectmie en nam gedurende de gehele studietermijn zowel anti-androgenen als oestrogenen in.Bij trans vrouwen bestaat de feminiserende hormonale therapie uit 25 tot 50 mg cyproterone acetaat (Androcur, Bayer, Duitsland) per dag in één dosis, gecombineerd met een oestrogeen. Meestal is dit oestrogeen een oraal oestradiol, oestradiol valeraat (Progynova, Bayer, Duitsland), 2 mg tweemaal per dag. Bij patiënten vanaf 45 jaar, werd oestradiol transdermaal gegeven via oestradiolpleisters (Dermestril, Besins, België) 100 mg/24u omwille van het tromboserisico bij orale oestrogenen. Indien de orale behandeling niet verdragen werd, werd ofwel 1,5 mg oraal ofwel transdermaal 17-β estradiol gel gegeven. De transdermale behandeling bestond uit: tweemaal 2 pompjes per dag toegediend op de bovenarm. Na de orchidectomie bleef oestrogeen in monotherapie gegeven worden in onveranderde dosis. Bij elk bezoek zijn bloedstalen verkregen. De bloedstalen verkregen op baseline, 12, 24 en 36 maanden werden nuchter afgenomen. Competitieve chemiluminescente immunoassays werden uitgevoerd voor serumtestosteron (E170 Modular, Roche; LOQ 10 ng/dL), Sex Hormone-Binding Globulin (SHBG) (E170 Modular, Roche; LOQ 0.35 nmol/L), Luteïniserend Hormoon (LH) (E170 Modular, Roche; LOQ 0,1 U/L) en FollikelStimulerend Hormoon (FSH) (E170 Modular, Roche; LOQ 0,1 U/L). Dehydroepiandrosteronsulfaat (DHEAS) werd gemeten met behulp van electrochemiluminescente immunoassays (E801 Modular, Roche; LOQ 3µq/dL). Vrij testosteron werd berekend met een formule afgeleid van de wet van massa-actie, gebruikmakend van de totale testosteron serumconcentratie, serum-SHBG en serumalbumine (1).
Om na te gaan of de testosteronconcentratie verschilt tussen trans vrouwen met orchidectomie (groep A) en zonder orchidectomie (groep B) werden de (totale en vrije) testosteron-, DHEAS-, SHBG-DHEAS-, LH- en FSH-concentraties tussen deze twee groepen vergeleken bij het eerste bezoek (baseline), bij het laatste bezoek preoperatief (groep A) versus na 12 maanden genderaffirmerende hormoontherapie (groep B) en bij het eerste bezoek postoperatief (groep A) versus na 24 maanden gender affirmerende hormoontherapie (groep B). Ook werd binnen
21
de groepen onderling vergeleken of de testosteronconcentratie verschilde preoperatief versus postoperatief en na 12 maanden versus 24 maanden genderaffirmerende hormoontherapie. Er werd gekozen voor maand 12 en maand 24 als respectievelijk pre- en postoperatief bezoek aangezien de gemiddelde tijd tussen het eerste bezoek op baseline en de orchidectomie 20 maanden was en op deze maanden alle nodige androgeenconcentraties voorhanden waren. Deze data werden geanalyseerd met IBM SPSS 26.0 software (IBM Corporation, Armonk, New York). Normale verdeling werd nagegaan via de Shapiro-Wilk test. Zoals eerder aangehaald, werden de geïncludeerde trans vrouwen opgedeeld in een groep A (met orchidectomie) en een groep B (zonder orchidectomie). Verschillen in androgeenconcentratie tussen de twee groepen werden onderzocht met ongepaarde t-testen (normaal verdeelde data) en Mann-Whitney U tests (niet normaal verdeelde data). Verschillen binnen de groepen onderling (pre-/postoperatief voor groep A en 12/24 maanden hormoontherapie voor groep B) werden onderzocht met gepaarde Student’s t-testen (normaal verdeelde data) en met Wilcoxon signed-rank testen voor niet normaal verdeelde data. Subgroepanalyses werden additioneel uitgevoerd, waarbij proefpersonen met een totaal testosteron £ 10 ng/dL (wegens LOQ van totaal testosteron en daaruit volgend een onberekenbaar vrij testosteron) en FSH- en LH-outliers werden geëxcludeerd (wegens vermoeden van therapieontrouwheid).22
Figuur 5: Flowdiagram van de studiepopulatie23
Resultaten
1. Baseline karakteristieken
1.1 Aantal
De totale studiepopulatie bedroeg 118 proefpersonen. Hiervan werden 85 trans vrouwen geïncludeerd in groep A en 33 trans vrouwen geïncludeerd in groep B.
1.2 Leeftijd
De gemiddelde leeftijd van de gehele studiepopulatie was 32,6 jaar. Er was geen significant verschil in leeftijd tussen beide groepen (P=0,339).
1.3 BMI
Het gemiddelde BMI van de gehele studiepopulatie was 23,13 kg/m2. Er was geen significant
verschil in BMI tussen beide groepen (P=0,452).
1.4 Medicatie
Er zijn verschillende preparaten op de markt die gebruikt kunnen worden voor de transitie van trans vrouwen. Alle trans vrouwen die aan deze studie meededen, gebruikten Progynova als oestrogeen en Androcur als anti-androgeen.
1.5 Totaal testosteron
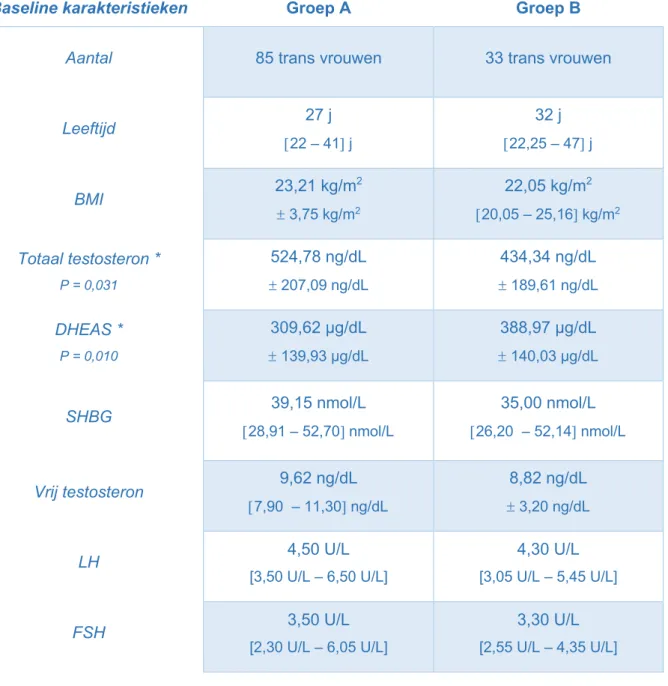
De baseline testosteron serumconcentratie van de groep die orchidectomie onderging (groep
A) bedroeg 524,78 ± 207,09 ng/dL en verschilde significant van de
serumtestosteronconcentratie van de groep die geen orchidectomie onderging (groep B) (434,34 ± 189,61 ng/dL) (P=0,031).
1.6 SHBG
De baseline SHBG-serumconcentratie van de groep die orchidectomie onderging (groep A) was 39,15 [28,91– 52,70] nmol/L en van de groep die geen orchidectomie onderging (groep B) was dit 35,00 [26,20 – 52,14] nmol/L. Groep A en groep B verschilden niet significant van elkaar (P=0,429).
24
1.7 Vrij testosteron
De baseline serumconcentratie van vrij testosteron van de groep die
een orchidectomie onderging (groep A) was 9,62 [7,90 –11,30] ng/dL en verschilde niet
significant van de serumconcentraties van de groep die geen orchidectomie onderging (groep B) (8,82 ± 3,20 ng/dL) (P=0,227).
1.8 DHEAS
De baseline DHEAS serumconcentratie van de groep die orchidectomie onderging (groep A) bedroeg 309,62 ± 139,93 µg/dL en verschilde significant van de groep die geen orchidectomie onderging (groep B) (388,97 ± 140,03 µg/dL) (P=0,010).
25
Tabel 2: Baseline karakteristieken in groep A (groep met orchidectomie) en groep B (groep zonder orchidectomie)* = significant verschil
Baseline karakteristieken Groep A Groep B
Aantal 85 trans vrouwen 33 trans vrouwen
Leeftijd 27 j [22 – 41] j 32 j [22,25 – 47] j BMI 23,21 kg/m 2 ± 3,75 kg/m2 22,05 kg/m2 [20,05 – 25,16] kg/m2 Totaal testosteron * P = 0,031 524,78 ng/dL ± 207,09 ng/dL 434,34 ng/dL ± 189,61 ng/dL DHEAS * P = 0,010 309,62 µg/dL ± 139,93 µg/dL 388,97 µg/dL ± 140,03 µg/dL SHBG 39,15 nmol/L [28,91 – 52,70] nmol/L 35,00 nmol/L [26,20 – 52,14] nmol/L Vrij testosteron 9,62 ng/dL [7,90 – 11,30] ng/dL 8,82 ng/dL ± 3,20 ng/dL LH 4,50 U/L [3,50 U/L – 6,50 U/L] 4,30 U/L [3,05 U/L – 5,45 U/L] FSH 3,50 U/L [2,30 U/L – 6,05 U/L] 3,30 U/L [2,55 U/L – 4,35 U/L]
26
2. Prospectief
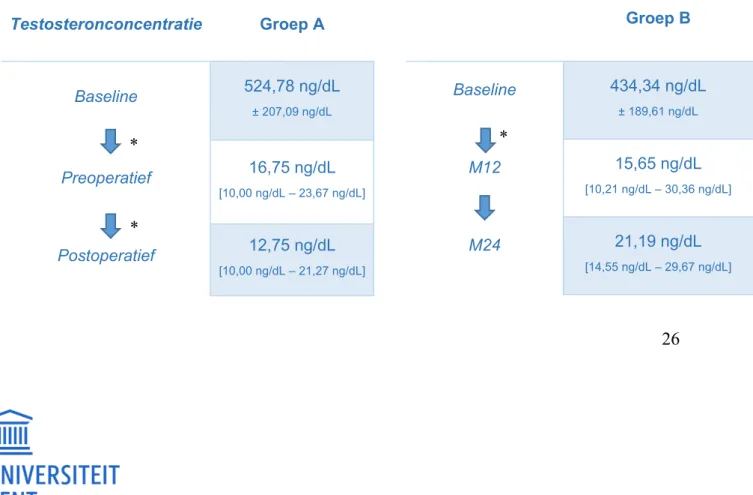
2.1 Totaal testosteron
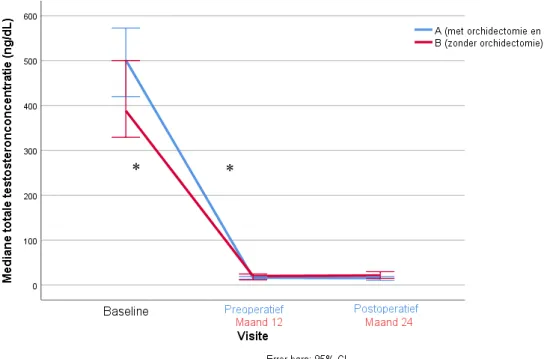
Serumconcentraties voor totaal testosteron waren 434,34 ± 189,61 ng/dL vóór het starten van de hormonale therapie in de groep die geen orchidectomie onderging (groep B), waarna deze daalden naar 15,65 [10,21 – 30,36] (-398,92, 95%CI -468,34 - -329,51, P<0,001) ng/dL na één jaar hormonale therapie. De serumconcentraties bleven stabiel over het tweede jaar (P=0,256). In de groep die orchidectomie onderging (groep A), daalden de serumwaarden voor
totaal testosteron van 524,78 ± 207,09 ng/dL baseline naar 16,75 [10,00 – 23,67] (-481,33,
95%CI -527,98 – -434,67, P<0,001) ng/dL preoperatief, met een tweede daling na de chirurgie, naar 12,75 [10,00 – 21,27] (-19,32, 95%CI -45,22 – 6,58 , P=0,012) ng/dL.
De daling van baseline naar preoperatief en van baseline naar één jaar hormonale behandeling bleef ook aanwezig na de subgroepanalyse, die zich beperkte tot personen met meetbaar serumtestosteron (P<0,001 respectievelijk P<0,001), maar postoperatief bleek het totaal testosteron stabiel te blijven (P= 0,050). Deze stabilisatie postoperatief werd ook opgemerkt in een tweede subgroepanalyse waarbij LH- en FSH-outliers preoperatief of na één jaar hormonale therapie werden geëxcludeerd (P=0,285). De andere resultaten bleven gelijk.
Tabel 3: Prospectieve analyse van totaal testosteron in groep A (met orchidectomie en stop Androcur postoperatief) en groep B (zonder orchidectomie) * = significant verschil
Testosteronconcentratie Groep A Baseline 524,78 ng/dL ± 207,09 ng/dL Preoperatief 16,75 ng/dL [10,00 ng/dL – 23,67 ng/dL] Postoperatief 12,75 ng/dL [10,00 ng/dL – 21,27 ng/dL] Groep B Baseline 434,34 ng/dL ± 189,61 ng/dL M12 15,65 ng/dL [10,21 ng/dL – 30,36 ng/dL] M24 21,19 ng/dL [14,55 ng/dL – 29,67 ng/dL]
*
*
*
*
27
Figuur 6: Prospectieve analyse van mediane totale testosteronconcentratie in groep A (met orchidectomie en stop Androcur postoperatief) versus groep B (zonder orchidectomie) * = significant verschilFiguur 7: Prospectieve analyse van mediane totale testosteronconcentratie in groep A (met orchidectomie en stop Androcur postoperatief) versus groep B (zonder orchidectomie) indien LH- en FSH-outliers preoperatief of na één jaar hormonale therapie werden geëxcludeerd * = significant verschil
*
*
*
28
2.2 SHBG
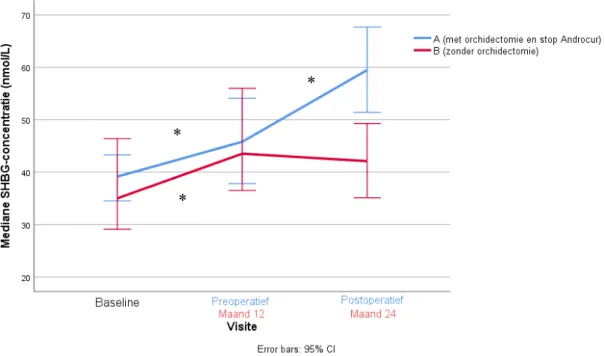
Serumconcentraties SHBG stegen van 35,00 [26,20 – 52,14] nmol/L naar 43,52 [34,93 – 61,55] nmol/L (+11,78, 95%CI 3,37 – 20,20 , P=0,001) over het eerste jaar van de hormonale therapie, waarna de waarden stabiel bleven over het tweede jaar (P=0,799) in groep B. In de groep die orchidectomie onderging (groep A), stegen de serumwaarden voor SHBG van 39,15 [28,91 – 52,70] nmol/L baseline naar 45,80 [33,00 – 70,10] nmol/L (+6,53, 95%CI 0,05 – 13,01 , P=0,001) preoperatief, met een tweede stijging tussen de laatste preoperatieve meting en de eerste postoperatieve meting naar 59,50 [42,55 – 92,05] (+ 19,02, 95%CI 13,11 – 24,93 , P<0,001) nmol/L.
Tabel 5: Prospectieve analyse van SHBG in groep A (met orchidectomie en stop Androcur postoperatief) en groep
B (zonder orchidectomie) * = significant verschil
SHBG- concentratie Groep A Baseline 39,15 nmol/L [28,91 nmol/L – 52,70 nmol/L] Preoperatief 45,80 nmol/L [33,00 nmol/L – 70,10 nmol/L] Postoperatief 59,50 nmol/L [42,55 nmol/L – 92,05 nmol/L] Groep B Baseline 35,00 nmol/L [26,20 nmol/L – 52,14 nmol/L] M24 43,52 nmol/L [34,93 nmol/L – 61,55 nmol/L] M12 42,10 nmol/L [32,20 nmol/L – 56,35 nmol/L]
*
*
*
29
Figuur 8: Prospectieve analyse van mediane SHBG-concentratie in groep A (met orchidectomie en stop Androcur postoperatief) versus groep B (zonder orchidectomie) * = significant verschil2.3 Vrij testosteron
Serumconcentraties voor vrij testosteron bedroegen 8,82
±
3,20 ng/dL voor het starten vande hormonale therapie in de groep die geen orchidectomie onderging (groep B). Over het eerste jaar van de hormonale therapie daalden deze waarden naar 0,35 [0,25 – 0,48] ng/dL (-7,47, 95%CI -8,66 – -6,28 , P<0,001), waarna de waarden stabiel bleven over het tweede jaar van de hormonale therapie (P=0,809). In de groep die orchidectomie onderging (groep A), daalden de serumconcentraties voor vrij testosteron van 9,62 [7,90 – 11,30] ng/dL baseline naar 0,28 [0,20 – 0,39] ng/dL preoperatief (-8,58, 95%CI -9,56 – -7,60 , P<0,001). Wanneer deze waarden voor de orchidectomie werden vergeleken met de waarden na de orchidectomie, werd een verdere daling opgemerkt naar 0,21 [0,14 – 0,36] ng/dL (- 0,52, 95%CI -1,30 – 0,27 , P=0,001). De serumconcentraties voor vrij testosteron daalden evenveel van baseline naar preoperatief als van baseline naar het eerste jaar hormonale therapie (P=0,079). Deze resultaten veranderden niet na beide subgroepanalyses.
*
*
*
30
Tabel 6: Propsectieve analyse van vrij testosteron in groep A (met orchidectomie en stop Androcur postoperatief) en groep B (zonder orchidectomie) * = significant verschilFiguur 9: Prospectieve analyse van mediane vrije testosteronconcentratie in groep A (met orchidectomie en stop Androcur postoperatief) versus groep B (zonder orchidectomie) * = significant verschil
Vrij testosteron concentratie Groep A Baseline 9,62 ng/dL [7,90 ng/dL – 11,30 ng/dL] Preoperatief 0,28 ng/dL [0,20 ng/dL – 0,39 ng/dL] Postoperatief 0,21 ng/dL [0,14 ng/dL – 0,36 ng/dL] Groep B Baseline 8,82 ng/dL ± 3,20 ng/dL M12 0,35 ng/dL [0,25 ng/dL – 0,48 ng/dL] M24 0,34 ng/dL [0,25 ng/dL – 0,42 ng/dL]
*
*
*
*
*
*
31
Figuur 10: Prospectieve analyse van mediane vrije testosteronconcentratie in groep A (met orchidectomie en stop Androcur postoperatief) versus groep B (zonder orchidectomie) met exclusie van LH- en FSH-outliers preoperatief of na één jaar hormonale therapie * = significant verschilFiguur 11: Prospectieve analyse van mediane vrije testosteronconcentratie in groep A (met orchidectomie en stop Androcur postoperatief) versus groep B (zonder orchidectomie) met enkel proefpersonen met meetbaar testosteron
* = significant verschil
*
*
*
*
*
*
32
2.4 DHEAS
Serumconcentraties voor DHEAS bedroegen 388,97 ± 140,03 µg/dL vóór het starten van de hormonale therapie in de groep die geen orchidectomie onderging (groep B). Deze waarden daalden naar 307,50 [203,50 – 393,75] (-60,17, 95%CI -88,87 – -31,47, P<0,001) µg/dL na 12 maanden hormonale therapie en stegen naar 336,26 ± 149,30 (-3,48, 95%CI -24,63 – 17,67 , P<0,001) µg/dL na het tweede jaar van hormonale behandeling. De groep die orchidectomie onderging (groep A), kende ook een daling in DHEAS serumconcentraties na het starten van de hormonale therapie (van 309,62 ± 139,93 µg/dL op baseline naar 261,50 [154,25 – 370,25] µg/dL) preoperatief (-34,21, 95%CI -50,25 – -18,17 , P<0,001) met een tweede daling naar 232,42 ± 112,28 µg/dL (-40,42, 95%CI -63,73 – -17,10 , P<0,001) postoperatief.
In de subgroepanalyse, die zich beperkte tot personen met meetbaar serumtestosteron, bleven de prospectieve resultaten wat betreft de groep die orchidectomie onderging (groep A), ongewijzigd. Wat wel veranderde tegenover de analyse van de totale studiepopulatie, was dat er na subgroepanalyse met enkel meetbaar serumtestosteron geen significant verschil aangetoond kon worden in serum-DHEAS-waarden na 12 maanden hormonale therapie versus na 24 maanden hormonale therapie (P=0,707). Er werd wel een significant verschil aangetoond van baseline naar 12 maand hormonale therapie (p=0,008) en van baseline naar 24 maand hormonale therapie (p=0,001). In de subgroepanalyse waarbij de LH- en FSH-outliers werden geëxcludeerd, werd ook geen significant verschil aangetoond tussen de serum-DHEAS-waarden na een jaar hormonale therapie versus na twee jaar hormonale therapie (P=0,526). De andere resultaten bleven gelijk.
33
Tabel 4: Prospectieve analyse van DHEAS in groep A (met orchidectomie en stop Androcur postoperatief) en groepB (zonder orchidectomie) * = significant verschil
Figuur 12: Prospectieve analyse van mediane DHEAS-concentratie in groep A (met orchidectomie en stop Androcur postoperatief) versus groep B (zonder orchidectomie) * = significant verschil
DHEAS- concentratie Groep A Baseline 309,62 µg/dL ± 139,93 µg/dL Preoperatief 261,50 µg/dL [154,25 µg/dL – 370,25 µg/dL] Postoperatief 232,42 µg/dL ± 112,28 µg/dL Groep B Baseline 388,97 µg/dL ± 140,03 µg/dL M12 307,50 µg/dL [203,50 µg/dL – 393,75 µg/dL] M24 336,26 µg/dL ± 149,30 µg/dL
*
*
*
*
*
*
*
*
34
Figuur 13: Prospectieve analyse van mediane DHEAS-concentratie in groep A (met orchidectomie en stop Androcur postoperatief) versus groep B (zonder orchidectomie) met exclusie van LH- en FSH-outliers preoperatief of na éénjaar hormonale therapie * = significant verschil
Figuur 14: Prospectieve analyse van mediane DHEAS-concentratie in groep A (met orchidectomie en stop Androcur postoperatief) versus groep B (zonder orchidectomie) met enkel proefpersonen met meetbaar
testosteron * = significant verschil
*
*
*
*
*
*
35
2.5 LH
LH-serumconcentraties daalden van 4,30 [3,05 – 5,45] U/L baseline naar 0,10 [0,10 – 0,10] U/L na één jaar hormonale therapie (-4,43, 95%CI -5,44 – -3,42 , P<0.001) in de groep die geen operatie onderging (groep B), waarna de waarden licht stegen naar 0,10 [0,10 – 0,40] U/L), (+2,55, 95%CI -2,33 – 7,44 , P=0,017) over het tweede jaar van de hormonale therapie. In de groep die orchidectomie onderging (groep A) daalden de waarden van 4,50 [3,50 – 6,50] U/L baseline naar 0,10 [0,10 – 0,14] U/L preoperatief (-3,59, 95%CI -4,76 – -2,43 , P<0.001), met een stijging postoperatief naar 20,00 [4,60 – 40,00] U/L (+ 24,24, 95%CI 19,03 – 29,45 , P<0.001). Een belangrijke notie hierbij is dat de LOQ van de LH-bepaling 0,10 U/L is.
De stijging tussen preoperatieve en postoperatieve waarden (groep A) was significant hoger dan de prospectieve veranderingen over het tweede jaar hormonale therapie (groep B) (P<0,001), hoewel er geen verschil was in prospectieve veranderingen in LH over het eerste jaar (groep B) versus van baseline tot preoperatief (groep A) (P=0,894).
Tabel 7: Prospectieve analyse van LH in groep A (met orchidectomie en stop Androcur postoperatief) en groep B
(zonder orchidectomie) * = significant verschil
LH
Groep A
Baseline
[3,50 U/L – 6,50 U/L]4,50 U/L
Preoperatief
[0,10 U/L – 0,14 U/L]0,10 U/L
Postoperatief
[4,60 U/L – 40,00 U/L]20,00 U/L
Groep B
Baseline
[3,05U/L- 5,45 U/L]4,30 U/L
M12
[0,10 U/L – 0,10 U/L]0,10 U/L
M24
[0,10 U/L – 0,40 U/L]0,10 U/L
*
*
*
36
2.6 FSH
FSH-serumconcentraties daalden van 3,30 [2,55 – 4,35] U/L baseline naar 0,15 [0,10 – 0,35] U/L na één jaar hormonale therapie (-3,20, 95%CI -4,91 – -1,47 , P<0,001) in de groep die geen operatie onderging (groep B), waarna de waarden stegen naar 0,17 [0,10 – 0,85] U/L (+5,02, 95%CI -4,31 – 14,36 , P=0,007) over het tweede jaar van de hormonale therapie. In de groep die orchidectomie onderging (groep A), daalden de waarden van 3,50 [2,30 – 6,05] U/L baseline naar 0,17 [0,10 – 0,58] U/L preoperatief (-3,41, 95%CI -5,11 – -1,71, P<0,001), met een stijging postoperatief naar 22,50 [5,60 – 52,00] U/L (+32,56, 95%CI 24,66 – 40,46, P<0,001).
Tabel 8: Prospectieve analyse van FSH in groep A (met orchidectomie en stop Androcur postoperatief) en groep
B (zonder orchidectomie) * = significant
FSH
Groep A
Baseline
[2,30 U/L – 6,05 U/L]3,50 U/L
Preoperatief
[0,10 U/L – 0,58 U/L]0,17 U/L
Postoperatief
[5,60 U/L – 52,00 U/L]22,5 U/L
Groep B
Baseline
[2,55 U/L – 4,35U/L]3,30 U/L
M12
[0,10 U/L – 0,35 U/L]0,15 U/L
M24
[0,10 U/L – 0,85 U/L]0,17 U/L
*
*
*
37
3. Cross-sectioneel
3.1 Totaal testosteron
Er was geen significant verschil op te merken tussen beide groepen wanneer men de testosteron serumconcentraties preoperatief (16,75 [10,00 – 23,67] ng/dL) vergeleek met de testosteronwaarde na 12 maand feminiserende hormonale therapie (15, 65 [10,21 – 30,36] ng/dL) (P=0,765). Deze groepen verschilden echter wel van mekaar indien de waarden na 24 maand hormoontherapie (21,19 [14,55 – 29,67] ng/dL) vergeleken werden met deze na orchidectomie (12,75 [10,21 – 30,36] ng/dL) (P=0,002).
3.2 SHBG
De serumconcentraties van SHBG weken preoperatief (groep A) (45,80 [33,00 – 70,10] nmol/L niet af van deze na 12 maanden hormonale therapie (groep B) (43,52 [34,93 – 61,55] nmol/L) (P=0,786). Postoperatief (groep A) (59,50 [42,55 – 92,05] nmol/L) bleken deze wel te verschillen (P=0,005) van de concentraties na 24 maanden feminiserende hormonale therapie (groep B) (42,10 [32,20– 56,35] nmol/L).
3.3 Vrij testosteron
Bij het vergelijken van preoperatieve serumconcentraties vrij testosteron (groep A) (0,28 [0,20 – 0,39] ng/dL) met deze na één jaar hormoontherapie (groep B) (0,35 [0,25 – 0,48 ] ng/dL) werd geen significant verschil waargenomen (P=0,180). Dit werd wel gezien indien men postoperatieve concentraties (groep A) (0,21 [0,14 – 0,36] ng/dL) vergeleek met concentraties na twee jaar hormonale behandeling (groep B) (0,34 [0,25 – 0,42] ng/dL) (P=0,001).
3.4 DHEAS
De serumconcentraties van DHEAS verschilden preoperatief (261,50 [154,25 – 370,25] µg/dL) niet significant van de concentraties na één jaar hormoontherapie (307,50 [203,50 – 393,75] µg/dL) (P= 0,672) tussen beide groepen A en B. Postoperatief (232,42 ± 112,28 µg/dL) werd echter wel een significant verschil (P=0,006) waargenomen indien DHEAS serumconcentraties werden vergeleken met deze na twee jaar hormonale therapie (336,26 ± 149,30 µg/dL).
38
Discussie
Vooraleer de resultaten bediscussieerd worden, een korte toelichting over de uitgevoerde subgroepanalyses. In de eerste subgroepanalyse werden enkel proefpersonen met een meetbaar testosteron geïncludeerd. 30 proefpersonen hadden een testosteronconcentratie van 10 ng/dL omdat dit de detectielimiet is van de competitieve chemiluminescente immunoassays voor totaal testosteron. Bij deze subgroepanalyse werden dus enkel proefpersonen geïncludeerd met een totale testosteronconcentratie >10 ng/dL. Bij de tweede subgroepanalyse werden preoperatieve/na één jaar hormonale therapie LH- en FSH-outliers geëxcludeerd. Een hoge LH- en FSH-concentratie kan wijzen op een onvolledige onderdrukking van de GnRH – LH/FSH-as en dus mogelijks slechte compliance. Dit was het geval voor 5 personen in de groep die geen orchidectomie onderging en voor 21 personen in de groep die wel een orchidectomie onderging.
De twee belangrijkste resultaten zijn: ten eerste het significant verder dalen van vrij testosteron na de orchidectomie met het gelijktijdig staken van de androgeendeprivatietherapie en ten tweede, een daling van DHEAS na het starten van de hormoontherapie en een bijkomende daling postoperatief. Dit impliceert dat de orchidectomie wel degelijk invloed heeft op beide hormonen en dat DHEAS, zoals testosteron, dus ook onderhevig is aan de hormoontherapie. Hieronder worden deze twee bevindingen samen met de andere resultaten verder toegelicht. Wat de baseline karakteristieken betreft, zijn totaal testosteron en DHEAS significant verschillend tussen de twee groepen. De andere karakteristieken (SHBG, vrij testosteron, LH, FSH, BMI, soort therapie, leeftijd) zijn vergelijkbaar. Ondanks dat de gemiddelde leeftijd in groep A (27j) vijf jaar lager ligt dan de gemiddelde leeftijd van groep B (32j), is dit leeftijdsverschil niet significant (P = 0,339) waardoor dit niet als verklaring kan dienen. Waarom totaal testosteron en DHEAS dan niet vergelijkbaar zijn tussen groep A en B blijft onduidelijk. Een eerste logische bevinding was dat totaal testosteron daalde van baseline naar preoperatief (groep A) en van baseline naar één jaar hormonale therapie (groep B), aangezien beide groepen het anti-androgeen Androcur innamen. Androcur zorgt voor onderdrukking van de testosteronproductie (16), (17). Het hormoon bleef stabiel over het tweede jaar hormonale therapie (groep B), wat ook logisch is aangezien de therapie ongewijzigd bleef. Dezelfde evolutie werd gezien voor vrij testosteron.