Scheikunde praktijk P2
Inleiding
In periode één heb je leren werken met pipetten en maatkolven en heb je leren wegen met de analytische balans. Deze vaardigheden ga je in deze periode toepassen. Mocht de kennis van deze zaken toch even zijn weggezakt, dan is het absoluut geen schande om de dit weer op te zoeken in de documentatie van vorige periode (vb. P1 ijking maatglaswerk en je labjournaal). Bedenk dat de tekst: “weeg ongeveer 200 mg nauwkeurig af ” betekent dat je een weegflesje leeg op de analytische balans weegt; dat je op de bovenweger 0,2 gram toevoegt; dat je het gevulde weegflesje wederom op de analytische balans weegt om precies te weten of je binnen 10% van de 200 mg hebt ingewogen. Als je meer dan 10% verschil ziet, moet je opnieuw afwegen met nieuw monster en het oude weggooien (juiste afvalvat). Weeg altijd 100 mg of meer af!
Bij een aantal proeven is het noodzakelijk om CO2-vrij water te gebruiken. Dit komt doordat zoutzuur reageert met carbonaat dat gevormd is na absorptie van
kooldioxide uit de lucht. Het aanwezige carbonaat reageert bij het eindpunt tot monowaterstofcarbonaat.
Bedenk dat je alle veiligheidsinformatie opgezocht moet hebben alvorens de labzaal te betreden. (dat kan niet meer op het practicum zelf). Ook de voorberekeningen vormen een onderdeel van deze voorbereidingen.
Let voor het correct invullen van het labjournaal op de richtlijnen in het uitgereikte dictaat “Organisatie van het Chemisch practicum”. Bestudeer Het Chemisch practicum van Udo en Leene.
Bedenk dat je elk experiment zelf (individueel) moet uitvoeren en dat je elk monster tenminste in duplo moet uitvoeren. De eerste week wordt gedeeltelijk besteedt aan uitleg, waarbij je zorgvuldig aantekeningen maakt. De klas wordt in twee groepen verdeeld: de groep SPECTRO en de groep TITRATIE. Halverwege wordt gewisseld en de indeling wordt tijdens de eerste week opgesteld.
De experimenten moeten in onderstaande volgorde worden individueel worden uitgevoerd. Vermeld ook welk monster je hebt gebruikt.
Inhoudsopgave
Inleiding... 1
Titreren... 4
Spectrometrie... 5
Groep TITRATIE...Fout! Bladwijzer niet gedefinieerd. BA007 – De buret en ijking...6
BA006 – Buret en indicatoren...10
TI112 – Stellen van zoutzuur op natriumcarbonaat...13
TI106 – Bepaling van natriumhydroxide in gootsteenontstopper...15
TI102 – Stellen van natronloog op kaliumwaterstofftalaat...17
TI101 – Bepaling van azijnzuur in tafelazijn...18
Groep SPECTRO...Fout! Bladwijzer niet gedefinieerd. S101 – Bepaling van kleurstof in limonadesiroop...20
SO103 – Bepaling van ijzer(III) ionen in een monster...23
Titreren
Algemeen
Voer voor elke proef eerst een titerstelling (vaststellen juiste concentratie) in 3 goede titraties uit.
Lees de buret af in twee decimalen (bijv. 23,45 mL). De monsterbepaling wordt tenminste in triplo uitgevoerd (minder dan 5% verschil). Met de Q-test kan eventueel een uitschieter gevonden worden.
Hieronder volgt een lijst van fouten die je bij een titratie kunt maken. De lijst is niet compleet en misschien kun je zelf nog enkele toevoegen.
1. Balans niet op nul gesteld.
2. Oertiterstof gemorst bij overbrengen in bekerglas. 3. Roerstaaf niet nagespoeld.
4. Bekerglas niet goed nagespoeld.
5. Trechter niet goed nagespoeld in maatkolf. 6. Maatkolf niet goed gedroogd.
7. Maatkolf niet goed aangevuld.
8. Maatkolf niet goed gehomogeniseerd. 9. Pipet niet drie maal voorgespoeld. 10. Binnenkant erlenmeyer niet nagespoeld. 11. Buret niet drie maal voorgespoeld.
12. Druppel niet van de buretkraan gehaald voor je begon te titreren. 13. luchtbel in de buretkraan.
14. Te ver getitreerd.
Spectrometrie
Algemeen
De monsters worden in triplo uitgevoerd, de kalibratielijn monoplo. Elke persoon weegt zelf monsters af. Wegen doe je op de manier die je in periode 1 hebt geleerd. Zet direct de meetresultaten in een grafiek. Als resultaat bereken je met de lijn het gezochte gehalte. Je geeft bij drie waarden het gemiddelde en standaarddeviatie op. Daarna vergelijk je jouw resultaat met de theoretische waarde of de specificaties op het etiket.
BA007 – De buret en ijking
Tijdens deze proef ga je werken met een buret. De meeste buretten hebben een maximum volume van 50 ml. De maatverdeling is in 0,1 ml, wat betekent dat het verschil tussen twee maatstreepjes 0,1 ml bedraagt. Zoals bij bijna alle meetapparatuur moet je ook hier de laatste decimaal schatten. Dit houdt in dat je een buret altijd in twee cijfers achter de komma af leest; bijvoorbeeld 36,25 ml.
Doel
Het leren werken met een buret
Chemicaliën
- Zoutzuur 0,1 mol/l - Natronloog 0,1 mol/l - Methylrood oplossing
Uitvoering
Voor de ijking van de buret heb je demiwater nodig. Zet direct aan het begin van het practicum een bekerglas met water klaar zo dat dit de temperatuur van het lokaal kan aannemen.
A. IJken van de buret
Vul een schone buret op de voorgeschreven manier met demiwater en meet de temperatuur van het water. Maak een weegflesje schoon en droog en weeg het op de analytische balans. Noteer de beginstand van de buret en laat het weegflesje voor driekwart vollopen. Noteer de eindstand van de buret, weeg het flesje en noteer de massa in je labjournaal. Doe deze ijking in totaal zes maal en meet tenslotte weer de temperatuur van het water.
Opruimen
Gebruikte buretten worden schoongespoeld en drie maal nagespoeld met demiwater. Leg de buret terug in de kast of als deze uit een wandhouder gehaald is vul je de buret met teepol (een bepaalde zeepoplossing) en zet je hem in de houder. Voorbereiding en verwerking van de gegevens.
IJking van de buret
Bereken voor elke meting de V20.
Waarbij:
V20 = volume (ml) van het gewogen water bij 20 °C. m = massa van het water in g.
k = correctiefactor voor temperatuur (tabel 1). Temperatuurcorrectiefactoren Temp. in °C k 17 1,00235 18 1,00249 19 1,00266 20 1,00282 21 1,00300 22 1,00320 Tabel 1: Temperatuurcorrectiefactoren.
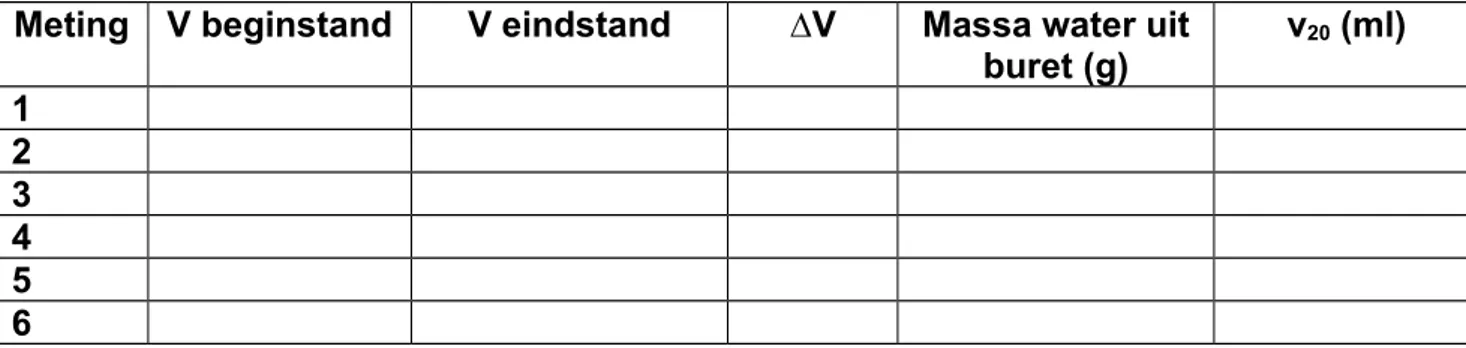
Zet de meetwaarden en de berekende V20-waarden in tabel 2. Bereken het gemiddelde en de standaarddeviatie (stdev).
Meting V beginstand V eindstand ∆V Massa water uit buret (g) v20 (ml) 1 2 3 4 5 6 Tabel 2: Invulschema.
B. Titratie van natronloog.
Vul een buret zoals voorgeschreven met 0,1 mol/l HCl. Pipetteer 25 ml natronloog in een erlenmeyer en spuit de binnenkant van de erlenmeyer af met een beetje water, zodat alle natronloog onder in de erlenmeyer komt en voeg vier druppels methylrood toe. Strijk voorzichtig het druppeltje van de punt van de buretkraan af. Deze druppel hoort niet in de erlenmeyer.
Zet de erlenmeyer onder de buret, noteer de beginstand (VB) op 2 decimalen (vb. 1,23 ml) en titreer druppelsgewijs tot kleuromslag. Zwenk tijdens het titreren de erlenmeyer rustig om. Spuit regelmatig de binnenkant van de erlenmeyer schoon met demiwater, om alle reagens onderin te krijgen. Lees de eindstand (VE) op 2
decimalen af en noteer deze in je labjournaal. Herhaal nu de titratie.
Herhaal de titratie nog een keer en laat nu steeds de buretstanden door de buurman controleren.
Laat de buret leeglopen en spoel drie maal met demiwater. Maak de volgende tabel in je labjournaal.
Meting Voorbeeld 1 2 3 Reserve
VE HCl (ml) 36,56
VB HCl (ml) 0,23
V HCl (ml) 36,33 Gem. St. dev.
CNaOH (mol/l) 0,1004
Tabel 3: Invulschema.
Rond st. dev. af op één significant cijfer en let op het aantal decimalen voor het gemiddelde. Deze moet net zoveel decimalen hebben als de st. dev.
Gem. 0,1008
St. dev. 0,0004
Bereken de concentratie cNaOH van het natronloog volgens de formule:
Waarbij:
- CHCl = concentratie zoutzuur in mol/l. - VHCl = volume verbruikt zoutzuur in ml. - VNaOH = volume verbruikt NaOH in ml. Bereken het gemiddelde en de standaarddeviatie.
BA006 – Buret en indicatoren
Inleiding
Een analyse die goed en eenvoudig kan worden uitgevoerd is een titratie. Bij een titratie wordt uit een buret vloeistof toegedruppeld aan een monster. De vloeistof reageert met een stof in het monster. Net op het moment dat de stof in het monster opgereageerd is, moet je stoppen met het toevoegen van vloeistof uit de buret. Dit is het eindpunt van de titratie. Om het eindpunt goed te kunnen zien wordt een indicator aan het monster toegevoegd. Een indicator is een kleurstof die bij het eindpunt van de titratie van kleur verandert.
Er zijn enkele tientallen indicatoren en welke je moet gebruiken hangt af van het monster en de vloeistof in de buret. In het algemeen geldt dat je titreert tot de eerst waarneembare kleurafwijking (mengkleur). In de BINAS staan omslag-pH's
(zuurgraad) vermeldt. Als de indicator methylrood omslaat van rood (zuur) naar geel (basisch), dan stop je zodra de mengkleur oranje verschijnt, tenzij er in het
Buret preparen en aflezen
Spoel de buret schoon met kraan water, spoel drie maal met demiwater en vul de buret met demiwater. Let er op dat de hele buret (ook de kraan) vrij is van
luchtbellen. Laat zoveel water uit de buret lopen dat de meniscus tussen 0,00 en 1,00 ml staat. Rol een filtreerpapiertje om een roerstaaf en droog de hals van de buret ermee. Sluit de buret van boven af met een centrifugebuis.
Lees de stand af en noteer (in een tabel) in je labjournaal. Laat twee buren ook de stand aflezen en noteer ook deze waarden.
Laat wat water weglopen en noteer weer de stand. Het aflezen doe je nu door een plastic trechter met de wijde kant tegen de buret gezet. Vervolgens kijk je door de steel van de trechter naar de buretstand. Op deze manier lees je de buret op de juiste hoogte af.
Doel
Het leren titreren tot de juiste omslagkleur.
Titratiecurve opnemen
Voer de bepaling als volgt uit: vul de buret met 0,1 M HCl en noteer de beginstand. Pipetteer 10 ml 0,1 M NaOH en verdun. Voeg 4 druppels universeel indicator toe. Titreer nu tot de kleur verandert en noteer de buretstand. Zoek op welke pH-waarde hoort bij de kleur. Vervolg de titratie tot de volgende kleur en noteer de buretstand en pH. Ga hiermee door tot alle kleuren zijn geweest. Voer de proef in triplo uit.
Verwerking van de gegevens.
Maak op papier een titratiecurve. Zet op de horizontale as de toegevoegde
hoeveelheid zuur uit. Zet op de verticale as de pH uit. Trek een vloeiende lijn door de meetpunten.
- Teken voor elke indicator het omslag traject in de curve. - Welke indicator slaat om in het juiste gebied?
TI112 – Stellen van zoutzuur op natriumcarbonaat
Inleiding
De HCl-concentratie van zoutzuur is te bepalen met een zogenaamde oertiterstof. Dit is een zeer zuivere stof die ongemakkelijk vocht aantrekt, of op een andere manier van samenstelling verandert. Als een hoeveelheid van de oer(titer)stof
nauwkeurig wordt afgewogen, dan kun je bepalen wat de concentratie van de HCl is. Uit het volume zoutzuur wat nodig is om de afgewogen stof te neutraliseren is de concentratie van zoutzuur te berekenen. Dit noemen we stellen. Stellen is dus nauwkeurig de concentratie bepalen.
Een stelling moet altijd zeer nauwkeurig gebeuren. Er wordt daarom vaak gebruik gemaakt van koolzuurvrij (CO2-vrij) water. CO2 uit de lucht wordt gemakkelijk door een basische oplossing aangetrokken en reageert dan met de base in de oplossing. Er is dan minder zuur nodig om de oplossing te neutraliseren, waardoor een fout wordt gemaakt.
Je kunt water CO2-vrij maken door het gedurende 5 minuten te laten koken. Koel het daarna weer af en doe het in de spuitfles. Zorg er voor dat het water tijdens het afkoelen niet in contact komt met CO2-houdende lucht. Gebruik dus een stop of filter. Het oplossen van stof, het aanvullen van een maatkolf en het afspuiten van de
erlenmeyer moeten met CO2-vrij water gebeuren.
De aflezing van de buret is onnauwkeuriger bij kleine volumes. Zorg daarom voor een eindpunt rond de 35-40 ml. Door jouw inweegmassa in te vullen in de formule kun je controleren of je voldoende volume zult krijgen of dat het niet binnen een buretvolume past. Je hoeft niet exact de hoeveelheid af te wegen volgens voorschrift, het mag binnen 10% meer of minder zijn. Weeg altijd globaal op de bovenweger en daarna op de ingestelde balans (op 0,0000 gram). Reken de exacte massa uit en vul in de formule in ter controle.
Doel
Het bepalen van de concentratie van HCl in zoutzuur.
Chemicaliën
- Natriumcarbonaat p.a. - Methyloranjeoplossing - Zoutzuur 0,1 mol/l
Stellen van zoutzuur op Na2CO3
Weeg ca. 185 mg watervrij natriumcarbonaat nauwkeurig af. Breng het over in een erlenmeyer en los het op. Vul aan tot ca. 75 ml en voeg methyloranje toe. Titreer de oplossing tot de eerste kleurafwijking. Voer de proef in triplo uit (mits stdev < 0,0004 anders vaker).
Verwerking van de meetgegevens
Laat met een voorberekening zien dat de afgewogen massa aan Na2CO3, met c = 0,1 mol/l, binnen een buretinhoud past (v ligt op ca 35 ml).
Waarbij:
- cHCl = Concentratie HCl oplossing in mol/l. - vHCl = Verbruikte volume HCl uit de buret. - mNa2CO3 = Massa inweeg natriumcarbonaat in mg.
Bereken de concentraties van zoutzuur, het gemiddelde en de standaarddeviatie.
Voorbereiding
Neem onderstaande tabel over in je labjournaal.
Meting 1 2 3 Eindstand buret (mL) Beginstand buret (mL) Verbruik (mL) mweegfl+Na2CO3 (g) mweegfles (g) mNa2CO3 (g) cHCl (mol/L) Gemiddelde cHCl (mol/L) Standaarddeviatie (mol/L)
TI106 – Bepaling van natriumhydroxide in
gootsteenontstopper
Inleiding
Gootsteenontstoppers hebben als hoofdbestanddeel natriumhydroxide (NaOH). Het gehalte NaOH en de toegevoegde hulpstoffen verschillen per merk. De ontstoppers zijn in vaste vorm maar ook in vloeibare vorm verkrijgbaar. Als een gootsteen verstopt is moet men daarin een hoeveelheid ontstopper brengen en vervolgens overgieten met heet water. De ontstoppende werking van de verkregen hete natronloog berust op de chemische afbraak van de stoffen die in het vuil aanwezig zijn. Uiteraard werkt natronloog ook bijtend op lichaamsweefsels. Het kan zelfs haren en nagels doen oplossen. Grote voorzichtigheid is dus geboden als je het gebruikt.
Chemicaliën - Gootsteenontstopper - Natriumcarbonaat p.a. - Methyloranjeoplossing - Zoutzuur 0,1 mol/l Uitvoering
Voer de bepaling uit met CO2-vrij water. Kook demiwater ca. 5 min. in een erlenmeyer, laat dit afkoelen en breng het over in je spuitfles.
A. Stellen van zoutzuur op NaCO3
Reeds uitgevoerd bij TI112.
B. Titratie oplossing van gootsteenontstopper
Noteer het merk en/of de producent van de te onderzoeken ontstopper. Indien er op de verpakking nog meer informatie staat die voor het onderzoek van belang kan zijn, noteer deze dan ook.
Weeg ongeveer 125 mg ontstopper nauwkeurig af in een weegflesje (blijf binnen een marge van 10%, dus binnen de 113-138 mg). Bereken met de afgewogen massa hoeveel je volgens de formule aan volume zult gebruiken. Werk veilig! Zeer
agressieve stof! Breng de afgewogen massa met een roerstaafje kwantitatief over in een erlenmeyer van 300 ml, spoel na met CO2-vrij water. Vergeet niet het
roerstaafje ook na te spoelen. Vul aan tot ongeveer 75 ml en voeg drie druppels indicator toe en titreer met 0,1 mol/l zoutzuur tot de meng of tussenkleur. Voer de titratie in triplo uit. (3 goede metingen met kleine s.d., anders een quadruplo doen!)
Verwerking van de meetgegevens
Bereken het NaOH-gehalte (G) in de ontstopper.
Waarbij:
- GNaOH = Gehalte natronloog in ontstopper in massaprocenten. - CHCl = Concentratie zoutzuur in mol/L.
- Montstopper = Inweeg ontstopper in mg. - VHCl = Volume zoutzuur in ml.
TI102 – Stellen van natronloog op kaliumwaterstofftalaat
Inleiding
Met deze proef ga je de concentratie van NaOH in natronloog bepalen op een zure oertiterstof. De oertiterstof is kaliumwaterstofftalaat (KH(C8H4O4)), met molaire massa (M) 204,22 g/mol. Chemicaliën - Kaliumwaterstofftalaat p.a. - Thymolblauw - Natronloog 0,1 mol/l Uitvoering
Maak eerst CO2-vrij water. Weeg ca. 2,5 g kaliumwaterstofftalaat af en breng over in een maatkolf van 100 ml. Pipetteer 25 ml in een erlenmeyer, verdun tot ca. 75 ml, voeg 4 druppels indicator toe en titreer tot kleuromslag. Voer de titratie minimaal in triplo uit.
Verwerking van de meetgegevens
Bereken het gemiddelde en de standaarddeviatie.
Waarbij:
- cNaOH = Concentratie NaOH in mol/L
- m = Massa kaliumwaterstofftalaat in mg. - VNaOH = Volume NaOH in ml.
TI101 – Bepaling van azijnzuur in tafelazijn
Inleiding
Azijn is een waterige oplossing van azijnzuur. Zuiver azijnzuur is een bijtende en brandbare vloeistof en wordt ijsazijn genoemd, omdat het als vaste stof (T<17 °C) op ijs lijkt. Voor consumptie geschikte azijn moet aan de eisen, zoals beschreven in de warenwet, voldoen. Eén van de eisen is dat het gehalte azijnzuur ten minste 4 g per 100 cm3 moet zijn. Ook de manier waarop dit gehalte moet worden bepaald staat in de warenwet beschreven. Tijdens dit practicum ga je het azijnzuurgehalte in
tafelazijn bepalen. Chemicaliën - Tafelazijn - Thymolblauw - Natronloog 0,1 mol/L - Kaliumwaterstofftalaat Uitvoering
Gebruik deze proef CO2-vrij water.
A. Stellen van natronloog op kaliumwaterstofftalaat Reeds uitgevoerd bij TO102.
B. Titratie van tafelazijn
Noteer de code, merk en/of producent van de tafelazijn. Noteer ook eventuele
andere specificaties die van belang kunnen zijn. Vul een weegflesje voor de helft met water, weeg hierin vervolgens 5 g tafelazijn af, breng het over in een erlenmeyer en titreer met natronloog op indicator tot kleuromslag. Voer de proef in duplo uit.
Voorbereiding en verwerking van de gegevens Maak vooraf tabellen in je labjournaal.
A. Stellen van natronloog op kaliumwaterstofftalaat
Waarbij:
- cNaOH = Concentratie natronloog in mol/L. - m = Massa kaliumwaterstofftalaat in mg. - V = Volume natronloog in ml.
B. Titratie tafelazijn
Waarbij:
- Gazijnzuur = Gehalte azijnzuur in massaprocenten. - cNaOH = Concentratie natronloog in mol/L. - mazijn = Inweeg azijn in mg.
- V = Volume natronloog in ml.
Bereken voor de titratie het procentuele verschil (∆%) tussen de uitkomsten. Gebruik hierbij de volgende formule:
S101 – Bepaling van kleurstof in limonadesiroop
Inleiding
Analyses worden vaak uitgevoerd met behulp van een kalibratieserie. Dit is een serie oplossingen waarvan de concentratie bekend is. De concentratie van de onbekende kun je dan schatten door bijvoorbeeld de kleur met die van de kalibratieserie met elkaar te vergelijken. Deze manier van werken is onnauwkeurig, omdat je ogen niet zo nauwkeurig kunnen waarnemen. Je ziet pas verschil tussen rood en donker rood als de kleur meer dan 10% donkerder is. Een apparaat dat dit soort metingen veel nauwkeuriger kan doen is een spectrofotometer. Een dergelijke meter kan per golflengte de intensiteit van het licht meten.
De werking van het apparaat is betrekkelijk eenvoudig. Aan de ene kant van het apparaat zit een lampje, waarvan het licht door een buisje met de gekleurde vloeistof gaat. Aan de andere kant bevindt zich een lichtgevoelige cel die precies meet
hoeveel licht er door de vloeistof is gekomen.
Je kunt nu zeer nauwkeurig meten door eerst een kalibratieserie te meten, waarbij de concentraties van deze oplossingen bekend zijn. Bij elke kalibratieoplossing meet je hoeveel licht er door gaat, waarna je van al deze metingen en grafiek maakt.
Vervolgens meet je het licht dat het monster door laat. Je kunt nu in de kalibratiegrafiek aflezen welke concentratie er bij hoort.
Chemicaliën
- Kleurstof stamoplossing met bekende concentratie - Kleurstof monster
Uitvoering
Een kalibratieserie (soms kalibratielijn genoemd) wordt meestal gemaakt door een stam- of standaardoplossing met exact bekende concentratie te verdunnen. Deze oplossing staat deze week al klaar.
A. Kalibratieserie of verdunningsreeks
Maak een kalibratieserie door 0,00 - 2,00 - 5,00 - 10,00 - 15,00 - 20,00 en 25,00 ml te pipetteren in maatkolven van 100 ml. Vergeet niet elke maatkolf en pipet drie maal op de juiste manier voor te spoelen.
B. Monster (triplo)
Pipetteer 5,00 ml limonadesiroop in een maatkolf van 50 ml. Zet een “x” op deze maatkolf (na afloop wel weer verwijderen). Doe dit in totaal 3 keer.
C. Extincties meten
Raadpleeg de docent voor het gebruik van de spectrofotometer. Opwarmtijd 5 min. De golflengte dient te worden ingesteld op 490 nm (nm=nanometer). Noteer de codering op de fotometer.
Meet van alle oplossingen de extinctie in drie decimalen nauwkeurig en zet ze in het labjournaal. Spoel de cuvet steeds eerst drie keer voor met de vloeistof die je wilt gaan meten.
Neem onderstaande tabel over in je labjournaal om de meetwaarden in te vullen.
Oplossing Concentratie kleurstof in mg/L E (extinctie) Blanco Maatkolf 1 Maatkolf 2 Maatkolf 3 Maatkolf 4 Maatkolf 5 Maatkolf 6 Monster (m1) Monster (m2) Monster (m3) Stamoplossing
Meet nu alle oplossingen op een andere vergelijkbare fotometer.
Verwerking van de meetgegevens
De concentratie voor elke maatkolf van de kalibratiereeks wordt als volgt berekend:
Waarbij:
- Conc. = Concentratie kalibratiemonster in mg/L. - Vpipet = Volume pipet in ml
De waarden zet je uit in een grafiek op millimeter papier. Op de horizontale as zet je de concentraties en op de verticale as de extincties. Trek een rechte lijn door de punten en lees met behulp van de grafiek af welke concentratie (cx) hoort bij Ex.
Bereken het kleurstofgehalte G:
Waarbij:
- G = Gehalte kleurstof in het monster in mg/L. - cx = Concentratie kleurstof in het monster in mg/L. Maak voor beide reeksen de grafiek.
Vragen
1. Verklaar de factor 10 in de formule .
2. Een goede meetserie blijft tussen E = 0,1 en E = 0,8 , voldoen jouw metingen hieraan?
3. Loopt de kalibratielijn helemaal recht of buigt deze iets af? 4. Gaat de lijn door (0,0)?
5. Zet de metingen in een grafiek en vergelijk de afgelezen monsters met jouw papieren grafiek. Is de papieren versie beter en waarom? (Kijk o.a. naar beide hellingen (rc) en asafsnede)
SO103 – Bepaling van ijzer(III) ionen in een monster
Inleiding
IJzer is een metaal dat in oplossingen kan voorkomen. Er zijn dan vaak Fe2+ en Fe3+ -ionen aanwezig. IJzer(III) kan worden gekleurd met het thiocyanaation (SCN-). Om het ijzergehalte in een monster te bepalen wordt daarom eerst alle aanwezige ijzer omgezet tot ijzer(III) door oxidatie (met permanganaat).
Chemicaliën
- IJzer stamoplossing, 100 mg Fe(III) in 1 L. o Deze staat klaar.
o Zo niet: los 700 mg Mohr's zout op in water; 20 ml 2 M zwavelzuur toevoegen; oxideren door 0,02 M kaliumpermanganaat toe te druppelen; aanvullen tot 1 l.
- Kaliumthiocyanaat oplossing, 200 g/L. - IJzermonster, 10 - 15 mg/L.
Uitvoering
A. Standaard (verdunningsreeks)
Maak een standaardreeks door 0,00 - 1,00 - 2,00 - 3,00 - 4,00 en 5,00 ml
ijzer(III)standaard te pipetteren in maatkolven van 100 ml. Vul de maatkolven nog niet aan! Misschien kun je beter eerst beginnen met B. Beoordeel dit alvorens te beginnen.
B. Monster in triplo
Pipetteer telkens 20 ml ijzer(III)-monster en breng het kwantitatief over in een maatkolf van 100 ml. Vul de maatkolf nog niet aan!
C. Maatkolven aanvullen
Voeg nu uit een maatcilinder zo snel mogelijk aan alle maatkolven 10 ml kaliumthiocyanaat oplossing toe, vul de maatkolven aan en homogeniseer (met vooraf gepaste stop).
D. Extincties meten
Meet binnen 20 min. de extincties van de oplossingen tegen demiwater als blanco. Stel de golflengte in op 480 nm.
Neem onderstaande tabel in je labjournaal over om de meetwaarden in te vullen. Oplossing Concentratie Fe3+ in mg/L E (extinctie)
Blanco Kalibratie 1 Kalibratie 2 Kalibratie 3 Kalibratie 4 Kalibratie 5 Monster 1 Monster 2 Monster 3 Stamoplossing
Verwerking van de meetgegevens
Zet de meetwaarden uit in een grafiek. Zet op de horizontale as de concentraties en op de verticale as de extincties.
De concentratie ijzer in de standaardreeks bereken je als volgt:
Waarbij:
- Conc. = Concentratie kalibratiemonster in mg/L. - Vpipet = Volume pipet in ml
- Vmaatkolf = Volume maatkolf in ml
- Cs = Concentratie stamoplossing in mg/L (voor waarde zie fles).
Bepaal uit de grafiek, m.b.v. de extinctie, wat de concentratie is van het (verdunde) monster (cx). Noteer: cx = .
Bereken het ijzergehalte (G) m.b.v. de volgende formule:
Waarbij:
- G = Gehalte ijzer in het monster in mg/L. - cx = Concentratie ijzer in het monster in mg/L. Vragen
plaatsvinden?
SO106 – Bepaling van sacharine in “zoetjes”
Inleiding
Sacharine (E954) is een kunstmatige zoetstof en kan gebruikt worden voor het zoeter maken van voedsel. Sacharine wordt o.a. gebruikt als tafelzoetstof (‘zoetjes’), in frisdranken en fruitdrinks, ijsthee, zuiveldranken, jam, snoep, gebak, dressings, sauzen, ijs, desserts, kauwgom, en chocolade. Sacharine levert geen energie en heeft een zoetkracht die 350 maal groter is dan die van suiker. Dit betekent dat toevoeging in de orde van milligrammen aan voedingsmiddelen hetzelfde effect geeft als toevoegen van grammen suiker. Sacharine kan echter ook een onaangename metalige nasmaak hebben bij grotere hoeveelheden.
Chemicaliën
- Sacharine stam oplossing 1 g/l in NaOH 0.1 mol/L - NaOH 0.1mol/L
- Sacharinemonster 1 - Sacharinemonster 2
Uitvoering
A. Standaard (verdunningsreeks)
Maak een standaardreeks door 0,00 - 2,00 - 5,00 - 10,00 - en 15,00 ml sacharine-standaard te pipetteren in maatkolven van 100 ml. Vul de maatkolven aan met NaOH 0.1 mol/L
B. Monster 1 in triplo
Pipetteer 5 ml sacharine-monster in een maatkolf van 50 ml. Vul de maatkolven aan met NaOH 0.1 mol/L
C. Monster 2 in triplo
Weeg een “zoetje” af en los het op in 0.1 mol/L NaOH.
Breng het kwantitatief over in een maatkolf van 50 ml en vul aan met 0.1 mol/L NaOH.
D. Extincties meten
Gebruik voor deze metingen kwarts cuvetten
Meet de extincties van de oplossingen tegen 0.1mol/L NaOH als blanco. Stel de golflengte in op 266 nm.
Neem onderstaande tabel in je labjournaal over om de meetwaarden in te vullen.
Oplossing Concentratie sacharinein mg/L E (extinctie) NaOH 0.1mol/L (Blanco) Kalibratie 1 Kalibratie 2 Kalibratie 3 Kalibratie 4 Monster 1 (x) Monster 1 (x) Monster 1 (x) Monster 2 (x) Monster 2 (x) Monster 2 (x) Stamoplossing
Verwerking van de meetgegevens
Zet de meetwaarden uit in een grafiek. Zet op de horizontale as de concentraties en op de verticale as de extincties.
De concentratie sacharine in de standaardreeks bereken je als volgt:
Waarbij:
- Conc. = Concentratie kalibratiemonster in mg/L. - Vpipet = Volume pipet in ml
- Vmaatkolf = Volume maatkolf in ml
- Cs = Concentratie stamoplossing in mg/L (voor waarde zie fles).
Bepaal uit de grafiek, m.b.v. de extinctie, wat de concentratie is van de monsters (cx). Noteer: cx = .
Bereken het sacharine gehalte (G) van monster 1 m.b.v. de volgende formule:
Waarbij:
- G = Gehalte sacharine in het monster in mg/L. - cx = Concentratie sacharine in het monster in mg/L.
Bereken het massapercentage sacharine van monster 2 m.b.v. de volgende formule:
Waarbij:
- V = Volume 0,1 Mol/L NaOH in L waarin het monster is opgelost - cx = Concentratie sacharine in het monster in mg/L.
- M = Massa in mg van het “zoetje” Vragen
1. Waarom moet gemeten worden met een kwarts cuvet.
2. Welke producten heb je thuis die suiker vervangers bevatten.