DE PREDICTIEVE VALIDITEIT VAN DE
BEPURA SCHAAL
EEN NIEUWE MANIER VAN KIJKEN NAAR PREVENTIE VAN
DECUBITUS
Aantal woorden: 5657
Vereecke Dieter
Stamnummer: 01204740Promotor: Prof. dr. Dimitri Beeckman Copromotor: Mevr. Liesbet Demarré
Mentoren: Mr. Steven Smet, Mevr. Katrien Vanderwee
Masterproef voorgelegd voor het behalen van de graad van master in de verpleegkunde en de vroedkunde
©Copyright UGent
Zonder voorafgaande schriftelijke toestemming van zowel de promotor als de auteurs is overnemen, kopiëren, gebruiken of realiseren van deze uitgave of gedeelten ervan verboden. Voor aanvragen tot of informatie in verband met het overnemen en/of gebruik en/of realisatie van gedeelten uit deze publicatie, wend u tot de promotor. Voorafgaande schriftelijke toestemming van de promotor is eveneens vereist voor het aanwenden van de in de masterproef beschreven (originele) methoden, producten en resultaten voor publicatie of commercieel nut en voor de inzending van deze publicatie ter deelname aan wetenschappelijke prijzen of wedstrijden.
DE PREDICTIEVE VALIDITEIT VAN DE
BEPURA SCHAAL
EEN NIEUWE MANIER VAN KIJKEN NAAR PREVENTIE VAN
DECUBITUS
Aantal woorden: 5657
Vereecke Dieter
Stamnummer: 01204740Promotor: Prof. dr. Dimitri Beeckman Copromotor: Mevr. Liesbet Demarré
Mentoren: Mr. Steven Smet, Mevr. Katrien Vanderwee
Masterproef voorgelegd voor het behalen van de graad van master in de verpleegkunde en de vroedkunde
Deze pagina is niet beschikbaar omdat ze persoonsgegevens bevat.
Universiteitsbibliotheek Gent, 2021.
This page is not available because it contains personal information.
Ghent University, Library, 2021.
Inhoud
Woord vooraf ... 2 Abstract ... 4 Inleiding ... 6 Methode ... 9 Doel ... 9 Design... 9 Setting en steekproef ... 9 Datacollectie ... 10 Instrumenten ... 11 Nortonschaal ... 11 Bradenschaal ... 12 BEPURA schaal ... 12Schalen voor zorgzwaarte ... 13
Data analyse ... 13
Ethische overwegingen ... 14
Resultaten ... 15
Beschrijving van de steekproef ... 15
Incidentie en Preventie van en Risico op decubitus in de totale steekproef . 17 Predictieve validiteit van de Norton, Braden en BEPURA schalen ... 21
Discussie ... 22 Conclusie... 29 Referentielijst ... 30 Bijlagen ... 34 Bijlage 1: Datacollectieformulier ... 34 Bijlage 2: Risicoschalen ... 35
Bijlage 3: KATZ-schaal ... 37 Bijlage 4: ROC-curves en kruistabellen ... 38 Tabellen en Figuren ... 47
2
Woord vooraf
Met deze masterproef sluit ik een hoofdstuk in mijn opleiding tot “Master of Science in de verpleegkunde en vroedkunde” aan de UGent af. De keuze voor het onderwerp, valideren van een nieuwe risicoschaal voor decubitus, kwam voort uit mijn praktijkervaring als geriatrisch verpleegkundige. Deze ervaring gaf me de achtergrond nodig om bepaalde beslissingen te maken gedurende het proces van de masterproef, maar ook gaf het me inzicht in het belang van een accurate en haalbare risicoschaal voor decubitus.
Het opmaken van deze masterproef was een uitdaging in zelfstandig werken, verpleegkundig onderzoek en wetenschappelijk schrijven. Verschillende personen hebben mij hierbij geholpen, zowel bewust als onbewust. Mijn dank gaat uit naar elk van hen.
Vooreerst wil ik mijn promotor, Prof. Dr. Dimitri Beeckman, bedanken. De overlegmomenten gaven mij steeds veel richting en inzichten in het wetenschappelijk onderzoek gedurende de masterproef. Ook wil ik mijn copromotor en mentoren, Mevr. Liesbet Demarré, Mevr. Katrien Vanderwee en Mr. Steven Smet, bedanken. Zij gaven deskundig advies en ondersteunden mij in de aanvragen voor de Commissie medische ethiek, alsook op het werkveld. Daarnaast ben ik ook mijn medestudenten zeer dankbaar. Zij gaven mij tips en duiding wanneer een aspect van de masterproef niet duidelijk was en gaven opbouwende feedback waar nodig. Zonder hen was het niet mogelijk geweest om elk van de delen van de masterproef tot een goed einde te brengen.
Een “van harte dank u wel” gaat ook uit naar de patiënten en de verpleegkundige teams voor hun interesse in en inzet bij de datacollectie voor de masterproef. Als laatste wil ik mijn vrienden en familie bedanken voor hun steun gedurende deze proef. In het bijzonder wil ik mijn vriendin Febe bedanken. Zij ondersteunde mij met een engelengeduld en zette mij aan om verder te doen wanneer alles in het honderd leek te lopen.
3
DE MASTERPROEF IS IN ARTIKELVORM GESCHREVEN. DE UITGEBREIDE RAPPORTAGE VAN DE SYSTEMATISCHE LITERATUURSTUDIE MAAKT
GEEN DEEL UIT VAN HET GESCHREVEN ARTIKEL. DE
LITERATUURSTUDIE WERD EERDER BEOORDEELD IN HET
4
Abstract
Nederlandstalige versie
Deze studie kadert in een breder onderzoek naar het gebruik van de “BElgian Pressure Ulcer Risk Assessment” (BEPURA) in de verpleegkundige praktijk. Het doel van de studie was het nagaan van de predictieve validiteit van de BEPURA schaal en deze te vergelijken met de Norton- en Bradenschalen. Deze huidige risicoschalen voor decubitus worden immers in vraag gesteld naar wat betreft het nut, haalbaarheid en accuraatheid. De nieuw ontwikkelde BEPURA schaal heeft als doel op een tijdige, haalbare en accurate manier een beoordeling te maken van het risico van een patiënt op het ontwikkelen van decubitus.
Deze observationele studie, lopende van oktober tot en met december 2019, rekruteerde 304 participanten bij wie risico-score lijsten werden afgenomen. De gegevenscollectie vond plaats in twee regionale en één universitair ziekenhuis in Vlaanderen. De predictieve validiteit van elk van de drie schalen werd geanalyseerd aan de hand van de sensitiviteit, specificiteit, positieve voorspellende waarde, negatief voorspellende waarde en toegepaste preventiemaatregelen. Waar nodig werden “receiver operating characteristic curves” opgesteld en “likelihood ratio’s” berekend en geanalyseerd.
De studie stelde de beste predictieve validiteit vast bij de Bradenschaal, gevolgd door de BEPURA schaal en dan de Nortonschaal. Voor de BEPURA schaal werd een goede predictieve validiteit vastgesteld. Verder onderzoek naar de predictieve validiteit van de BEPURA schaal, alsook het nut ervan in een verpleegkundige setting is echter aangewezen vooraleer een brede toepassing kan worden aanbevolen.
5 English Version
This research paper is part of a broader study evaluating the use of the “BElgian Pressure Ulcer Risk Assessment” (BEPURA) in nursing practice. The aim of this paper was to evaluate the predictive validity of the BEPURA scale and to compare it to that of the Norton and Braden scales. These currently available risk scales for pressure ulcers are being questioned for their use, feasibility and accuracy in the prevention of these sores. The newly developed BEPURA scale aims at making an assessment of the risk of developing pressure ulcers in a timely, feasible and accurate manner.
This observational study, running from October up to and including December 2019, recruited 304 participants who were evaluated for pressure ulcer development by implementing the risk scales. The collection of data took place in two regional and one university hospital in Flanders. The predictive validity of the three scales was analyzed by comparing sensitivity, specificity, positive predictive value, negative predictive value and the applied prevention measures. When appropriate, receiver operating characteristic curves were made and likelihood ratios were calculated and analyzed.
The study revealed the best predictive value for the Braden scale, followed by the BEPURA scale and finally the Norton scale. The BEPURA scale had good predictive value in this study. Further research into the predictive validity of the BEPURA scale, as well as the use of it in the nursing practice, is recommended before its wide application can be recommended.
6
Inleiding
Decubitus wordt door de European Pressure Ulcer Advisory Panel (EPUAP) en de American National Pressure Advisory Panel (NPUAP) gedefinieerd als “a localized injury to the skin and/or underlying tissue usually over a bony prominence, as a result of pressure, or pressure in combination with shear” (National Pressure Ulcer Advisory Panel, European Pressure Ulcer Advisory Panel, & Pan Pacific Pressure Injury Alliance, 2014). Er worden vier niet opeenvolgende graden van decubitus onderscheiden: niet wegdrukbare roodheid bij intacte huid (graad één), verlies van een deel van de huidlaag of blaar (graad twee), verlies van de volledige huidlaag met zichtbare vetlaag (graad drie) en verlies van de volledige weefsel-laag met zichtbare spieren/bot (graad vier). Het ontwikkelen van een decubitusletsel veroorzaakt fysieke, sociale en psychologische problemen, alsook verlengt het de opnameduur voor de patiënt (Graves, Birrell, & Whitby, 2005; Jiang et al., 2014). Eveneens zorgt de aandoening voor een verhoogde werklast voor het personeel en worden de medische kosten voor de patiënt en de samenleving opgedreven(Jiang et al., 2014). De significantie van deze lasten is des te groter omdat deze aandoening meestal te voorkomen is (Van Den Bos et al., 2011).
De kosten voor de behandeling van de aandoening liggen bovendien veel hoger dan de preventie ervan. De jaarlijkse kost voor de behandeling van decubitus bedraagt 165.75 miljoen euro in de Vlaamse ziekenhuizen. De kost voor preventie is echter begroot op slechts 28.354 miljoen euro (Demarre et al., 2015). Inzetten op preventie is dus noodzakelijk (Park & Lee, 2016).
De eerste stap voor preventie is het maken van een verpleegkundig oordeel aan de hand van een risicoschaal. De Belgische richtlijnen in het kader van decubituspreventie stellen dat naast het gebruik van een gevalideerde risicoschaal eveneens de klinische blik van de zorggever alsook de inspectie van de huid van cruciaal belang zijn (Beeckman. et al., 2013).
Er bestaat een verscheidenheid aan risicoschalen (Moore et al., 2019). De meest gebruikte zijn de Braden- en Nortonschalen (Satekova & ziakova, 2014). De
7
predictieve validiteit van deze schalen wordt echter in vraag gesteld omdat de sensitiviteit en specificiteit, de terecht-positieven en -negatieven, variëren in verschillende studies (Park & Lee, 2016; Satekova & ziakova, 2014; Schoonhoven et al., 2002). Om te spreken van een goede predictieve schaal moet een evaluatie gemaakt worden van de sensitiviteit en specificiteit, waarbij beide waarden 1.0 benaderen (Zhu, Zhang, & Wang, 2010). Voor de Bradenschaal vonden Park & Lee (2016), in een systematische review, een variërende sensitiviteit tussen 0.89 en 1.00 en een specificiteit tussen 0.18 en 0.92. Voor de Nortonschaal varieerde de sensitiviteit tussen 0.27 en 0.92 en de specificiteit 0.29 en 0.98. Naast het probleem met de variabiliteit in de predictieve validiteit is er bovendien bezorgdheid over een onvoldoende kennis rond het gebruik van deze schalen , alsook een beperkte waardering voor de schalen bij zorgverleners (Demarre et al., 2012).
De Pressure Ulcer Risk Primary Or Secondary Evaluation Tool (PURPOSE T schaal) werd ontwikkeld om de hiaten van de bestaande risicoschalen aan te pakken (Coleman et al., 2016). De implementatie van deze schaal bestaat uit drie stappen. In de eerste stap worden de mobiliteit en de huidstatus van de patiënt geobserveerd en gerapporteerd. In de tweede stap wordt een diepgaande inschatting gemaakt van de volgende parameters: beweging, perceptie, perfusie, huid, voorgeschiedenis van decubitus, vochthuishouding en diabetes. In de laatste stap wordt er dan op basis van deze evaluaties een beoordeling opgesteld waarbij patiënten worden ingedeeld in verschillende categorieën, namelijk een risicopatiënt, een niet-risicopatiënt, of een persoon die nu of in het verleden decubitus ontwikkeld heeft (Smith, Brown, Coleman, Wilson, & Nixon, 2015). Het complexe en tijdsintensieve karakter van de PURPOSE T-schaal zette het UZ Gent, samen met het Universitair Centrum voor Verpleegkunde en Vroedkunde van de Universiteit Gent, ertoe aan om een vereenvoudiging van deze schaal op te stellen, waarbij enkel de eerste stap werd opgenomen. De nieuwe schaal kreeg de naam BElgian Pressure Ulcer Risk Assesment (BEPURA). Aan de hand van twee ja/nee-vragen rond mobiliteit/activiteit en de huidstatus van de patiënt wordt het risico op decubitus nagegaan (Smet, de Graaf, Bernaerts, Casaer, & Beeckman, 2019).
8
In 2016 werd de BEPURA schaal geïntroduceerd in het UZ Gent en in 2017 in het UZ Leuven. In een pilootstudie van het UZ Leuven (Eussen & Vermeire, 2018) werden geen significante verschillen gevonden tussen de predictieve validiteit van de BEPURA- en de Nortonschaal. In deze masterproef die deel uitmaakt van een bredere studie, wordt onderzoek gedaan naar de predictieve validiteit van de BEPURA schaal.
9
Methode
Doel
Het doel van de studie is het nagaan van de predictieve validiteit van de BEPURA schaal bij gehospitaliseerde patiënten in Vlaanderen. Alsook wordt een vergelijking gemaakt met de predictieve validiteit van de Norton- en Bradenschalen op dezelfde groep patiënten.
Design
Aan de hand van een prospectieve observationele studie, gebruik makend van een ‘time-series design’, werd de incidentie van decubitus nagegaan bij gehospitaliseerde patiënten op de diensten geriatrie en intensieve zorgen van verschillende ziekenhuizen in Vlaanderen. De waarnemingen werden vervolgens geanalyseerd om de predictieve validiteit van de gebruikte risicoschalen na te gaan.
Setting en steekproef
In het kader van het onderzoek werd gekozen voor de diensten intensieve zorgen (INZO) en geriatrie. Deze diensten werden geselecteerd daar de prevalentie van decubitus op deze afdeling het grootste is (RIZIV), 2018). De eenheden bevonden zich in één universitair en twee regionale ziekenhuizen. De doelgroep omvatte alle gehospitaliseerde patiënten die gedurende een periode van drie maanden, oktober tot en met december, werden geëvalueerd.
De steekproef werd opgesteld aan de hand van de “consecutive non probability”-methode tot er minstens 300 participanten werden geïncludeerd. Deze steekproefgrootte werd per afdeling berekend op basis van beschikbare data van de Federale Overheidsdienst Volksgezondheid (2012) of van interne data van de deelnemende ziekenhuizen. De volgende formule werd hiervoor gehanteerd: (aantal bedden per afdeling x bezettingsgraad (%) x (observatietijd / gemiddelde ligduur per afdeling))/2.
Naast hun aanwezigheid op één van de bovengenoemde afdelingen moesten de patiënten ook aan de volgende inclusiecriteria voldoen: de Nederlandse taal machtig zijn aangezien de geïnformeerde toestemming en de duiding van de
10
studie in het Nederlands was, en beslissingsbekwaam zijn. Indien dit laatste niet het geval was, moest er een verantwoordelijke persoon beschikbaar zijn die een geïnformeerde toestemming kon geven. Voor de diensten INZO werd bovendien het extra criterium toegevoegd dat enkel beademde patiënten werden opgenomen in de studie om de werkdruk gekoppeld aan het afnemen van de risico-score lijsten voor de verpleegkundigen te beperken.
Datacollectie
In het kader van het werkbaar houden van deze masterproef werd voor de datacollectie samengewerkt met twee medestudenten die ook onderzoek deden naar de BEPURA schaal. Elk van de studenten volgde één setting op. De datasets werden vervolgens samengevoegd om een antwoord te formuleren op de respectievelijke onderzoeksvragen van elke student.
Voorafgaand aan de datacollectie werden er twee tot drie bijscholingen voorzien voor het betrokken personeel van elke dienst. Tijdens deze bijscholingen werd aan de hand van een plenair lesmoment, gecombineerd met de mogelijkheid tot open discussie, het doel van het onderzoek en de BEPURA schaal voorgesteld. Deze informatiemomenten werden georganiseerd om de kwaliteit van de data te garanderen.
Gedurende de datacollectie periode, van oktober tot en met december 2019, werden eveneens momenten voorzien waarbij de verpleegkundigen van de afdelingen vragen konden stellen aan de onderzoekers. Eveneens werden er kwaliteitscontroles georganiseerd door de onderzoekers op de gecollecteerde data.
De data werden aan de hand van een vooropgesteld datacollectieformulier verzameld (bijlage 1) door de verpleegkundigen van de afdelingen. In het universitair ziekenhuis (ZHU) werd enkel de bevraging voor de BEPURA-schaal afgenomen, om de studie werkbaar te houden voor de verpleegkundigen. De regionale ziekenhuizen rapporteerden naast de bevraging voor de BEPURA schaal tevens de totaalscores van ofwel de Bradenschaal (ZHR1) of de Nortonschaal (ZHR2). De deelscores van de BEPURA schaal werden dagelijks
11
gerapporteerd. De totaalscores van de Braden- en Nortonschalen werden wekelijks gerapporteerd.
Op het datacollectieformulier was tevens plaats voorzien voor de dagelijkse rapportering van decubitus. De decubitus evaluatie was gebaseerd op de “International EPUAP classification system” (NPUAP, EPUA, & PPPIA, 2014). De preventieve maatregelen aangewend bij de participanten, waaronder het toepassen van de wisselhouding en/of zwevende hielen, en het soort gebruikte matras, werden dagelijks gerapporteerd.
Naast de bovenvermelde data werden tevens demografische gegevens verzameld om een ruimer beeld te schetsen van de steekproef: leeftijd, geslacht, afdeling. De zorgzwaarte werd nagegaan aan de hand van de elementen van de KATZ-schaal (bijlage 3) of aan de hand van een door de setting gebruikt systeem (ZHR1).
De data werden gedurende de gehele opname van de patiënten bewaard in hun dossier. Bij ontslag van de participant werd de onderzoeker verwittigd en werden de data overgenomen en op anonieme wijze verwerkt. Participanten van wie er voor minder dan drie dagen data werden verzameld, werden niet opgenomen in de studie, omdat bij het ontwikkelen van decubitus er geen zekerheid kon zijn dat die opgelopen was in de geobserveerde setting.
Instrumenten
Nortonschaal
In 1962 ontwikkelden Norton et al. (1962) een schaal om risicopatiënten voor decubitus op te sporen in een geriatrische populatie. De schaal bevat vijf deeldomeinen die elk worden gescoord tussen één en vier: hoe lager de scores, hoe hoger het risico op decubitus. De domeinen zijn: fysieke conditie, mentale status, activiteit, mobiliteit en incontinentie. Op basis van de deelscores wordt een totaalscore op 20 verkregen (bijlage 2).
Zoals beschreven door Norton et al. (1962) werd in de setting waar deze schaal werd gebruikt (ZHR1) een afkappunt van 14 gehanteerd, gecombineerd met een klinische blik, om risicopatiënten op te sporen. Dit afkappunt wordt echter in vraag
12
gesteld in verschillende onderzoeken (Park & Lee, 2016; Satekova, Ziakova, & Zelenikova, 2017; Schoonhoven et al., 2002). Bovendien heeft de Nortonschaal ondanks zijn populariteit, een lagere validiteit dan andere veelgebruikte schalen in de verpleegkundige praktijk (Balzer, Pohl, Dassen, & Halfens, 2007; Defloor & Grypdonck, 2005; Satekova et al., 2017).
Bradenschaal
Ontwikkeld door Bergstrom et al. (1987) evalueert deze risicoschaal voor decubitus zes domeinen: gevoel, activiteit, mobiliteit, voedingsstatus en druk-/schuifkracht (bijlage 2). Bij elk van de domeinen wordt een sub-score van één tot vier gegeven, met uitzondering van de laatste die een maximale score van drie heeft. De totale score ligt dan tussen zes en 23, waarbij een lagere score een hogere kans op het ontwikkelen van decubitus betekent.
Zoals beschreven door Bergstrom et al. (1987), werd 18 als afkappunt gehanteerd in de setting waar deze schaal werd gebruikt om een participant als risicopatiënt te evalueren, in samenhang met de klinische blik van de verpleegkundigen. Ook dit afkappunt ligt echter ter discussie in verschillende onderzoeken (Pancorbo-Hidalgo, Garcia-Fernandez, Lopez-Medina, & Alvarez-Nieto, 2006; Park & Lee, 2016; Satekova & ziakova, 2014).
BEPURA schaal
De BEPURA schaal werd in 2016 ontwikkeld door het Universitair Centrum voor Verpleegkunde en Vroedkunde van de universiteit Gent en het UZ Gent als instrument voor het tijdig, haalbaar en gestructureerd opsporen van risicopatiënten voor decubitus (Smet et al., 2019). De schaal werd ontworpen aan de hand van de eerste stap van de PURPOSE T-schaal, namelijk screening (Coleman et al., 2016). De beoordeling gebeurt op basis van twee ja/nee vragen die de mobiliteit/activiteit en de huidstatus van de patiënt nagaan (bijlage 2). Vervolgens wordt een dichotome uitkomstmaat geformuleerd die een uitspraak doet over de risicogroep waartoe de patiënt behoort: risico op het ontwikkelen van decubitus of geen risico op het ontwikkelen decubitus. De preventiemaatregelen in de gevolgde settings werden opgestart aan de hand van de risicoanalyse volgends de BEPURA schaal.
13 Schalen voor zorgzwaarte
De KATZ-schaal wordt in de Belgische gezondheidszorg gebruikt om een evaluatie te maken van de Activiteiten Dagelijks Leven (ADL) van een patiënt. Deze schaal is in gebruik sinds 1 januari 2014 en werd herzien op 10 oktober 2017 (RIZIV, 2018).
De evaluatieschaal omvat 6 gebieden: zich wassen, zich kleden, transfer en verplaatsingen, toiletbezoek, continentie en eten (bijlage 3). Aan elk van deze items wordt een score toegekend van één tot vier. Hierbij betekent één ‘geen behoefte aan enige hulp’ en geeft een score van vier ‘behoefte aan volledige hulp’ aan. Aan de hand van de quotering wordt door de arts een codering toegekend aan de persoon (RIZIV, 2018): A, B, of C, waarbij bij elk van de coderingen een forfait wordt toegekend.
In deze studie worden de data van de KATZ-schaal gebruikt om inzicht te geven op de zorgzwaarte van de steekproef. In één van de settings (ZHR1) werd de zorgzwaarte echter op een andere manier gerapporteerd. Een score van één tot vier werd toegekend aan elke patiënt op basis van de volgende elementen: zich wassen, zich kleden, eten, mobiliteit, toiletbezoek en zelfredzaamheid. Waarbij een score van één ‘geen hulp/basishulp’ betekent en vier ‘volledig afhankelijk’.
Data analyse
De data werden geanalyseerd aan de hand van het programma SPSS26.
Een beschrijving van het sample werd opgemaakt waarmee de zorgzwaarte van de patiënten in de verschillende diensten werd vergeleken aan de hand van de Mann-Whitney U-test, waarbij significantie werd vastgelegd op het 5% niveau. Daarnaast werd per dienst een vergelijking gemaakt van de procentuele verhouding risicopatiënten bekomen aan de hand van de verschillende schalen. Het afkappunt om te spreken van een risicopatiënt was het afkappunt gebruikt in de setting, voor de aanvang van de studie (Nortonschaal:14 en Bradenschaal: 18).
Voor elk van de schalen werd de sensitiviteit, specificiteit, positief voorspellende waarde en negatief voorspellende waarde van dag drie, vijf en tien berekend om
14
een uitspraak te kunnen doen over de predictieve validiteit. Dag drie werd geselecteerd omwille van het feit dat het de eerste dag is dat decubitus met zekerheid kan gelinkt worden aan de afdeling. Dag vijf en tien werden geselecteerd om een opvolging te kunnen maken van de variatie van de waarden van de predictieve validiteit van de schalen over de tijd.
Er werd een analyse gemaakt van de risicoschalen aan de hand van een “Receiver Operating Characteristic”-curve (ROC-curve) (Zhu et al., 2010). Voor de BEPURA schaal werd bovendien de positieve “likelihood ratio” (LR+) en negatieve “likelihood ratio” (LR-) berekend op elk van de drie bovenvermelde dagen (Zhu et al., 2010).
Het ontwikkelen van een decubitusletsel wordt in deze studie beschreven als: “het ontwikkelen van decubitus, volgens de NPUAP, EPUAP, & PPPIA (2014), gedurende de opname, rekenend vanaf dag drie na de opname” omdat er anders geen garantie kan gegeven worden dat de ontwikkelde decubitus eigen is aan de betrokken afdeling.
Defloor and Grypdonck (2004) merkten in hun kritische analyse van de predictieve validiteit van risicoschalen op dat wanneer er een uitspraak wordt gedaan over de sensitiviteit en specificiteit van een risicoschaal, de preventieve maatregelen die toegepast zijn bij de participanten eveneens in acht moeten genomen worden. Daarom werd de preventie die toegepast werd bij de participanten mee opgenomen in de analyse van de predictieve validiteit. Aan de hand van een Fisher Exact-test werden verschillen tussen de groepen geanalyseerd. De significantie werd vastgelegd op het 5% niveau.
Ethische overwegingen
Vanuit het ethisch oogpunt dat elk verpleegkundig onderzoek moet hebben (Polit & Beck, 2017), werd voorafgaand aan de aanvang van deze studie goedkeuring bekomen bij het centraal ethisch comité en bij elk van de betrokken instellingen. Bovendien is er bij elk van de participanten een geïnformeerde toestemming bekomen, alvorens de datacollectie werd gestart.
15
Resultaten
Beschrijving van de steekproef
Het totale aantal participanten geïncludeerd in deze studie bedroeg 305. Van deze participanten waren er 144 opgenomen in het universitair ziekenhuis (ZHU) en respectievelijk 89 (ZHR1) en 73 (ZHR2) in de regionale ziekenhuizen. Van deze participanten waren 61,51% vrouwelijk en 38,49% mannelijk. De leeftijd lag tussen de 24 en 98 jaar met een gemiddelde van 80 jaar en een standaard deviatie (SD) van 11,29. 20,72% van de participanten werd opgenomen op de dienst intensieve zorgen, 79,28% op de dienst geriatrie.
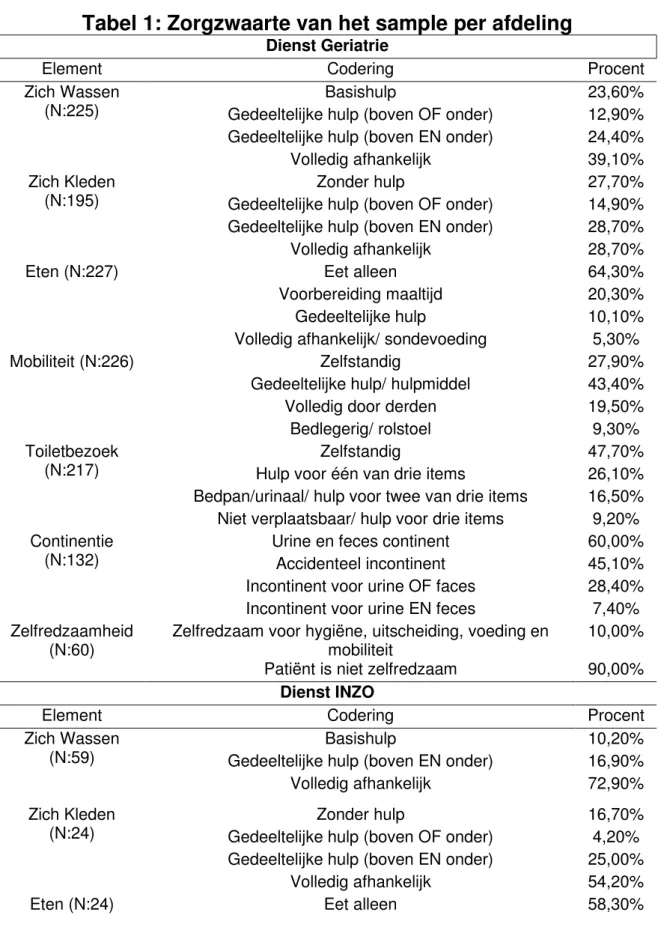
In het universitair ziekenhuis (ZHU), alsook in één van de regionale ziekenhuizen (ZHR2), werd de zorgzwaarte gemeten aan de hand van de criteria in de KATZ-schaal. In het andere regionale ziekenhuis (ZHR1) werd op een aangepaste wijze de zorgzwaarte gerapporteerd. In Tabel 1 is een overzicht van de gerapporteerde zorgzwaarte per afdeling terug te vinden. Wanneer de zorgzwaarte van de patiënten op beide diensten werd vergeleken aan de hand van Mann-Whitney U-testen, bleek er een significant verschil te zijn voor de volgende elementen: zich wassen (P<0.005), zich kleden (P=0.02), mobiliteit (P=0.04) en continentie (P<0.005). In alle gevallen hadden de patiënten op de INZO een zwaardere zorg nodig. Er waren bovendien ook verschillen, hoewel niet significant, voor de elementen eten (P=0.16), toiletbezoek (P=0.39) en zelfredzaamheid (P=0.44).
Tabel 1: Zorgzwaarte van het sample per afdeling
Dienst Geriatrie
Element Codering Procent
Zich Wassen (N:225)
Basishulp 23,60%
Gedeeltelijke hulp (boven OF onder) 12,90% Gedeeltelijke hulp (boven EN onder) 24,40%
Volledig afhankelijk 39,10%
Zich Kleden (N:195)
Zonder hulp 27,70%
Gedeeltelijke hulp (boven OF onder) 14,90% Gedeeltelijke hulp (boven EN onder) 28,70%
Volledig afhankelijk 28,70% Eten (N:227) Eet alleen 64,30% Voorbereiding maaltijd 20,30% Gedeeltelijke hulp 10,10%
16
Mobiliteit (N:226)
Zelfstandig 27,90%
Gedeeltelijke hulp/ hulpmiddel 43,40%
Volledig door derden 19,50%
Bedlegerig/ rolstoel 9,30%
Toiletbezoek (N:217)
Zelfstandig 47,70%
Hulp voor één van drie items 26,10%
Bedpan/urinaal/ hulp voor twee van drie items 16,50% Niet verplaatsbaar/ hulp voor drie items 9,20% Continentie
(N:132)
Urine en feces continent 60,00%
Accidenteel incontinent 45,10%
Incontinent voor urine OF faces 28,40%
Incontinent voor urine EN feces 7,40%
Zelfredzaamheid (N:60)
Zelfredzaam voor hygiëne, uitscheiding, voeding en mobiliteit
10,00%
Patiënt is niet zelfredzaam 90,00%
Dienst INZO
Element Codering Procent
Zich Wassen (N:59)
Basishulp 10,20%
Gedeeltelijke hulp (boven EN onder) 16,90%
Volledig afhankelijk 72,90%
Zich Kleden (N:24)
Zonder hulp 16,70%
Gedeeltelijke hulp (boven OF onder) 4,20% Gedeeltelijke hulp (boven EN onder) 25,00%
Volledig afhankelijk 54,20%
Eten (N:24)
Eet alleen 58,30%
Voorbereiding maaltijd 8,30%
Volledig afhankelijk/ sondevoeding 33,30% Mobiliteit (N:24)
Zelfstandig 20,80%
Gedeeltelijke hulp/ hulpmiddel 29,20%
Volledig door derden 20,80%
Bedlegerig/ rolstoel 29,20%
Toiletbezoek (N:24)
Zelfstandig 50,00%
Hulp voor één van drie items 8,30%
Bedpan/urinaal/ hulp voor twee van drie items 12,50% Niet verplaatsbaar/ hulp voor drie items 29,20% Continentie
(N:24)
Incontinent voor urine EN feces 100,00%
Zelfredzaamheid (N:18)
Zelfredzaam voor hygiëne, uitscheiding, voeding en mobiliteit
16,70%
Patiënt is niet zelfredzaam 83,30%
17
Incidentie en Preventie van en Risico op decubitus in de totale steekproef
Negentien participanten (6.22%) ontwikkelden decubitus gedurende hun opname op de verschillende diensten (Tabel 2). Hiervan waren er acht van de eerste graad en elf van de tweede graad.
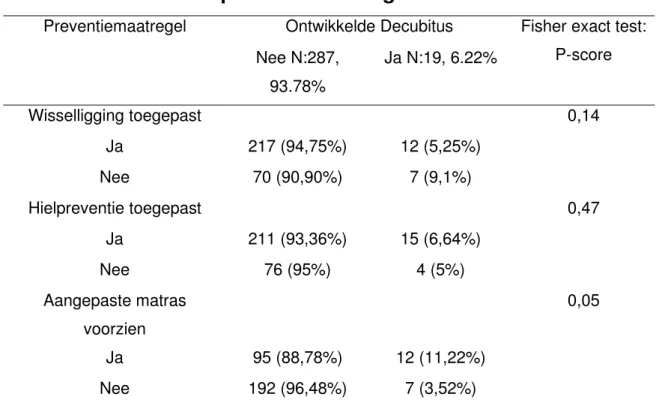
Over de diensten heen, werd er bij 99% van de risicopatiënten, zoals geëvalueerd volgens de BEPURA schaal, een vorm van preventieve maatregelen genomen gedurende de opname. In één van de regionale ziekenhuizen (ZHR1) kreeg elke participant op de dienst geriatrie preventieve maatregelen, namelijk wisselligging, ongeacht het risico op decubitus.
Wanneer de impact van preventiemaatregelen op de ontwikkeling van decubitus werd vergeleken tussen de groep die decubitus ontwikkelde en de groep die geen decubitus ontwikkelde, dan werd enkel voor het al dan niet gebruiken van een aangepast matras een significant verschil gevonden (P=0,05): het gebruik van een aangepaste matras kan dus als significante preventie worden beschouwd in de studie. Op basis van de data analyse zou hielpreventie weinig effect hebben en toepassen van wisselligging viel net buiten de significantiegrens van P<0.1.
Tabel 2: Overzicht en analyse van toegepaste
preventiemaatregelen
Preventiemaatregel Ontwikkelde Decubitus Fisher exact test: P-score Nee N:287, 93.78% Ja N:19, 6.22% Wisselligging toegepast 0,14 Ja 217 (94,75%) 12 (5,25%) Nee 70 (90,90%) 7 (9,1%) Hielpreventie toegepast 0,47 Ja 211 (93,36%) 15 (6,64%) Nee 76 (95%) 4 (5%) Aangepaste matras voorzien 0,05 Ja 95 (88,78%) 12 (11,22%) Nee 192 (96,48%) 7 (3,52%)
18
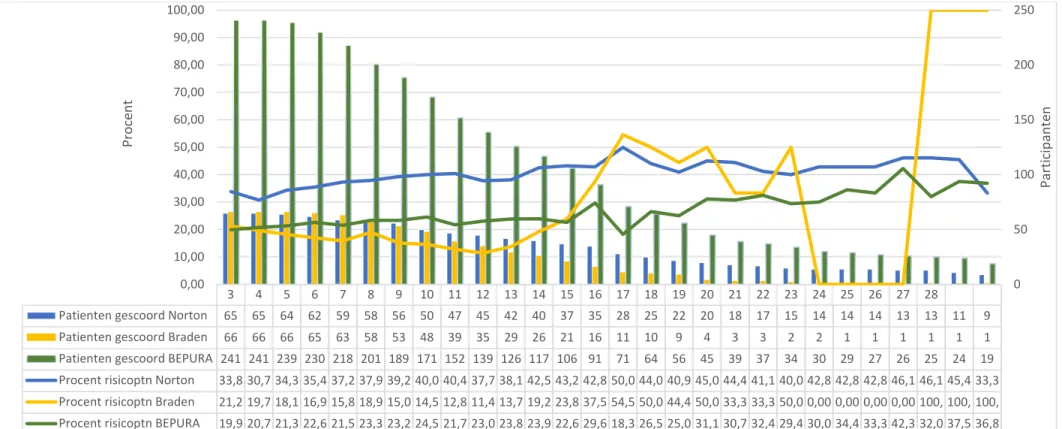
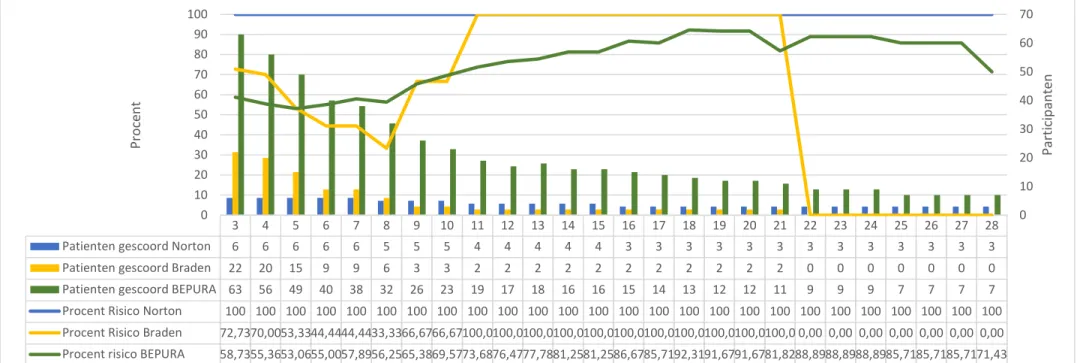
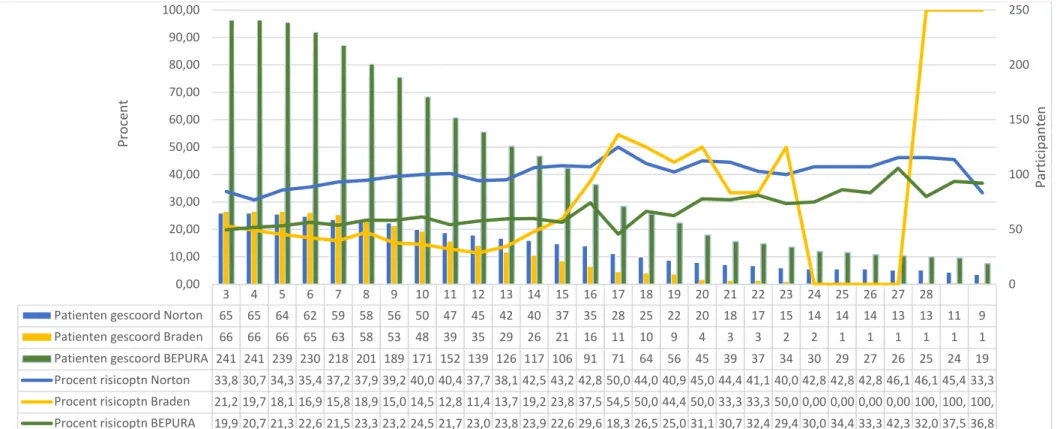
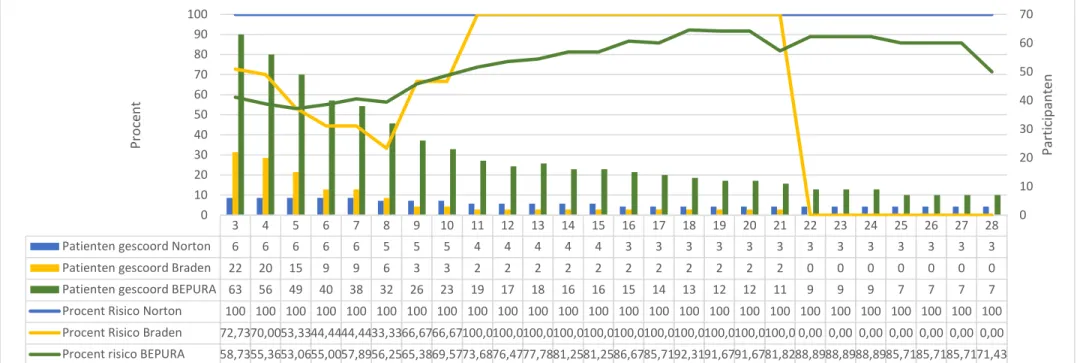
De resultaten van de analyse van het aantal risicopatiënten op de geriatrische diensten is weergegeven in Figuur 1 en op de INZO diensten in Figuur 2. Beide figuren geven voor de 3 verschillende schalen het aantal patiënten weer die per dag gescoord werden over een periode van 28 dagen. Bovendien is de procentuele verhouding weergegeven van het aantal risicopatiënten per dienst per dag en per schaal ten opzichte van het totaal aantal opgenomen participanten gescoord met dezelfde schaal.
De medianen van de procentuele verhouding risicopatiënten voor de geriatrie waren 40,68% voor de Nortonschaal, 31,24% voor de Bradenschaal en 27,22% voor de BEPURA schaal. Voor de INZO waren de medianen 100% voor de Nortonschaal, 80,81% voor de Bradenschaal en 75,03% voor de BEPURA schaal.
Een uitgebreid onderzoek naar het significant karakter van het verschil in het aantal risicopatiënten ten opzichte van het totale aantal patiënten op de twee afdelingen valt buiten het bestek van het in deze paper gevoerde onderzoek
19
Figuur 1: Analyse Risicopatiënten Geriatrie
3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28
Patienten gescoord Norton 65 65 64 62 59 58 56 50 47 45 42 40 37 35 28 25 22 20 18 17 15 14 14 14 13 13 11 9 Patienten gescoord Braden 66 66 66 65 63 58 53 48 39 35 29 26 21 16 11 10 9 4 3 3 2 2 1 1 1 1 1 1 Patienten gescoord BEPURA 241 241 239 230 218 201 189 171 152 139 126 117 106 91 71 64 56 45 39 37 34 30 29 27 26 25 24 19 Procent risicoptn Norton 33,8 30,7 34,3 35,4 37,2 37,9 39,2 40,0 40,4 37,7 38,1 42,5 43,2 42,8 50,0 44,0 40,9 45,0 44,4 41,1 40,0 42,8 42,8 42,8 46,1 46,1 45,4 33,3 Procent risicoptn Braden 21,2 19,7 18,1 16,9 15,8 18,9 15,0 14,5 12,8 11,4 13,7 19,2 23,8 37,5 54,5 50,0 44,4 50,0 33,3 33,3 50,0 0,00 0,00 0,00 0,00 100, 100, 100, Procent risicoptn BEPURA 19,9 20,7 21,3 22,6 21,5 23,3 23,2 24,5 21,7 23,0 23,8 23,9 22,6 29,6 18,3 26,5 25,0 31,1 30,7 32,4 29,4 30,0 34,4 33,3 42,3 32,0 37,5 36,8
0 50 100 150 200 250 0,00 10,00 20,00 30,00 40,00 50,00 60,00 70,00 80,00 90,00 100,00 P a rt ic ip a n te n P ro ce n t
20
Figuur 2: Analyse Risicopatiënten INZO
3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Patienten gescoord Norton 6 6 6 6 6 5 5 5 4 4 4 4 4 3 3 3 3 3 3 3 3 3 3 3 3 3 Patienten gescoord Braden 22 20 15 9 9 6 3 3 2 2 2 2 2 2 2 2 2 2 2 0 0 0 0 0 0 0 Patienten gescoord BEPURA 63 56 49 40 38 32 26 23 19 17 18 16 16 15 14 13 12 12 11 9 9 9 7 7 7 7 Procent Risico Norton 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 Procent Risico Braden 72,7370,0053,3344,4444,4433,3366,6766,67100,0100,0100,0100,0100,0100,0100,0100,0100,0100,0100,0 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Procent risico BEPURA 58,7355,3653,0655,0057,8956,2565,3869,5773,6876,4777,7881,2581,2586,6785,7192,3191,6791,6781,8288,8988,8988,8985,7185,7185,7171,43
0 10 20 30 40 50 60 70 0 10 20 30 40 50 60 70 80 90 100 P a rt ic ip a n te n P ro ce n t
21
Predictieve validiteit van de Norton, Braden en BEPURA schalen
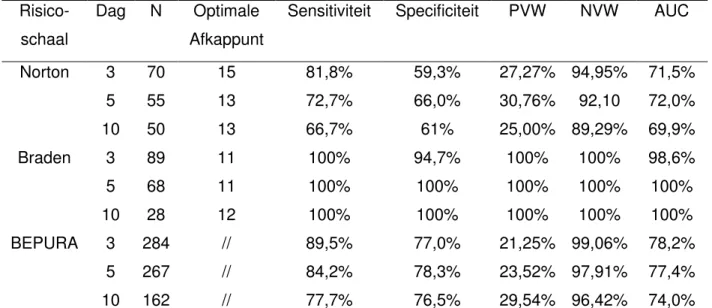
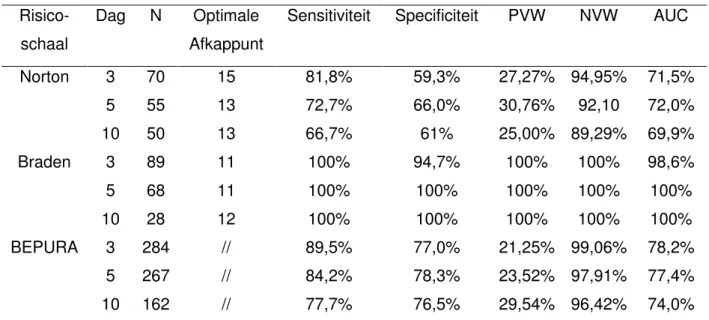
Op basis van de data werd vervolgens de predictieve validiteit van de drie gebruikte schalen geanalyseerd. Voor de BEPURA, Braden- en Nortonschalen werden kruistabellen en ROC-curves (bijlage 4) opgesteld met de data gerapporteerd op dag drie, vijf en tien (Tabel 3). Aan de hand van deze analyses werden de volgende parameters berekend: het optimale afkappunt, sensitiviteit, specificiteit, positief voorspellende waarde, negatief voorspellende waarde en ‘area under the curve’ (AUC). Gezien de dichotome uitkomstmaat van de BEPURA schaal werd geen optimaal afkappunt berekend.
Voor de analyse van de BEPURA schaal werd tevens de positieve “likelihood ratio” (LR+) en de negatieve “likelihood ratio” (LR-) berekend. Op dag 3 was de LR+ 3,53 en de LR- 0,10, op dag vijf waren LR+ en LR- waarden, respectievelijk, 3,80 en 0,15, en op dag tien 3,76 en 0,20.
Tabel 3: Analyse van de predictieve validiteit
Risico-schaal
Dag N Optimale Afkappunt
Sensitiviteit Specificiteit PVW NVW AUC
Norton 3 5 10 70 55 50 15 13 13 81,8% 72,7% 66,7% 59,3% 66,0% 61% 27,27% 30,76% 25,00% 94,95% 92,10 89,29% 71,5% 72,0% 69,9% Braden 3 5 10 89 68 28 11 11 12 100% 100% 100% 94,7% 100% 100% 100% 100% 100% 100% 100% 100% 98,6% 100% 100% BEPURA 3 5 10 284 267 162 // // // 89,5% 84,2% 77,7% 77,0% 78,3% 76,5% 21,25% 23,52% 29,54% 99,06% 97,91% 96,42% 78,2% 77,4% 74,0%
N: Aantal participanten gescoord; PVW: positief voorspellende waarde; NVW: negatief voorspellende waarde; AUC: ‘Area under the curve’
22
Discussie
In Belgische ziekenhuizen is het rapporteren van prevalentiecijfers van decubitus een wettelijke verplichting die valt binnen het kwaliteitsbeleid van de overheid (Agentschap zorg en gezondheid, 2018). Het opvolgen van deze kwaliteitscijfers wordt immers als cruciale kwaliteitsindicator opgenomen in het Vlaams Indicatorenproject voor Patiënten en Professionals (VIP²) (Agentschap zorg en gezondheid, 2018). Tijdens deze studie was er een incidentie van 6,22% bij de geobserveerde participanten (19 gevallen) over een periode van 3 maanden. Deze incidentie is lager dan de prevalentie van 12,1% die de Vlaamse ziekenhuizen rapporteren (Vanderwee et al., 2011) en ook lager dan de Europese mediaan die 10,8% bedraagt (Moore, Cowman, & Conroy, 2011).
Om het risico op het ontwikkelen van decubitus in te schatten worden in de Vlaamse ziekenhuizen verschillende schalen gebruikt, waaronder de Norton- en de Bradenschalen. Recent werd een nieuwe schaal opgesteld, de BEPURA schaal. Uit ons onderzoek blijkt dat er onafhankelijk van de gebruikte schaal, het procentuele aantal risicopatiënten op INZO veel hoger ligt dan op geriatrie. Een mogelijke verklaring hiervoor is de hogere zorgzwaarte en het meer voorkomen van risicofactoren voor decubitus bij patiënten opgenomen op de INZO. Een tweede vaststelling was dat afhankelijk van de gebruikte schaal er aanzienlijke verschillen zijn in de predictie van het procentuele aantal risicopatiënten, waarbij zowel voor de geriatrie als voor de INZO het hoogste percentage bekomen werd met de Nortonschaal, terwijl het laagste percentage met de BEPURA schaal werd berekend. Hoewel deze analyse geen onderdeel uitmaakt van deze studie is het essentieel om het belang van de verhouding risicopatiënten tussen de schalen op te volgen om de werkdruk voor de verpleegkundigen en de materiaalkost bij preventie in acht te nemen. De mediaan van de proportie risicopatiënten volgens BEPURA schaal komt voor de geriatrie (27,22%) in onze studie overeen met de waarde die Smet et al. (2019) rapporteerden in hun studie (25%) waarbij alle diensten van hun ziekenhuis werden geanalyseerd. Indien de vergelijking gemaakt wordt voor de INZO liggen de waarden van onze studie veel hoger (75.03%).
23
In de context van het voorkomen van decubitusletsels, is het afkappunt een belangrijke parameter om te bepalen bij welke patiënten preventiemaatregelen moeten toegepast. Voor de aanvang van de datacollectie, werd in setting ZHR1 het afkappunt 18 gehanteerd zoals origineel werd gepubliceerd voor de Braden schaal (Bergstrom, Braden, Laguzza, & Holman, 1987). Op basis van de ROC-curve werden in onze studie echter veel lagere optimale afkappunten bekomen, namelijk 11 voor dag drie en dag vijf en 12 voor dag tien. Deze waarden zijn ook lager dan optimale afkappunten uit de literatuur: voor de dienst intensieve zorgen werden waarden van 14 (Costa & Caliri, 2011; Kim, Lee, Lee, & Eom, 2009) en 16 (Balzer et al., 2007; Chan, Pang, & Kwong, 2009; Hyun et al., 2013) gerapporteerd, terwijl dat voor een geriatrische setting oploopt tot 17 (Defloor & Grypdonck, 2005) en 18 (de Souza, Santos, Iri, & Oguri, 2010; Tannen et al., 2010). Indien in de toekomst het lager afkappunt zou worden gehanteerd in ZHR1 dan zouden er minder patiënten preventiemaatregelen moeten ontvangen wat besparing van materiaal en minder werklast voor het personeel met zich zou meebrengen.
In setting ZHR2 waar de Nortonschaal wordt gebruikt, werd voorafgaande aan ons onderzoek een afkappunt van 14 gehanteerd zoals beschreven door Norton et al. (1962). De optimale afkappunten berekend in deze studie waren 15 voor dag 3 en 13 voor dag 5 en dag 10, wat in overeenstemming is met de gehanteerde waarde in de setting. Desalniettemin liggen deze waarden hoger dan deze uit andere studies wanneer wordt vergeleken in een geriatrische setting. In een geriatrische setting vermeldden Satekova et al. (2017) en Defloor & Grypdonck (2005) een afkappunt van 12, terwijl voor de intensieve zorgen een afkappunt van 14 werd gepubliceerd (Lospitao-Gomez, Sebastian-Viana, Gonzalez-Ruiz, & Alvarez-Rodriguez, 2017).
Een mogelijke verklaring voor het afwijken van de door ons berekende optimale afkappunten is de non-probabilistische methode waarmee de geïnformeerde toestemming werd bekomen: de patiënt werd eerst door de verpleegkundige aangesproken en pas daarna werd het gesprek rond toestemming gestart door de onderzoeker. Hierdoor is er mogelijks een preselectie van de participanten opgetreden, waarbij onbewust patiënten met een mindere zorgzwaarte werden
24
geselecteerd. Wegens ethische overwegingen was het echter niet mogelijk om dit aan te passen. Ook is er een verschil in zorgzwaarte te observeren tussen de geobserveerde diensten INZO en geriatrie. Een gegeven die het verschil in afkappunten verklaart tussen de twee respectievelijke diensten. Waardoor het afkappunt, gevonden bij de Bradenschaal, lager ligt voor de INZO.
Het belangrijkste doel van dit onderzoek was om de predictieve validiteit van de drie gebruikte schalen in kaart te brengen en deze met gegevens uit de literatuur en met elkaar te vergelijken. Om een uitspraak over predictieve validiteit te kunnen formuleren, moeten elk van de bekomen criteria worden geanalyseerd. Het analyseren van bijvoorbeeld enkel de sensitiviteit en positief voorspellende waarde kan ervoor zorgen dat er patiënten die nood hebben aan preventiemaatregelen over het hoofd worden gezien. Indien enkel de specificiteit en negatief voorspellende waarde worden geanalyseerd kan dit leiden tot een over-gebruik van verpleegkundige tijd en materialen. Het is wenselijk om voor elk van de parameter een zo hoog mogelijke waarde te hebben (Zhu et al., 2010). Voor de Braden schaal bleek er in onze studie een optimale balans te bestaan tussen alle criteria voor predictieve validiteit. De sensitiviteit, specificiteit, positief voorspellende waarde, negatief voorspellende waarde en AUC voor de geanalyseerde dagen waren 100%, 94,7%, 100%, 100% en 98,6% voor dag drie (afkappunt 11), en 100%, 100%, 100%, 100%, 100% voor dag vijf (afkappunt 11) en dag 10 (afkappunt 12). De sensitiviteit lag hoger dan deze uit andere studies waar voor geriatrische diensten waarden van 50,00% (Satekova et al., 2017), 75,9% (de Souza et al., 2010), en 89% (Kwong et al., 2005) werden opgetekend, en voor de intensieve zorgen 77,8% (Lima-Serrano, Gonzalez-Mendez, Martin-Castano, Alonso-Araujo, & Lima-Rodriguez, 2018). In onze studie was ook de specificiteit hoger dan in ander onderzoek: voor de geriatrische settings werden waarden van 70,09% (Satekova et al., 2017), 72% (de Souza et al., 2010) en 70,3% (Kwong et al., 2005) gerapporteerd, voor INZO 66,6% (Lima-Serrano et al., 2017). Bovendien waren zowel de positief als de negatief voorspellende waarden in onze studie hoger dan deze gerapporteerd in de literatuur: respectievelijk, 20,00% en 90,36% in Satekova et al. (2017), 43,6% en 90,7% in de Souza et al. (2010), en 16.9% en 97.2% voor INZO in Lima-Serrano et al. (
25
2018). Met een AUC van boven de 70% werd er door het gebruik van de Bradenschaal in onze studie een duidelijk onderscheid gemaakt tussen de risico- en niet-risico patiënten in het ontwikkelen van decubitus (Zhu et al., 2010). Hoewel de Bradenschaal dus een optimale predictieve validiteit had in onze studie, moeten er echter bij deze resultaten enkele kanttekeningen gemaakt worden. In één van de settings (ZHR1) werden er bij elke patiënt preventiemaatregelen genomen (toepassen wisselligging), ongeacht het risico op decubitus. Bovendien waren er tijdens de opvolgperiode in de setting waar de datacollectie van de Bradenschaal plaatsvond (ZHR1) slechts twee gevallen van decubitus. Het consequent toepassen van preventieve maatregelen en de lage prevalentie van decubitus heeft een invloed op de sensitiviteit en specificiteit van de schaal. Het waargenomen verschil tussen de afkappunten uit deze studie en uit de literatuur en de zeer goede balans tussen de criteria voor predictieve validiteit moeten dus met enige voorzichtigheid geïnterpreteerd worden.
Niettegenstaande de Nortonschaal de oudste in gebruik zijnde schaal is voor het opsporen van risicopatiënten voor decubitus, zijn er relatief weinig studies die de predictieve validiteit hebben onderzocht in verschillende settings. In de literatuur wordt er dan ook aangegeven dat meer onderzoek nodig is om een goede evaluatie te maken van de predictieve validiteit van deze schaal (Pancorbo-Hidalgo et al., 2006; Park & Lee, 2016; Satekova et al., 2017). In onze studie werden voor de Nortonschaal over het algemeen lagere predictieve waarden bekomen in vergelijking met de Braden schaal: op dag drie was de sensitiviteit 81,8%, de specificiteit 59,9%, de positief voorspellende waarde 27,27%, de negatief voorspellende waarde 94,95% en de AUC 71,50%; voor dag vijf waren deze waarden, respectievelijk, 72,7%, 66,0%, 30,76%, 92,1% en 72,0%, en voor dag tien 66,7%, 61%, 25,0%, 89,29%, en 69,9%. Zowel de sensitiviteit als de specificiteit lagen hoger in onze studie dan in ander onderzoek in een geriatrische setting: waarden van respectievelijk, 62,50% en 59,81% werden gerapporteerd door Satekova et al. (2017) en van 62,30% en 61% door Defloor en Grypdonck (2005). Wanneer er echter werd vergeleken met INZO diensten, dan was de sensitiviteit lager maar de specificiteit hoger dan die bekomen door Lospitao-Gomez et al. (2017) (respectievelijke waarden, 94,05% en 40,47%). Lagere
26
waarden voor specificiteit en sensitiviteit wijzen op het feit dat er verschillende patiënten onnodige voorzorgsmaatregelen krijgen wat tijd vergt van de verpleegkundigen en verbruik van extra materialen met zich meebrengt (Demarré et al., 2015; Guy, 2012). Ook zijn lage waarden niet wenselijk daar er patiënten fout kunnen worden ingedeeld in de niet-risico categorie waardoor er geen preventie wordt opgestart en mogelijks decubitus wordt ontwikkeld. Door een lagere positief voorspellende waarde van de risicoschaal kan het zijn dat een persoon die positief test toch geen letsel zal ontwikkelen, een gegeven dat moet worden meegenomen in de analyse van de predictieve validiteit van de schaal. Een lagere negatief voorspellende waarde betekent dat de persoon wel decubitus ontwikkelt, ook al was er geen risico gedetecteerd. De bekomen AUC waarde van de Nortonschaal in onze studie kan als adequaat worden beschouwd, wat betekent dat er een minder doch nog steeds adequaat vermogen is om een onderscheid te maken tussen risico en niet-risico patiënten voor het ontwikkelen van decubitus (Zhu et al., 2010).
De nieuw ontwikkelde BEPURA schaal (Smet et al., 2019) vertoonde in deze studie goede elementen van predictieve validiteit. De sensitiviteit, specificiteit, positief voorspellende waarde, negatief voorspellende waarde en AUC waren respectievelijk 89,5%, 77%, 21,25%, 99,06% en 78,2% voor dag drie, 84,2%, 78,3%, 23,52%, 97,91%, en 77,4% voor dag vijf en 77,77%, 76,5%, 29,54%, 96,42% en 74,0% voor dag tien. Een vergelijking met de literatuur is niet mogelijk gezien de nieuwe aard van de schaal. De lagere positief voorspellende waarde kan verklaard worden door de opstart van preventiemaatregelen tegen decubitus wanneer een persoon als risicopatiënt wordt beschouwd, volgens de BEPURA schaal, waardoor de persoon geen decubitus ontwikkelt. De AUC van de BEPURA schaal is steeds boven de 70% en kan dus als goed beschouwd worden (Zhu et al., 2010).
Voor de BEPURA schaal werden tevens de “likelihood ratio’s” berekend. De aannemelijkheidsverhouding geeft de mate aan waarin een patiënt met een positief resultaat op de risicoschaal decubitus ontwikkelt. De volgende LR+ waarden werden bekomen: 3,53 (dag 3), 3,8 (dag 5), en 3,76 (dag 7). Voor LR- waren dat 0,10 (dag 3), 0,15 (dag 5), 0,20 (dag 10). Deze berekende “likelihood
27
ratio’s” liggen binnen de waarden die vereist zijn voor een goede diagnostische kracht (LR+>1 en LR-<1 en LR-≈0) (Zhu et al., 2010; Polit & Tanato, 2017) en geven aan dat de participanten die als risicopatiënten werden beschouwd op dag drie meer kans hadden op het ontwikkelen van decubitus. De berekende verhoudingen spreken dus van een goede predictieve kracht.
Deze studie had als doel om de predictieve validiteit van de BEPURA schaal te analyseren en deze analyse te vergelijken met de Norton- en Bradenschalen. Om een uitspraak over predictieve validiteit te kunnen formuleren, moeten elk van de bekomen waarden worden geanalyseerd. Het analyseren van enkel de sensitiviteit en positief voorspellende waarde kan ervoor zorgen dat patiënten die nood hebben aan preventiemaatregelen over het hoofd worden gezien. Indien enkel de specificiteit en negatief voorspellende waarde worden geanalyseerd kan dit leiden tot een over-gebruik van verpleegkundige tijd en materialen. We willen voor elk van de waarden een zo hoog mogelijke waarde (Zhu et al., 2010). Wanneer we alle elementen van de predictieve validiteit van de drie schalen in beschouwing nemen dan is duidelijk dat de Braden schaal de optimale predictieve validiteit vertoont, gevolgd door de BEPURA schaal met een goede predictieve validiteit, en als derde de Norton schaal met een adequate predictieve validiteit. In de onuitgegeven pilootstudie van Eussen & Vermeire (2018) was er geen verschil in de predictieve validiteit van de BEPURA en Norton schaal. Om een zo correct mogelijke uitspraak te maken van de predictieve validiteit van de drie risicoschalen werden, zoals voorgesteld door Defloor en Grypdonck (2004), de gebruikte preventiemaatregelen ook in rekening gebracht. Er bleek een significant verschil (P: 0.05) bij het ontwikkelen van een decubitus indien er ter preventie gebruik werd gemaakt van een aangepaste matras. Voor de andere opgevolgde preventiemaatregelen was er geen significant verschil tussen de twee groepen (wisselligging P: 0.14 en hielpreventie P: 0.47).
Wanneer we tenslotte met een kritische blik op ons onderzoek terugkijken, dan kunnen we stellen dat de gebruikte methodologie geschikt is voor opvolgende studies naar de predictieve validiteit van de risicoschalen voor decubitus, mits er bepaalde uitbreidingen geïmplementeerd worden. In onze studie werd
28
bijvoorbeeld de BEPURA schaal bij elke patiënt afgenomen, maar de Braden- of Nortonschaal enkel bij een deel van de participanten, afhankelijk van de setting. De reden hiervoor was tweevoudig: de datacollectie moest werkbaar blijven voor de verpleegkundigen op de afdelingen en er was slechts deskundigheid in één van de twee schalen bij het personeel. In de toekomst zou het dus aan te raden zijn om de steekproefgrootte uit te breiden door de drie risicoschalen bij elk van de patiënten af te nemen, waardoor robuustere analyses mogelijk worden. Additionele mogelijkheden voor een uitbreiding van de steekproefgrootte zijn de inclusie van meer dan drie settings en een verlenging van de datacollectie periode. Deze aanpassingen kunnen het risico op bias, omwille van het gebruik van een “consecutive non-probability sampling method”, verkleinen. Door de beperkte steekproefgrootte in onze studie, werden de subgroepen te klein bevonden om diepgaandere analyses mogelijk te maken in verband met de verhoudingen risicopatiënten per schaal.
Bovendien werd in onze studie enkel het al dan niet ontwikkelen van decubitus en de graad opgevolgd, en niet de plaats van ontwikkeling. Een laatste limitatie van onze studie is dat slechts drie van de achttien preventiemaatregelen beschreven door de EPUAP en NPUAP (2014), worden geanalyseerd in deze studie. Het opzetten van verder prospectief longitudinaal onderzoek met deze voorwaarden is dus cruciaal.
Naast verder onderzoek naar de predictieve validiteit van de risicoschaal is verder onderzoek naar de haalbaarheid van het dagelijks invullen van de schaal, de impact op het aantal risicopatiënten, de werkdruk voor de verpleegkundigen en de kost van middelen ter preventie van decubitus een must om een compleet beeld te schetsen van de BEPURA schaal. Om zo het nut ervan in de verpleegkundige praktijk verder te onderzoeken.
29
Conclusie
Uit dit onderzoek blijkt dat de predictieve validiteit van de BEPURA schaal zich situeert tussen die van de Bradenschaal die het beste was en de Nortonschaal die het minst goed was. Er kan dus gesteld worden dat de BEPURA een schaal is met een goede predictieve validiteit en dat het gebruik ervan in de verpleegkundige praktijk geen mindere predictieve waarde vertoont dan de Nortonschaal. Gezien het nieuwe karakter van de schaal is verder prospectief longitudinaal onderzoek aangewezen om de predictieve validiteit te analyseren van de BEPURA schaal en het nut ervan in de verpleegkundige praktijk te duiden.
30
Referentielijst
Balzer, K., Pohl, C., Dassen, T., & Halfens, R. (2007). The Norton, Waterlow, Braden, and Care Dependency Scales: comparing their validity when identifying patients' pressure sore risk. Journal of wound, ostomy, and continence nursing : official publication of The Wound, Ostomy and Continence Nurses Society, 34(4), 389-398. doi:10.1097/01.WON.0000281655.78696.00
Bergstrom, N., Braden, B. J., Laguzza, A., & Holman, V. (1987). The Braden Scale for Predicting Pressure Sore Risk. Nursing Research, 36(4), 205-210. doi:Doi 10.1097/00006199-198707000-00002
Chan, W. S., Pang, S. M. C., & Kwong, E. W. Y. (2009). Assessing predictive validity of the modified Braden scale for prediction of pressure ulcer risk of orthopaedic patients in an acute care setting. Journal of clinical nursing, 18(11), 1565-1573. doi:10.1111/j.1365-2702.2008.02757.x
Coleman, S., Nixon, J., Keen, J., Muir, D., Wilson, L., McGinnis, E., . . . Nelson, E. A. (2016). Using cognitive pre-testing methods in the development of a new evidenced-based pressure ulcer risk assessment instrument. BMC medical research methodology, 16. doi:ARTN 15810.1186/s12874-016-0257-5
Costa, I. G., & Caliri, M. H. L. (2011). Predictive validity of the Braden Scale for patients in intensive care. Acta Paulista De Enfermagem, 24(6), 772-777. doi:Doi 10.1590/S0103-21002011000600007
Beeckman, D., Mathei, C., Van Lancker, A., Van Houdt, S., Vanwalleghem, G. Gryson, L., Heyman, H., Thyse, C., Toppets, A., Stordeur, S. & Van Heede, K. (2013). Een nationale richtlijn voor decubituspreventie Retrieved from https://kce.fgov.be/nl/een-nationale-richtlijn-voor-decubituspreventie
de Souza, D. M. S. T., Santos, V. L. C. D., Iri, H. K., & Oguri, M. Y. S. (2010). Predictive Validity of the Braden Scale for Pressure Ulcer Risk in Elderly Residents of Long-Term Care Facilities. Geriatric Nursing, 31(2), 95-104. doi:10.1016/j.gerinurse.2009.11.010
Defloor, T., & Grypdonck, M. F. H. (2005). Pressure ulcers: validation of two risk assessment scales. Journal of clinical nursing, 14(3), 373-382. doi:DOI 10.1111/j.1365-2702.2004.01058.x
Defloor T., H. A., Grypdonck M. et al. (2004). Herziening Belgische richtlijnen voor Decubituspreventie. Brussel: Federaal Ministerie van Sociale Zaken, Volksgezondheid en Leefmilieu.
Demarre, L., Van Lancker, A., Van Hecke, A., Verhaeghe, S., Grypdonck, M., Lemey, J., . . . Beeckman, D. (2015). The cost of prevention and treatment of pressure ulcers: A systematic review. International journal of nursing studies, 52(11), 1754-1774. doi:10.1016/j.ijnurstu.2015.06.006
Demarre, L., Vanderwee, K., Defloor, T., Verhaeghe, S., Schoonhoven, L., & Beeckman, D. (2012). Pressure ulcers: knowledge and attitude of nurses and nursing assistants in Belgian nursing homes. Journal of clinical nursing, 21(9-10), 1425-1434. doi:10.1111/j.1365-2702.2011.03878.x
31
Eussen, V., & Vermeire, N. (2018). Decubituspreventiebeleid. Implementatie van een nieuwe risicoscreenings- en preventiebeleid voor de decubitus in het Universitair Ziekenhuis Leuven: een kwaliteitsverbeteringsproject. [Onuitgegeven Masterproef] KU Leuven.
National Pressure Ulcer Advisory Panel, European Pressure Ulcer Advisory Panel and Pan Pacific Pressure Injury Alliance (2014). Prevention and
Treatment of Pressure Ulcers: Quick Reference Guide. Emily Haesler
(Ed.). Cambridge Media: Perth, Australia; 2014.
Graves, N., Birrell, F., & Whitby, M. (2005). Effect of pressure ulcers on length of hospital stay. Infection control and hospital epidemiology, 26(3), 293-297. doi:Doi 10.1086/502542
Guy, H. (2012). Pressure ulcer risk assessment. Nursing Times, 108(4), 16-20. Retrieved from https://www.nursingtimes.net/clinical-archive/tissue-viability/pressure-ulcer-risk-assessment-20-01-2012/
Hyun, S., Vermillion, B., Newton, C., Fall, M., Li, X. B., Kaewprag, P., . . . Lenz, E. R. (2013). Predictive Validity of the Braden Scale for Patients in Intensive Care Units. American Journal of Critical Care, 22(6), 514-520. doi:10.4037/ajcc2013991
Jiang, Q. X., Li, X. H., Qu, X. L., Liu, Y., Zhang, L. Y., Su, C. Y., . . . Wang, J. D. (2014). The incidence, risk factors and characteristics of pressure ulcers in hospitalized patients in China. International Journal of Clinical and Experimental Pathology, 7(5), 2587-2594.
Kim, E. K., Lee, S. M., Lee, E., & Eom, M. R. (2009). Comparison of the predictive validity among pressure ulcer risk assessment scales for surgical ICU patients. Australian Journal of Advanced Nursing, 26(4), 87-94.
Kwong, E., Pang, S., Wong, T., Ho, J., Xue, S. L., & Tao, L. J. (2005). Predicting pressure ulcer risk with the modified Braden, Braden, and Norton scales in acute care hospitals in Mainland China. Applied Nursing Research, 18(2), 122-128. doi:10.1016/j.apnr.2005.01.001
Lima-Serrano, M., Gonzalez-Mendez, M. I., Martin-Castano, C., Alonso-Araujo, I., & Lima-Rodriguez, J. S. (2018). Predictive validity and reliability of the Braden scale for risk assessment of pressure ulcers in an intensive care unit. Medicina intensiva, 42(2), 82-91. doi:10.1016/j.medin.2016.12.014 Lospitao-Gomez, S., Sebastian-Viana, T., Gonzalez-Ruiz, J. M., &
Alvarez-Rodriguez, J. (2017). Validity of the current risk assessment scale for pressure ulcers in intensive care (EVARUCI) and the Norton-MI scale in critically ill patients. Applied Nursing Research, 38, 76-82. doi:10.1016/j.apnr.2017.09.004
Moore, Z., Avsar, P., Conaty, L., Moore, D. H., Patton, D., & O'Connor, T. (2019). The prevalence of pressure ulcers in Europe, what does the European data tell us: a systematic review. Journal of wound care, 28(11), 710-719. doi:10.12968/jowc.2019.28.11.710
Moore, Z., Cowman, S., & Conroy, R. M. (2011). A randomised controlled clinical trial of repositioning, using the 30 degrees tilt, for the prevention of pressure ulcers. Journal of clinical nursing, 20(17-18), 2633-2644. doi:10.1111/j.1365-2702.2011.03736.x
32
Pancorbo-Hidalgo, P. L., Garcia-Fernandez, F. P., Lopez-Medina, I. M., & Alvarez-Nieto, C. (2006). Risk assessment scales for pressure ulcer prevention: a systematic review. Journal of advanced nursing, 54(1), 94-110. doi:DOI 10.1111/j.1365-2648.2006.03794.x
Park, S. H., & Lee, H. S. (2016). Assessing Predictive Validity of Pressure Ulcer Risk Scales- A Systematic Review and Meta-Analysis. Iranian Journal of Public Health, 45(2), 122-133.
Polit, D. F., & Beck, C. T. (2017). Nursing Research: Generating and Assessing Evidence for Nursing Practice (10 ed.). Philadelphia: Wolters Kluwer Health.
Rijksinstituut voor ziekte- en invaliditeitsuitkering (2018). Evaluatieschaal (Katz)
Retrieved from
https://www.riziv.fgov.be/nl/professionals/individuelezorgverleners/verple egkundigen/verzorging/Paginas/evaluatieschaal-katz.aspx
Satekova, L., & ziakova, K. (2014). Validity of pressure ulcer risk assement scales: rview. Central European Journal of Nursing and Midwifery, 5(2)(2336-3517), 85-92.
Satekova, L., Ziakova, K., & Zelenikova, R. (2017). Predictive validity of the Braden Scale, Norton Scale, and Waterlow Scale in the Czech Republic. International journal of nursing practice, 23(1). doi:ARTN e1249910.1111/ijn.12499
Schoonhoven, L., Haalboom, J. R. E., Bousema, M. T., Algra, A., Grobbee, D. E., Gyrpdonck, M. H., . . . Grp, p. S. (2002). Prospective cohort study of routine use of risk assessment scales for prediction of pressure ulcers. Bmj-British Medical Journal, 325(7368), 797-800. doi:DOI 10.1136/bmj.325.7368.797
Smet, S., de Graaf, A., Bernaerts, K., Casaer, M. P., & Beeckman, D. (2019). The Belgian pressure ulcer risk assessment project: Is assessing mobility and skin status a more accurate, reliable, and feasible approach to assess pressure ulcer risk in hospitalised patients? International wound journal, 16(6), 1577-1578. doi:10.1111/iwj.13240
Smith, I., Brown, S., Coleman, S., Wilson, L., & Nixon, J. (2015). Assessing the accuracy of routinely collected data and their potential use in pressure ulcer trials. Trials, 16. doi:Doi 10.1186/1745-6215-16-S2-P39
Tannen, A., Balzer, K., Kottner, J., Dassen, T., Halfens, R., & Mertens, E. (2010). Diagnostic accuracy of two pressure ulcer risk scales and a generic nursing assessment tool. A psychometric comparison. Journal of clinical nursing, 19(11-12), 1510-1518. doi:10.1111/j.1365-2702.2009.03005.x Van Den Bos, J., Rustagi, K., Gray, T., Halford, M., Ziemkiewicz, E., & Shreve, J.
(2011). The $17.1 billion problem: the annual cost of measurable medical errors. Health Aff (Millwood), 30(4), 596-603. doi:10.1377/hlthaff.2011.0084
Vanderwee, K., Defloor, T., Beeckman, D., Demarre, L., Verhaeghe, S., Van Durme, T., & Gobert, M. (2011). Assessing the adequacy of pressure ulcer prevention in hospitals: a nationwide prevalence survey. Bmj Quality & Safety, 20(3), 260-267. doi:10.1136/bmjqs.2010.043125
33
Zhu, W., Zhang, N., & Wang, N. (2010). Sensitivity, Specificity, Accuracy, Associated Confidence Interval and ROC Analysis with Practical SAS® Implementations. In Health Care and life Sciences.
34
Bijlagen
Bijlage 1: Datacollectieformulier
* Mobiliteit / activiteit: De patiënt kan en zal zich spontaan elke 4u draaien OF kan en zal bij pijn/ongemak frequente kleine positieveranderingen uitvoeren?
Huidstatus: Er is NU of er was in het VERLEDEN een decubitusletsel aanwezig? Datum Norton- of Braden-score 1/w *Nieuwe schaal 1/d Wisselhouding iedere ……u Zwevende hielen (ja / nee) Soort matras (traagfoam/ alternerende/ andere) Categorie decubitus aanwezig (ja + categorie / nee) Verminderde Mobiliteit/ activiteit (ja /nee) Decubitus nu/ in verleden (ja / nee)
35
Bijlage 2: Risicoschalen
Nortonschaal (Defloor T., 2004) Bradenschaal (Defloor T., 2004)36 BEPURA schaal
(Persoonlijk Communicatie, 2019)
Start
preventie
37
Bijlage 3: KATZ-schaal
38
Bijlage 4: ROC-curves en kruistabellen
Bradenschaal
Area Under the ROC Curve
Test Result Variable(s) Area
BradenDag3 0,986
BradenDag5 1,000
39
BradenschaalDag3 * Gedurende Opname decubitus ontwikkeld Kruistabel (Afkappunt 11)
Gedurende Opname decubitus ontwikkeld Total geen decubitus ontwikkeld decubitus ontwikkeld BradenschaalDag3 Geen risico Count 71 0 71 % within Gedurende Opname decubitus ontwikkeld 94,7% 0,0% 92,2% Wel risico Count 4 2 6 % within Gedurende Opname decubitus ontwikkeld 5,3% 100,0% 7,8% Total Count 75 2 77 % within Gedurende Opname decubitus ontwikkeld 100,0% 100,0% 100,0%
BradenschaalDag5 * Gedurende Opname decubitus ontwikkeld Kruistabel (Afkappunt 11)
Gedurende Opname decubitus ontwikkeld Total geen decubitus ontwikkeld decubitus ontwikkeld BradenschaalDag5 Geen risico Count 66 0 66 % within Gedurende Opname decubitus ontwikkeld 100,0% 0,0% 97,1% Wel risico Count 0 2 2 % within Gedurende Opname decubitus ontwikkeld 0,0% 100,0% 2,9% Total Count 66 2 68 % within Gedurende Opname decubitus ontwikkeld 100,0% 100,0% 100,0 %
40
BradenschaalDag10 * Gedurende Opname decubitus ontwikkeld Kruistabel (Afkappunt 12)
Gedurende Opname decubitus ontwikkeld Total geen decubitus ontwikkeld decubitus ontwikkeld BradenschaalDag 10 Geen risico Count 26 0 26 % within Gedurende Opname decubitus ontwikkeld 100,0% 0,0% 92,9% Wel risico Count 0 2 2 % within Gedurende Opname decubitus ontwikkeld 0,0% 100,0% 7,1% Total Count 26 2 28 % within Gedurende Opname decubitus ontwikkeld 100,0% 100,0% 100,0%
41 Nortonschaal
Area Under the ROC Curve
Test Result Variable(s) Area
NortonDag3 ,715
NortonDag5 ,720
42
NortonschaalDag3 * Gedurende Opname decubitus ontwikkeld Crosstabulation Gedurende Opname decubitus ontwikkeld Total geen decubitus ontwikkeld decubitus ontwikkeld
NortonschaalDag3 Geen risico Count 35 2 37
% within Gedurende
Opname decubitus
ontwikkeld
59,3% 18,2% 52,9%
Wel risico Count 24 9 33
% within Gedurende Opname decubitus ontwikkeld 40,7% 81,8% 47,1% Total Count 59 11 70 % within Gedurende Opname decubitus ontwikkeld 100,0% 100,0% 100,0%
NortonschaalDag5 * Gedurende Opname decubitus ontwikkeld Crosstabulation Gedurende Opname decubitus ontwikkeld Total geen decubitus ontwikkeld decubitus ontwikkeld
NortonschaalDag5 Geen risico Count 35 3 38
% within Gedurende
Opname decubitus
ontwikkeld
66,0% 27,3% 59,4%
Wel risico Count 18 8 26
% within Gedurende Opname decubitus ontwikkeld 34,0% 72,7% 40,6% Total Count 53 11 64 % within Gedurende Opname decubitus ontwikkeld 100,0% 100,0% 100,0%
43
NortonschaalDag10 * Gedurende Opname decubitus ontwikkeld Kruistabel (Afkappunt 15)
Gedurende Opname decubitus ontwikkeld Total geen decubitus ontwikkeld decubitus ontwikkeld NortonschaalDag10 Geen risico Count 25 3 28 % within Gedurende Opname decubitus ontwikkeld 61,0% 33,3% 56,0%
Wel risico Count 16 6 22
% within Gedurende Opname decubitus ontwikkeld 39,0% 66,7% 44,0% Total Count 41 9 50 % within Gedurende Opname decubitus ontwikkeld 100,0% 100,0% 100,0%
44 BEPURA schaal
Area Under the ROC Curve
Test Result Variable(s) Area
BEPURADag3 ,782
BEPURADag5 ,774
45
BEPURADag3 * Gedurende Opname decubitus ontwikkeld Kruistabel Gedurende Opname decubitus ontwikkeld Total geen decubitus ontwikkeld decubitus ontwikkeld
BEPURADag3 geen risico Count 211 2 213
% within Gedurende Opname decubitus ontwikkeld 77,0% 10,5% 72,7% Risico Count 63 17 80 % within Gedurende Opname decubitus ontwikkeld 23,0% 89,5% 27,3% Total Count 274 19 293 % within Gedurende Opname decubitus ontwikkeld 100,0% 100,0% 100,0%
BEPURADag5 * Gedurende Opname decubitus ontwikkeld Crosstabulation Gedurende Opname decubitus ontwikkeld Total geen decubitus ontwikkeld decubitus ontwikkeld
BEPURADag5 geen risico Count 188 3 191
% within Gedurende Opname decubitus ontwikkeld 78,3% 15,8% 73,7% Risico Count 52 16 68 % within Gedurende Opname decubitus ontwikkeld 21,7% 84,2% 26,3% Total Count 240 19 259 % within Gedurende Opname decubitus ontwikkeld 100,0% 100,0% 100,0%
46
BEPURADag10 * Gedurende Opname decubitus ontwikkeld Crosstabulation Gedurende Opname decubitus ontwikkeld Total geen decubitus ontwikkeld decubitus ontwikkeld
BEPURADag10 geen risico Count 108 4 112
% within Gedurende Opname decubitus ontwikkeld 77,7% 23,5% 71,8% Risico Count 31 13 44 % within Gedurende Opname decubitus ontwikkeld 22,3% 76,5% 28,2% Total Count 139 17 156 % within Gedurende Opname decubitus ontwikkeld 100,0% 100,0% 100,0%